鱼腥草抗单纯疱疹病毒作用机制研究
周良斌
(黄冈职业技术学院,湖北黄冈438002)
科学实验研究
鱼腥草抗单纯疱疹病毒作用机制研究
周良斌
(黄冈职业技术学院,湖北黄冈438002)
利用体外试验研究鱼腥草是否对第二型单纯疱疹病毒(HSV-2)感染具有抑制作用,并进一步探讨其抑制单纯疱疹病毒的效用与机制。结果表明:利用溶斑减少试验发现,鱼腥草初萃取物可抑制HSV-1、HSV-2及阿昔洛韦抗药性HSV-1(HSV-AR)。将鱼腥草初萃取物依据分子量分成1000 Da以下、1000~3000 Da、3000 Da以上三部分,发现三部分皆具有抗病毒的成分,其中以1000 Da以下的部分抑制效果最好。分析六种鱼腥草成分作用发现,B、E及F具有抗HSV活性。其中B可以同时抑制病毒进入细胞以及NF-κB活化。可见,鱼腥草可直接和病毒颗粒作用而抑制病毒进入细胞。在病毒进入细胞后,鱼腥草通过抑制细胞NF-κB活化而减少NF-κB结合至HSV的ICP0基因启动子而抑制HSV复制。
单纯疱疹病毒;鱼腥草;抗病毒作用
单纯疱疹病毒属于疱疹病毒科中的α疱疹病毒亚科(Alphaherpesvirinae),由于其表面蛋白质抗原性有所不同而可区分为两种血清型,即第一型单纯疱疹病毒(HSV-1)与第二型单纯疱疹病毒(HSV-2)。以往抗病毒药物多半重于西药开发,近年来中草药对抗病毒功效已慢慢被注意。
本试验利用体外试验方法找出鱼腥草抗单纯疱疹病毒效用与机制后,测试鱼腥草是否对第二型单纯疱疹病毒及阿昔洛韦抗药性HSV-1感染也具有抑制作用,并进一步探讨其抑制单纯疱疹病毒机制。
1 材料与方法
1.1 萃取中草药 清洗鱼腥草后,加入适量蒸馏水,以搅拌切割机打碎,分别以下列比例配制:鱼腥草100 g+水1 L,以小火煮沸至体积400 mL。3000 r/min离心10 min,收取上清液。药液再分别以棉花、100目金属网、0.2 μm过滤膜依序过滤。分装至15 mL离心管,置于-70℃保存备用。经煎煮的药液冷冻干燥处理后,再秤重配制成100 mg/L浓度。
1.2 鱼腥草内含成分制备 购买不同鱼腥草成分的化合物A、B、C、D、E及F。所有药物皆溶于二甲亚砜溶液(DMSO)。
1.3 细胞培养 将体外连续培养细胞株Vero细胞 (猴肾细胞)、A549细胞 (人类肺癌细胞)以及HEp-2细胞(人类喉癌细胞)由液态氮中取出后快速解冻,经离心去除冰冻保存液,加入含有胎牛血清的细胞生长培养基,移至细胞培养瓶中,置于含5%CO2的37℃培养箱进行培养。细胞每3~4 d进行一次继代培养,当细胞生长形成完整的单层细胞时,将培养基移除,用磷酸盐缓冲液清洗两次后,加入胰蛋白质酵素作用5~10 min,见细胞脱落即可加入生长培养基,细胞经充分混合均匀后,以1∶4的比例分装于新的培养瓶中。或计数细胞数目后,稀释成适当的浓度,供培养病毒或后续测试用。
1.4 病毒培养 将人类单纯疱疹病毒HSV接种于细胞,置于37℃使病毒吸附于细胞,1 h后,换上新鲜的维持培养基,置于内含 5%CO2的37℃培养箱培养。直至细胞病变大于75%即可收取病毒,病毒液于4℃、5000 r/min(Hitachi SCR20B)离心30 min以移除细胞沉淀物,去除细胞的病毒培养上清液,以少量分装于小安瓶内,保存于-80℃下。
1.5 MTT试验测试中草药的细胞毒性 将3×104的Vero细胞于37℃、5%CO2培养箱隔夜培养于96孔盘。稀释鱼腥草粗萃取液,最高浓度的鱼腥草与2×浓度的E-4(2×EMEM含4%FBS)以1∶1等体积稀释,其他浓度以E-2(EMEM含2%FBS)做2×序列稀释。缓慢吸去细胞培养基,加入100 μL中草药稀释液,细胞对照组则加100 μL E-2,37℃培养3 d。加入MTT(5 mg/mL PBSA)25 μL/well,置于37℃2 h。加入裂解液100 μL/well,37℃2 h后,移至室温放置24 h。以OD570nm分析。
1.6 溶斑试验 细胞浓度调整到8×105cells/mL,放入6孔细胞培养盘(1 mL/孔),37℃培养 24 h。稀释病毒,以E-2将HSV稀释。缓慢吸去细胞培养基,加入 100 μL病毒稀释液/well,细胞对照组则加100 μL E-2,置于37℃使病毒吸附1 h,准备含有2%纤维甲醚(MC)的覆盖介质溶液与2×E-4以1∶1的比例混合,加入2 mL/well,37℃培养3 d。加入1 mL 10%福尔马林溶液,固定1 h。倒掉所有覆盖液体,滴上1%crystal violet,染色10 min。以清水温和润洗,计数溶斑(PFU)
PFU/mL=(溶斑平均数)×(1/接种体积)×(1/稀释倍数)。
1.7 溶斑减少试验 细胞浓度调整度到5×105个/mL,放入6孔细胞培养盘,37℃培养24 h。稀释病毒,以E-2调整病毒浓度至100 PFU/100 μL。缓慢吸去细胞培养基,加入100 μL混合液,细胞对照组则加100 μL E-2,病毒对照组直接加入病毒,37℃使病毒吸附1 h。加上含有不同浓度鱼腥草粗萃取液的加入第二种溶液,37℃培养3 d。加入1 mL 10%福尔马林溶液,固定1 h。倒掉所有覆盖液体,滴上1%crystal violet,染色10 min。以清水温和地润洗,计数溶斑。
1.8 病毒前处理试验 将5×105个/mL的病毒细胞在37℃、5%CO2的培养箱隔夜培养于6孔盘。隔天在病毒感染前3 h,先将HSV-1用培养液稀释并加入不同浓度的鱼腥草使病毒力价为100 PFU/100 μL。将病毒和鱼腥草在室温下作用3 h。之后将细胞培养液移除,加入已和鱼腥草作用过的病毒100 μL,在37℃下感染1 h,然后吸去病毒液,以2 mL PBS润洗细胞三次。再加入2 mL不含鱼腥草的MC覆盖液。3 d后读取细胞溶斑数。再将加药物的试验组与病毒控制组做比较。
1.9 细胞前处理试验 将5×105个/mL的病毒细胞于37℃、5%CO2培养箱隔夜培养于6孔盘。隔天在病毒感染前3 h,先将孔内培养液换成含有不同浓度鱼腥草的培养液,在37℃下作用3 h。3 h后移去上清液,再以2 mL PBS润洗细胞三次。每孔感染100 PFU/100 μL的HSV-1,在37℃下感染1 h,之后吸去病毒液,再以2 mL PBS润洗细胞三次。再加入2 mL不含鱼腥草的MC覆盖液。3 d后读取细胞溶斑数。再将加药物的试验组与病毒控制组做比较。
1.10 病毒吸附试验 将5×105个/mL的Vero细胞于37℃、5%CO2培养箱隔夜培养于6孔盘。第2天于试验前先将6孔盘置于4℃预冷,1 h后吸去培养液每孔加入力价含100 PFU/100 μL HSV-1病毒与特定浓度鱼腥草的混合液100 μL,病毒控制组则加入不含药物的病毒液100 μL,再将6孔盘置于4℃1.5 h,病毒于4℃下只能吸附在细胞表面,无法进入细胞。1.5 h后将病毒液吸去并以预冷PBS清洗3次以洗去残余药物,再加入2 mL不含鱼腥草的MC覆盖液。3 d后读取细胞溶斑数。再将加药物的试验组与病毒控制组做比较。
1.11 病毒穿透试验 将5×105个/mL的Vero细胞于37℃、5%CO2培养箱隔夜培养于6孔盘。第2天于试验前先将6孔盘置于4℃预冷,1 h后吸去培养液,每孔加入力价含 100 PFU/100 μL HSV-1病毒,在4℃下吸附2 h,之后吸去病毒液,每孔加入1 mL含有鱼腥草的培养液,37℃培养15 min,以允许病毒穿透细胞膜。之后吸去培养液,每孔加入1 mL酸性PBS(pH=3)作用1 min,将细胞外上外穿透细胞膜的病毒去活化,再以1 mL PBS润洗细胞三次以中和酸碱性。之后每孔加入2 mL不含鱼腥草的MC覆盖液。3 d后读取细胞溶斑数。再将加药物试验组与病毒控制组做比较。
1.12 药物加入作用时间点试验 将5×105个/mL的Vero细胞于37℃、5%CO2培养箱隔夜培养于6孔盘。第2天吸去培养液,每孔感染1 MOI的病毒。在37℃下感染1 h后吸去病毒液,再以2 mL PBS润洗细胞三次。0 h组加入2 mL含有1 mg/mL鱼腥草的培养液,其余组则加入不含鱼腥草的培养液。分别在感染后的不同时间点吸去细胞上清液,以2 mL PBS润洗细胞,加入2 mL含有1 mg/mL的鱼腥草培养液。24 h后,将细胞上清液移去,以PBS润洗细胞,利用胰岛素将细胞打下,悬浮于1 mL培养液。在-80℃下冰冻解冻三次。以5000 r/min离心10 min,将上清液保存在-80℃。利用溶斑试验定量不同时间点加药的病毒量。
1.13 病毒RNA萃取 将Vero细胞以5×105个/mL种于6孔盘,待隔日细胞长满后以1 MOI的病毒感染细胞。病毒吸附1 h后将病毒液吸起,并补入含1 mg/mL鱼腥草的维持培养液1 mL,病毒控制组则补入维持培养液。置于37℃培养箱培养,分别在之后的第2、10、24 h以trypsin将各组细胞打下收于1.5 mL微量离心管,以2500 r/min离心10 min后将trypsin移除并以200 μL维持培养液将细胞混匀,暂时于4℃保存。之后将细胞离心并移去维持培养液,加入1 mL TRIzol试剂混合均匀后置于室温5 min,然后加入0.2 mL氯仿并剧烈混合15 s后静置于室温3 min,再以12000 r/min于4℃离心15 min。将上层含RNA的水溶液移至新的1.5 mL微量离心管并加入0.5 mL异丙醇混合均匀后静置于室温10 min,以12000 r/min于4℃离心10 min后去除上清液。以1 mL 75%酒精清洗沉淀于管底的RNA,再以7500 r/min于4℃离心5 min后小心的移去酒精,并利用真空抽干5 min将RNA干燥,再以20 μL DEPC水(去除RNase的二次水)回溶RNA。为去除DNA的干扰,RNA中可再加入5 μL DNase I、3 μL 10×DNase缓冲液再补DEPC水至体积30 μL,置于37℃水浴槽作用20 min后,再加入50 mmol/L EDTA 3.5 μL于75℃水浴槽作用10 min后可将RNA保存于-80℃。
1.14 蛋白痕迹(Western blot)试验 取出转渍蛋白完成的 PVDF膜放到干净的盒子中,加入10.0 mL缓冲液,于室温中反应2 h以上。待遮蔽作用完成后,以PBST清洗PVDF膜三次,每次5 min,接着加入10.0 mL以5%脱脂奶粉稀释后的一级抗体,在室温中反应2 h,再以PBST清洗三次,再加入10.0 mL以5%脱脂奶粉稀释后的二级抗体,在室温中反应2 h,最后再以PBST清洗二次、PBS清洗一次之后呈色。
2 结果
2.1 中草药的细胞毒性试验 测试经处理后鱼腥草粗萃取液对细胞的毒性,将药液连续两倍稀释,加在预先培养好的细胞上,以MTT试验来测试。图1测试结果显示,即使使用最高浓度(50 mg/mL),细胞仍然可以维持50%以上的活性,表明本中草药安全低毒。

图1 MTT试验测试鱼腥草对Vero细胞毒性
2.2 鱼腥草抑制病毒试验 先将大量培养的单纯疱疹病毒连续10倍稀释,以溶斑试验测定病毒浓度,再将含有100 PFU的病毒液在37℃下感染Vero细胞1 h。洗去病毒液后,加入含有不同鱼腥草粗萃取液浓度的1%MC。3 d后读取细胞溶斑数。图2测试结果显示,鱼腥草抑制HSV-1、HSV-2以及AR-HSV-1的50%感染力的药液浓度(EC50)分别为0.692l、0.3、1.11 mg/mL。

图2 溶斑减少试验测试鱼腥草抑制HSV-1、HSV-2以及ACV-HSV-1的作用
2.3 鱼腥草抑制HSV-1及HSV-2的机制 图3结果显示,低于IC50浓度的鱼腥草在室温下和病毒作用3 h后,就可以完全抑制细胞产生溶斑,而将细胞先和鱼腥草在37℃下作用则无法抑制病毒感染细胞。此结果显示鱼腥草可能直接和病毒颗粒作用而抑制病毒进入细胞。在HSV-1以及HSV-2皆可以观察到相同的结果。为了进一步了解在病毒和鱼腥草作用3 h后,病毒是否已死亡,将105PFU的病毒和不同浓度鱼腥草作用 3 h后,将病毒稀释1000倍以降低鱼腥草的作用,将稀释后的病毒感染细胞,此含有100 PFU的病毒在37℃感染细胞1 h后,以PBS洗细胞3次,加入MC覆盖液。3 d后判读细胞溶斑数。结果显示,和最高浓度0.1 mg/mL鱼腥草作用3 h后的病毒,其病毒颗粒仍然具有感染力,显示鱼腥草和病毒作用并不会直接杀死病毒(图4)。
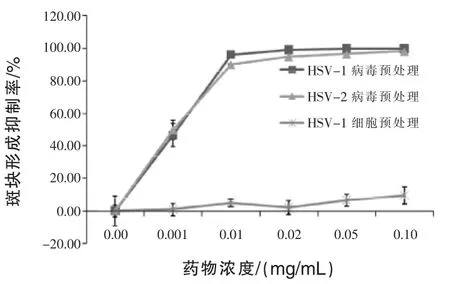
图3 细胞和病毒预处理试验探讨鱼腥草抑制HSV-1和HSV-2的机制

图4 溶斑试验测试鱼腥草和病毒作用是否会杀死病毒
2.4 Western blot法试验检测鱼腥草抑制病毒吸附细胞试验 将病毒感染预冷的Vero细胞同时给与不同浓度的鱼腥草,待病毒吸附1.5 h后,用预冷的PBS将病毒洗去。之后将细胞刮下,以抗病毒的醇蛋白D(anti-gD)的抗体侦测鱼腥草是否可以抑制病毒贴附在细胞上。
图5显示,随着鱼腥草浓度增加,病毒贴附到细胞上的量会越来越少,显示鱼腥草的确可以抑制病毒贴附在细胞上。
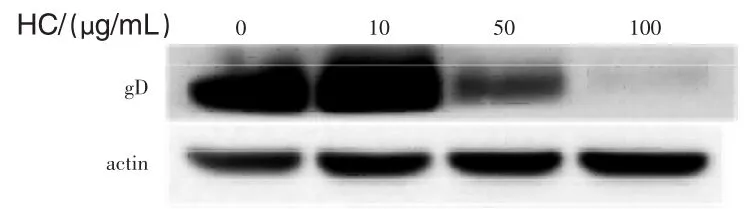
图5 Western blot发检测鱼腥草抑制病毒贴附细胞试验
2.5 鱼腥草抑制HSV吸附细胞以及穿透细胞试验 根据药物作用时间点的结果,鱼腥草应该在病毒感染细胞的前期抑制了HSV感染Vero细胞。因此进一步探讨鱼腥草抑制病毒进入的机制。将病毒感染预冷的Vero细胞给予不同浓度鱼腥草,待病毒吸附1.5 h后,用预冷的PBS将病毒洗去,并加入不含鱼腥草的培养液。结果显示加鱼腥草的试验组有效抑制CPE生成(P<0.05)。而在鱼腥草抑制HSV穿透细胞试验方面,利用病毒于4℃下只能吸附在细胞表面,无法穿透细胞的特性,先将病毒液与细胞于4℃作用一段时间,之后再加入药物并将已被病毒吸附的细胞于37℃培养。结果显示鱼腥草同时也可以抑制病毒穿透细胞(图6)。

图6 鱼腥草抑制HSV吸附细胞及穿透细胞试验
已知阿昔洛韦不会抑制细胞吸附,做为试验控制组。
2.6 检测核内VP16蛋白质及质内ICP4蛋白质表现 分别在病毒吸附以及穿透细胞时加入鱼腥草,收集细胞,萃取细胞核蛋白质以及细胞质蛋白质,分别以Western blot法侦测病毒VP16以及ICP4蛋白质表达,藉此确认鱼腥草是否会抑制病毒吸附以及穿透细胞。图7显示,随着鱼腥草浓度增加,病毒VP16蛋白质以及ICP4蛋白质表达量可看到被抑制的现象。显示鱼腥草确实可以抑制病毒吸附以及穿透细胞。

图7 通过细胞核内VP16以及细胞质内ICP4的表达观察鱼腥草抑制病毒贴附及穿透细胞效果
2.7 鱼腥草抑制病毒糖蛋白 D吸附细胞试验HSV的糖蛋白D可以和宿主细胞表面蛋白质结合而调控病毒进入细胞内,是病毒进入细胞很重要蛋白质。为了了解鱼腥草是否会经由结合病毒糖蛋白D而抑制病毒进入细胞,因此利用杆状病毒系统表现HSV-2的糖蛋白D。将10-5μg/cell的重组糖蛋白D加入Vero细胞内,在37℃下作用1 h,以PBS润洗细胞3次,之后将细胞刮下,以Western blot法侦测鱼腥草是否可以抑制糖蛋白D结合到细胞上。图8结果显示,随着鱼腥草浓度增加,抑制糖蛋白D结合到细胞上的作用就更加明显。

图8 鱼腥草抑制病毒糖蛋白D贴附细胞试验
由此试验推断鱼腥草可能是经由结合病毒糖蛋白D而抑制病毒进入细胞内。另外为了证明鱼腥草是否抑制gD蛋白质结合到细胞上而并非抑制gD蛋白质表达,将gD蛋白质与不同浓度鱼腥草在37℃下作用1 h,利用Western blot法分析gD蛋白质的量(图9),推测鱼腥草并不会改变糖蛋白D蛋白质的量。

图9 以Western blot法分析鱼腥草是否会抑制糖蛋白D表达
2.8 药物作用时间点试验 为了更进一步了解鱼腥草抑制病毒的机制,利用药物作用时间点试验探讨鱼腥草抑制HSV的时间点。以1 MOI的HSV-1感染细胞1 h,在感染后的不同时间点加入1 mg/mL的鱼腥草,于24 h后将细胞上清液移去,再以胰蛋白酶将细胞打下,悬浮于培养液后,冰冻解冻三次将病毒释放出,最后利用溶斑试验定量病毒。
图10显示,在经过感染12 h后加鱼腥草,仍然可以抑制98%以上的病毒量,因此推测鱼腥草除了可以抑制病毒进入细胞外,也有可能可以抑制病毒在细胞内的复制。
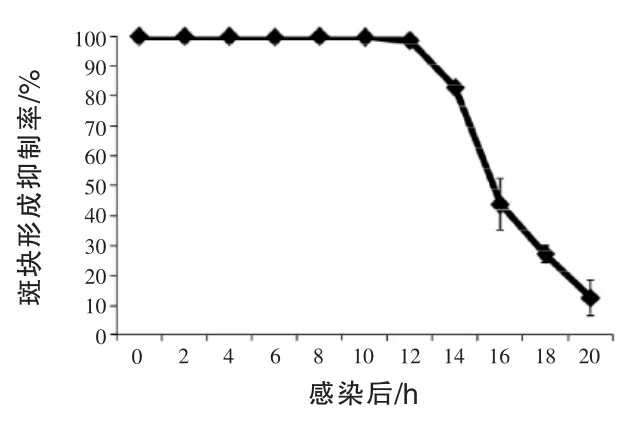
图10 测试鱼腥草抑制HSV-1感染的作用时间点试验
2.9 免疫荧光法检测鱼腥草抑制病毒蛋白质合成 目前推测鱼腥草除了可以抑制病毒进入细胞外,可能也可以抑制病毒在细胞内的复制。为了了解鱼腥草是抑制病毒复制的哪一步骤,将分别根据病毒蛋白质合成以及不同时期基因表现来探讨。首先研究鱼腥草是否会抑制病毒蛋白质合成。以1 MOI的HSV感染细胞1 h,等病毒进入细胞后以PBS润洗除去末进入细胞内的病毒,之后加入1 mg/mL的鱼腥草,24 h后将细胞收下,点在玻片上,待细胞风干固定后,以抗HSV (anti-HSV)的抗体侦测病毒蛋白质表达。结果显示加入鱼腥草后,病毒的荧光量减少很多(图11)。可见鱼腥草可以有效抑制病毒蛋白质的合成。
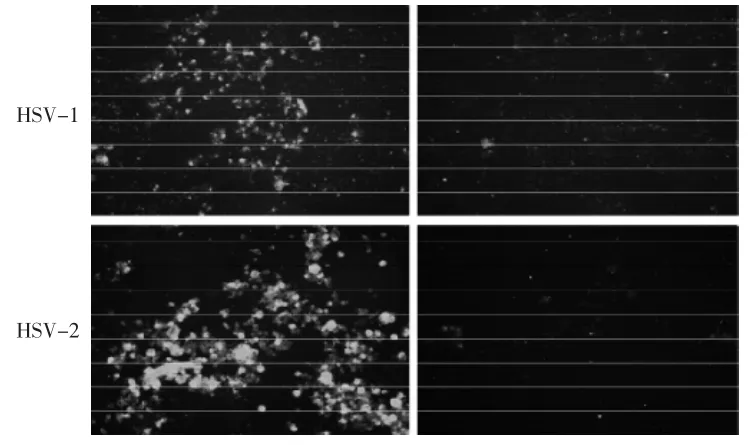
图11 利用荧光试验检测鱼腥草是否抑制HSV蛋白质合成
2.10 鱼腥草对人类细胞株毒性以及其抑制HSV-1感染人类细胞株的活性 先前所有的试验都是在猴肾细胞株Vero上所进行,为了了解鱼腥草对人类细胞是否具有毒性,因此选用了A549细胞(人类肺癌细胞)及HEp-2细胞(人类喉癌细胞)。首先以MTT试验研究鱼腥草对这两株细胞的毒性。将鱼腥草连续两倍稀释,加在预先培养好的细胞上,以MTT试验来测试。结果显示,鱼腥草对于A549以及HEp-2细胞的毒性作用和在Vero细胞上类似(P>0.05),与细胞对照组比较,即使使用最高浓度(50 mg/mL),细胞仍然可以维持50%以上的活性(P>0.05)(图12)。

图12 以病毒前处理试验分析B以及E抑制HSV试验
2.11 以溶斑减少试验分析不同分子量鱼腥草抗HSV活性分析 为了进一步探讨在鱼腥草中具有抗HSV活性的成分,使用QuixStand系统进一步将鱼腥草初萃取物依据分子量分成1000 Da以下、1000~3000 Da、3000 Da以上三个部分。利用溶斑减少试验进一步分析此三种不同分子量的鱼腥草抗HSV活性。结果显示此三个部分皆具有抗病毒成分,但其中以1000 Da以下的部分抑制效果最好 (P<0.01)(EC50=0.069 mg/mL)。而 1000~3000 Da以及 3000 Da以上的 EC50则分别为0.183、0.564 mg/mL。此部分鱼腥草抑制单纯疱疹病毒浓度结果总结于表1中。

表1 鱼腥草粗萃取液抑制单纯疱疹病毒剂量
2.12 以溶斑减少试验分析不同鱼腥草成分抗HSV活性分析 根据目前文献指出,鱼腥草内所含成分中大部分的物质分子量都在1000 Da以下,因此接下来将进一步分析这些分子中的抗HSV活性以及其机制。本试验选定了六种成分进行分析。首先利用溶斑减少试验分析此六种不同分子的抗HSV活性。根据显示,在这六种分子中,B、E以及F具有抗HSV-1以及HSV-2的活性(P<0.05)(表2)。
2.13 以病毒前处理试验以及Western blot法分析不同鱼腥草成分抑制HSV吸附细胞 之前结果显示鱼腥草可以经由直接和病毒颗粒作用而抑制病毒进入细胞。接下来将进一步分析在鱼腥草内是何种成分抑制病毒进入细胞。首先利用病毒前处理试验分析三种确定具有抗HSV活性的鱼腥草成分是否可以抑制病毒进入细胞。将不同浓度的化合物分别和病毒以及细胞在室温以及37℃下作用3 h,以100 PFU的病毒在37℃感染细胞1 h后,以PBS洗细胞3次,加入MC覆盖液。3 d后判读细胞溶斑数。

表2 不同鱼腥草成分抑制单纯疱疹病毒剂量

图13 MTT试验测试鱼腥草对HEp-2以及A549细胞的毒性
图13显示,B、E、F三种具有抗HSV活性的物质中只有B可以直接和病毒作用而抑制病毒进入细胞内。利用Western blot法做进一步确认。将病毒感染预冷的Vero细胞给予不同浓度鱼腥草,待病毒在4℃下吸附5 h后,以预冷的PBS将病毒洗去。之后将细胞刮下,以抗病毒糖蛋白D的抗体侦测鱼腥草是否可以抑制病毒进入细胞内。随着B浓度增加,抑制病毒结合到细胞上的作用就更加明显(前后对比P<0.05),而E则无法观察到此现象(图14)。显示 B确实可以抑制病毒吸附在细胞上(前后对比P>0.05)。
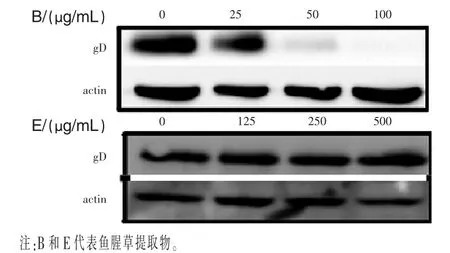
图14 以Western blot法分析B以及E抑制HSV贴附细胞
2.14 以Western blot法分析不同鱼腥草成分抑制HSV感染所引起的细胞NF-κB活化 鱼腥草除了可以经由直接和病毒颗粒作用而抑制病毒进入细胞,在病毒进入细胞后,鱼腥草也可以经由抑制细胞 NF-κB活化而减少 NF-κB结合至HSV的ICP0基因启动子而抑制HSV复制。接下来分析在鱼腥草内是何种成分抑制HSV感染所引起的细胞NF-κB活化。以1 MOI的HSV感染细胞1 h,等病毒进入细胞后以PBS洗去未进入细胞内的病毒,分别加入不同浓度的化合物,在感染后 3 h收集细胞,抽取细胞核蛋白质,以Western blot法检测是否可以抑制NF-κB的活化。图15显示,B可以抑制NF-κB的活化,而E则无此明显抑制现象。

图15 Western blot法分析B以及E抑制HSV感染所引起的细胞NF-κB活化
3 讨论与结论
研究结果显示,鱼腥草除了可抑制HSV-1,对于HSV-2以及Acyclovir resistant HSV-1(HSVAR)也具有很好的抑制效果。且鱼腥草在高浓度时对细胞无毒性。将鱼腥草初萃取物依据分子量分成 1000 Da以下、1000~3000 Da、3000 Da以上三部分,发现三部分皆具有抗病毒的成分,而其中又以1000 Da以下的部分抑制效果最好。因为利用QuixStand系统分离不同分子量物质时,无法完全将小分子量物质从大分子量中分离出来,故分子量3000 Da以上可能仍然含有部分的小分子量物质。因此分子量为 1000~3000 Da以及3000 Da以上的抗HSV活性有可能是因为分子量1000 Da以下残留所导致。
而在鱼腥草抑制病毒机制研究方面,结果显示鱼腥草可以抑制病毒感染的不同步骤。首先在病毒感染前,鱼腥草直接和病毒的糖蛋白D结合而抑制病毒进入细胞内。除了糖蛋白D可以和宿主细胞表面蛋白质结合并调控病毒进入细胞之外,糖蛋白B也扮演了重要角色,在病毒进入细胞后,鱼腥草也可以抑制因 HSV感染所引起的细胞NF-κB活化,进而减少NF-κB结合至 HSV的 ICP0基因启动子而抑制HSV复制。本研究证实了鱼腥草确实可以抑制因HSV感染所引起的细胞NF-κB活化,减少NF-κB结合至HSV的ICP0基因启动子而抑制HSV复制。
目前分析六种鱼腥草成分作用发现其中三种化合物B、E以及F具有抗HSV活性。其中B已被报道具有抗HSV的功效,然而其抑制HSV的机制尚未被证明。而E尚未有文献指出具有抗HSV的活性。本研究指出B可以抑制病毒进入细胞以及NF-κB活化,F与E抑制HSV的机制目前则尚未了解。B已知为抗氧化物质,目前有研究指出B可以抑制NF-κB活化而有抗氧化的功能。另外在HSV感染时也会促使NF-κB活化而增加细胞内氧化压力,且HSV的ICP27也可增加细胞内活性氧(reactive oxygen speces)以促使细胞凋亡。而B的抗氧化特性和抗病毒活性之间是否具有关联则需进一步试验证实。
[1]Gerald Kleymann,et al.New helicase-primase inhibitors as drug candidates forthetreatmentofherpessimplexdisease[J].NatureMedicine,2002,8:392~398.
[2]Goodkin M L,Ting A T,Blaho J A.NF-kappaB is required for apoptosis preventionduringherpessimplexvirustype1infection[J].JVirol,2003,77:7261~7280.
[3]James J,Crute,et al.Herpes simplex virus helicase-primase inhibitors are active in animal models of human disease[J].Nature Medicine,2002,8:386~391.
[4]KhanMTH,AtherA,ThompsonKD,etal.Extractsandmoleculesfrommedicinal plants against herpes simplex viruses[J]..Antiviral Res,2005,67:107~119.
[5]Kim I S,Kim J H,Kim J S,et al.The inhibitory effect of Houttuyniacordata extract on stem cell factor-induced HMC-1 cell migration[J].J Ethnopharmacol,2007,112(1):90~95.
In vitro experimental was used to study cordate Houttuynia whether has inhibitory effect on type 2 herpes simplex virus infection,and further explore its inhibition mechanism and utility of herpes simplex virus.The results showed that using dissolve freckle reduction experiment found that its original extract can inhibit the following three kinds of viruses: less than 1000 Da,1000~3000 Da,more than 3000 Da.Among them,less than 1000 Da can show the best effect.Through analysis of six kinds of cordate Houttuynia,it’s found that B,E and F had anti HSV activity,B can suppress the virus into the cell.Cordate Houttuynia can suppress the virus and virus particles directly into the cell.After the virus into cell,cordate houttuynia by inhibiting NF-KB cell to reduce NF-KB combine,then HSVICPO gene start and inhibit the replication of HSV.
herpes simplex virus;Houttuynia;antiviral effect
S816.3
A
1004-3314(2017)10-0010-07
10.15906/j.cnki.cn11-2975/s.20171003

