转基因油菜Ms8质粒分子的制备
余笑波, 沙跃兵, 张江东, 赵 雷, 陈 怡, 隋志伟
(1.浙江省计量科学研究院,浙江 杭州 310018; 2.中国计量科学研究院,北京 100013)
转基因油菜Ms8质粒分子的制备
余笑波1, 沙跃兵1, 张江东1, 赵 雷1, 陈 怡1, 隋志伟2
(1.浙江省计量科学研究院,浙江 杭州 310018; 2.中国计量科学研究院,北京 100013)
随着转基因产品的大规模商业化和我国大规模进口油菜籽,有效管控存在的风险显得非常必要和有意义,试验研究了质粒标准分子pMs8的研制过程,包括质粒分子的构建、纯度分析、特异性检测、均匀性检验、稳定性考察、定值。结果表明,该质粒分子标准物质的内源基因和外源基因的均匀性良好,没有扩增出所选的其他特异性基因,短期稳定性在14 d(处理温度大于25 ℃)发生显著变化,长期稳定性大于6个月,两种方法对外源基因拷贝数的定值结果相近,因此,pMs8是有准确量值的质粒标准分子。可替代性研究结果表明,其可替代基因组作为转基因油菜Ms8定量的阳性标准。
转基因油菜;数字PCR;质粒标准分子;Ms8
随着转基因技术的日趋成熟,转基因产品已经大规模商业化。目前,加拿大和美国是转基因油菜商业化的主要分布国,而我国还没有转基因油菜的商业化种植。我国平均每年从加拿大进口油菜籽100多万t,最多时达300万t,其中转基因油菜籽占比在60%以上。为了更好地对转基因作物及产品进行管理和风险控制,各国也出台了相应的转基因含量标识制度[1-2],我国于2002年出台《农业转基因生物标识管理办法》,规定了我国第一批实施标识管理的农业转基因生物目录,包括大豆、玉米、油菜籽、棉花种子等产品。Ms8Rf3是由德国拜耳公司利用转基因不育系Ms8(转Barnase与Bar基因)和转基因恢复系Rf3(转Barstar与Bar基因)培育的抗草胺膦杂交油菜,转基因油菜Ms8Rf1也由德国拜耳作物科学公司研制,1994年美国首先批准转基因油菜Ms8Rf3进行商业化种植。随之而来的,就需要对这些产品进行定性和定量检测。转基因油菜Ms8进行质粒标准分子具有以下一些优势,首先,相对于基体标准物质,质粒分子具有容易获得,稳定性好等特点;其次,通用性更好,研制的质粒标准分子适用于油菜中转入外源基因Ms8的定性和定量检测;其三,准确性好,质粒标准分子可以排除基体标准物质基体效应对定值的影响,直接作为产品进行定性、定量检测[3]。基于上述背景,本试验选取转基因油菜Ms8进行质粒标准分子的制备,其标准质粒分子不仅可用于产品的定性和定量检测,也可用于安全评价、仪器计量和实验室质量控制。
1 材料与方法
1.1 材料
1.1.1 试剂及材料
TaqMan*Universal Master Mix购自Applied Biosystems公司;正反向引物、TaqMan 探针均由英潍捷基(上海)贸易有限公司合成;质粒提取试剂盒购于麦伯生物技术有限公司;质粒pUC57simple、Oligo DNA、感受态细胞(大肠埃希菌)TOP10由英潍捷基(上海)贸易有限公司提供。
1.1.2 实验仪器
实时荧光定量 PCR仪为 ViiA 7(美国ABI公司);紫外可见分光光度计Cary60(美国Agilent公司);微量荧光分光光度计Qubit 2.0(美国Invitrogen公司);数字PCR(QuantStudio 3D Digital PCR System,美国Applied biosystems公司);电泳仪和凝胶成像系统(Gel DocTMXR+Gel Documentation System,美国Bio Rad公司)。
1.2 方法
1.2.1 质粒分子的制备
根据转化体的相关信息,选取油菜转化体特异性Ms8序列为外源基因,长130 bp[4],单拷贝;选取CruA基因片段序列为内源基因,长101 bp[4],单拷贝。具体序列见表1。
构建的质粒pUC57simple(含外源基因和内源基因)转化至大肠埃希菌受体菌TOP10(感受态细胞)中,筛选标记物为氨苄青霉素,确认为阳性克隆体后在LB培养液中进行大量培养,培养的菌液用质粒提取试剂盒进行提取和纯化。
提取的质粒分子采用琼脂糖凝胶电泳法和紫外可见分光光度计、微量荧光分光光度计来确定纯度和浓度,并选取Invitrogen公司进行测序来验证插入质粒片段的正确性。
1.2.2 实时荧光定量PCR法进行检测
实验中的内/外源引物和探针由英潍捷基(上海)贸易有限公司合成,具体序列见表2。荧光定量PCR的外源扩增体系为:2×MIX(12.5 μL)、正向引物和反向引物(1 μL,10 μmol·L-1)、探针(0.5 μL,10 μmol·L-1)、DNA模板(5 μL),其余超纯水补齐至25 μL。荧光定量PCR的内源扩增体系为:2×MIX(12.5 μL)、正向引物和反向引物(0.5 μL,10 μmol·L-1)、探针(0.5 μL,10 μmol·L-1)、DNA模板(5 μL),其余超纯水补齐至25 μL。扩增条件为:50 ℃,2 min;95 ℃,10 min,45个循环;95 ℃,15 s,60 ℃,60 s。
表1Ms8和CruA的基因序列
Table 1 Gene sequence ofMs8 andCruA

目标Target序列SequenceMs8(130bp)GTTAGAAAAAGTAAACAATTAATATAGCCGGCTATTTGTGTAAAAATCCCTAATATAATCGACGGATCCCCGGGAATTCCGGGGGAAGCTTAGATCCATGGATTTGTTATGATAACCAAAAACACCCTCCCruA(101bp)GGCCAGGGTTTCCGTGATATGCACCAGAAAGTGGAGCACATAAGGACTGGGGACACCATCGCTACACATCCCGGTGTAGCCCAATGGTTCTACAACGACGG
表2 外源基因(Ms8)和内源基因(CruA)引物及探针序列
Table 2 Primer and probe sequence of endogenous geneCruAand exogenous gene ofMs8

目标Target引物Primer序列(5’⁃3’)Sequence(5’⁃3’)扩增片段Amplifiedfragment/bpMs8Ms8⁃FGTTAGAAAAAGTAAACAATTAATAT⁃AGCCGG130Ms8⁃RGGAGGGTGTTTTTGGTTATCMs8⁃PFAM⁃AATATAATCGACGGATCCCCGG⁃GAATTC⁃TAMCruACruA⁃FGGCCAGGGTTTCCGTGAT101 CruA⁃RCCGTCGTTGTAGAACCATTGGCruA⁃PVIC⁃AGTCCTTATGTGCTCCACTTTCTG⁃GTGCA⁃TAM
1.2.3 特异性检验
为验证质粒分子的特异性,采用不同作物的转化体的内源和外源特异性引物对质粒分子进行扩增,扩增体系和扩增条件见1.2.2节。选取转基因玉米NK603、转基因大豆MON89788和转基因水稻TT51-1三种转化体的内、外源引物对质粒分子进行检测。
1.2.4 可替代性实验
实时荧光定量PCR试验时,平常实际检测的是基体转基因作物(基因组DNA),所以利用质粒标准分子去定量检测,存在质粒和基体的定量效果是否一致的问题[5]。为了解质粒分子是否可以替代基因组DNA对转基因作物进行检测,分别对质粒分子和基因组DNA进行系列浓度的qPCR扩增,扩增体系和扩增条件见1.2.2节,根据获得的结果,以浓度作为x轴,以拷贝数或Ct值为y轴,进行线性拟合,主要考察标准曲线的扩增效率和线性拟合度 (R2)。在比较质粒和基因组在扩增效率和扩增线性拟合度的基础上,分别以pMs8和基因组DNA(100%阳性标准品)为线性标准对样品基因组DNA(100%阳性样品)进行外源基因含量的测定,即计算外源基因拷贝数和内源基因拷贝数的比值。
1.2.5 均匀性分析
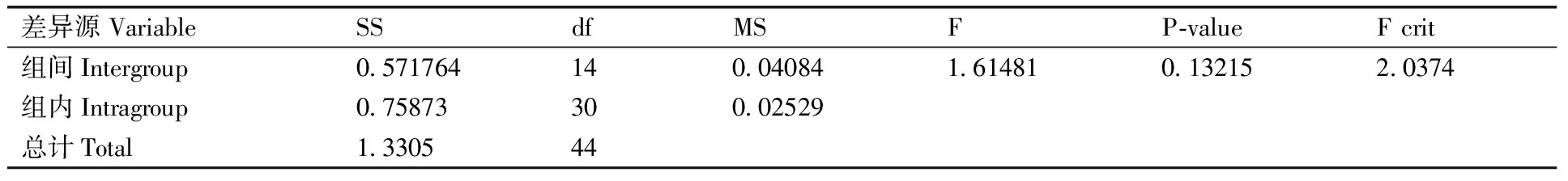
pMs8共制备了200管质粒分子,每管200 μL。随机抽取15管,分别标记1~15。对15管质粒分子(内源基因和外源基因)进行实时荧光定量PCR扩增实验,每管进行3次重复。利用F方差法对内源基因和外源基因扩增的Ct值进行分析。
1.2.6 稳定性分析
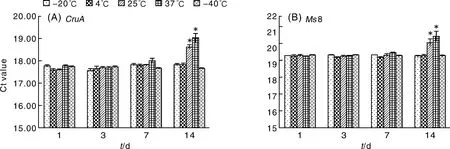
稳定性包括短期稳定性和长期稳定性,即在规定的时间间隔和环境条件下,标准物质的特性量值保持在规定范围内的性质[6]。短期稳定性测定:分别将标质粒分子存储在-20、4、25和37 ℃下,保存1、3、7、14 d,每个时间点在每个温度下各取3管,每管设置3个平行反应(N=3,n=3)。以存储在-40 ℃的作参照,通过qPCR对两个基因含量进行分析。将某一温度下的数据同-40 ℃(默认为稳定条件)相比较,分析外源与内标准基因的Ct值,通过双尾T检验,置信区间为0.95,当结果t>2.26(P为95%,n为9时,t=2.26)时表明发生显著变化,以*标记,即不稳定。
长期稳定性测定:将制备好的转基因油菜Ms8质粒分子标准物质放置在-20 ℃下进行长期稳定性考察,分别在1、2、3、6个月进行测定。每个时间点取3管,每管做3个平行,通过qPCR方法进行测定。数据经格拉布斯检验无离群值需要剔除,目前已统计6个月。考察以时间为横坐标(xi),分别以Ms8转化体特异性基因与内标准基因的Ct值为纵坐标(yi内和yi外),拟合成一条直线,斜率为b1,截距为b0。
1.2.7 定值
根据两种不同原理对转基因质粒进行拷贝数定值,采用微量荧光分光法(Picogreen法)测定质粒DNA的浓度,根据公式:每微升目标基因的拷贝数=6.022×1023×每微升质粒DNA的质量/核酸分子量,计算出pMs8的内源基因和外源基因的拷贝数。
利用dPCR[7-8]对内外源基因的拷贝数进行考察,Ms8的数字PCR扩增体系为:正向引物、反向引物、探针0.3 μL(10 μmol·L-1),DNA模板1 μL,超纯水补齐至15 μL。CruA的数字PCR扩增体系为:正向引物、反向引物0.6 μL,探针0.3 μL,DNA模板1 μL,超纯水补齐至15 μL。扩增条件为:96 ℃,10 min;60 ℃,2 min,39个循环;96 ℃,30 s;60 ℃,2 min。
2 结果与分析
2.1 质粒
2.1.1 质粒分子的构建
将一系列化学合成的转化体DNA片段(130 bp)和内标准基因DNA片段(101 bp)通过PCR的方法拼接成所需的序列,并将合成好的序列克隆入pUC57 simple载体(2 710 bp),其位置在载体中的BglⅡ酶切位点上。
2.1.2 质粒分子的纯化和质量分析
构建得到的含目标质粒的大肠埃希菌,以载体氨苄青霉素(Amp)抗性为筛选标记,在含有氨苄青霉素的LB培养液中进行大量培养,然后采用质粒提取试剂盒进行纯化提取。用紫外可见分光光度计测定所提取的DNA的纯度,D260/D280值应在1.8~2.0,D260/D230值应该大于2。测定结果见表3。
表3 pMs8质粒分子的紫外测定结果
Table 3 The UV measurement results of pMs8

pMs8123456D260/D2302 42 22 42 32 32 2D260/D2801 91 81 81 81 81 9
通过测序分析来验证构建质粒片段的正确性及插入的拷贝数,将提取的质粒DNA送到英潍捷基(上海)贸易有限公司进行测序分析,结果表明,连入的片段和设计的质粒一致,且目标基因均为单拷贝。
2.1.3 特异性检测
选取转基因玉米NK603、转基因大豆MON89788和转基因水稻TT51-1三种转化体的内、外源引物对质粒分子进行检测,结果见图1。除了pMs8质粒分子的内外源基因有扩增条带,为阳性之外,其他作物检测结果集空白对照(NTC)为阴性,因此,pMs8质粒分子的内外源基因针对其他引物特异性良好。
2.2 可替代性研究
2.2.1 qPCR扩增效率的分析评价
采用t检测(双尾)分析,一般认为在95%的置信区间内,取a=0.05,即临界P值。在实验次数为3次的情况下,其P值为2.78,若计算得的P值<2.78,即在95%的区间内,认为两组数据没有差别;若计算得的P值>2.78,即在小概率区间内,认为两组数据有显著性差别。比较基因组DNA和质粒DNA的扩增效率(表4)发现,两者的内外源基因的扩增效率并没有显著差别,表明质粒DNA的扩增效率与基因组 DNA的扩增效率是相似的。

M, Marker; 1, CruA; 2, zSSIIb; 3, RBE4; 4, lec; 5, NTC; 6, Ms8; 7, NK603; 8, TT51-1; 9, MON89788; 10, NTC图1 CruA内标准片段和pMs8外源片段特异性扩增Fig.1 Specific amplification of endogenous gene CruA and exogenous gene Ms8
2.2.2 线性拟合度的分析评价
由试验数据分析转基因基体Ms8标准物质和质粒分子pMs8的线性拟合度,并进行了比较。由表5可知,两者的内源线性拟合度和外源线性拟合度均无显著差异 (P<2.78) 。由上面分析可知,转基因基体Ms8标准物质和质粒分子pMs8的扩增效率和线性拟合度都具有相似性。在实际定量操作中可以互相替代作为阳性标准物质。
2.2.3 定值验证
采用1.2.2节的扩增条件,将pMs8和基因组DNA稀释到合适的浓度梯度,对样品基因组DNA进行定值(外源基因拷贝数和内源基因拷贝数的比值)测定。标准曲线每个浓度点进行3次重复,取其平均值作为标准曲线的Ct值,再根据线性公式和样品的Ct值,计算出同一样品在pMs8和基因组DNA为标准的外源基因与内源基因的比值,具体数据见表6和表7。
由表7可知,同一阳性样品在以质粒Ms8标准分子为标准模板的情况下,其外源基因拷贝数和内源基因拷贝数的比值为110.6%,在以基因组Ms8标准物质为标准模板的情况下,其外源基因拷贝数和内源基因拷贝数的比值为94.5%。进一步验证了pMs8可以替代基因组Ms8标准物质来对转基因油菜进行比值定量检测。
表4 基因组 DNA和质粒 DNA的扩增效率的比较
Table 4 Comparison of amplification efficiency of genomic DNA and plasmid DNA
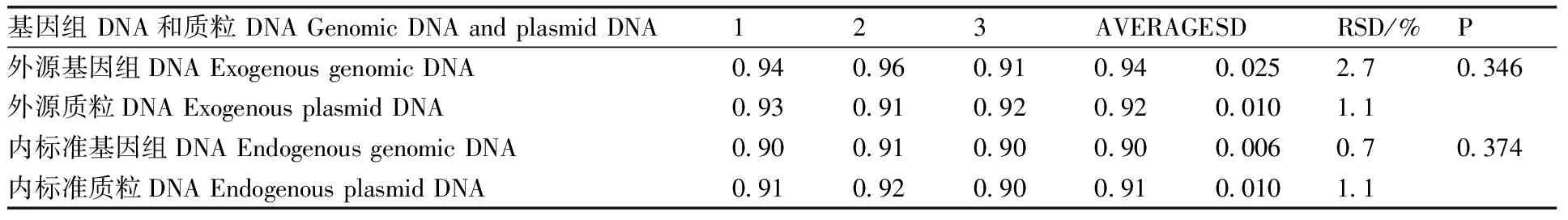
基因组DNA和质粒DNAGenomicDNAandplasmidDNA123AVERAGESDRSD/%P外源基因组DNAExogenousgenomicDNA0 940 960 910 940 0252 70 346外源质粒DNAExogenousplasmidDNA0 930 910 920 920 0101 1内标准基因组DNAEndogenousgenomicDNA0 900 910 900 900 0060 70 374内标准质粒DNAEndogenousplasmidDNA0 910 920 900 910 0101 1
表5 转基因基体Ms8标准物质和质粒分子pMs8的线性拟合度比较
Table 5 Comparison of linear fitting of pMs8 and transgenic matrixMs8
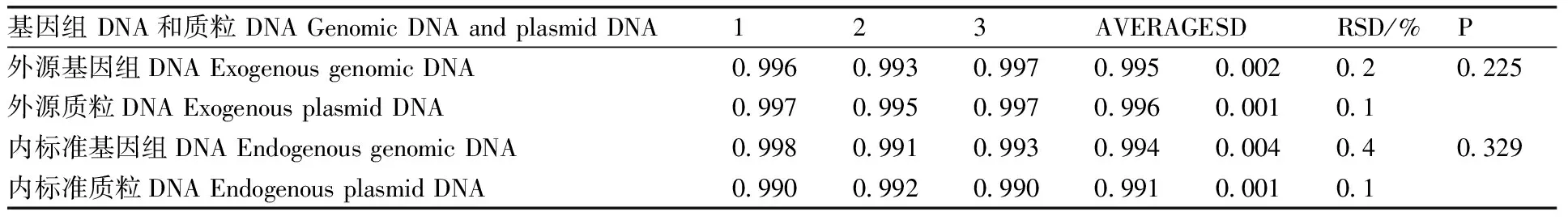
基因组DNA和质粒DNAGenomicDNAandplasmidDNA123AVERAGESDRSD/%P外源基因组DNAExogenousgenomicDNA0 9960 9930 9970 9950 0020 20 225外源质粒DNAExogenousplasmidDNA0 9970 9950 9970 9960 0010 1内标准基因组DNAEndogenousgenomicDNA0 9980 9910 9930 9940 0040 40 329内标准质粒DNAEndogenousplasmidDNA0 9900 9920 9900 9910 0010 1
表6 以pMs8和基因组为标准模板的内外源基因扩增结果
Table 6 Amplified results of PCR about endogenous gene and exogenous gene of DNA template pMs8 and genomics
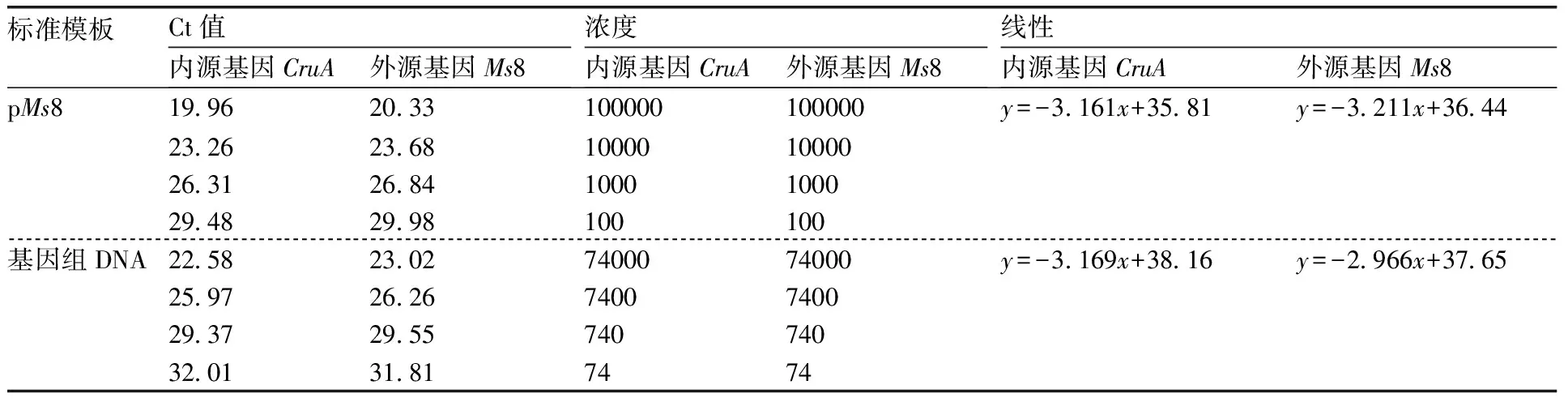
标准模板Ct值内源基因CruA外源基因Ms8浓度内源基因CruA外源基因Ms8线性内源基因CruA外源基因Ms8pMs819 9620 33100000100000y=-3 161x+35 81y=-3 211x+36 4423 2623 68100001000026 3126 841000100029 4829 98100100基因组DNA22 5823 027400074000y=-3 169x+38 16y=-2 966x+37 65 25 9726 267400740029 3729 5574074032 0131 817474
表7 以pMs8和基因组为标准模板的同一阳性基因组样品的外源/内源比值
Table 7 The ratio ofCruAtoMs8 for one positive sample which DNA template are pMs8 and genomics
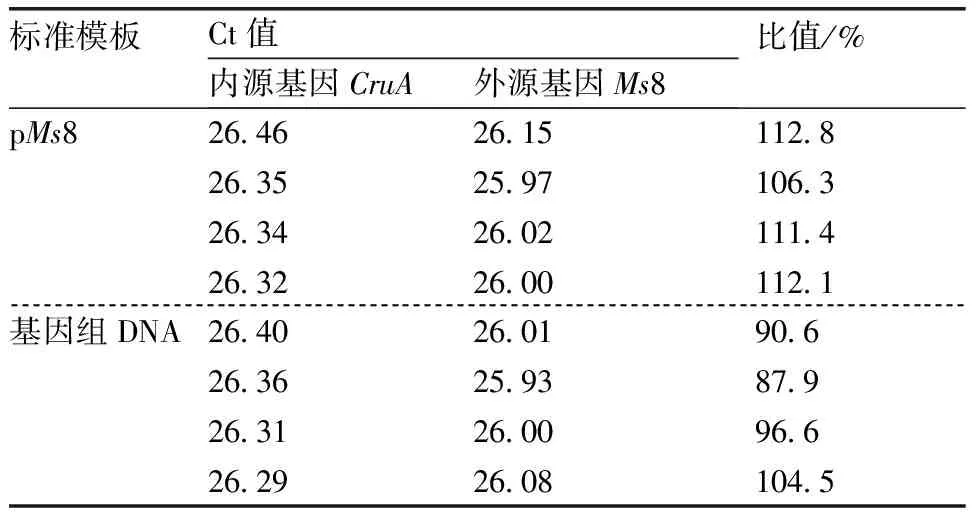
标准模板Ct值内源基因CruA外源基因Ms8比值/%pMs826 4626 15112 826 3525 97106 326 3426 02111 426 3226 00112 1基因组DNA26 4026 0190 6 26 3625 9387 926 3126 0096 626 2926 08104 5
2.3 均匀性检测
采用F检验的方法对实时定量PCR所获得的外源Ct值和内源Ct值进行分析,结果如表8和表9,从中可以看出,F 2.4 稳定性检测 按ISO导则35 标准物质/标准样品定值的一般原则和统计方法对标准物质的稳定性进行评价,图2为pMs8标准物质两个目标基因对应Ct值及统计分析结果。将-40 ℃默认为稳定条件,以此为参照,由图2可知,25和37 ℃条件下存放至第14天,外源基因和内标准基因对应的Ct比值都发生了显著变化。因此pZJIM-01标准物质在7 d内没有发生显著变化。 表8 pMs8外源基因荧光定量PCR扩增值均匀性分析 Table 8 The homogeneous of exogenous gene pMs8 by using FQ-PCR 差异源VariableSSdfMSFP⁃valueFcrit组间Intergroup0 44164140 0315461 513720 165872 0374组内Intragroup0 6252300 02084总计Total1 0668444 表9 pMs8内源基因荧光定量PCR扩增值均匀性分析 Table 9 The homogeneous of endogenous gene pMs8 by using FQ-PCR 差异源VariableSSdfMSFP⁃valueFcrit组间Intergroup0 571764140 040841 614810 132152 0374组内Intragroup0 75873300 02529总计Total1 330544 图2 pMs8内源基因(CruA)和外源基因(Ms8)短期稳定性检测结果(Ct值)Fig.2 The result(Ct value) of short term stability for pMs8(endogenous gene CruA and exogenous gene Ms8) 2.5 定值 本研究构建的是一个含内源基因CruA和外源基因Ms8的质粒DNA,采用核酸染料结合DNA双链,再进行荧光分光法定值。根据荧光分光法测定的浓度,采用浓度换算成拷贝数公式,算出拷贝数浓度。同时,采用dPCR对内外源基因的拷贝数进行考察。 表10 稳定性内源基因和外源基因检验结果 Table 10 The results of long term stability for endogenous gene and exogenous gene 时间(月)Time(month)内标准基因Endogenousgene外源基因Exogenousgene0(-40℃)17 9519 66117 7219 89217 8119 63317 7119 65617 6719 61|b1|0 0370 024S0 0190 025 2.5.1 荧光分光法确定内外源基因拷贝数参考值 荧光分光法对分装管中的原始溶液浓度进行平行重复4次测定,其平均值为3.36 ng·μL-1,根据其初始浓度,换算成拷贝数浓度,结果为内源基因和外源基因的拷贝数约为1.0×109copies·μL-1,测序结果表明插入的内外源拷贝数均为单拷贝。 图3 pMs8内源基因和外源基因长期稳定性数据统计Fig.3 The data statistics of long term stability for pMs8 2.5.2 dPCR法确定内外源基因拷贝数参考值 根据其初始浓度(微量荧光分光光度计测定),稀释到所需浓度100~2 000 copies·μL-1,利用dPCR对内源基因和外源基因拷贝数进行6次测定,结果显示,内源基因的平均拷贝数为8.38×108copies·μL-1,相对标准偏差为5.4%,外源基因的平均拷贝数为9.42×108copies·μL-1,相对标准偏差为5.7%。 本试验采用两种方法对样品进行浓度定值,结果表明数字PCR的外源基因及内源基因拷贝数和微量荧光分光光度计的测定值的拷贝数比较接近。通过微量荧光分光光度法来计算标准质粒的拷贝数,进而确定其外源基因片段和内源基因片段的拷贝数,结果为1.0×109copies·μL-1。通过dPCR的方法来计算外源基因片段和内源基因片段的拷贝数,其外源基因片段和内源基因片段的拷贝数分别为9.42×108copies·μL-1和8.38×108copies·μL-1,分装的各个单元具有良好的均匀性和稳定性。本文的可替代性研究表明,质粒标准分子pMs8可作为替代基体转基因油菜Ms8的阳性标准品,可用于实验室质量控制、仪器计量和转基因作物及产品的定性、定量分析。 [1] Principles for the risk analysis of foods derived from modern biotechnology( CAC/GL 44 , 2003)[EB/OL].[2016-10-28].http://wenku.baidu.com/link?url=va8IRAJrcNyEcx-1INmpRBl0BQhOt3hb-LB_h4jcIVXgXdcWf8hPUMGRSNZXH OxPGY5RWx8gSeO6K5Nee8I7SBMMYS0ZNPYffPSNq9b3Z1C [2] Guideline for the conduct of food safety assessment of foods derived from recombinant-DNA plants[EB/OL].[2016-10-28].http://www.mct.gov.br/upd_blob/0200/200112.pdf [3] LI L, ZHANG X J, WAN Y S, et al. Development of a novel reference plasmid for accurate quantification of genetically modified Kefeng6 rice DNA in food and feed samples[J].BioMedResearchInternational, 2013, 10: 134675. [4] MAZZARA M, BOGNI A, SAVINI C, et al. Event-specific method for the quantification of oilseed rape line Ms8 using real-time PCR-validation report and protocol-seeds sampling and DNA extraction of oilseed rape[M]. OPOCE, 2007. [5] 张玲, 盛灵慧, 王晶, 等. 转基因棉花Mon15985 质粒标准物质多家验证实验研究及不确定度分析[J]. 计量学报,2013,34(6): 597-601. ZHANG L, SHENG L H, WANG J, et al. Research on transgenic cotton Mon15985 plasmid reference material and uncertainty analysis[J].ActaMetrologicaSinica, 2013, 34(6):597-601.(in Chinese with English abstract) [6] 一级标准物质技术规范: JJF 1006-1994 [S]. 1994. [7] 李亮,隋志伟,王晶,等. 基于数字 PCR 的单分子DNA定量技术研究进展[J]. 生物化学与生物物理进展,2012,39(10):1017-1023. LI L, SUI Z W, WANG J, et al. Progress of digital PCR for single DNA quantification[J].ProgressinBiochemistryandBiophysics, 2012, 39(10):1017-1023. (in Chinese with English abstract) [8] 余笑波,崔海峰,俞晓平,等. 水稻淀粉分支酶基因(RBE4)作为转基因水稻基体标准物质的内标准基因的研究[J]. 农业生物技术学报,2012,20(11):1234-1243. YU X B, CUI H F, YU X P, et al. Studies on rice starch branching enzyme(RBE4)as endogenous reference gene for the matrix reference material of transgenic rice (OryzasativaL.)[J].JournalofAgriculturalBiotechnology, 2012, 20(11):1234-1243. (in Chinese with English abstract) (责任编辑 张 韵) Development of a reference plasmid of genetically modified rapeseedMs8 YU Xiaobo1, SHA Yuebing1, ZHANG Jiangdong1, ZHAO Lei1, CHEN Yi1, SUI Zhiwei2 (1.ZhejiangProvinceInstituteofMetrology,Hangzhou310018,China; 2.NationalInstituteofMetrology,Beijing100013,China) With the commercialization of genetically modified organism (GMO) and large scale of rapeseed imported to China, it was essential to manage and control existing risks. In this paper, genetically modified rapeseedMs8 was prepared including analysis on preparation, purity, homogeneity, stability and certified value. The results showed that the homogeneity of endogenous gene and exogenous gene of reference molecule was well. No other selective specific gene had been amplified by PCR. Short term stability of reference molecule was obviously changed which were stored at room temperature for 14 days, and long term stability of reference molecule was more than 6 months. The certified value of exogenous gene of reference molecule determined by microspectrophotometric method and digital PCR method was similar. Thus, pMs8 can be used as reference material, and the reference molecule is suitable for the rapid identification of modified rapeseedMs8 in unknown samples. transgenic rapeseed; digital PCR; reference plasmid;Ms8 http://www.zjnyxb.cn 10.3969/j.issn.1004-1524.2017.05.02 2016-12-29 浙江省质量技术监督局一般项目(20150211) 余笑波(1985—),男,浙江杭州人,硕士,工程师,主要从事生物化学分析仪器的检定和生物化学相关标准物质研制。E-mail: yuxiaobo.123@163.com S634.3 A 1004-1524(2017)05-0694-07 浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(5): 694-700 余笑波, 沙跃兵, 张江东,等. 转基因油菜Ms8质粒分子的制备[J].浙江农业学报,2017,29(5): 694-700.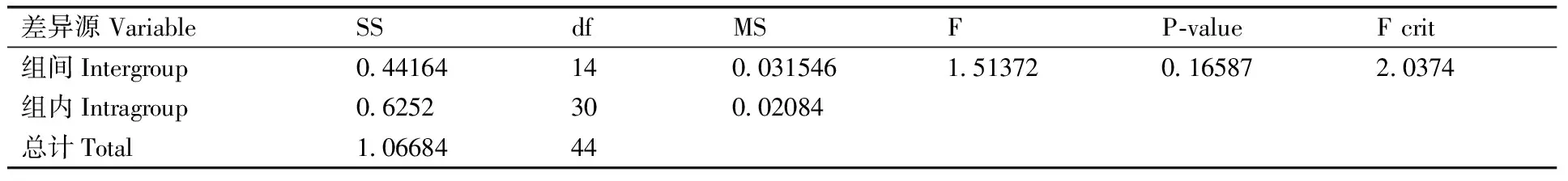
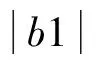
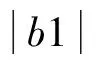


3 讨论

