软骨细胞对滑膜间充质干细胞诱导分化的影响
徐训安,丛 波,韩 龙,姚旺林,张仲文
软骨细胞对滑膜间充质干细胞诱导分化的影响
徐训安,丛 波,韩 龙,姚旺林,张仲文
目的 明确软骨细胞对滑膜间充质干细胞(synovial mesenchymal stem cells,SMSCs)向软骨细胞诱导分化情况的影响。 方法 (1)消化分离原代软骨细胞和SMSCs,测定细胞存活率、计数并传代培养。显微镜下观察各代软骨细胞和SMSCs生长情况,并对软骨细胞和SMSCs进行类别鉴定。(2)取第1代兔软骨细胞和第3代SMSCs共培养,第3代SMSCs单独培养作为对照组。(3)5 d、10 d后分别对SMSCs进行免疫荧光、免疫组化和流式细胞仪检测,通过观察SMSCs对Ⅱ型胶原的表达情况,了解软骨细胞诱导SMSCs向软骨细胞分化的影响。 结果 (1)原代软骨细胞刚分离初为卵圆形,贴壁后呈三角形或梭形。每100 mg软骨组织可分离出原代软骨细胞为3~5×105个,细胞存活率为90.0%。甲苯胺蓝染色后细胞质内可见散在蓝紫色异染颗粒。(2)原代滑膜细胞刚分离初为圆形,贴壁生长后可见少量较大卵圆形细胞和较多梭形细胞,传代后几乎都为梭形。每100 mg滑膜组织可分离出原代滑膜细胞为1~2×106个。SMSCs表面抗原CD68、CD90和CD105检测阳性率分别为0.5%、92.5%和90.7%。(3)对SMSCs的免疫组化、检测显示,与第1代软骨细胞共培养5 d、10 d后的第3代SMSCs对于Ⅱ型胶原的表达阳性率比单一生长的第3代SMSCs要高。(4)对SMSCs的流式细胞仪检测显示,与第1代软骨细胞共培养5 d、10 d后的第3代SMSCs对于Ⅱ型胶原的表达阳性率比单一生长的第3代SMSCs要高,并与免疫组化、检测的结果相吻合。 结论 与第1代软骨细胞共培养的SMSCs对Ⅱ型胶原表达持上升,出现向软骨细胞分化的现象。软骨细胞能较好地诱导SMSCs向软骨细胞分化。
软骨细胞;滑膜间充质干细胞;共培养;组织工程
根据基质的复合物组成不同,将软骨分为弹性软骨、纤维软骨、纤维弹性透明软骨[1],其中在关节活动中起主要作用的透明软骨再生修复极其困难[2],损伤后很少能够自愈,严重影响患者的运动功能和正常生活质量[3]。传统治疗关节软骨损伤的方法比较局限,长期随访结果均不太理想[4]。随着组织工程技术的发展自体软骨细胞移植术(autologous chon-drocyte implantation,ACI)为解决人体软骨组织修复问题提供了一种新的治疗途径。ACI技术中种子细胞的获取是一个非常重要的部分。有研究报道工程化软骨组织形成的最佳细胞浓度高达5×1010/L,最佳形成时间为第6周[5]。体外培养软骨细胞存在去分化现象,即随着传代次数及培养时间的增加,体外单层培养的软骨细胞失去原有的细胞生物特性,如Ⅱ型胶原、蛋白聚糖和SOX9等基因表达下降,Ⅰ型胶原表达增加[6],极大限制了组织工程软骨修复技术的发展。
本研究旨在通过创造一个与关节腔类似的微环境,将滑膜细胞用transwell小室与软骨共培养[7],再运用免疫组化和流式细胞仪检测,共培养后滑膜间充质干细胞(synovial mesenchymal stem cells,SMSCs)向软骨细胞的分化程度。
1 材料与方法
1.1 材料 4周龄的新西兰大耳兔,购自北京市昌扬西山养殖场,动物许可证号为[SCXK(京)2011-0010]。Transwell培养系统(北京优尼康生物科技有限公司);4%多聚甲醛溶液(北京索莱宝科技有限公司);胰蛋白酶(北京leagen公司);Ⅱ型胶原(上海sigma公司);吐温-20磷酸钠缓冲液(北京leagen公司);胎牛血清(上海Gibco公司);甲苯胺蓝染液(北京Leagene公司);鼠抗兔Ⅱ型胶原一抗(Abcam公司,美国);山羊抗鼠荧光二抗(Abcam公司,美国);鼠抗人CD68、CD90、CD105多克隆抗体(武汉博士德生物科技公司);Ⅱ型胶原免疫组化试剂盒(武汉博士德生物科技公司)。
1.2 细胞的分离培养、计数和存活率的测定 (1)细胞分离培养:取4周龄新西兰大耳兔处死,在无菌操作下取出膝关节处的软骨和滑膜组织。分别将软骨和滑膜组织块剪成1 mm3碎块,用加有双抗的磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗3次。分别置入装有等体积0.25%胰蛋白酶的小烧杯中,与磁力搅拌器一起置于培养箱中37℃恒温消化30 min。加培养液终止消化。随后将小烧杯内的碎块和液体一同吸出,过100目过滤网过滤,弃掉滤液,将碎块吸出,再用PBS洗3遍后,将软骨碎块放入装有等体积0.2%Ⅱ型胶原酶的烧杯中,将滑膜碎块放入装有等体积0.2%Ⅰ型胶原酶的烧杯中分别与磁力搅拌器一起置于培养箱中37℃恒温消化2 h。加培养液终止消化。再将小烧杯内的混悬液用100目过滤网过滤,取滤液放入15 ml离心管中(2000 r/min,8 min)。(2)弃上清,加入培养液悬浮细胞。(2)细胞计数及存活率测定:用细胞计数板对软骨细胞进行计数。滴少许台盼蓝染液于细胞计数板中,活细胞不被染色,死细胞被染成蓝色。调整细胞悬液浓度,以1×104个/cm2的浓度接种于25 ml细胞培养瓶中,放于恒温细胞培养箱中培养,2~3 d换液。如小烧杯内残留组织碎块较多,可再加入胶原酶进行2次消化。当培养瓶中细胞融合至80.0%以上时,可将细胞消化传代培养。
1.3 软骨细胞和SMSCs的鉴定 软骨细胞甲苯胺蓝染色对软骨细胞进行鉴定:将第1代软骨细胞制作成细胞爬片,用PBS轻轻冲洗3次,再浸泡于4%多聚甲醛溶液固定10 min。将爬片放入干净培养皿中,滴入适量0.1%甲苯胺蓝染液孵育4 h。无水乙醇冲洗3 min,干燥后显微镜观察并拍照。流式细胞术对SMSCs的鉴定:消化收集第3代SMSCs,调整细胞浓度在1×106/ml,分别加入异硫氰酸荧光素(fluorescein isothiocyanate,FITC)、藻红蛋白(P-phycoerythrin,PE)、抗原提呈细胞(antigen presenting cell,APC)标记的20 μl鼠抗人白细胞分化抗原68(cluster of differentiation 68,CD68)、CD90、CD105混匀,4℃避光孵育30 min,再用流式洗涤液洗涤离心3次后,加固定液重悬细胞,上机检测。
1.4 SMSCs与软骨细胞分层共培养体系的建立 消化收取第3代SMSCs,调整细胞浓度达2×105/ml,接种于4块带transwell小室的6孔细胞培养板,每孔加入1 ml SMSCs悬液,分为A1、A2、B1、B2四组,每组6个样本。同样消化收取第1代软骨细胞,调整细胞浓度达2×105/ml,A1、A2组在上层小室中加入1 ml第1代软骨细胞悬液;B1、B2组在上层小室中加入1 ml第3代SMSCs,作为对照组。用于流式细胞仪检测。
调整第3代SMSCs浓度为1×105/ml,接种于2块带transwell小室的24孔细胞培养板,培养板孔中,放入圆形载玻片,每孔加入500 μl SMSCs悬液,制成细胞爬片,同样分为C1、C2、D1、D2四组,每组4个样本。同样消化收取第1代软骨细胞,调整细胞浓度达1×105/ml,C1、C2组在上层小室中加入500 μl软骨细胞悬液;D1、D2组在上层小室中加入500 μl SMSCs悬液,作为对照组。用以进行免疫组化检测。
1.5 SMSCsⅡ型胶原表达的免疫组化 将之前建立好的共培养体系中,对C1、D1在共培养5 d后,C2、D2组10 d后,对共培养后的SMSCs进行Ⅱ型胶原表达的免疫组化检测。将有SMSCs贴附的细胞爬片取出,吐温-20磷酸盐缓冲液(phosphate buffer solution Tween-20,PBST)轻微冲洗3遍。在室温下,用4%多聚甲醛浸泡固定。再对细胞进行透化、封闭。加鼠抗兔Ⅱ型胶原一抗孵育,在4℃的温度下过夜。PBST轻轻漂洗3遍再加山羊抗鼠二抗孵育室温避光处孵育1 h。轻轻漂洗3遍。凉干后,封片,尽快观察。免疫组化:重复上述步骤,在加入二抗时选用博士德DBA(diaminobenzidine)显色二抗染色。
1.6 SMSCs对Ⅱ型胶原表达的流式细胞检测 将之前建立好的共培养体系中,A1、B1在共培养5 d后,A2、B2组10 d后,对共培养后的SMSCs进行Ⅱ型胶原表达进行流式细胞检测。消化收集细胞,加入鼠抗兔Ⅱ型胶原一抗孵育。PBS洗涤细胞3次。加入适用流式细胞检测的荧光二抗孵育。PBS洗涤细胞3次,再用冰冷PBS重悬细胞,立即上机检测。
1.7 统计学处理 采用SPSS 17.0统计软件对每组测得的6个样本细胞阳性率进行统计学分析,计量资料以x ±s表示,检测数据正态性及方差齐性后,对相同天数不同组间和同组间不同天数分别采用析因方差分析(ANOVA),如交互效应显著,再进行简单效应分析,以P<0.05 为差异有统计学意义。
2 结 果
2.1 软骨细胞的形态、细胞计数及存活率 原代软骨
细胞重悬后初为卵圆形,在培养箱培养2 d贴壁后和培养7 d后的软骨细胞镜下观察(图1)。高倍镜下可见软骨细胞胞核清楚,为圆形、椭圆形较多。每100 mg透明软骨约可分离出原代软骨细胞3~5×105个,台盼蓝染色测定细胞存活率约为90.0%。传代后的第1代软骨细胞贴壁多为梭形或多角形。
2.2 SMSCs的形态、细胞计数及存活率 原代滑膜细胞分为巨噬样和成纤维样细胞。48 h滑膜细胞大部分贴壁。巨噬样滑膜细胞胞体较大呈卵圆形,有不规则短状突起,胞核偏向一边;成纤维样滑膜细胞大量增殖生长,胞体呈梭形,胞核呈卵圆形位于细胞中央。培养7 d时成纤维样滑膜细胞铺满瓶底,巨噬样滑膜细胞几乎不可见(图1)。每100 mg滑膜组织约可分离出原代滑膜细胞1~2×106个,台盼蓝染色测定细胞存活率约为90.0%。传代后巨噬样滑膜细胞基本不见,而成纤维样滑膜细胞形态良好,呈指纹状生长。纤维样滑膜细胞由胚胎干细胞分化而来,在纯化传代后,第3代的滑膜细胞即为SMSCs。形态多成梭形和多角形(图1)。
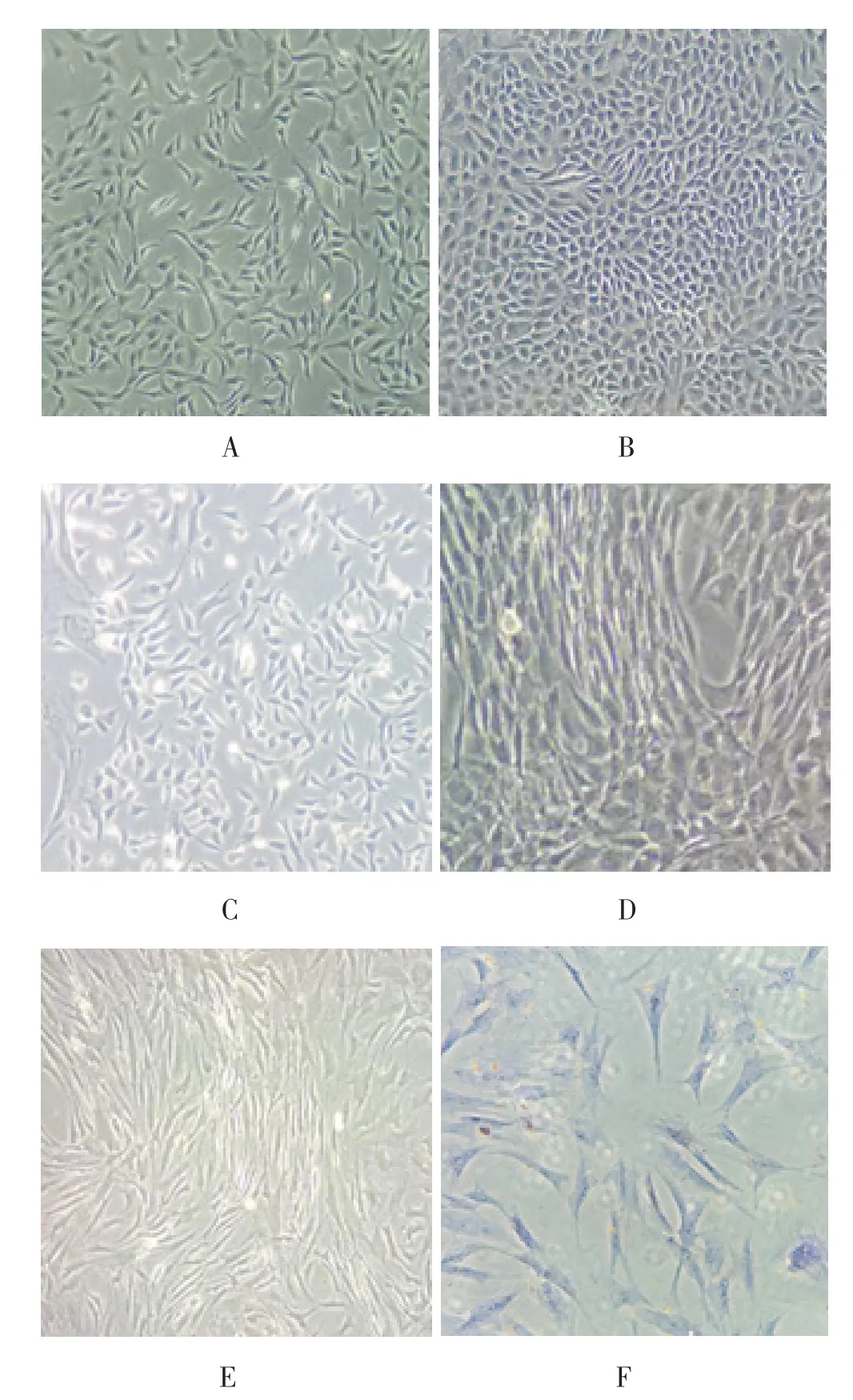
图1 贴壁软骨细胞和滑膜细胞及软骨细胞染色的镜下观察
2.3 软骨细胞和SMSCs的鉴定 软骨甲苯胺蓝染色:软骨细胞均被染色,可见较清晰细胞外形。细胞核深染,细胞质浅染,镜下观察可区分。有蓝紫色异染颗粒存在细胞质内(图1F)。SMSCs表面抗原的流式检测:CD68是巨噬样滑膜细胞表面标志抗原,SMSCs表面标志抗原也是多符合干细胞谱系的抗原,即CD90、CD105等。流式细胞检测结果第3代SMSCs,CD68阳性率0.5%,CD90阳性率92.5%、CD105阳性率95.0%。传代后,巨噬样滑膜细胞基本消失,多为成纤维样的SMSCs。
2.4 软骨细胞对Ⅱ型胶原表达的免疫组化 在共培养5 d后,检测C1、D1组的软骨细胞对Ⅱ型胶原表达免疫组化,镜下观察C1组的阳性率比D1组的阳性率表达要高。共培养10 d后,检测C2、D2组,镜下观察C2组阳性率表达比D2组高(图2)。
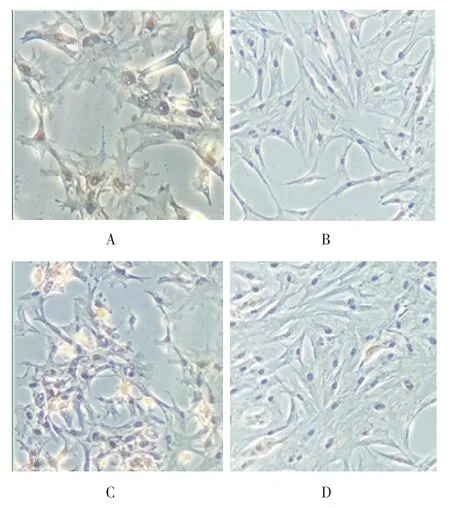
图2 两组SMSCs不同时间的Ⅱ型胶原表达(免疫组化染色×200)
2.5 软骨细胞对Ⅱ型胶原表达的流式细胞检测 在共培养5 d时,对A1、B1组SMSCsⅡ型胶原表达的6个样本进行流式细胞检测,共培养10 d时,对A2、B2组6个样本进行检测。结果显示:A1组Ⅱ型胶原表达率(11.2±1.2)%,B1组(3.3±1.2)%,A2组(17.4±1.9)%,B2组(3.6±1.1)%,共培养(F=362.60,P<0.001)及时间因素(F=28.45,P<0.001),交互作用显著(F=23.40,P<0.001);再进行简单效应比较发现,A1组的Ⅱ型胶原表达率高于B1组(F=100.75,P<0.001);A2组的Ⅱ型胶原表达率分别高于A1组(F=51.82,P<0.001)、B2组(F=285.34,P<0.001);B1、B2组表达率比较,差异无统计学意义。
3 讨 论
ACI经历了3次更新换代,从第1代到第3代基质诱导的自体软骨细胞移植技术(matrix-induced autologous chondrocyte implantation,MACI),其治疗效果得到了极大的改善和提高。张仲文等[8]报道了10例接受MACI治疗的患者,术后随访1~2 年,均有较好的愈后,生活质量显著提高。随着ACI技术的发展,对种子细胞这一重要内容和难点的研究也得到飞速发展[9]。
本研究为了解软骨细胞对于SMSCs诱导分化的影响,取同只实验兔子膝关节的滑膜和软骨组织,采用两步酶消化法获取细胞,进行分层共培养,模拟膝关节微环境。获取细胞时注意控制好消化时间、酶的浓度和适宜温度,使组织块酶充分混合消化,可以极大地增加细胞获取效率。软骨细胞的细胞核及细胞质均为酸性,甲苯胺蓝染液是一种碱性染料。细胞中阳离子能与之结合,染色为深蓝色的是细胞核,染色为浅蓝色的是细胞质。可对软骨细胞进行鉴定[10]。对于软骨细胞的鉴定可通过细胞形态观察和甲苯胺蓝染色[11]。软骨细胞贴壁后刚开始是三角或多角形,集落生长80%融合后,呈“铺路石”样典型的软骨细胞形态[12]。
原代滑膜细胞分为巨噬样滑膜细胞和成纤维样滑膜细胞,经过传代陪养后,增殖活性低的巨噬样滑膜细胞逐渐消失,剩下是增殖活性高的SMSCs。SMSCs也具有干细胞谱系的大部免疫表型,主要对CD9、CD105高度表达,巨噬样滑膜细胞对CD68具有特异性,因此对培养的细胞进行CD90、CD105和CD68的流式细胞检测,可以对SMSCs进行鉴定分离[13]。但是CD90、CD105对于SMSCs特异性较差,目前对于其较高特异性表达的鉴定还有待进一步研究。
共培养的技术分为接触式和非接触式,常见的共培方式有单层共培养、分层渗透共培养、悬浮共培养、细胞团块共培养、细胞层共培养及三维支架共培养[14]。在滑膜细胞和软骨细胞的共培养体系上,本研究采用的是插入式细胞培养皿,即transwell小室培养系统。培养时将小室插入杯内以建立细胞的共培养[7],从而很好地实现了关节腔内微环境的模拟。
滑膜细胞在传第3代后基本都为SMSCs,且具有较高增殖活性和分化原性。而软骨细胞在原代还处于生长潜伏期,在第1代具有较高增殖活性和细胞生物活性,继续体外培养从P2代以后开始出现去分化现象,细胞外基质的分泌改变,最先是蛋白糖胺聚糖的分泌减少,第3代开始出现Ⅱ型胶原、蛋白聚糖和SOX9等基因表达的下调[15,16]。因此,选取具有较高增殖活性剂分化原性的第3代SMSCs细胞与同样具有较高增殖活性和细胞生物活性的软骨细胞第1代进行共培养。
检测方法选择上,采用免疫组化及流式细胞检测。软骨细胞相对其他细胞特异性且大量的表达Ⅱ型胶原。在共培养组中,上层小室中的细胞也会分泌Ⅱ型胶原到培养液中,所以测量培养液中Ⅱ型胶原含量方法并不准确。而免疫组化及流式细胞检测能比较准确的反应下层SMSCs对Ⅱ型胶原在胞质内的表达情况[17]。根据SMSCs的增殖和分化的特性取5 d、10 d进行检测,培养时间过短,细胞增殖分化程度差异不明显,培养时间过长细胞贴满平底,对检测结果也会有影响[18]。对SMSCs免疫组化检测后,镜下的直观观察,再结合流式细胞仪检测的SMSCs对Ⅱ型胶原的表达阳性率值的统计学分析,可表明软骨细胞诱导SMSCs分化的影响。
本研究显示,SMSCs和软骨细胞共培养后对Ⅱ型胶原表达持续上升,出现向软骨细胞分化的现象,软骨细胞能有效诱导SMSCs向软骨细胞分化。但要完全明确其对SMSCs分化的影响,还需对SMSCs在基因水平,以及分化后细胞特性保持和利用上进行大量的研究。伴随着组织工程学的进步和发展,本研究相信随着研究的深入和探索,不久的将来或发展出能对软骨细胞大量增殖有能维持其性状表型的培养方式。
[1]Wilusz R E, Sanchez-Adams J, Guilak F. The structure and function of the pericellular matrix of articular cartilage [J]. Matrix Biol, 2014(39):25-32. DOI: 10.1016/ j.matbio.2014.08.009.
[2]Li H P, Sun T S, Zhu J L, et al. Analysis of the characteristics of articular cartilage lesions under knee arthroscopy in different age groups [J]. Zhongguo Gu Shang, 2012(25): 903-905.
[3]Vinatier C, Mrugala D, Jorgensen C. Cartilage engineering: acrucial combi-nation of cells, biomaterials and biofactors [J]. Trends Biotechnol, 2009, 27(5): 307-314. DOI: 10.1016/j.tibtech.2009.02.005.
[4]Capeci C M, Turchiano M, Strauss E J, et al. Osteochondral allografts: appli-cations in treating articular cartilage defects in the knee [J]. Bull Hosp Jt Dis, 2013, 71(1): 60-67.
[5]夏万尧, 曹谊林, 商庆新, 等. 组织工程化软骨组织形成的最佳细胞浓度和最佳形成时间的实验研究[J]. 中国修复重建外科杂志, 1999, 13(4): 244-248.
[6]Karlsen T A, Shahdadfar A, Brinchmann J E. Human primary articular chond-rocytes, chondroblasts-like cells, and dedifferentiated chondrocytes: differences in gene, microRNA, and protein expression and phenotype [J]. Tissue Eng Part C Methods, 2011, 17(2): 219-227. DOI: 10.1089/ten.TEC.2010.0200.
[7]Lincoln D W, Phillips P G, Bove K. Estrogen-induced ets-1 promotes capillary formation in an in vitro tumor angiogenesis model [J]. Breast Cancer Res Treat, 2003, 78(2): 167-178. DOI: 10.1023/A:1022904624054.
[8]张仲文,侯世科, 杨造成,等. 基质诱导的自体软骨细胞移植术修复膝关节软骨缺损10例术后2年的随访[J]. 中华关节外科杂志电子版, 2010, 4(6):17-21. DOI: 10.3877/cma.j.issn.1674-134X.2010.06.004.
[9]Zhang C, Wang L, Zhai T, et al. The surface grafting of graphene oxide withpoly( ethylene glycol) as a reinforcement for poly( lactic acid) nanocomposite scaffolds for potential tissue engineering applications [J]. J Mech Behav Biomed Mater, 2015(53): 403. DOI: 10.1016/j.jmbbm.2015.08.043.
[10]Erenpreisa J, Freivalds T. Anisotropic staining of apurinic acid with toluidine blue [J]. Histochem Cell Biol, 1979, 60(3): 321-325.
[11]Fletcher C D M. WHO classification of tumours of soft tissue and bone [M]. IARC Press, 2013: 95-104.
[12]张书丰, 王 弘, 张 涛, 等. AKT/mTOR信号通路在大鼠终板软骨细胞体外自然退变模型中的表达及意义[J]. 中华医学杂志,2016,96( 5 ): 375-379. DOI: 10.3760/ cma.j.issn.0376-2491.2016.05.013.
[13]陈 松, 符培亮, 丛锐军, 等. 人滑膜间充质干细胞的分离培养与鉴定[J]. 中国骨与关节外科, 2014(2): 146-151. DOI: 10.3969/j.issn.1674-1439.2014.02-013.
[14]王珊青, 徐剑炜. 干细胞共培养的方法及其分化诱导[J]. 中国组织工程研究, 2007, 11(11): 2122-2125. DOI: 10.3321/j.issn:1673-8225.2007.11.039.
[15]Pei M, He F. Extracellular matrix deposited by synoviumderived stem cells delays replicative senescent chondrocyte dedifferentiation and enhances redifferentiation [J]. J Cell Physiol, 2012, 227(5): 2163-2174. DOI: 10.1002/jcp.22950.
[16]徐 磊, 叶朝阳, 周 燕, 等. 体外传代培养兔关节软骨细胞的去分化现象[J]. 中国组织工程研究, 2013, 17(20): 3626-3634. DOI: 10.3969/j.issn.2095-4344. 2013.20.003.
[17]Wang L, Verbruggen G, Almqvist K F, et al. Flow cytometric analysis of the human articular chondrocyte phenotype in vitro [J]. Osteoarthritis Cartilage, 2001, 9(1): 73-84. DOI: 10.1053/joca.2000.0352.
[18]Klein G R, Vaccaro A R, Albert T J, et al. Efficacy of magnetic resonance imaging in the evaluation of posterior cervical spine fractures [J]. Spine( Phila Pa 1976), 1999, 24(8): 771-774. DOI: 10.1097/00007632-199904150-00007.
(2017-01-08收稿 2017-04-16修回)
(本文编辑 罗发菊)
Effects of chondrocytes on the induction of differentiation of synovial mesenchymal stem cells
XU Xun'an, CONG Bo, HAN Long, YAO Wanglin, and ZHANG Zhongwen. The Fourth Department of Orthopaedics, General Hospital of Chinese People's Armed Police Force, Beijing 100039, China
ZHANG Zhongwen, E-mail: zhang6816151@163.com
Objective This study was conducted to determine the effect of chondrocytes on the differentiation of SMSCs into chondrocytes. Methods (1) Primary chondrocytes and SMSCs were digested and separated, the cells were subcultured after their viability and counting were determined. The growth of chondrocytes and SMSCs was observed under microscope, and chondrocytes and SMSCs were identified. (2) The 1st generation chondrocytes and the 3rd generation SMSCs were co-cultured, and the 3rd generation SMSCs was cultured as control group. (3) After 5 days and 10 days, immunohistochemistry and flow cytometry were both performed on SMSCs, respectively. The effect of chondrocytes on the differentiation of SMSCs was observed by observing the expression of type Ⅱ collagen in SMSCs. SPSS17.0 software was used to analyze the data measured by flow cytometry. Results (1) Primary chondrocytes were oval in shape when it was just seperated out at the beginning, and displayed triangular or spindle after adherent to the wall. Each 100 mg cartilage tissue can be isolated from the original chondrocytes of about 3-5×105. The cell viability was determined to be about 90% by trypan blue staining. Toluidine blue staining after the cytoplasm can be seen scattered in the blue and purple stained particles. (2) Primary synovial cells just isolated early round, adherent growth can be seen after a small amount of larger oval cells and more spindle cells, after passing almost all are spindleshaped. Each 100 mg synovial tissue can be isolated from the original synovial cells of about 1.5×106. The positive rates of CD68, CD90 and CD105 in synoviocytes were 0.5%, 92.5% and 90.7%, respectively. (3) The immunohistochemical assay of SMSCs showed that the expression of 3rd generation SMSCs for type Ⅱ collagen was higher than that of single-growth 3rd generation SMSCs for 5 days and 10 days. (4) Flow cytometry analysis of SMSCs showed that the expression of 3rd generation SMSCs for type Ⅱ collagen was higher than that of single-growth 3rd generation SMSCs, which was consistent with the detection results of immunohistochemistry. Conclusions The expression of typeⅡ collagen in SMSCs cocultured with chondrocytes continued to increase and the differentiation into chondrocytes appeared. Chondrocytes can induce the differentiation of SMSCs into chondrocytes.
chondrocytes; synovial mesenchymal stem cells; co-culture; tissue engineering
R681.3;R686.7
10.13919/j.issn.2095-6274.2017.05.008
首都特色临床应用研究(Z161100000516013)
100039 北京,武警总医院骨四科
张仲文,E-mail: zhang6816151@163.com

