离子液体[BMIM]PF6酶法辅助提取姜黄挥发油工艺优化及成分分析
卢彩会,牟德华
离子液体[BMIM]PF6酶法辅助提取姜黄挥发油工艺优化及成分分析
卢彩会,牟德华*
(河北科技大学生物科学与工程学院,河北 石家庄 050000)
以姜黄粉为原料,采用响应面试验设计对离子液体[BMIM]PF6结合酶法提取姜黄挥发油的工艺进行优化。以离子液体添加量、纤维素酶添加量、液料比和酶解温度为自变量,姜黄挥发油含量为响应值,优化得到姜黄挥发油最佳提取工艺条件为离子液体添加量体积分数18%、纤维素酶添加量质量分数1.4%、液料比10∶1(mL/g)、 酶解温度50 ℃,在此条件下姜黄挥发油含量为5.0 mL/g。将水蒸气蒸馏和离子液体酶2 种方法制得的姜黄挥发油经气相色谱-质谱分析,分别鉴定出48 种和53 种组分,主要为倍半萜烯类物质,占相对含量的74.49%和84.57%。与水蒸气蒸馏法相比,离子液体酶法获得的姜黄挥发油组分也有所增加。2 种提取方法得到的姜黄挥发油其主要成分相同,但相对含量有所差别。其中水蒸气蒸馏法得到的芳姜黄酮、姜黄新酮和1-(1,5-二甲基-4-己烯-1-基)-4-甲基苯的相对含量为42.86%、13.71%和7.22%;离子液体酶法分别为39.37%、15.02%和9.12%。
离子液体[BMIM]PF6;纤维素酶;姜黄挥发油;组分
姜黄(Curcuma longa L.)是姜科属多年生草本植物姜黄的根茎,主要成分为姜黄素和姜黄挥发油[1]。姜黄挥发油的提取方法多为水蒸气蒸馏法,刘江等[2]采用水蒸气蒸馏法提取姜黄挥发油,并对提取工艺进行了优化,得到最适工艺条件下的姜黄挥发油得率为3.6%;李瑞敏等[3]采用水蒸气蒸馏法提取姜黄挥发油,姜黄挥发油得率仅为2.13%。也有一些报道采用新型的提 取方法,如微波辅助提取法、超声辅助提取法、超临界提取法亚临界水萃取法[4]。姜黄挥发油所含成分极其复杂,一般有数十种至数百种组分,主要有脂肪类化合物、萜类化合物、芳香族化合物,如姜黄烯、倍半萜烯、姜黄酮和脂肪酸等物质[5],且不同地区、不同品种、不同年份的姜黄得到的姜黄挥发油成分也有很大的差别[6]。姜黄挥发油具有抗氧化、抗癌、抗炎、抑菌、止咳等功能,多应用于食品、化妆品和医药行业[7-8]。
离子液体是指在室温或接近室温条件下呈现液态的、完全由阴阳离子所组成的盐,也称为低温熔融盐[9]。与传统有机溶剂相比,离子液体具有蒸汽压低、黏度范围宽、导电性好、溶解能力强及热稳定性高等优点[10]。同时,离子液体还具有良好的可设计性,即可通过阴阳离子组合或基团修饰来调节其极性、溶解度、疏水性或亲水性等物理化学性质[11]。离子液体与酶结合提取植物挥发油,离子液体既能作为生物催化介质,提高酶的活性及酶解产物的得率,也能作为萃取介质,替代传统的有机溶剂,提高萃取率和选择性[12]。同时离子液体能够有效稳定酶-底物的过渡态,降低反应活化能,使酶表现出较高的催化活性[13]。离子液体作为绿色溶剂,在环境友好型和回收利用方面具有无可替代的优势和潜力,非常适用于对安全性要求较高的医药和食品行业[14]。
本实验主要研究离子液体[BMIM]PF6酶法提取姜黄挥发油的工艺并对其进行优化,并且比较传统水蒸气蒸馏与离子液体酶2 种提取方法得到的姜黄挥发油成分的区别,为姜黄挥发油的提取及应用提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
姜黄,2014年产于印度卡纳塔克邦;纤维素酶(酶活≥400 U/mg) 上海宝曼生物科技有限公司;离子液体[BMIM]PF6(1-丁基-3-甲基咪唑六氟磷酸盐)(纯度99%) 上海成捷化学有限公司;柠檬酸、磷酸氢二钠(分析纯) 天津市津东天正精细化学试剂厂;乙醚(分析纯) 天津市永大化学试剂有限公司。
DELA 320型pH计 梅特勒-托利多仪器有限公司;HAHFY0500型挥发油提取装置 上海臻浔金属制品有限公司;7820-5975C气相色谱-质谱联用仪 美国安捷伦公司;AR1140电子分析天平 奥豪斯国际贸易(上海)有限公司。
1.2 方法
1.2.1 姜黄粉的制备
将姜黄自然晾晒干燥,用粉碎机打碎,过40 目筛,得到姜黄粉,使用前放置在80 ℃左右干燥箱中烘干至水分含量低于0.5%,放于干燥器中备用。
1.2.2 水蒸气蒸馏法提取姜黄挥发油
姜黄挥发油的水蒸气蒸馏法参照《中国药典》2015(一部)附录挥发油测定法[15],以挥发油含量为考察指标。姜黄挥发油含量按下式计算:
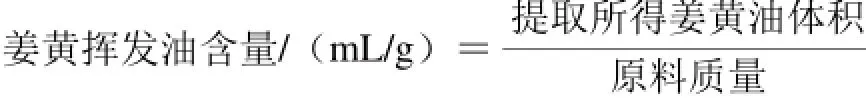
1.2.3 离子液体酶法协同辅助制取姜黄挥发油
称取10 g姜黄粉于圆底烧瓶中,加入纤维素酶和含离子液体[BMIM]PF6的磷酸氢二钠-柠檬酸缓冲液(pH 4.0)混匀,置于恒温摇床中酶解90 min,用挥发油提取装置提取15 min,读取体积并收集姜黄挥发油,无水硫酸钠进行干燥,放于4 ℃的冰箱中保存备用。将剩余提取液过滤去渣,取上清液静置,[BMIM]PF6、缓冲液双相体系会自动分层,上层为缓冲液,下层为离子液体相。通过分液漏斗进行分层后,收集下层离子液体相,经过旋转蒸发得到无色透明黏稠状液体,即离子液体[BMIM]PF6,可循环使用。
1.2.4 单因素试验
单因素试验各因素水平设置如下:离子液体添加量为总体积的0%、5%、10%、15%、20%、25%,纤维素酶添加量为样品质量的0%、0.2%、0.5%、1%、1.5%、2%,液料比为6∶1、8∶1、10∶1、12∶1、14∶1(mL/g),酶解温度为30、40、50、60、70 ℃。分别考察上述4 个因素对姜黄挥发油含量的影响,姜黄挥发油含量按1.2.2节公式计算。
1.2.5 提取工艺优化
在单因素试验结果的基础上,采用响应面分析法,利用Box-Behnken试验原理,以离子液体添加量、纤维素酶添加量、液料比及酶解温度为变量,姜黄挥发油含量为响应值,选用二次回归方程,进行精油提取工艺条件的优化,见表1。
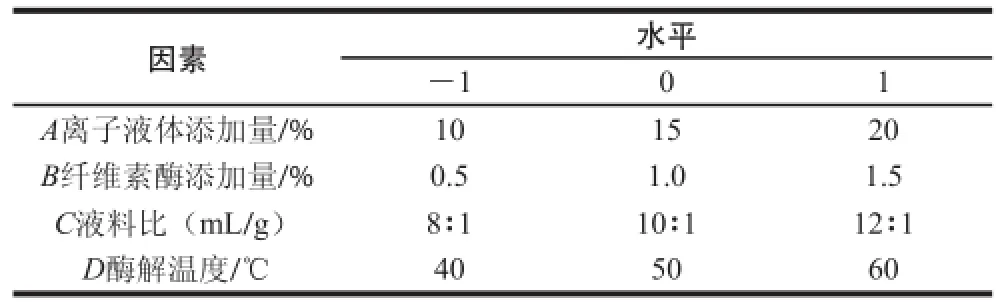
表 1 响应面试验因素与水平Table 1 Coded and actual values for the factors used in response surface analysis
1.2.6 姜黄挥发油组分的气相色谱-质谱测定
气相色谱条件:HP-5色谱柱(30.0 m×0.25 mm,0.25 μm);升温程序:初温50 ℃,保持2 min,以15 ℃/min的速率上升至128 ℃,保持2 min,再以1 ℃/min的速率上升至168 ℃,保持3 min,最后以15 ℃/min的速率上升至259 ℃并保持2 min;载气为高纯He;载气流量1 mL/min;进样量1 μL;进样口温度230 ℃;分流比5∶1。
质谱条件:电子电离源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;溶剂延迟时间3 min;质量扫描范围45~550 u。
1.2.7 定性和定量分析
通过对总离子流图中各色谱峰相应的质谱图进行NIST 05.1和NIST 05-ILB谱库检索,人工谱图解析,根据各峰的质谱裂片,参考有关文献[16-19]对各峰的英文名称及分子式等方面进行比较,并且根据保留时间和其他可靠的质谱标准进行最后鉴定。定量分析结果依据总离子流色谱峰的峰面积归一化法来计算各组分的相对含量。
2 结果与分析
2.1 单因素试验结果
2.1.1 离子液体添加量对姜黄挥发油含量的影响
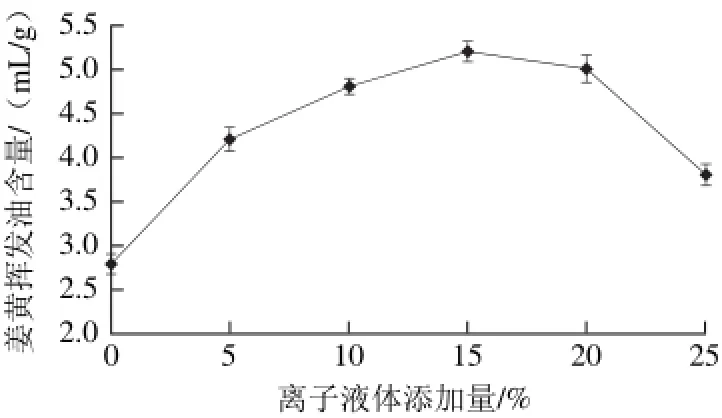
图 1 离子液体添加量对姜黄挥发油含量的影响Fig. 1 Effect of ionic liquid concentration on the extraction yield of curcuma oil
离子液体具有较强的催化活性,在与酶结合提取植物挥发油时,酶活性都比其在有机溶剂中高[20]。如图1所示,在离子液体添加量为0%~15%时,姜黄挥发油的含量随着离子液体添加量的增加而增加,当添加量达到15%时,姜黄挥发油含量达到5.2 mL/g,其后随着离子液体添加量的增加,姜黄挥发油的含量反而下降。适当的离子液体添加能够增强纤维素酶的催化活性,当离子液体添加量较低时,则可能影响非酶水解反应速率,从而使反应初速率受到影响。但当离子液体添加量过大时,由于其本身较高的黏度,使得溶剂提取体系的黏度增大,降低了传质速率,阻碍了纤维素酶与底物的结合,从而影响到纤维素酶的催化作用,降低酶解速率[21]。
2.1.2 纤维素酶添加量对姜黄挥发油含量的影响
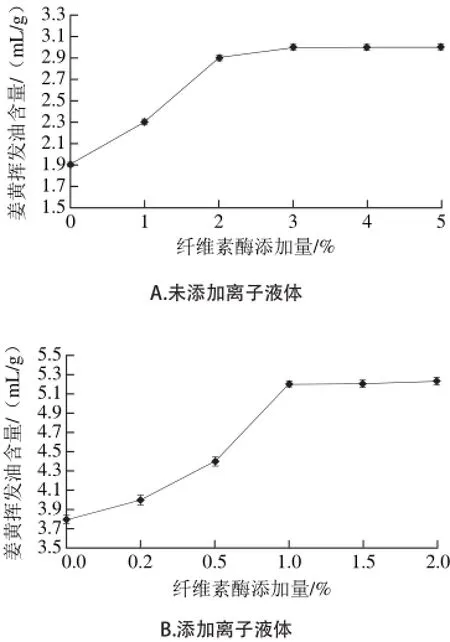
图 2 纤维素酶添加量对姜黄挥发油含量的影响Fig. 2 Effect of cellulase concentration on the extraction yield of curcuma oil
姜黄细胞壁主要由纤维素、半纤维素组成,纤维素容易产生分子内氢键及纤维素链之间的分子间氢键,并聚集形成纤维素微纤丝。当提取溶液中加入适量的纤维素酶时,能有效地破坏姜黄的细胞壁,提高提取效率[22]。如图2A所示,在不加离子液体的情况下,姜黄挥发油含量随着纤维素酶添加量的增加而增加,当纤维素酶添加量达到3%时,姜黄挥发油含量为3.0 mL/g。如图2B所示,纤维素酶添加量为0%时,加入离子液体后的姜黄挥发油含量明显提高。原因是离子液体本身对细胞壁具有很好的溶解性,能竞 争性地与纤维素形成氢键,且对纤维素的活性位点具有更强的亲和力,更大程度地破坏纤维素微纤丝的氢键网状结构,而这种作用力能够改变纤维素的特性,破坏它的三级结构,溶解纤维素,进而显著提高萃取效率[23]。当纤维素酶添加量在0%~1%时,姜黄挥发油含量随着加酶量的增加而增加,当纤维素酶添加量为1%时姜黄挥发油含量达到最高值5.2 mL/g,此时纤维素酶的添加量已能够将姜黄细胞壁破坏完全,添加过量的纤维素酶对提高含量没有很大的影响。
由图2A、B比较可知,随着离子液体的加入,纤维素酶添加量从3%降低到1%,姜黄挥发油最高含量从3 mL/g升高到5.2 mL/g。原因可能是[BMIM]PF6是疏水性的离子液体,能够形成疏水性的微环境,有利于保持酶的活性[24];且酶在疏水性的离子液体中的表观活化能较低,能够增加与底物的亲和能力,从而使酶的活性增强,提高酶的转移活性[25]。也可能是因为[BMIM]PF6影响了姜黄细胞壁的离子化状态,从而使底物的键更易与纤维素酶结合[26]。
2.1.3 液料比对姜黄挥发油含量的影响
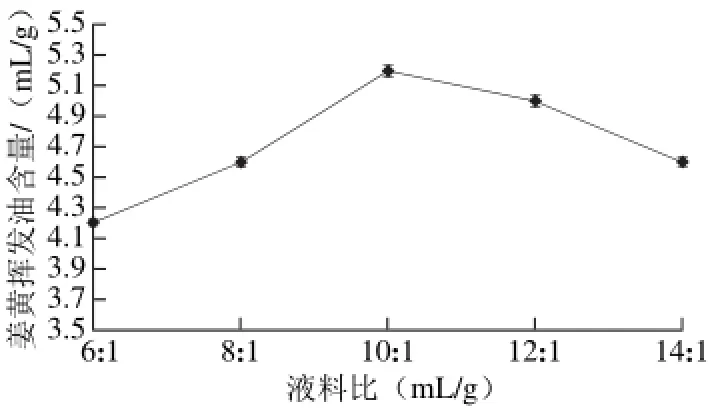
图 3 液料比对姜黄挥发油含量的影响Fig. 3 Effect of liquid-to-solid ratio on the extraction yield of curcuma oil
由图3可知,当液料比过低时,姜黄挥发油含量比较低,且提取时出现焦糊现象。当液料比为10∶1时,姜黄挥发油含量达到最大值为5.2 mL/g,而后随着液料比的增加,姜黄挥发油的含量并没有继续增大,反而出现了减小的趋势,原因是液料比不断增加,使得酶的浓度降低,导致酶解反应的降低,降低了提取效果。
2.1.4 酶解温度对姜黄挥发油含量的影响
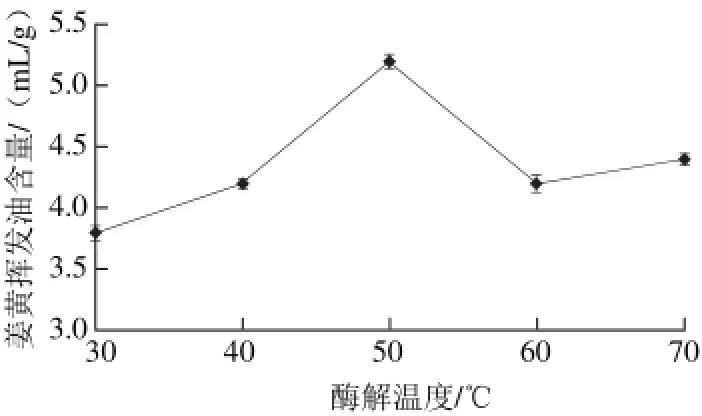
图 4 酶解温度对姜黄挥发油含量的影响Fig. 4 Effect of hydrolysis temperature on the extraction yield of curcuma oil
由图4可知,当酶解温度在50 ℃时,酶解速率最高,姜黄挥发油的含量为5.2 mL/g。当酶解温度70 ℃时,姜黄挥发油的含量又出现上升的趋势,可能是因为此时虽然酶的活性很低,但高温也能破坏姜黄的细胞壁,有利于挥发油的提取,从而增加了姜黄挥发油的含量。
2.2 响应面优化试验设计及结果
2.2.1 Box-Behnken试验设计及结果
以离子液体添加量、纤维素酶添加量、液料比、酶解温度为自变量,以姜黄挥发油含量为响应值,响应面试验分析及结果如表2所示。
表 2 响应面试验分析及结果Table 2 Experimental design and results for response surface analysis
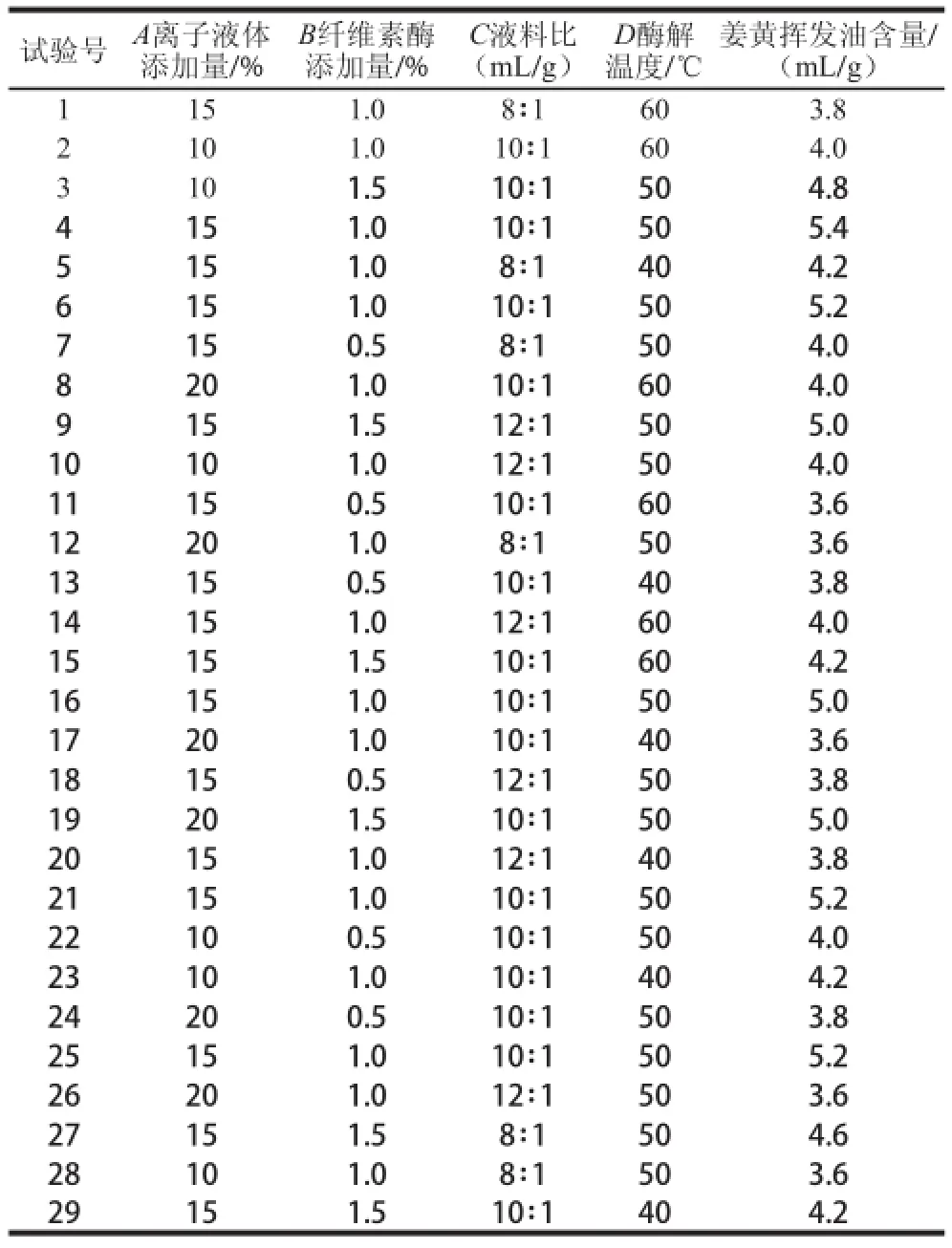
表 2 响应面试验分析及结果Table 2 Experimental design and results for response surface analysis
试验号A离子液体添加量/ %姜黄挥发油含量/(m L / g)1 1 5 1 . 0 8∶1 6 0 3 . 8 2 1 0 1 . 0 1 0∶1 6 0 4 . 0 3 1 0 1 . 5 1 0∶1 5 0 4 . 8 4 1 5 1 . 0 1 0∶1 5 0 5 . 4 5 1 5 1 . 0 8∶1 4 0 4 . 2 6 1 5 1 . 0 1 0∶1 5 0 5 . 2 7 1 5 0 . 5 8∶1 5 0 4 . 0 8 2 0 1 . 0 1 0∶1 6 0 4 . 0 9 1 5 1 . 5 1 2∶1 5 0 5 . 0 1 0 1 0 1 . 0 1 2∶1 5 0 4 . 0 1 1 1 5 0 . 5 1 0∶1 6 0 3 . 6 1 2 2 0 1 . 0 8∶1 5 0 3 . 6 1 3 1 5 0 . 5 1 0∶1 4 0 3 . 8 1 4 1 5 1 . 0 1 2∶1 6 0 4 . 0 1 5 1 5 1 . 5 1 0∶1 6 0 4 . 2 1 6 1 5 1 . 0 1 0∶1 5 0 5 . 0 1 7 2 0 1 . 0 1 0∶1 4 0 3 . 6 1 8 1 5 0 . 5 1 2∶1 5 0 3 . 8 1 9 2 0 1 . 5 1 0∶1 5 0 5 . 0 2 0 1 5 1 . 0 1 2∶1 4 0 3 . 8 2 1 1 5 1 . 0 1 0∶1 5 0 5 . 2 2 2 1 0 0 . 5 1 0∶1 5 0 4 . 0 2 3 1 0 1 . 0 1 0∶1 4 0 4 . 2 2 4 2 0 0 . 5 1 0∶1 5 0 3 . 8 2 5 1 5 1 . 0 1 0∶1 5 0 5 . 2 2 6 2 0 1 . 0 1 2∶1 5 0 3 . 6 2 7 1 5 1 . 5 8∶1 5 0 4 . 6 2 8 1 0 1 . 0 8∶1 5 0 3 . 6 2 9 1 5 1 . 5 1 0∶1 4 0 4 . 2 B纤维素酶添加量/ % C液料比(m L / g)D酶解温度/℃
2.2.2 模型方程的建立及显著性检验
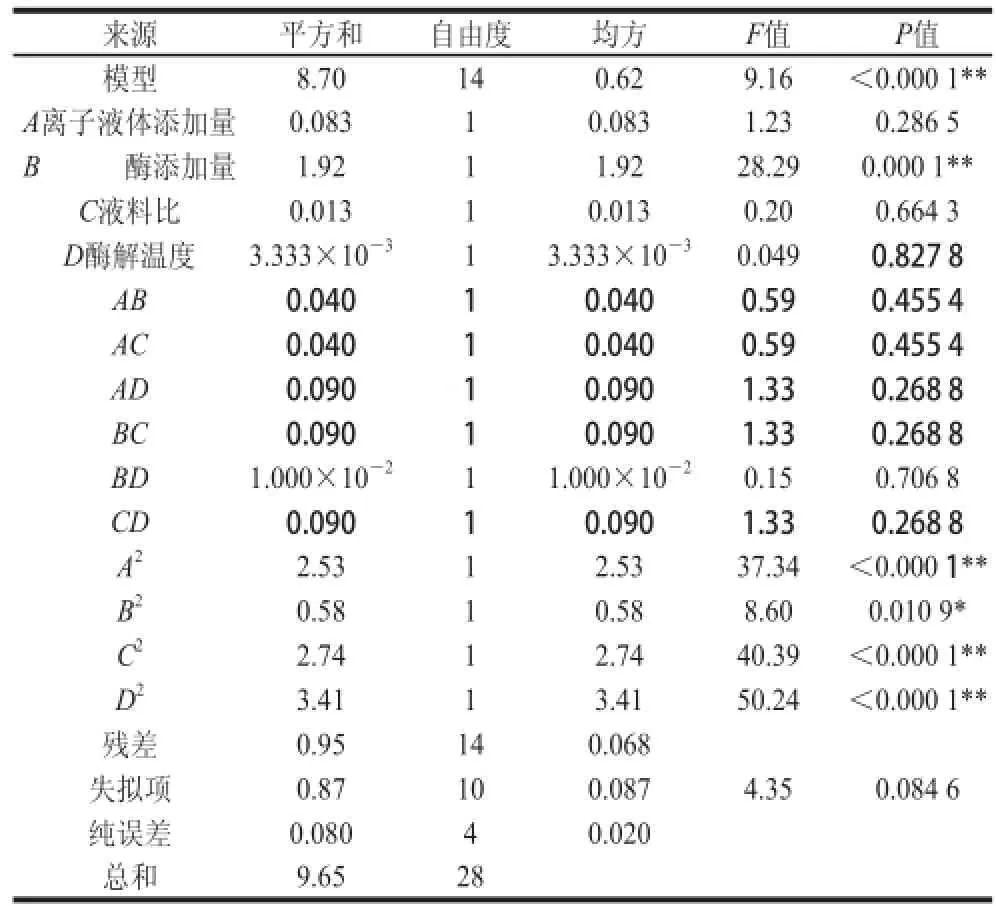
表 3 回归模型的方差分析Table 3 Analysis of variance of the fitted quadratic regression model for extraction yield
采用Design-Expert软件对表2所得的姜黄挥发油含量试验数据进行回归拟合,如表3所示,得到A离子液体添加量、B纤维素酶添加量、C液料比、D酶解温度为自变量对姜黄挥发油含量的回归方程:姜黄挥发油含量
5.200 -0.083A+0.400B+0.033C-0.017D+0.100AB-0.100AC+0.150AD+0.150BC+0.050BD+0.150CD-0.630A2-0.300B2-0.650C2-0.720D2。
通过回归模型的方差分析表得出,整体模型的P值小于0.000 1,表明二次模型极显著,失拟项P0.084 6大于0.05,不显著,表明此二项模型拟合有效,可以分析和预测各因素与响应值的关系。各影响因素的主次顺序为:B纤维素酶添加量>A离子液体添加量>C液料比>D酶解温度。
2.2.3 各因素的响应面分析
响应面图形是响应值对各试验因素A、B、C、D所构成的三维空间的曲面图,从响应面分析图上可形象地看出最佳参数及各参数之间的相互作用。根据回归方程得出不同因素的响应面分析图及相应等高线图结果见图5。各因素交互作用对姜黄中姜黄挥发油含量的影响,若曲线越陡峭,则表明该因素对姜黄挥发油含量的影响越大,相应表现为响应值变化的大小[27]。而由等高线图可以看出存在极值的条件应该在圆心处。从图5可以看出,纤维素酶添加量对姜黄挥发油含量影响最大,表3回归分析结果也与此相吻合,纤维素酶添加量的P值为0.000 1,达到了极显著水平。
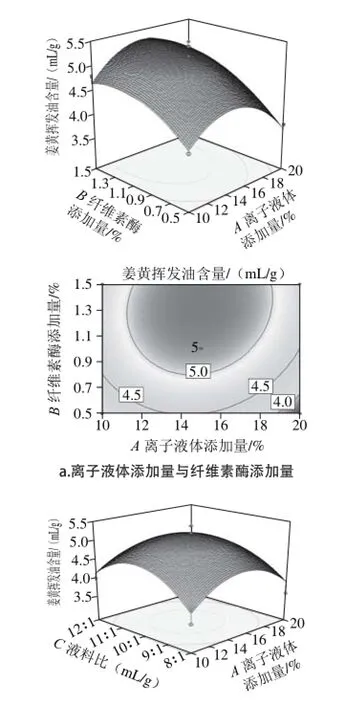
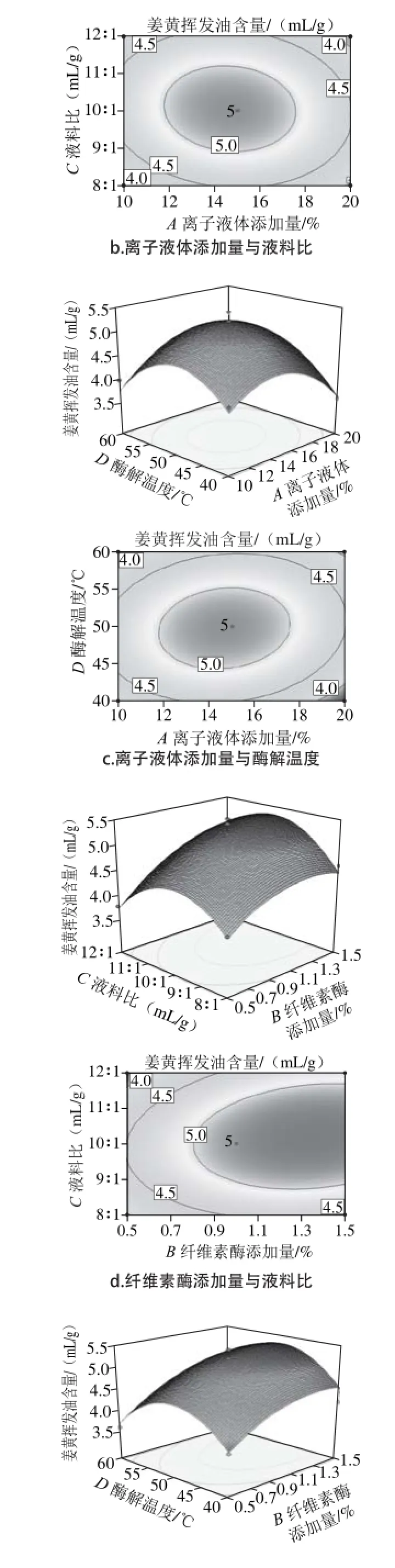
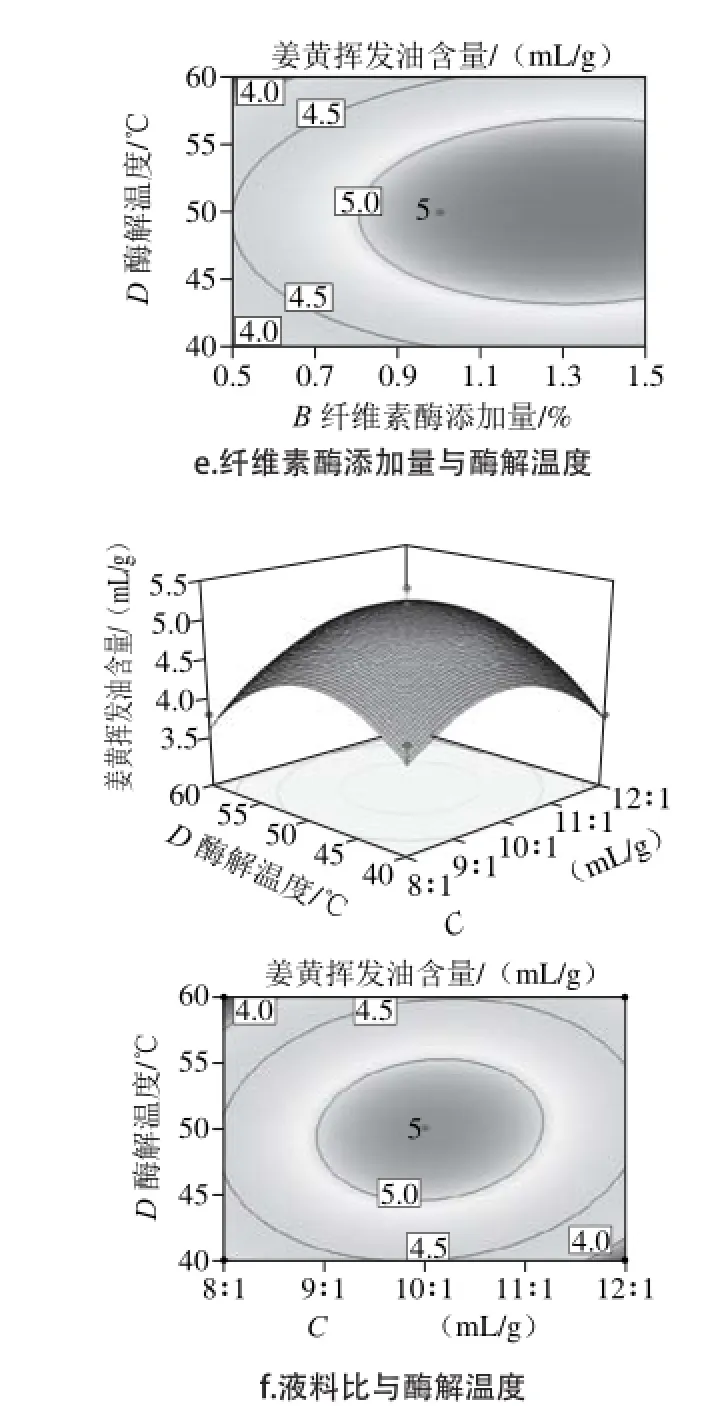
图 5 两因素交互作用对总姜黄挥发油含量的响应面和等高线图Fig. 5 Response surface and contour plots for the effect of operating parameters on the extraction yield of curcuma oil
2.3 最佳试验条件预测与验证
由Design-Expert软件可求得回归方程的极值点,得到姜黄挥发油提取最佳工艺条件为:离子液体添加量18.43%、纤维素酶添加量1.40%、液料比10.15∶1、酶解温度50.95 ℃。所用浸提液为pH 4的磷酸氢二钠-柠檬酸缓冲溶液,酶解时间为90 min,在此条件下姜黄挥发油的理论预测含量为5.040 53 mL/g。对最佳提取条件进行验证实验,考虑到实际操作,将最佳工艺参数修正为:离子液体添加量18%、纤维素酶添加量1.4%、液料比10∶1、酶解温度50 ℃。测得姜黄挥发油含量为5.0 mL/g,与预测值接近。
2.4 姜黄挥发油提取物的气相色谱-质谱分析
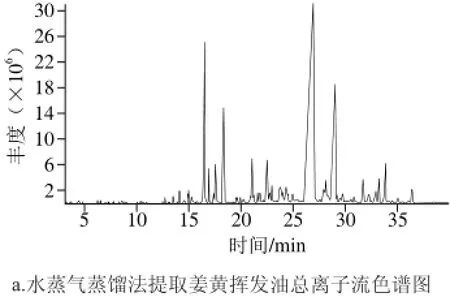
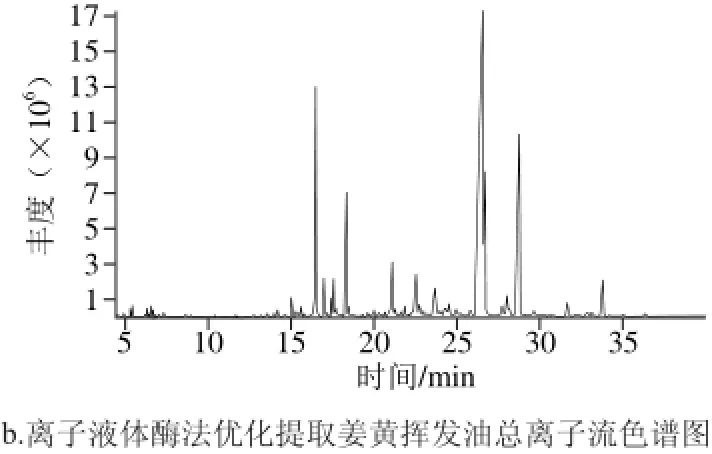
图 6 姜黄挥发油GC-MS总离子流色谱图Fig. 6 Total ion current chromatograms of curcuma oils extracted by different methods
按最佳实验条件对2 种提取方式得到的姜黄挥发油化学成分进行测定分析,如图6所示。采用质谱检索和查阅相关文献对其定性,定性结果及相对含量见表4。

表 4 姜黄挥发油中化学成分的气相色谱-质谱鉴定结果及各化合物的相对含量Table 4 Chemical components of curcuma oils identified using GC-MS

续表4
由表4可以看出,水蒸气蒸馏法和离子液体酶法提取得到的姜黄挥发油组分分别为48 种和53 种。其中单萜烯类分别有13 种(相对含量6.76%)和10 种(相对含量3.63%);倍半萜烯分别为21 种(74.49%)和25 种(84.57%);二萜烯只有1 种,相对含量为1.32%,只存在水蒸气蒸馏得到的姜黄挥发油中。2 种方法得到的姜黄挥发油相同成分有29 种,相对含量分别为79.95%和84.59%。其主要成分多为倍半萜烯,在倍半萜烯中酮类物质所占比重较大,分别为58.32%和60.38%。
水蒸气蒸馏法得到的姜黄挥发油主要成分为芳姜黄酮(42.86%)、姜黄新酮(13.71%)、1-(1,5-二甲基-4-己烯-1-基)-4-甲基苯(7.22%)、[S-(R*,S*)]-3-(1,5-二甲基-4-环烯基)-6-亚甲基环己烯(4.70%)、4-异丙基甲苯(3.64%)、乙基-四甲基环戊二烯(2.35%)、β-红没药烯(1.70%)、姜黄酮(1.65%)、对伞花烯(1.45%)9 种成分,占总含量的79.28%;离子液体酶法得到的姜黄挥发油主要成分为芳姜黄酮(39.37%)、姜黄新酮(15.02%)、1-(1,5-二甲基-4-己烯-1-基)-4-甲基苯(9.12%)、姜黄酮(5.99%)、[S-(R*,S*)]-3-(1,5-二甲基-4-环烯基)-6-亚甲基环己烯(4.95%)、2-乙基对二甲苯(2.58%)、乙基-四甲基环戊二烯(2.27%)、β-红没药烯(1.34%)、5-甲基水杨醛(1.20%)9 种成分,占含量的81.84%。
2 种提取方法得到的姜黄挥发油的主要组分均为芳姜黄酮,芳姜黄酮具有较强的抗癌、抑制细胞增值的作用。Yue等[28]从姜黄挥发油中分离纯化得到芳姜黄酮,发现其具有抑制血管生成的作用,笔者发现芳姜黄酮能显著抑制官腔的形成和HMEC-1细胞在非细胞毒素浓度条件下的增值。季明杰[29]将芳姜黄酮从姜黄中分离纯化出来,同时对实验用的肿瘤细胞株无毒性,发现姜黄酮能够诱导肿瘤细胞凋亡,并具有良好的量效和时效依赖关系,并且芳姜黄酮对诱导的肿瘤细胞凋亡具有选择性,尤其对白血病细胞的凋亡效果明显。
从提取的主要成分及相对含量上来看,2 种提取方法并没有很大的区别,但离子液体酶法可以破坏姜黄细胞壁,使姜黄挥发油更容易被提取出来,减少了一些热敏性成分的破坏,使得提取得到的姜黄挥发油组分更多,相对含量也有所提高。
Gounder等[30]分别用鲜的姜黄和干燥的姜黄(印度产)提取得到姜黄挥发油,分别得到28 种和14 种成分,多为倍半萜烯类物质,主要成分分别为芳姜黄酮(21.0%、30.3%)、α-姜黄酮(33.5%、26.5%)、β-姜黄酮(18.9%、19.1%)。Ferreira等[31]用水蒸气蒸馏法提取姜黄(Curcuma longa L.)挥发油,得到25 种组分,主要成分为芳姜黄酮(33.2%)、α-姜黄酮(23.5%)、β-姜黄酮(22.7%),与文献[30]得到的成分相似,但都与本实验得到的姜黄挥发油的成分有所区别,这可能是因为不同的产地、气候和收获时间等因素对姜黄挥发油的组成有一定的影响。
3 结 论
本研究通过单因素试验和响应面试验设计对离子液体酶法提取工艺进行优化,最佳提取条件为:离子液体添加量18%、纤维素酶添加量1.4%、液料比10∶1、酶解温度50 ℃。在此条件下得到的姜黄挥发油含量为5.0 mL/g。经气相色谱-质谱分析,水蒸气蒸馏法和离子液体酶法分别鉴定出48 种和53 种组分。与水蒸气蒸馏法相比,离子液体酶法得到的姜黄挥发油组分有所增加。2种提取方法提取得到的姜黄挥发油组分多为倍半萜烯类物质,主要成分为芳姜黄酮、姜黄新酮等物质。
[1] MONTON C, CHAROENCHAI L, SUKSAEREE J, et al. Quantitation of curcuminoid contents, dissolution pro le, and volatile oil content of turmeric capsules produced at some secondary government hospitals[J]. Journal of Food and Drug Analysis, 2016, 24(3): 493-499. DOI:10.1016/j.jfda.2016.01.007.
[2] 刘江, 樊钰虎, 王泽秀, 等. 响应面法优化姜黄挥发油提取工艺及其化学成分研究[J]. 西南师范大学学报(自然科学版), 2012, 37(10): 70-76. DOI:10.3969/j.issn.1000-5471.2012.10.016.
[3] 李瑞敏, 李湘洲, 张胜. 姜黄油的不同提取方法及其化学成分的研究[J]. Journal of Central South University of Forestry and Technology, 2013, 33(4): 114-116. DOI:10.14067/i.cnki.1673-923x.2013.04.006.
[4] MEMARZADEH S M, PIRBALOUTI A G, ADIBNEJAD M. Chemical composition and yield of essential oils from Bakhtiari savory (Satureja bachtiarica Bunge.) under different extraction methods[J]. Industrial Crops and Products, 2015, 76: 809-816. DOI:10.1016/ j.indcrop.2015.07.068.
[5] GOUNDER D K, LINGAMALLU J. Comparison of chemical composition and antioxidant potential of volatile oil from fresh, dried and cured turmeric (Curcuma longa) rhizomes[J]. Industrial Crops and Products, 2012, 38: 124-131. DOI:10.1016/j.indcrop.2012.01.014.
[6] 丁洪涛. 姜黄挥发油组效关系研究[D]. 天津: 天津大学, 2012.
[7] CARVALHO P I N, OSORIO-TOBÓN J F, ROSTAGNO M A, et al. Techno-economic evaluation of the extraction of turmeric (Curcuma longa L.) oil and ar-turmerone using supercritical carbon dioxide[J]. The Journal of Supercritical Fluids, 2015, 105: 44-54. DOI:10.1016/ j.su p u.2015.03.020.
[8] LERTSUTTHIWONG P, NOOMUN K, JONGAROONNGAMSANG N, et al. Preparation of alginate nanocapsules containing turmeric oil[J]. Carbohydrate Polymers, 2008, 74(2): 209-214. DOI:10.1016/ j.carbpol.2008.02.009.
[9] VALDERRAMA J O, CAMPUSANO R A. Melting properties of molten salts and ionic liquids. Chemical homology, correlation, and prediction[J]. Comptes Rendus Chimie, 2016, 19(5): 654-66 4. DOI:10.1016/j.crci.2016.02.002.
[10] KUCHLYAN J, KUNDU N. Ionic liquids in microemulsions: formulation and characterization[J]. Current Opinion in Colloid and Interface Science, 2016, 25: 27-38. DOI:10.1016/j.cocis.2016.05.011.
[11] CHO C W, PARK J S, STOLTE S, et al. Modelling for antimicrobial activities of ionic liquids towards Escherichia coli, Staphylococcus aureus and Candida albicans using linear free energy relationship descriptor s[J]. Journal of Hazardous Materials, 2016, 311:1 68-175. DOI:10.1016/j.jhazma t.2016.03.006.
[12] 曹红, 段海燕, 李春, 等. 离子液体超声-微波协同制取洋葱精油[J]. 化工学报, 2012, 63(3): 826-833. DOI:10.3969/ j.issn.0438-1157.2012.03.022.
[13] 曹红, 孙倩, 段海燕, 等. [BMIM]PF6/缓冲液两相体系中固定化β-葡萄糖醛酸苷酶催化特性研究[J]. 北京理工大学学报, 2011, 31(6): 732-736. DOI:10.15918/j.tbit1001-0645.2011.06.005.
[14] ARCE A, EARLE M J, RODRÍGUEZ H, et al. Separation of benzene and hexane by solvent extraction with 1-alkyl-3-methylimidazolium bis {(tri uoromethyl) sulfonyl} amide ionic liquids: effect of the alkylsubstituent length[J]. The Journal of Physical Chemistry B, 2007, 111(18): 4732-4736. DOI:10.1021/jp066377u.
[15] 国家药典委员会. 中华人民共和国药典: 第一部[M]. 北京: 中国医药科技出版社, 2015: 259-260.
[16] ZAIBUNNISA A H, NORASHIKIN S, MAMOT S, et al. An experimental design approach for the extract ion of volatile compounds from turmeric leaves (Curcuma domestica) using pressurised liquid extraction (PLE)[J]. LWT-Food Science and Technology, 2009, 42(1): 233-238. DOI:10.1016/j.lwt.2008.03.0 15
[17] KAMAZERI T S A T, SAMAH O A, TAHER M, et al. Antimicrobial activity and essential oils of Curcuma aeruginosa, Curcuma mangga, and Zingiber cassumunar from Malaysia[J]. Asian Pacific Journal of Tropical Medicine, 2012, 5(3): 202-209. DOI:10.1016/S1995-7645(12)60025-X.
[18] ANGEL G R, MENON N, VIMAL A B, et al. Essential oil composition of eight starchy Curcuma species[J]. Industrial Crops and Products, 2014, 60: 233-238. DOI:10.1016/j.indcrop.2014.06.028.
[19] SINGH P, SINGH S, KAPOOR I P S, et al. Chemical composition and antioxidant activities of essential oil and oleoresins from Curcuma zedoaria rhizomes, part-74[J]. Food Bioscience, 2013, 3: 42-48. DOI: 10.1016/j.fbio.2013.06.002.
[20] GO RDON C M. New developments in catalysis using ionic liquids[J]. Applied Catalysis A: General, 2001, 222(1): 101-117. DOI:10.1016/ S0926-860X(01)00834-1.
[21] 刘辉鸿, 胡飞, 李平凡. 离子液体[Emim]OAc环境提取生姜精油的研究[J]. 食品工业科技, 2015, 36(6): 208-211. DOI:10.13386/ j.issn1002-0306.2015.06.038.
[22] WHITE K E, REEVES J B, COALE F J. Cell wall compositional changes during incubation of plant roots measured by mid-infrared diffuse re ectance spectroscopy andber analysis[J]. Geoderma, 2016, 264: 205-213. DOI:10.1016/j.geoderma.2015.10.018.
[23] CAO Y, WU J, ZHANG J, et al. Room temperature ionic liquids (RTILs): a new and versatile platform for cellulose processing and deriva tization[J]. Chemical Engineering Journal, 2009, 147(1): 13-21. DOI:10.1016/j.cej.2008.11.011.
[24] 罗莞超. 基于离子液体复合膜的葡萄糖生物传感器[J]. 临床医学工程, 2011, 18(10): 1507-1509. DOI:10.3969/j.issn.1674-4659.2011.10.1507.
[25] 马歌丽, 韩甜甜, 李全喜, 等. β-呋喃果糖苷酶在离子液体中的酶学特性研究[J]. 饲料工业, 2014, 35(6): 18-24. DOI:10.13302/j.cnki. .2014.06.005.
[26] 陈金燕, 刘桂艳, 李春. 离子液体对重组β-葡萄糖醛酸苷酶催化特性的影响[J]. 石河子大学学报(自然科学版), 2011, 29(5): 603-607. DOI:10.13880/j.cnki.65-1 174/n.2011.05.027.
[27] 赵妍嫣, 秦新生, 朱圣伟, 等. 大豆凝集素的超声波辅助提取工艺优化及其性质[J]. 食品科学, 2016, 37(10): 34-39. DOI:10.7506/ spkx1002-6630-201610007.
[28] YUE G G L, KWOK H F, LEE J K M, et al. Novel anti-angiogenic effects of aromatic-turmerone, essenti al oil isolated from spice turmeric[J]. Journal of Functional Foods, 2015, 15: 243-253. DOI:10.1016/j.jff.2015.03.030.
[29] 季明杰. 中药姜黄组分芳姜黄酮诱导肿瘤细胞凋亡的研究[D].济南: 山东大学, 2005.
[30] GOUNDER D K, LINGAMALLU J. Comparison of chemical composition and antioxidant potential of volatile oil from fresh, dried and cured turmeric (Curcuma longa) rhizomes[J]. Industrial Crops and Products, 2012, 38: 124-131. DOI:10.1016/j.indcrop.2012.01.014.
[31] FERREIRA F D, KEMMELMEIER C, ARROTÉIA C C, et al. Inhibitory effect of the essential oil of Curcuma longa L. and curcumin on aflatoxin production by Aspergillus flavus Link[J]. Food Chemistry,2013, 136(2): 789-793. DOI:10.1016/ j.foodchem.2012.08.003.
Optimization of [BMIM]PF6Ionic Liquid-Assisted Enzymatic Extraction of Curcuma Oil and Analysis of Its Composition
LU Caihui, MOU Dehua*
(College of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang 050000, China)
In this investigation, the response surface methodology was employed to optimize the ionic liquid [BMIM]PF6-assisted enzymatic extraction of curcuma oil from turmeric powder. For this purpose, a regression model was developed to describe the yield of curcuma oil as a function of 4 independent variables including ionic liquid concentration, cellulase concentration, liquid-to-solid ratio and hydrolysis temperature. The optimum extraction parameters were determined as follows: ionic liquids concentration, 18% (V/V); cellulase concentration, 1.4% (m/m); liquid-to-solid ratio, 10:1 (mL/g); and hydrolysis temperature, 50 ℃. Under these conditions, the yield of curcuma oil was 5.0 mL/g. The essential oils obtained from SD and ILSE were analyzed by gas chromatography-mass spectrometry (GC-MS). A total of 48 and 53 components were identified, respectively, which were mainly sesquiterpenes substance and its total relative content reached 74.49% and 84.57%, respectively. Compared with the steam distillation method, the volatile oil component of turmeric powder was increased. The volatile oil of turmeric had the same components, but their relative contents were different. The major components and their relative contents from SD andILSE methods were ar-turmerone (42.86%, 39.37%), curlone (13.71%, 15.02%), and benzene,1-(1,5 -dimethyl-4-hexen-1-yl)-4-methyl- (7.22%, 9.12%), respectively.
ionic liquid [BMIM]PF6; cellulase; curcuma oil; composition
10.7506/spkx1002-6630-201710043
TS202.1
A
1002-6630(2017)10-0264-08
卢彩会, 牟德华. 离子液体[BMIM]PF6酶法辅助提取姜黄挥发油工艺优化及成分分析[J]. 食品科学, 2017, 38(10): 264-271. DOI:10.7506/spkx1002-6630-201710043. http://www.spkx.net.cn
LU Caihui, MOU Dehua. Optimization of [BMIM]PF6ionic liquid-assisted enzymatic extraction of curcuma oil and analysis of its composition[J]. Food Science, 2017, 38(10): 264-271. (in Chinese with English abstract)
10.7506/spkx1002-6630-201710043.http://www.spkx.net.cn
2016-09-26
卢彩会(1992—),女,硕士研究生,研究方向为农产品加工。E-mail:2269984137@qq.com
*通信作者:牟德华(1960—),男,教授,学士,研究方向为农产品加工。E-mail:dh_mou@163.com

