皱皮木瓜籽油提取工艺优化及其理化性质和抗氧化活性
邓叶俊,黄立新,2,*,张彩虹,2,谢普军,2,张 琼,丁莎莎
(1.中国林业科学研究院林产化学工业研究所,生物质化学利用国家工程实验室,国家林业局林产化学工程重点开放性实室,江苏省生物质能源与材料重点实验室,江苏 南京 210042;2.中国林业科学研究院林业新技术研究所,北京 100091)
皱皮木瓜籽油提取工艺优化及其理化性质和抗氧化活性
邓叶俊1,黄立新1,2,*,张彩虹1,2,谢普军1,2,张 琼1,丁莎莎1
(1.中国林业科学研究院林产化学工业研究所,生物质化学利用国家工程实验室,国家林业局林产化学工程重点开放性实室,江苏省生物质能源与材料重点实验室,江苏 南京 210042;2.中国林业科学研究院林业新技术研究所,北京 100091)
以皱皮木瓜籽为原料,研究溶剂浸提法提取皱皮木瓜籽油的最佳工艺。在单因素试验的基础上,进行正交试验优化分析,确定皱皮木瓜籽油的最佳提取工艺条件为:料液比1∶4(g/mL)、提取温度60 ℃、提取时间150 min。在该条件下皱皮木瓜籽油的提取率为28.48%。皱皮木瓜籽油的酸值和过氧化值等指标达到了食用油脂的标准。将皱皮木瓜籽油甲酯化后,利用气相色谱-质谱联用法鉴定出12 种脂肪酸,主要为油酸(42.69%)、亚油酸(32.46%)、棕榈酸(12.92%)、硬脂酸(4.82%)、花生酸(3.27%),不饱和脂肪酸含量达77.42%。通过测定清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基能力来评价皱皮木瓜籽油的抗氧化活性,结果表明对DPPH自由基和羟自由基的IC50分别为8.51、0.396 mg/mL。
皱皮木瓜籽油;提取;工艺优化;理化性质;抗氧化活性
皱皮木瓜(Chaenomeles speciosa (Sweet) Nakai)为蔷薇科木瓜属植物贴梗海棠的果实,又名铁脚梨和宣木瓜等,主要分布于中国四川、湖北、山东、安徽、浙江等省[1]。皱皮木瓜与番木瓜不同,皱皮木瓜是原产于中国且具有独特药用和保健效果的果实[2]。据本草纲目记载,木瓜具有舒经络、健脾胃、益精血的药理作用,临床上用于治疗吐泻腹痛、风湿关节痛、腰膝酸痛等疾病[3-4]。研究表明,皱皮木瓜中含有丰富的糖类、皂苷、有机酸、黄酮、维生素等[5-9],具有护肝、抗氧化、抑菌、抗肿瘤、降血脂等特殊疗效[10-12]。皱皮木瓜一般被加工用作饮片、木瓜酒或木瓜醋,具有很好的经济价值[13]。
皱皮木瓜籽作为皱皮木瓜加工后的副产物,除了少量留作育种外,大量的木瓜籽都被当成垃圾丢弃,造成极大的浪费。据研究报道[14],皱皮木瓜籽提取物具有多种的生理功能,如皱皮木瓜籽的乙醇提取物含有丰富的三萜类化合物,具有一定的免疫活性,同时具有明显的镇痛和抗感染的作用。因此,皱皮木瓜籽及其功能成分的开发具有重要意义。皱皮木瓜籽的高值化利用不仅可以解决资源浪费及环境污染问题,同时也能带来良好的经济效益。我国皱皮木瓜的种植规模已相当可观,但鲜有关于皱皮木瓜籽油提取、理化性质以及抗氧化活性的报道。本实验对皱皮木瓜籽油的提取、理化性质及抗氧化活性进行了系统研究,以期为皱皮木瓜籽油的开发和利用提供理论依据。
1 材料与方法
1.1 材料与试剂
四川产皱皮木瓜籽 市售。
无水乙醇、石油醚(30~60 ℃和60~90 ℃)、氢氧化钾、碘化钾、硫代硫酸钠、冰乙酸、环己烷、30%双氧水 南京化学试剂有限公司;一氯化碘、邻菲罗啉、七水合硫酸亚铁 国药集团化学试剂有限公司;邻苯二甲酸氢钾 上海凌峰化学试剂有限公司;酚酞 天津市化学试剂研究所;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、胆固醇美国Sigma公司;生育酚标准品 上海绿源公司。以上试剂均为分析纯。
1.2 仪器与设备
电热恒温鼓风干燥箱 上海索普仪器有限公司;电子分析天平、PB-10型酸度计 赛多利 斯科学仪器有限公司;旋转蒸发器、循环水式真空泵 上海东玺制冷仪器设备有限公司;紫外-可见分光光度计 北京谱析 通用仪器有限责任公司;真空干燥箱 上海一恒科学仪器有限公司;灵巧型粉碎机 上海隆拓仪器设备有限公司。
1.3 方法
1.3.1 皱皮木瓜籽一般组分分析
脂肪含量测定:采用索氏提取法,参照GB/T 5009.6—2003《食品中脂肪的测定》;粗蛋白含量测定:杜马斯燃烧法;粗纤维含量测定:参照GB/T 5009.10—2003《植物类食品中粗纤维的测定》;水分含量测定:参照GB/T 5009.3—2010《食品中水分的测定》;灰分含量测定:参照GB 5009.4—2010《食品中灰分的测定》;总糖含量测定:采用蒽酮比色法。
1.3.2 皱皮木瓜籽油提取
将皱皮木瓜籽置于真空干燥箱中,45 ℃抽真空干燥48 h,将木瓜籽粉碎备用。准确称取10.00 g皱皮木瓜籽粉,小心移入250 mL圆底烧瓶中,并按一定料液比加入60~90 ℃石油醚,安装好冷凝回流装置,在一定温度条件下恒温水浴回流浸提一定时间后,旋转蒸发回收石油醚,得到金黄色皱皮木瓜籽油粗品,将木瓜籽油置于真空干燥箱内50 ℃烘至质量恒定。皱皮木瓜籽油的提取率按式(1)计算:

式中:M为皱皮木瓜籽粉质量/g;M1为空瓶质量/g;M2为空瓶和皱皮木瓜籽油质量/g。
1.3.3 单因素试验
以皱皮木瓜籽油的提取率为指标,以料液比(1∶2、1∶3、1∶4、1∶5、1∶6、1∶7(g/mL))、提取温度(20、30、40、50、60、70 ℃)、提取时间(30、60、90、120、150、180 min)为因素,其他条件保持相同,分别进行单因素试验,考察各因素对皱皮木瓜籽油提取率的影响。
1.3.4 正交试验
在单因素试验基础上,选择料液比、提取温度、提取时间3 个影响因素进行正交试验,每个因素设置3 个水平,采用L9(33)正交试验,以提取率为评价指标,优化皱皮木瓜籽油提取工艺。正交试验因素与水平见表1。

表 1 正交试验因素与水平Table 1 Factors and levels used in orthogonal array design
1.3.5 皱皮木瓜籽油理化性质分析
水分及挥发物含量测定:参照GB/T 5528—2008《动植物油脂 水分及挥发物含量测定》[15]方法;密度测定:密度计法;折光率测定:折光仪法;酸值测定:参照GB/T 5530—2005《动植物油脂 酸值和酸度测定》[16]方法;皂化值测定:参照GB/T 5534—2008《动植物油脂 皂化值的测定》[17]方法;碘值测定:参照GB/T 5532—2008《动植物油脂 碘值的测定》[18]方法;过氧化值测定:参照GB/T 5538—2005《动植物油脂 过氧化值测定》[19]方法。1.3.6 皱皮木瓜籽油脂肪酸成分分析[20-22]
脂肪酸甲酯化:准确称取50 mg皱皮木瓜籽油于20 mL具塞试管中,加入4 mL苯和石油醚(30~60 ℃)的混合溶剂(体积比1∶1),摇动试管使油脂完全溶解。再加入4 mL 0.5 mol/L 氢氧化钾-甲醇溶液,振荡混匀。在室温反应30 min,加蒸馏水使全部有机相甲酯溶液上升至试管口,静置澄清后吸取上层清液,加入少量无水硫酸钠 去除痕量水分后用于色谱分析。
色谱条件:采用Agilent HP-5MS色谱柱,进样口温度250 ℃,载气流速1 mL/min,进样量1 μL,分流比30∶1。柱箱升温程序:80 ℃保持5 min,以10 ℃/min升至240 ℃。
质谱条件:接口温度250 ℃,离子源温度230 ℃,电子能量70 eV,扫描范围40~650 u。
1.3.7 皱皮木瓜籽油活性物质测定[23-24]
1.3.7.1 皱皮木瓜籽油总酚含量测定
皱皮木瓜籽油中多酚物质的提取:准确称取2.5 g皱皮木瓜籽油于离心管中,用2.5 mL正己烷溶解,加入80%甲醇溶液10 mL,将 离心管置于涡旋振荡器上混匀萃取30 min后,于8 000 r/min离心10 min。分离得到甲醇相,皱皮木瓜籽油以同样的条件重复萃取3次,合并甲醇相。
标准曲线的绘制:精确称取焦性没食子酸0.2 g,用7.5%碳酸钠定容至100 mL容量瓶,使母液质量浓度为2 mg/mL。准确量取0、1、2、3、4、5、6 mL母液于50 mL容量瓶中,加入2.5 mL Folin-Ciocalteau试剂,混合均匀,静置1 min后,加入7.5%碳酸钠溶液5 mL,蒸馏水定容至50 mL。75 ℃水浴加热10 min,冷却后,于765 nm波长处测定吸光度,绘制标准曲线。焦性没食子酸标准曲线:y=0.139 71x+0.001 86(R2=0.998 2)。
皱皮木瓜籽油多酚含量测定:精确移取1 mL多酚提取液于50 mL容量瓶中,加入2.5 mL Folin-Ciocalteau试剂,混合均匀,静置1 min后,加入7.5%碳酸钠溶液5 mL,蒸馏水定容至50 mL。75 ℃水浴加热10 min,冷却后,于765 nm波长处测定吸光度。根据标准曲线,确定其质量浓度。结果以mg/g表示,即多酚含量相当于标准曲线对应焦性没食子酸的毫克数。
1.3.7.2 皱皮木瓜籽油VE含量测定
标准溶液配制:准确称取α-VE、γ-VE、δ-VE各5 mg,分别用脱醛乙醇溶解并定容于25 mL棕色容量瓶,配制成质量浓度为0.2 mg/mL的α-VE、γ-VE、δ-VE标准储备液。测定前分别取等体积的标准储备液混合。
测试溶液的制备:称取0.25 g左右的皱皮木瓜籽油,于25 mL容量瓶中,加入脱醛乙醇溶解并定容,超声10 min,溶液过0.45 μm滤膜。
1.3.7.3 皱皮木瓜籽油甾醇含量测定
皱皮木瓜籽油甾醇的制备:参照文献[25]并稍加修改:在分别装有1~2 g皱皮木瓜籽油的圆底烧瓶中加入1 mL内标溶液(1 mg/mL的胆固醇乙醇溶液)和15 mL 2.5 mol/L KOH-乙醇溶液,80 ℃回流40 min。向皂化液中加入40 mL蒸馏水水稀释,再用40 mL正己烷混合萃取,取上层有机相,萃取重复3 次,合并有机相;有机相用蒸馏水洗至中性,于45 ℃条件下真空旋转蒸发除去溶剂,得到样品溶于1 mL正己烷,加入少量无水硫酸钠除去痕量水分,进行气相色谱-质谱分析。
色谱条件:参照参考文献[26],检测器及进样口温度为320 ℃,柱温采用程序升温方式,以4 ℃/min的速率从240 ℃增加至255 ℃,载气为氢气,分流比为1∶20。
1.3.8 抗氧化活性的测定
1.3.8.1 DPPH自由基清除能力测定
DPPH自由基清除能力测定参考Ali等[27]的方法加以调整,用无水乙醇配制质量浓度分别为2、4、6、8、10、12 mg/mL的皱皮木瓜籽油溶液和60 μmol/L的DPPH溶液;准确移取2 mL DPPH溶液于具塞试管中,分别各加入等体积不同质量浓度的皱皮木瓜籽油溶液,混合均匀后于黑暗处室温反应30 min,于517 nm波长处测定各样品的吸光度,平行测定3 次,取平均值,以2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT)作为对照。DPPH自由基清除率计算如式(2)所示:

式中:A0为2 mL DPPH溶液+2 mL无水乙醇吸光度;A1为2 mL DPPH溶液+2 mL皱皮木瓜籽油乙醇溶液吸光度;A2为2 mL无水乙醇+2 mL皱皮木瓜籽油乙醇溶液吸光度。
1.3.8.2 羟自由基清除能力测定[28]
参照Feton反应的方法建立反应体系。反应体系及所需溶液及试剂:磷酸缓冲液(pH 7.4)、0.75 mmol/L邻菲罗啉乙醇溶液、0.75 mmol/L FeSO4溶液、0.01%双氧水、不同质量浓度的皱皮木瓜籽油乙醇溶液。不同组别各溶液加入反应体系的体积见表2,同时以VC作为参照。

表 2 各溶液加入反应体系的体积Table 2 Composition of the reaction system for hydroxyl radical scavenging assaymL
反应体系置于37 ℃恒温水浴中反应1 h以后,迅速测定其在536 nm波长处的吸光度,平行测定3次,取平均值。羟自由基计算如式(3)所示:

1.4 数据处理
实验数据重复测定3次,结果以±s形式列出。最终数据通过DPS软件计算处理。
2 结果与分析
2.1 皱皮木瓜籽一般组分分析结果
皱皮木瓜籽中脂肪含量达(30.88±0.62)%,可作为特种油脂加以开发利用,皱皮木瓜籽水分含量为(6.79±0.18)%,灰分含量为(2.39±0.04)%,皱皮木瓜籽的粗蛋白含量也较光皮木瓜籽丰富[29],粗蛋白含量为(21.1±0.69)%,总糖和粗纤维的含量分别为(17.1±0.31)%和(19.3±0.32)%。
2.2 单因素试验结果
2.2.1 料液比对皱皮木瓜籽油提取率的影响。
称取10 g皱皮木瓜籽粉于圆底烧瓶中,按一定比例加入石油醚,在提取温度40 ℃、提取时间60 min的条件下,探讨料液比对皱皮木瓜籽油提取率的影响,结果见图1。
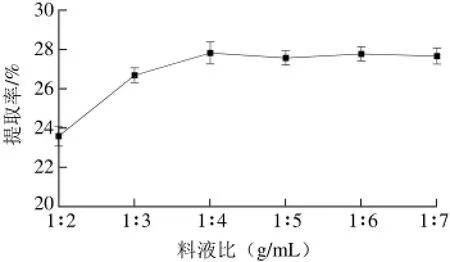
图 1 料液比对皱皮木瓜籽油提取率的影响Fig. 1 Effect of solid-to-liquid ratio on the extraction yield of oil
从图1可知,在一定范围内随着溶剂用量的升高,皱皮木瓜籽油的提取率明显增加,这是由于对一定量的皱皮木瓜籽来说,溶剂用量的增加使得溶剂体系中的木瓜籽油浓度减少,木瓜籽仁与溶剂内含油量浓度差增大,进而提高传质速率;当料液比达到1∶4后,随着溶剂用量的增加,木瓜籽油的提取率略有下降,原因可能是溶剂用量增加使得溶剂回收时间延长,造成油脂在回收过程中的损失增加。因此,初步选择最佳料液比为1∶4。
2.2.2 提取温度对皱皮木瓜籽油提取率的影响
称取10 g皱皮木瓜籽粉于圆底烧瓶中,按照料液比1∶4加入石油醚,在不同温度浸提60 min,提取温度对皱皮木瓜籽油提取率的影响见图2。

图 2 提取温度对皱皮木瓜籽油提取率的影响Fig. 2 Effect of extraction temperature on the extraction yield of oil
从图2可知,在20~50 ℃范围内,随着温度升高,皱皮木瓜籽油的提取率随之增高;当提取温度超过50 ℃后,提取率有所降低。随着温度升高,溶剂挥发量增加,实际参与浸提的溶剂量降低,导致提取率下降。并且随着温度升高,油脂的品质会受到影响,因此选择50 ℃为最佳提取温度。
2.2.3 提取时间对皱皮木瓜籽油提取率的影响
称取10 g皱皮木瓜籽粉于圆底烧瓶中,按照料液比1∶4加入石油醚,在50 ℃浸提不同时间,提取时间对油脂提取率影响的结果见图3。

图 3 提取时间对皱皮木瓜籽油提取率的影响Fig. 3 Effect of extraction time on the extraction yield of oil
从图3可知,在30~120 min,皱皮木瓜籽油的提取率随着提取时间的延长逐渐增加,当提取时间达到120 min后,提取过程达到平衡,提取率相对稳定。这是由于在皱皮木瓜籽油提取初期,皱皮木瓜籽粉中的油脂含量高,固液之间质量浓度差大,油脂大量扩散到溶剂中,使得油脂的提取率增加;提取时间超过120 min时,由于大部分油脂已经被提取出来,溶剂的溶解度趋于饱和,随着提取时间的延长提取率逐渐平缓。因此,选择提取时间120 min为最佳提取时间。
2.3 正交试验优化结果
在单因素试验的基础上,采用正交试验设计法对皱皮木瓜籽油的提取工艺进行三因素三水平优化设计,正交结果见表3。
由表3极差分析可知,3 个因素对提取率的影响顺序是C>A>B,即提取时间>料液比>提取温度,其中,提取时间对提取率的影响最为显著。得到最佳工艺条件为A2B3C3,即料液比1∶4(g/mL)、提取温度60 ℃、提取时间150 min。按所得最佳工艺条件进行验证实验,3 次所得皱皮木瓜籽油提取率平均值为28.48%,高于其他各组合的测定值,与正交试验数据相符。

表 3 正交试验设计及结果Table 3 Orthogonal array design arrangement with experimental results
2.4 皱皮木瓜籽油的理化性质
溶剂浸提法得到皱皮木瓜籽毛油及溶剂法提取番木瓜籽油[30]的理化性质见表4。由表4可知,皱皮木瓜籽油与番木瓜籽油的理化性质相似,皱皮木瓜籽油粗品的酸值为1.81 mg KOH/g,说明皱皮木瓜籽油中含有少量的游离脂肪酸;皱皮木瓜籽油粗品的碘值为93 g/100 g,说明皱皮木瓜籽油含有一定量的不饱和脂肪酸;皱皮木瓜籽油的皂化值为182.26 mg KOH/g,说明皱皮木瓜籽油可能主要以16~18 个碳原子的中长链脂肪酸为主;皱皮木瓜籽油的过氧化值较低,是一种优质的植物油脂,皱皮木瓜籽油的水分及挥发物含量较高,但比溶剂法提取的番木瓜籽油低。
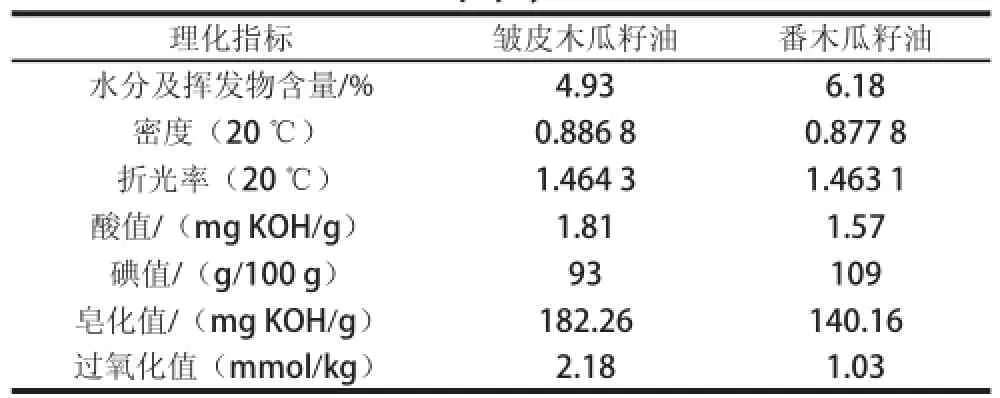
表 4 皱皮木瓜籽油及番木瓜籽油的理化性质Table 4 Physicochemical properties of Chaenomeles speciosa (Sweet) Nakai and papaya seed oils
2.5 脂肪酸组成
皱皮木瓜籽及番木瓜籽油脂肪酸[31]组成见表5。将目前研究较多的番木瓜籽油与皱皮木瓜籽油的脂肪酸组成进行对比研究,发现皱皮木瓜籽油与番木瓜籽油的不饱和脂肪酸含量都较高。由表5可知,皱皮木瓜籽油中共检测出12 种脂肪酸,不饱和脂肪酸含量达77.42%,主要由油酸和亚油酸组成,其中油酸和亚油酸的含量分别为42.69%和32.46%;番木瓜籽油的油酸含量高,达到73.5%,但亚油酸含量远低于皱皮木瓜籽油;皱皮木瓜籽油饱和脂肪酸主要是棕榈酸、硬脂酸和花生酸,占脂肪酸总量的21.01%。研究[32-33]表明,适量增加油酸的摄入量对高血压人群降低血脂、控制血压有明显效果;亚油酸是人体必须脂肪酸,能降低血液中胆固醇含量及防止动脉粥样硬化。因此,皱皮木瓜籽油可作为优质食用保健油脂加以开发。

表 5 皱皮木瓜籽油与番木瓜籽油脂肪酸组成及含量Table 5 Fatty acid compositions of Chaenomeles speciosa (Sweet) Nakai and papaya seed oils
2.6 皱皮木瓜籽油活性成分

表 6 皱皮木瓜籽油活性成分Table 6 Active components of Chaenomeles speciosa (Sweet) Nakai seed oil
由表6可以看出,皱皮木瓜籽油活性成分含量丰富,其中总酚含量达到538 mg/kg,油脂中的多酚类物质可以起到抗氧化的作用;皱皮木瓜籽油中谷甾醇含量丰富,达到5.42 mg/g,丰富的谷甾醇有利于降低血清胆固醇,对预防动脉粥样硬化有良好生理功能;同时在皱皮木瓜籽油中检测到丰富的VE,其中α-VE与δ-VE含量较高,分别达到77.598、65.1 mg/100 g,丰富的VE能有效地防止油脂氧化,同时也能促进人性腺发育,增强动脉血液循环。皱皮木瓜籽油中的活性成分含量与日本木瓜籽油[34]中活性成分含量相当。皱皮木瓜籽油的活性成分含量高,可以作为一种保健类油脂加以开发利用。
2.7 皱皮木瓜籽油的抗氧化活性
2.7.1 DPPH自由基的清除能力

图 4 皱皮木瓜籽油对DPPH自由基的清除率Fig. 4 DPPH radical-scavenging capacity of Chaenomeles speciosa (Sweet) Nakai seed oil
从图4可以看出,在实验质量浓度范围内,皱皮木瓜籽油对DPPH自由基具有良好的清除能力,且其清除能力随质量浓度的增加而增强。将皱皮木瓜籽油清除DPPH自由基的能力与BHT进行比较,发现在质量浓度范围内BHT对DPPH自由基的清除能力高于皱皮木瓜籽油。通过拟合曲线计算皱皮木瓜籽油清除DPPH自由基的IC50为8.51 mg/mL。
2.7.2 羟自由基的清除能力

图 5 皱皮木瓜籽油对羟自由基的清除率Fig. 5 Hydroxyl radical-scavenging capacity of Chaenomeles speciosa (Sweet) Nakai seed oil
由图5可以看出,在实验质量浓度范围内,皱皮木瓜籽油对羟自由基具有良好的清除能力,且其清除能力随质量浓度的增加而增强。在0.1~0.3 mg/mL质量浓度范围内,皱皮木瓜籽油对羟自由基的清除能力优于VC,随着质量浓度增大,VC对羟自由基的清除能力大于皱皮木瓜籽油。通过拟合曲线计算皱皮木瓜籽油清除羟自由基的IC50为0.396 mg/mL。
3 结 论
在单因素试验的基础上,采用正交试验设计法优化分析,以皱皮木瓜籽油提取率为指标,以料液比、提取温度、提取时间为考察因素进行试验。确定了皱皮木瓜籽油的最佳提取工艺参数为料液比1∶4、提取温度60 ℃、提取时间150 min,在此条件下皱皮木瓜籽油的提取率为28.48%。浸提法得到的皱皮木瓜籽油的碘值为93 g/100 g,皂化值为182.26 mg KOH/g,酸值和过氧化值等指标达到了食用油脂的标准。皱皮木瓜籽油富含大量不饱和脂肪酸,其中油酸和亚油酸的含量分别为42.69%和32.46%;饱和脂肪酸主要由棕榈酸和硬脂酸组成,占脂肪酸总量的21.01%。皱皮木瓜籽油中活性成分含量高,总酚含量达到538 mg/kg,谷甾醇含量为5.42 mg/g,同时皱皮木瓜籽油中含有丰富的VE,其中α-VE与δ-VE含量分别达到77.598 mg/100 g和65.1 mg/100 g。皱皮木瓜籽油具有一定的抗氧化活性,清除DPPH自由基和羟自由基的IC50分别为8.51、0.396 mg/mL。因此,皱皮木 瓜籽油是极具开发意义的天然保健油脂。
[1] 何银生, 廖朝林, 郭汉玖, 等. 皱皮木瓜前景美好[J]. 中国现代中药, 2008, 10(9): 46-47. DOI:10.3969/j.issn.1673-4890.2008.09.017.
[2] 张茜, 王光, 何祯祥, 等. 木瓜种质资源的植物学归类及管理原则[J]. 植物遗传资源学报, 2005, 6(3): 339-343. DOI:10.3969/ j.issn.1672-1810.2005.03.021.
[3] 李娜, 金敬红, 姜洪芳, 等. 宣木瓜总有机酸的纯化及镇痛抗炎作用[J].中国实验方剂学杂志, 2011, 17(1): 113-116; 119. DOI:10.3969/ j.issn.1005-9903.2011.01.035.
[4] 刘世尧, 白志川, 李加纳. 皱皮木瓜与光皮木瓜品质多性状指标综合评价[J]. 中国中药杂志, 2012, 37(7): 901-907. DOI:10.4268/ cjcmm20120707.
[5] 田冰梅, 谢晓梅, 沈盼盼, 等. 分级醇沉宣木瓜多糖含量、分子量测定和活性初步研究[J]. 光谱学与光谱分析, 2015, 35(5): 1331-1334. DOI:10.3964/j.issn.1000-0593(2015)05-1331-04.
[6] 潘国波, 杨小明, 丁艳, 等. 响应面法优化超声辅助提取宣木瓜总皂苷提取工艺研究[J]. 天然产物研究与开发, 2012, 24(9): 1292-1296. DOI:10.3969/j.issn.1001-6880.2012.09.032.
[7] 蔡娟, 刘世尧, 韦正鑫, 等. 皱皮木瓜皮渣齐墩果酸和熊果酸提取工艺优化研究[J]. 食品工业科技, 2015, 36(2): 282-285; 290. DOI:10.13386/j.issn1002-0306.2015.02.052.
[8] 魏旖琪, 姚雷. 皱皮木瓜中总黄酮分离纯化工艺[J]. 上海交通大学学报(农业科学版), 2014, 32(6): 71-77. DOI:10.3969/ J.ISSN.1671-9964.2014.06.011.
[9] ZHANG S Y, HAN L Y, ZHANG H, et al. Chaenomeles speciosa: a review of chemistry and pharmacology[J]. Biomedical Reports, 2014, 2(1): 12-18. DOI:10.3892/br.2013.193.
[10] XIE X F, ZOU G L, LI C H. Antitumor and immunomodulatory activities of water-soluble polysaccharide from Chaenomeles speciosa[J]. Carbohydrade Ploymers, 2015, 132(5): 323-329. DOI:10.1016/j.carbpol.2015.06.046.
[1 1] YAO G D, LIU C Q, HUO H Q, et al. Ethanol extract of Chaenomeles speciosa Nakai induces apoptosis in cancer cells and suppresses tumor growth in mice[J]. Oncology Letters, 2013, 6(1): 256-260. DOI:10.3892/ol.2013.1340.
[12] XIE X F, CAI X Q, ZHU S Y, et al. Chemical composition and antimicrobial activity of essential oils of Chaenomeles speciosa from China[J]. Food Chemistry, 2007, 100(4): 1312-1315. DOI:10.1016/ j.foodchem.2005.12.011.
[13] 韩立敏. 木瓜的营养保健功能及其开发利用[J]. 广东农业科学, 2009(9): 138-139. DOI:10.3969/j.issn.1004-874X.2009.09.045.
[14] 刘淑霞, 刘淑琴, 王士杰, 等. 木瓜籽提取物抗感染镇痛活性研究[J]. 中国医药导报, 2008, 5(2): 13-15. DOI:10.3969/ j.issn.1673-7210.2008.02.009.
[15] 中粮北海粮油工业(天津)有限公司. 动植物油脂 水分及挥 发物含量测定: GB/T 5528—2008[S]. 北京: 中国标准出版社, 2008.
[16] 国家粮食局西安油脂食品及饲料质量监督检验测试中心, 北京市粮油食品检验所. 动植物油脂 酸值和酸度的测定: GB/T 5530—2005[S]. 北京: 中国标准出版社, 2005.
[17] 武汉工业学院, 国家粮食储备局武汉科学研究设计院. 动植物油脂皂化值的测定: GB/T 5534—2008[S]. 北京: 中国标 准出版社, 2008. [18] 武汉工业学院. 动植物油脂 碘值的测定: GB/T 5532—2008[S].北京: 中国标准出版社, 2008.
[19] 国家粮食局西安油脂食品及饲料质量监督检验测试中心. 动植物油脂 过氧化值测定: GB/T 5538—2005[S]. 北京: 中国标准出版社, 2005.
[20] LEE W J, LEE M H, SU N W. Chracteristics of papaya seed oils obtained by extrusion-expelling process[J]. Journal of Science of Food and Agriculture, 2011, 91(13): 2348-2354. DOI:10.1002/jsfa.4466.
[21] 付骋宇, 李莹, 梁靓, 等. 快速甲酯化-气相色谱法测试油脂组成[J].中国粮油学报, 2014, 29(6): 104-107; 111.
[22] 王欢, 李杨, 江连洲, 等. 水酶法提取火麻籽油的工艺优化及其脂肪酸组成分析[J]. 食品科学, 2013, 34(22): 27-32. DOI:10.7506/ spkx1002-6630-201322006.
[23] 王艳, 周波, 钟海雁. 制取工艺对杏仁油中总酚含量及其抗氧化能力的影响[J]. 食品与机械, 2014, 30(6): 149-152. DOI:10.13652/ j.issn.1003-5788.2014.06.037.
[24] 谢云峰, 王浩, 刘佟, 等. 在线固相萃取-高效液相色谱联用测定动物源食品中的维生素A、E[J]. 分析化学, 2014(9): 1343-1347. DOI:10.11895/j.issn.0253-3820.140445.
[25] 彭丽霞, 朱亿竹, 魏阳吉, 等. 葡萄籽油中植物甾醇的提取与鉴定[J]. 中国食品学报, 2012, 12(3): 185-191. DOI:10.3969/ j.issn.1009-7848.2012.03.026.
[26] 南京财经大学. 动植物油脂 甾醇组成和甾醇总量的测定 气相色谱法: GB/T 25223—2010[S]. 北京: 中国标准出版社, 2010.
[27] ALI I B E H, CHAOUACHI M, BAHRI R, et al. Chemical composition and antioxidant, antibacterial, allelopathic and insecticidal activities of essential oil of Thymus algerienis Boiss. et Reut[J]. Industrial Crops and Products, 2015, 77(23): 631-639. DOI:10.1016/ j.indcrop.2015.09.046.
[28] 董迪迪, 王鸿飞, 周增群, 等. 杨梅籽油抗氧化活性及其调节血脂作用的研究[J]. 中国粮油学报, 2014, 29(5): 53-57.
[29] 徐怀德, 李海鹏, 刘乐全, 等. 光皮木瓜籽的营养成分分析[J]. 营养学报, 2008, 30(1): 111-112. DOI:10.3321/j.issn:0512-7955.2008.01.027.
[30] 刘书成, 邓楚津, 钟益强, 等. 番木瓜籽油的提取工艺优化及其理化特性[J]. 中国粮油学报, 2010, 25(8): 42-46.
[31] NOORZIANNA A M Y, JALALDEEN M N M, BANGUN P N, et al. Physico-chemeical characteristics of papaya (Carica papaya L.) seed oil of the Hong Kong/Sekaki variety[J]. Journal of Oleo Science, 2014, 63(9): 885-892. DOI:10.5650/jos.ess13221.
[32] 许明塔, 陈剑锋. 尿素包合法制备油茶籽油中油酸的工艺研究[J]. 中国粮油学报, 2012, 27(5): 56-59. DOI:10.3969/ j.issn.1003-0174.2012.05.012.
[33] B E R G A M O P, L U O N G O D, M I Y A M O T O J, e t a l. Immun omodulatory activity of a gut microbial metabolite of dietary linoleic acid, 10-hydroxy-cis-12-octadecenoic acid, associated with improved antioxidant/detoxifying defences[J]. Journal of Functional Foods, 2014, 11: 192-202. DOI:10.1016/j.jff.2014.10.007.
[34] PAWEL G, ALEKSANDER S, DALIJA S. Physicochemichal characteristics of the cold-pressed Japanese quince seed oil: new promising unconventional bio-oil from by-product for the pharmaceutical and cosmetic industry[J]. Industrial Crops and Products, 2013, 48: 178-182. DOI:10.1016/j.indcrop.2013.04.018.
Optimization of Extraction, Physicochemical Properties and Antioxidant Ability of Chaenomeles speciosa (Sweet) Nakai Seed Oil
DENG Yejun1, HUANG Lixin1,2,*, ZHANG Caihong1,2, XIE Pujun1,2, ZHANG Qiong1, DING Shasha1
(1. Jiangsu Province Key Laboratory of Biomass Energy and Material, Key and Open Laboratory of Forest Chemical Engineering, State Forestry Administration, National Engineering Laboratory for Biomass Chemical Utilization, Institute of Chemical Industry of Forest Products, Chinese Academy of Forestry, Nanjing 210042, China; 2. Research Institute of Forestry New Technology, Chinese Academy of Forestry, Beijing 100091, China)
The conditions for solvent extraction of Chaenomeles speciosa (Sweet) Nakai seed oil (CSNSO) were optimized using one-factor-at-a-time and orthogonal array design methods. A solid-to-liquid ratio of 1:4 (g/mL); an extraction temperature of 60 ℃ and an extraction time of 150 m in were found to be optimal for the maximum oil yield (28.48%). Both the acid value and peroxide value of CSNSO met the quality standard for edible oils and fats. After methyl esteri cation, 12 fatty acids were identi ed by gas chromatography-mass spectrometry (GC-MS), and the major fatty acid in the oil was oleic acid, which accounted for 42.69% of the total fatty acids, followed by linoleic acid (32.46%), palmitic acid (12.92%), stearic acid (4.82%) and arachic acid (3.27%). The relative content of unsaturated fatty acids was as high as 77.42%. The antioxidant activity of CSNSO was estimated by testing DPPH free radical and ·OH scavenging ability, and the 50% inhibitory concentration (IC50) values were determined to be 8.51 and 0.396 mg/mL, respectively.
Chaenomeles speciosa (Sweet) Nakai seed oil; extraction process; process optimization; physicochemical properties; antioxidant activity
10.7506/spkx1002-6630-201710038
TS201.1
A
1002-6630(2017)10-0229-07
邓叶俊, 黄立新, 张彩虹, 等. 皱皮木瓜籽油提取工艺优化及其理化性质和抗氧化活性[J]. 食品科学, 2017, 38(10): 229-235. DOI:10.7506/spkx1002-6630-201710038. http://www.spkx.net.cn
DENG Yejun, HUANG Lixin, ZHANG Caihong, et al. Optimization of extraction, physicochemical properties and antioxidant ability of Chaenomeles speciosa (Sweet) Nakai seed oil[J]. Food Science, 2017, 38(10): 229-235. (in Chinese with English abstract)
10.7506/spkx1002-6630-201710038. http://www.spkx.net.cn
2016-06-03
“十三五”国家重点研发计划重点专项(2016YFD0600800);中国林业科学研究院中央级公益性科研院所基本科研业务费专项(CAFYBB2016QA011)
邓叶俊(1993—),男,硕士研究生,主要从事天然产物深加工研究。E-mail:yejun_deng@163.com
*通信作者:黄立新(1967—),男,研究员,博士,主要从事林特产品深加工及干燥技术研究。E-mail:l_x_huang@163.com

