西藏牦牛奶渣中优势乳酸菌产胞外多糖及其耐受性
万金敏,杨丽娜,葛武鹏,*,张 静,耿 炜,李小鹏,吴小勇
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西咸阳质量技术检测检验所,陕西 咸阳 712000;3.咸阳市食品药品检测检验中心,陕西 咸阳 712000)
西藏牦牛奶渣中优势乳酸菌产胞外多糖及其耐受性
万金敏1,杨丽娜1,葛武鹏1,*,张 静1,耿 炜2,李小鹏3,吴小勇3
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西咸阳质量技术检测检验所,陕西 咸阳 712000;3.咸阳市食品药品检测检验中心,陕西 咸阳 712000)
从分离自西藏牦牛奶渣的113 株乳酸菌中筛选出4 株优势菌株(GY-L003、GY-L004、GY-L055、GYL112),对其产胞外多糖(exopolysaccharide,EPS)能力、耐酸能力、耐胆酸盐能力、耐渗透压能力及抑菌能力进行了比较研究。结果表明:4 株乳酸菌产EPS能力不尽相同,其中性能最优的菌株为GY-L003,为379.94 mg/L;4 株菌株表现出不同的耐受能力,其中GY-L003和GY-L004在pH 1.5条件下仍能存活;当胆酸盐质量分数高于0.4%时,GY-L003和GY-L004亦能生存,GY-L055和GY-L112则受到抑制;在耐渗透压方面,GY-L003和GY-L004性能较优,9% NaCl溶液中仍能生长;4 株菌均具较好的抑菌特性,对金黄色葡萄球菌抑制最强的为GY-L004,抑菌圈可达(15.94±0.31) mm;GY-L003对大肠杆菌和沙门氏菌的抑制效能最强,抑菌圈分别为(18.21±0.65)、(16.27±0.50) mm;GY-L112对单增李斯特菌抑菌效果佳,抑菌圈为(15.24±0.35) mm。综上,GY-L003和GYL004产EPS、耐受性、抑菌能力等性能俱佳,具有较好的应用潜力,为工业化利用提供了参考依据。
乳酸菌;胞外多糖;耐受特性;抑菌活性
奶渣是西藏牧民制取奶油后得到的一种特色发酵乳品,一直是沿袭传统而古老的方法制作而成,其制作过程是将牦牛鲜乳或者提制酥油后的脱脂乳加热处理后,经自然发酵、过滤、加糖调配、成型、干制等工序制成。产品特点是质地较硬,易于保存,是高原牧民重要的蛋白质食物来源之一,在野外放牧生活中食用十分方便[1]。奶渣营养价值丰富,富含脂肪酸、蛋白质、氨基酸、维生素等[2],色白味酸,具有较好的助消化作用,并有一定滋补气血作用,牧区民众普遍喜食。奶渣中具有较为丰富的微生物菌相,是获取具有优良发酵性能乳酸菌的主要来源[3-4]。
乳酸菌应用范围愈来愈广,其多样的代谢产物具有很好的改善食品质构能力及不同营养特性。其产生的胞外多糖(exopolysaccharide,EPS)具有乳化稳定特性及调节免疫能力、抗溃疡、改善肠道菌群等特性。EPS是天然的增稠剂和品质改良剂,可以增强发酵乳制品的黏性、稳定性和保水性,减少脱水收缩和奶酪加工中的乳清析出[5],从而改善发酵乳制品的口感、质地和风味[6]。并且,来源于乳酸菌的EPS对机体无毒副作用,具有来源安全可靠等优点。最新的研究发现EPS能提高益生菌在胃肠道中定殖能力,可作为益生元促进益生菌在肠道增菌定殖[7]。产EPS的乳酸菌及其产生的EPS广泛应用于酸奶、低脂奶酪、餐后甜点等发酵乳制品的生产中[8]。
优选自传统发酵乳制品中的乳酸菌,经过纯化、活化及发酵性能改良,能适应肠道菌群,和谐共生于肠道微生态体系,保持微生态平衡,抑制肠道内腐败菌繁殖和有害产物的产生,代谢产生多种营养因子,刺激或促进营养成分吸收转化[9-10]。具备成为益生菌的乳酸菌,其前提是应具有良好的耐受性能(耐酸、耐胆酸盐、耐渗透压)和抑菌能力。
本研究从西藏牦牛奶渣中依据不同发酵性能筛选出4 株优势菌株,对其产EPS能力、体外耐酸、耐胆酸盐、耐渗透压能力及其抑菌能力进行比较评价,为其工业化利用提供技术参考。
1 材料与方法
1.1 菌种
乳酸菌菌种来自西北农林科技大学乳品科学实验室,是从西藏牦牛奶渣中分离得到的113 株乳酸菌菌株,经比对其不同发酵性能筛选出4 株优势菌株,分别是类干酪乳杆菌类干酪亚种(Lactobacillus. paracasei ssp. paracasei)GY-L003、类干酪乳杆菌类干酪亚种(L. paracasei ssp. paracasei)GY-L004、鼠李糖乳杆菌(L. rhamnosus)GY-L055、瑞士乳杆菌(L. helveticus)GY-L112;大肠杆菌ATCC25922、金黄色葡萄球菌ATCC29213、沙门氏菌ATCC14028、单增李斯特菌ATCC54004均购自中国工业微生物菌种保藏中心。
1.2 试剂与培养基
牛胆酸盐、氯化钠 国药集团化学试剂有限公司;三氯乙酸、苯酚、浓硫酸 成都科龙化工试剂厂。
MRS肉汤培养基 北京陆桥技术股份有限公司。
1.3 仪器与设备
DRP-9162型电热恒温培养箱 上海森信实验仪器有限公司;UV-2802型紫外分光光度计 上海尤尼柯仪器有限公司;PHSJ-3F型数显pH计 赛多利斯科学仪器有限公司;FC104型分析天平 长沙湘平科技发展有限公司;HC3018型高速离心机 安徽科大中佳有限公司;YXQ-LS-50S11型立式蒸汽灭菌器 上海博讯实业有限公司。
1.4 方法
1.4.1 乳酸菌EPS提取
乳酸菌按体积分数3%接种于MRS液体培养基中,37 ℃条件下静置培养24 h,取10 mL乳酸菌发酵液,加入250 μL体积分数为80%的三氯乙酸溶液,使蛋白质变性沉淀,5 000×g离心10 min去菌体,上清液装入透析袋中流水透析48 h。透析液中加入3 倍体积的95%乙醇,4 ℃条件下冷藏过夜,多糖呈絮状沉淀析出,4 ℃、8 000×g离心20 min,弃上清液,得到沉淀后的EPS[11]。将EPS溶于10 mL蒸馏水中,得到EPS溶液。采用苯酚-硫酸法测定EPS质量浓度,测定490 nm波长处的吸光度,以葡萄糖质量浓度(mg/L)为横坐标,吸光度为纵坐标绘制标准曲线。通过标准曲线(y=0.719 8x+ 0.019,R2=0.996 7)确定对应的多糖质量浓度[12]。EPS含量为样品多糖质量浓度减去未接种乳酸菌的空白培养基的背景干扰值[13]。
1.4.2 乳酸菌耐酸能力测定
将活化好的4 株菌株按3%接种量分别接入pH 1.5、2.5、3.5、4.5、5.5、6.5的MRS液体培养基中,37 ℃恒温静置培养,使用菌落平板计数法分别于0、2、4、6、24 h进行活菌计数,平行测试3 次[14]。
1.4.3 乳酸菌耐胆酸盐能力测定
MRS液体培养基中牛胆酸盐质量分数分别为0.00%、0.05%、0.10%、0.40%、0.80%、1.20%,其他培养及测试条件同1.4.2节[15]。
1.4.4 乳酸菌耐渗透压能力测定
MRS液体培养基中NaCl质量分数分别为为0%、1%、3%、5%、7%、9%,其他培养及测试条件同1.4.2节。
1.4.5 抑菌活性的测定
采用牛津杯法[16]筛选具有抑菌活性的乳酸菌。将20 mL LB培养基倒入直径为9 cm的培养皿中,水平静置至凝固,将指示菌菌悬液100 μL均匀涂布在LB固体培养基上,固定1 h。在每个平皿中等距离放置牛津杯4 个,其中3 个牛津杯中加入200 μL乳酸菌上清液,其余一个作为对照加入等量的灭菌MRS液体培养基,于37 ℃培养16 h,观察并测量抑菌圈。每个菌株平行3 次。
2 结果与分析
2.1 4 株优势乳酸菌产EPS能力比较

图 1 乳酸菌菌株产EPS能力差异Fig. 1 EPS-producing ability of selected LAB strains
由图1可知,4 株乳酸菌产EPS的能力差别较大,其中GY-L003性能最优,EPS产量为379.94 mg/L;其次是GYL004,EPS产量为333.46 mg/L;其余2 株GY-L055、GYL112产EPS能力表现一般,依次为272.54、244.51 mg/L。Degeest等[17]研究发现,乳酸菌在合成和半合成培养基中产EPS的能力一般在40~600 mg/L之间,本研究结果与其一致。由此得到GY-L003、GY-L004是2 株产EPS性能较佳的乳酸菌,具有商业开发潜力。菌株不同,EPS的合成产量差别较大,原因包括:遗传因素,即菌株自身因素影响。乳酸菌合成EPS在基因水平上的不稳定,导致其EPS的合成量差异显著;培养基种类、培养基初始pH值、培养温度、氨基酸种类及含量等外在因素的影响。菌株、培养基种类和培养条件对EPS合成都有不同程度的影响,这些因素之间并不是孤立的,而是相互影响的。如果能够平衡它们之间的关系,优化出最佳条件,对于提高EPS的合成量具有重要的应用价值[18]。
2.2 4 株菌耐酸能力比对
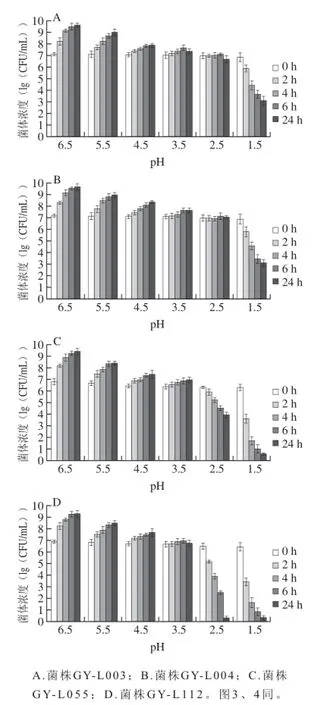
图 2 4 株乳酸菌对不同pH值的耐受力Fig. 2 Tolerance of LAB strains to different pH values
乳酸菌到达肠道之前,必须先经过胃酸环境,胃酸pH值可低至1.5。胃酸对微生物的生存影响很大,大部分来自食物中的微生物会被胃液中的胃酸杀死[19]。乳酸菌能够顺利通过胃酸屏障存活下来,必须具有一定的耐酸能力,这是筛查益生菌的首要条件。由图2可知,4 株菌株随着pH值的不断降低,随着培养时间的延长各菌株的生存状态表现出高度一致性,菌体生长均呈现随pH值的降低而减小的现象,减小幅度不尽相同;同一菌株在不同pH值时表现了不同的生存状态,在弱酸性条件下呈现增菌繁殖状态,在低酸性条件下呈现繁殖能力略增、持平或下降态势,表明不同菌株对酸的耐受能力不同。GY-L055耐酸能力最弱,在pH 2.5、1.5时,4 h后活菌数远小于初始状态,表明活菌衰减迅速,菌体处于低生存状态,可能是由于pH值过低,导致乳酸菌无法维持自身细胞内pH值的稳定,从而导致生长停滞,甚至衰亡。GY-L112在pH 2.5时,培养24 h后,菌体浓度仍接近104CFU/mL;pH 1.5时,菌体浓度下降迅速,在24 h时几乎为零,看出该菌株几乎被完全抑制,藉此判定该菌株耐酸极限pH 2.5。对于GY-L003和GY-L004两株菌而言,即使在极低pH 1.5条件下,菌体浓度仍高于103CFU/mL,故判定这两株菌具有较好的耐酸性。
2.3 耐胆酸盐能力测试评价
乳酸菌耐受胆酸盐的能力是其能在肠道中存活的必要条件,因此耐胆酸盐能力是益生菌微生物的一个重要特征[20]。菌株的生长受胆酸盐的影响很大,不同菌株的胆酸盐耐受性差异明显。人体小肠中胆酸盐质量分数在0.03%~0.3%之间波动,能够在正常生理胆酸盐质量分数中生长和代谢的菌株才可能在肠道消化过程中存活[21]。由图3可知,培养24 h,4 株菌活菌数随着胆酸盐质量分数不断增加而降低;同一菌株在胆酸盐质量分数逐渐升高时,表现出不同的生长态势。在0.4%及更高的胆酸盐质量分数下,2 h后GY-L055和GY-L112的活菌数远小于初始状态,菌株处于低生命状态,说明菌株的生长已被抑制,对胆酸盐较为敏感,表明其胆酸盐耐受力差。图3清晰显示出GY-L003和GY-L004在质量分数为0.4%时活菌数达到105CFU/mL以上,而在更高的质量分数下(0.8%、1.2%)菌株生长受到抑制,表明乳酸菌生长繁殖过程中虽均具有一定的耐胆酸盐能力,但耐受能力各不相同,这对于益生菌筛选是更不容忽视的。根据菌体活菌数生长状况比较,GY-L004能力优于GY-L003。
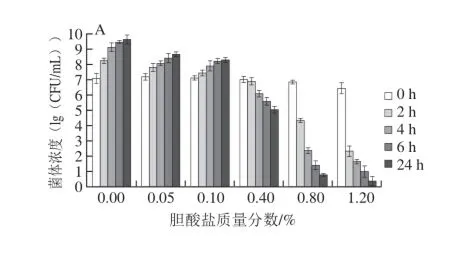
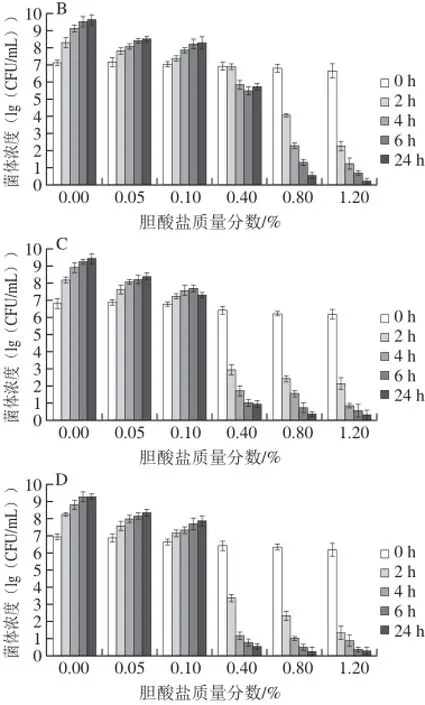
图 3 4 株菌对不同胆酸盐质量分数的耐受力Fig. 3 Tolerance of four LAB strains to different bile salt concentrations
2.4 耐渗透压能力比较

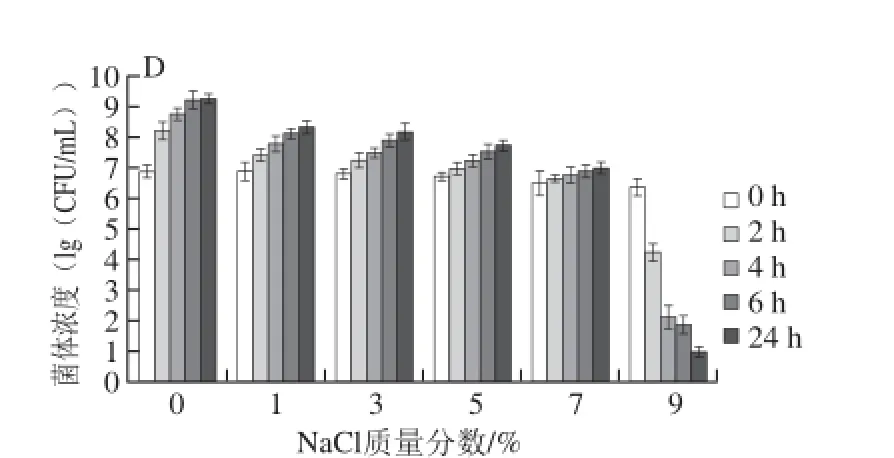
图 4 4 株乳酸菌对不同质量分数NaCl的耐受力Fig. 4 Tolerance of four LAB strains to different NaCl concentrations
微生物能否在胃肠道中存活,渗透压耐受性亦是关键评价指标之一。微生物对渗透压变化有一定的适应能力,突然增大或减小,对微生物的生长不利,甚至死亡[21]。由图4可知,不同质量分数NaCl下,4 株菌表现出了各不相同的耐受能力。菌株GY-L112耐渗透压能力最弱,在NaCl质量分数为7%、9%时,生长过程中活菌数远小于初始状态,说明其生存状态已经被抑制。GY-L055菌株在9% NaCl条件下基本不能生存。而GY-L003和GY-L004在所有质量分数下均表现出一定的生存能力,培养24 h后,活菌数分别在106CFU/mL和105CFU/mL以上,在NaCl质量分数渐次提高时,相同质量分数下GY-L003比GY-L004表现出较好的耐受性能,据此GY-L003的耐渗透压能力最优。不同微生物对耐受能力的考核侧重点不同,对于乳酸菌来说,主要考察耐酸、耐胆酸盐、耐渗透压能力。乳酸菌产生的EPS可作为益生元促进肠道内其他益生菌的生长,调节肠道菌群。乳酸菌的抑菌机理是:进入肠道后,通过黏附定植、竞争性排斥病原菌的黏附、产生多种抑菌物质以保护肠黏膜上皮细胞免受各种病原微生物的损害[22]。这些功能起作用的前提是乳酸菌进入肠道定植的过程中要能经受耐酸、耐胆酸盐和耐渗透压能力的检验。因此乳酸菌的耐酸、耐胆酸盐和耐渗透压能力是使其具有益生功能的重要指标。将筛选出的乳酸菌进行耐酸、耐胆酸盐和耐渗透压实验以确定乳酸菌能适应肠道环境。
2.5 4 株菌抑菌特性比较

表 1 乳酸菌菌株的抑菌结果Table 1 The antibacterial activities of LAB strains
由表1可知,在对大肠杆菌的抑制作用中,GYL003的抑菌效果最强,抑菌圈为(18.21±0.65) mm,G Y-L 0 0 4的抑菌效果仅次于G Y-L 0 0 3,为(16.27±0.41) mm;对金黄色葡萄球菌的抑制作用中,GY-L004的抑菌圈达到(15.94±0.31) mm,抑菌效果最好,其次是G Y-L 0 5 5的抑菌圈达到(15.20±0.35) mm;对沙门氏菌抑菌作用最强的为GYL003抑菌圈为(16.27±0.50) mm;对单增李斯特菌的抑制作用中,GY-L112的抑菌效果最强,抑菌圈为(15.24±0.35) mm。乳酸菌在代谢过程中会产生有机酸、细菌素、过氧化氢和类细菌素等物质[23]。有研究表明[24],这类物质可以抑制胃肠道中的有害微生物,如大肠杆菌、金黄色葡萄球菌、沙门氏菌、单增李斯特菌等生长繁殖,对致病菌引起的肠道感染、腹泻等疾病有预防和保护作用。目前消费者越来越青睐安全的、不添加防腐剂的产品。乳酸菌是国际公认安全微生物,抗致病菌乳酸菌食品的防腐方面展现出了巨大的应用潜力。因此,对菌株抑菌能力进行研究,筛选出抑菌能力较强的乳酸菌也是不容忽视的。
3 结 论
本实验测定出4 株乳酸菌菌株具有不同的产EPS
能力,性能较优的是GY-L003和GY-L004,EPS产量为
379.94 、333.46 mg/L。4 株乳酸菌均表现出不同程度的发酵耐受特性,GY-L003和GY-L004在极限pH 1.5、胆酸盐质量分数达到0.4%、NaCl质量分数高达9%时活菌数分别达到103、105、105CFU/mL以上,表现出较好的耐受性。抑菌能力比较,4 株菌株表现出不同的抑菌特性。抑制金黄色葡萄球菌能力最强的为GY-L004,抑菌圈达(15.94±0.31) mm;GY-L003对大肠杆菌和沙门氏菌的抑制作用均最强,抑菌圈分别达(18.21±0.65)、(16.27±0.50) mm;对单增李斯特菌的抑制GY-L112
性能最优,最大抑菌圈达(15.24±0.35) mm。综合比较,GY-L003和GY-L004产EPS能力、耐受能力及抑菌能力较为突出,具有开发利用价值。
[1] 李进波, 孙昊, 孙烨琪, 等. 牦牛奶渣理化成分及干酪素生产工艺研究[J]. 中国奶牛, 2011(8): 58-62. DOI:10.3969/ j.issn.1004-4264.2011.08.018.
[2] 林亚秋, 郑玉才, 邝良德, 等. 牦牛奶渣营养成分分析[J]. 食品科技, 2009, 34(7): 26-29. DOI:10.13684/j.cnki.spkj.2009.07.022.
[3] 丁武蓉. 青藏高原传统牦牛发酵奶中乳酸菌多样性及其益生功能研究[D]. 兰州: 兰州大学, 2014: 16-17.
[4] 廖钰婷, 吴均, 龙谋, 等. 西藏牧区自然发酵牦牛酸奶的乳酸菌菌种筛选及工艺优化[J]. 食品科学, 2015, 36(11): 140-144. DOI:l0.7506/ spkxl002-6630-201511027.
[5] de PALENCIA P F, WERNING M L, SIERRA-FILARDI E, et al. Probiotic properties of the 2-substituted (1,3)-D-glucan-producing bacterium Pediococcus parvulus 2.6[J]. Applied and Environmental Microbiology, 2009, 75: 4887-4891. DOI:10.1128/AEM.00394-09.
[6] 王辑. 产胞外多糖植物乳杆菌的分离筛选、分子表征及其应用研究[D]. 长春: 吉林大学, 2015: 28-29.
[7] YUN H JU, LEE Y J, YEO S H, et al. Isolation and characterization of exopolysaccharide producing lactic acid bacteria from Korean soy sauce and soybean[J]. Microbiology and Biotechnology Letters, 2013, 41(2): 190-197. DOI:10.4014/kjmb.1302.02004.
[8] 于静, 曾小群, 王鸿飞, 等. 高产胞外多糖乳酸菌的筛选及其发酵条件优化[J]. 中国食品学报, 2015, 15(2): 93-97. DOI:10.16429/j.1009-7848.2015.02.014.
[9] WALTER J, LEY R. The human gut microbiome: ecology and recent evolutionary changes[J]. Annual Review of Microbiology, 2011, 65: 411-429. DOI:10.1146/annurev-micro-090110-102830.
[10] CHAN E S, LEE P P, RAVINDRA P, et al. A standard quantitative method to measure acid tolerance of probiotic cells[J]. Applied Microbiology and Biotechnology, 2010, 86(1): 385-391. DOI:10.1007/ s00253-009-2384-y.
[11] 张玉龙, 胡萍, 王金龙, 等. 产胞外多糖乳酸菌的筛选及抗氧化特性研究[J]. 中国酿造, 2015, 34(10): 38-42. DOI:10.11882/ j.issn.0254-5071.2015.10.009.
[12] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356. DOI:10.1021/ ac60111a017.
[13] RIMADA P S, ABRAHAM A G. Comparative study of different methodologies to determine the exopolysaccharide produced by ke r grains in milk and whey[J]. Lait, 2003, 83(1): 79-87. DOI:10.1051/lait: 2002051.
[14] 李清, 王英, 刘小莉, 等. 一株广谱抑菌活性乳酸菌的筛选及特性研究[J]. 微生物学通报, 2015, 42(2): 332-339. DOI:10.13344/ j.microbiol.china.140373.
[15] 李利, 孔丽, 张宁, 等. 耐酸耐胆盐乳酸菌的鉴定及筛选[J]. 食品科学, 2015, 36(21): 123-128. DOI:10.7506/spkx1002-6630-201521024.
[16] 曾小群, 潘道东, 杨瑶, 等. 一株高效降解胆固醇乳酸菌的筛选鉴定及其益生潜能初探[J]. 食品科学, 2009, 30(21): 241-245.
[17] DEGEEST, B, de VUYST L. Indication that the nitrogen source influences both amount and size of exopolysaccharides produced by Streptococcus thermophilus LY03 and modeling of the bacterial growth and exopolysaccharide production in a complex medium[J]. Applied and Environmental Microbiology, 1999, 65(7): 2863-2870.
[18] 胡盼盼, 宋微, 单毓娟, 等. 影响乳酸菌胞外多糖产量的因素[J]. 食品科技, 2014, 39(9): 31-37. DOI:10.13684/j.cnki.spkj.2014.09.008.
[19] 郭兴华, 曹郁生, 东秀珠. 益生乳酸细菌-分子生物学及生物技术[M].北京: 科学出版社, 2008: 256-260.
[20] 魏艳, 曾小群, 潘道东, 等. 新疆地区不同酸奶中优势乳酸菌的分离与鉴定[J]. 中国食品学报, 2012, 12(12): 161-166.
[21] 王娴, 赵湘涛. 两株乳酸菌的耐受特性分析与研究[J]. 中国酿造, 2013, 32(11): 87-90. DOI:10.3969/j.issn.0254-5071.2013.11.021.
[22] RESTA-LENERT S, BARRETT K E. Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive Escherichia coli (EIEC)[J]. Gut, 2003, 52: 988-997. DOI:10.1136/ gut.52.7.988.
[23] 余瑛, 张娅, 刘锐, 等. 不同乳杆菌对常见病原菌的抑菌效果研究[J]. 西南农业学报, 2006(19): 294-296. DOI:10.3969/ j.issn.1001-4829.2006.02.030.
[24] PRINGSULAKA O, THONGNGAM N, SUWANNASAI N, et al. Partial characterisation of bacteriocins produced by lactic acid bacteria isolated from Thai fermented meat andsh products[J]. Food Control, 2012, 23(2): 547-551. DOI:10.1016/j.foodcont.2011.08.029.
Exopolysaccharide (EPS)-Producing Ability and Tolerance of Dominant Lactic Acid Bacteria (LAB) Strains from Yak Milk Dreg in Tibet
WAN Jinmin1, YANG Lina1, GE Wupeng1,*, ZHANG Jing1, GENG Wei2, LI Xiaopeng3, WU Xiaoyong3
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China; 2. Institute of Inspection of Xianyang Bureau of Quality and Supervision, Xianyang 712000, China; 3. Xianyang Food and Drug Inspection Center, Xianyang 712000, China)
A total of 113 strains of lactic acid bacteria (LAB) were isolated from yak milk dreg in Tibet. Out of these, four dominant LAB stains were screened and compared for their exopolysaccharide (EPS)-producing ability, acid, bile and osmotic pressure tolerance, and antimicrobial activity. Results demonstrated that the EPS-producing abilities were different for the 4 selected strains, with strain GY-L003 producing the highest yield of EPS (379.94 mg/L). The LAB strains exhibited different levels of tolerance to three environmental factors and strains GY-L003 and GY-L004 could survive at extremely acidic pH of 1.5. At a bile concentration of higher than 0.4%, GY-L003 and GY-L004 could grow while GY-L055 and GY-L112 were inhibited. In terms of osmotic tolerance, GY-L003 and GY-L004 were superior, being able to grow when NaCl concentration was up to 9%. All four LAB strains had strong antimicrobial activity, among which GY-L004 had the strongest inhibitory effect against Staphylococcus aureus, with an inhibition zone diameter of (15.94 ± 0.31) mm, GY-L003 had the strongest inhibitory effect against both E. coli and Salmonella, with an inhibition zone circle of (18.21 ± 0.65) and (16.27 ± 0.50) mm, respectively, and GY-L112 exhibited the strongest inhibitory effect against Listeria monocytogenes with an inhibition zone diameter of (15.24 ± 0.35) mm. Taken collectively, our results suggested that both GY-L003 and GY-L004 had high EPS-producing ability, good tolerance to acid, bile and osmotic pressure, and strong antimicrobial activity. Accordingly, these strains have a good application potential and can provide a reference basis for application in the production of fermented dairy products.
lactic acid bacteria; exopolysaccharide; tolerance; antimicrobial activity
2016-08-15
陕西省科技厅战略性新兴产业重大产品(群)项目(2015KTCQ03-08)
万金敏(1990—),女,硕士研究生,研究方向为食品科学。E-mail:agerkp67321@126.com
*通信作者:葛武鹏(1965—),男,副教授,博士,研究方向为食品科学。E-mail:josephge@sina.com
10.7506/spkx1002-6630-201710017
TS252.1
A
1002-6630(2017)10-0098-06引文格式:
万金敏, 杨丽娜, 葛武鹏, 等. 西藏牦牛奶渣中优势乳酸菌产胞外多糖及其耐受性[J]. 食品科学, 2017, 38(10): 98-103.
10.7506/spkx1002-6630-201710017. http://www.spkx.net.cn
WAN Jinmin, YANG Lina, GE Wupeng, et al. Exopolysaccharide (EPS)-producing ability and tolerance of dominant lactic acid bacteria (LAB) strains from yak milk dreg in Tibet[J]. Food Science, 2017, 38(10): 98-103. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201710017. http://www.spkx.net.cn
——2017年渗透压相关高考真题赏析

