黑荆树原花色素二聚体的分离制备及抗氧化活性研究
周 蒙, 刘功骏, 何凌霄, 王 飞
(1.南京林业大学 江苏省林业资源高效加工利用协同创新中心,江苏 南京 210037;2.南京林业大学 化学工程学院;江苏省生物质绿色燃料与化学品重点实验室,江苏 南京 210037)
黑荆树原花色素二聚体的分离制备及抗氧化活性研究

ZHOU Meng
周 蒙1,2, 刘功骏1,2, 何凌霄1,2, 王 飞1,2*
(1.南京林业大学 江苏省林业资源高效加工利用协同创新中心,江苏 南京 210037;2.南京林业大学 化学工程学院;江苏省生物质绿色燃料与化学品重点实验室,江苏 南京 210037)
以黑荆树皮为原料,采用超声波辅助提取技术提取原花色素,并利用溶剂萃取法得到低聚原花色素含量较高的乙酸乙酯萃取物;进一步通过葡聚糖凝胶Sephadex LH-20柱和快速蛋白液相色谱(FPLC)分离纯化制备黑荆树原花色素二聚体,并采用HPLC-MS对产物结构进行了鉴定。结果表明:超声波辅助提取原花色素的粗提物得率高达50.21%,其中含原花色素为40.75%,乙酸乙酯萃取物经葡聚糖凝胶Sephadex LH-20柱可得液相纯度约为60%的组分I(得率约为5%);组分I经FPLC分离,水-甲醇为流动相,得到纯度为91.72%的原花色素二聚体(得率约为13%);HPLC-MS分析表明,原花色素二聚体相对分子质量为578,可能是由原花青定的C-4键与原刺槐定的C- 8键相连。黑荆树原花色素二聚体对DPPH自由基的清除率分析表明:原花色素二聚体的抗氧化活性总体高于儿茶素以及表没食子儿茶素没食子酸酯(EGCG)标样,当二聚体浓度为60 μmol/L时对DPPH清除率大于80%,高于EGCG(约为68%)和儿茶素(约为50%)。
黑荆树皮;原花色素;制备;抗氧化活性
原花色素是自然界广泛存在的一类多酚化合物的总称,具有C6-C3-C6基本构架,广泛存在于植物的根、茎、叶、花、果实和树皮中,已发现的原花色素含量较高的植物超过600种,其中对海岸松、花旗松、葡萄籽、山楂、高粱、越桔、地榆、苹果等原花色素植物资源进行的研究较系统[1-2]。原花色素优越的抗氧化能力和自由基清除活性已被人们广泛认可,同时,原花色素还具有抑制肿瘤、改善人体微循环[3-4]、抗炎[5]等多种特殊功效。Wood等[6]研究了不同pH值条件下海岸松树皮原花色素以及葡萄籽原花色素的抗氧化活性,结果表明碱性条件下原花色素的抗氧化活性高且两种原料的原花色素超氧化自由基清除率均大于维生素C和维生素E。Oldoni等[7]从花生种皮中得到原花青素A1和原花青素A2,通过活性对比研究发现原花青素A1和原花青素A2的抗氧化活性高于合成抗氧化剂丁基羟基茴香醚(BHA)和二丁基羟基甲苯(BHT)。目前以葡萄籽中原花色素作为主要活性成分的保健品开发较多,市售的法国沿海松树皮提取物胶囊主要生物活性成分也为原花青素。黑荆树(AcaciamearnsiiDe Willd)为豆科金合欢属常绿乔木,原产新南威尔士、维多利亚、南澳大利亚、塔斯马尼亚等地,我国主要适宜栽植于福建、广东、湖南、广西、湖北、四川、云南、贵州等南方省区,是一种生长快、伐期短、用途广、商业性强的树种,其制成的栲胶颜色浅、鞣性好,为国际上公认的优质烤胶。近年来研究发现黑荆树具有抑菌[8]、抗氧化等生物活性,其主要活性成分为黑荆树原花色素。常见的葡萄籽中原花色素约占干基的3.9%[9]。黑荆树树皮中原花色素约占干基的20%[10],其高含量使得黑荆树皮原花色素的分离纯化存在先天优势。黑荆树皮原花色素存在4个单体:原菲瑟定、原花青定、原刺槐定以及原翠雀定[10],复杂的单体组成导致二聚体、三聚体结构增多,相比于葡萄籽原花色素更难分离。Kusano等[11]从黑荆树皮中分离制备出16种纯品,且首次分离出4′-O-甲基刺槐亭醇-3′-O-β-D- 吡喃葡萄糖苷以及两个原花色素二聚体(菲瑟亭醇-4α,6-没食子儿茶素、表刺槐亭醇-4β,8-儿茶素),但分离过程复杂且得率低。本研究利用葡聚糖凝胶柱以及快速蛋白液相色谱仪分离纯化制备黑荆树皮原花色素二聚体,采用HPLC-MS方法分析了二聚体的结构,并考察了原花色素二聚体的DPPH清除能力,旨在寻找一种简单、快速、高效的原花色素二聚体纯品制备方法,同时为黑荆树原花色素的抗氧化、抗肿瘤、抗炎等生物活性研究提供技术支持。
1 材料与方法
1.1 原料与试剂
黑荆树(AcaciamearnsiiDe Willd)树皮,广西黄冕林场提供,经粉碎机粉碎至0.25~0.55 mm,备用;儿茶素和表没食子儿茶素没食子酸酯(EGCG)购自SIGMA公司;葡聚糖凝胶Sephadex LH-20购自GE Healthcare公司;乙腈、甲醇为色谱纯;水为超纯水;石油醚、乙醇、乙酸乙酯、甲醇均为分析纯试剂。
1.2 黑荆树皮原花色素的提取和初步分离
采用超声波辅助提取技术提取黑荆树皮原花色素[12]:黑荆树皮粗粉10.0g以体积分数50%乙醇作为提取溶剂,料液比为1 ∶11(g ∶mL),提取温度34 ℃,提取时间30 min,超声波频率67 kHz,提取3次。提取液旋蒸后冷冻干燥得粗提物4.52 g,样品用溶剂萃取法进一步分级分离。10 g粗提物溶解于 100 mL 水中,加入石油醚萃取(体积比2 ∶1,萃取3次)。水层再用乙酸乙酯萃取(体积比1 ∶3,重复3次)。水层和乙酸乙酯层分别旋蒸后冷冻干燥,备用。根据文献[13]乙酸乙酯萃取物中主要含中等相对分子质量(Mn=860)的单宁化合物,如儿茶素的2~5聚体;水层主要是相对分子质量较高(Mn=1 550)的多酚以及少量的非单宁化合物。本实验以乙酸乙酯层的低聚原花色素为原料进行分离纯化。
黑荆树皮原花色素粗提物得率计算公式见式(1):
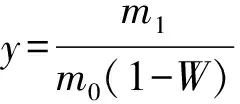
(1)
式中:y—粗提物得率,%;m0—树皮质量,g;m1—提取物质量,g;W—树皮含水量,%。
1.3 黑荆树皮原花色素的分离纯化
1.3.1 葡聚糖凝胶Sephadex LH-20分离 称取2 g 1.2节所得低聚原花色素样品(乙酸乙酯萃取物)溶于乙醇,过0.45 μm滤膜,所得溶液通过葡聚糖凝胶Sephadex LH-20柱(3 cm×30 cm)进行层析分离。洗脱液为无水乙醇,流速0.5 mL/min,洗脱液(10 mL/管)分管按顺序收集(洗脱至少800 mL),最后用50 %丙酮冲洗出吸附物质。所得样品经液相分析后合并备用,得到组分I。
1.3.2 快速蛋白液相色谱(FPLC)分离 配制质量浓度为10 g/L组分I的甲醇溶液,待FPLC基线平稳后进样,进样体积为 2 mL,按梯度洗脱方法纯化组分I,根据色谱峰收集目标组分。
梯度洗脱方法:FPLC分离选用反向层析的方法模板,制备色谱柱为博纳艾杰尔科技XBP-C18柱(250 mm×10 mm,5 μm);流动相为水和甲醇(流动相过0.45 μm滤膜,超声波脱气);梯度洗脱程序为0~80 min下甲醇体积分数10%→50%,流速为1.5 mL/min,检测波长为280 nm。
1.4 HPLC-MS分析方法
HPLC分析条件:色谱柱为ZORBAX Eclipse XDB-C18(250 mm×4.6 mm,5 μm);流动相为乙腈和水;线性洗脱方式为0~30 min时乙腈体积分数10%→25%,30~35 min时乙腈体积分数25%→75%。进样量为5 μL,流速为0.5 mL/min,柱温30 ℃,检测波长为280 nm。
MS分析条件:离子源为ESI,负离子扫描;扫描范围m/z50~1 500 ;雾化气温度为350 ℃;雾化气流速为12 L/min;雾化气压力241.38 kPa;毛细管电压4 000 V;锥孔电压-40.0 V;毛细管出口电压-135 V。
1.5 原花色素抗氧化活性分析
参照文献[14]抗氧化活性测定方法比较原花色素二聚体及儿茶素、EGCG标样的抗氧化活性。以50%乙醇为溶剂配制浓度为5×10-5mol/L的DPPH乙醇溶液,524 nm下DPPH有强吸收峰,原花色素与DPPH结合使其吸光度变小从而评价样品的抗氧化能力。取0.5 mL不同浓度的样品溶液加入3 mL DPPH溶液,反应30 min后测得吸光度记为Ai;0.5 mL样品溶液加入3 mL溶剂,测得吸光度记为Aj;0.5 mL溶剂加入3 mL DPPH溶液,测得吸光度记为Ac。
DPPH自由基清除率(yDPPH·)的计算方法见式(2):
yDPPH·=(1-(Ai-Aj)/Ac) ×100%
(2)
2 结果与分析
2.1 黑荆树皮原花色素的提取及初步分离
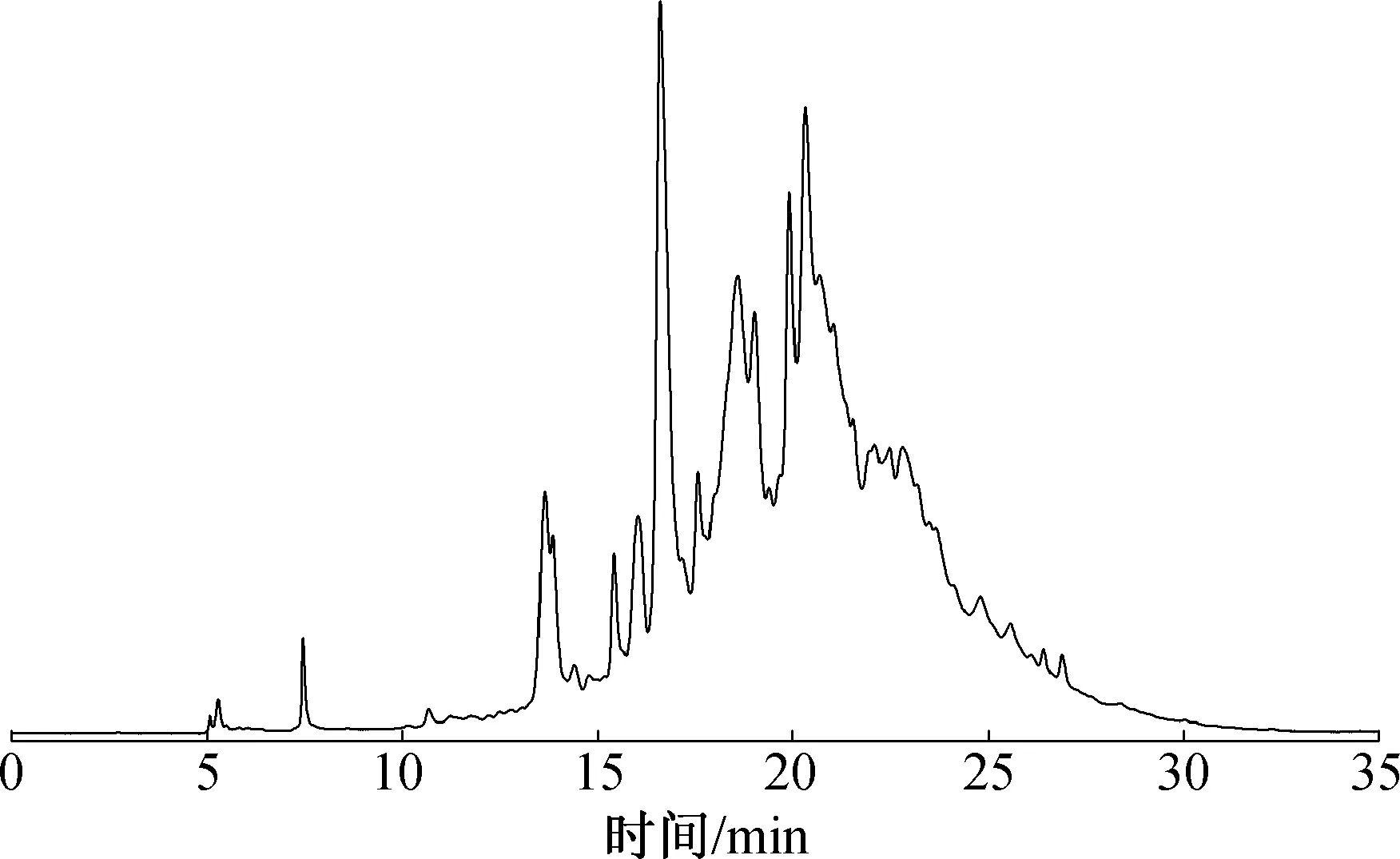
图1 黑荆树皮提取物乙酸乙酯层的HPLC图Fig.1 HPLC chromatogram of acetic ether phase from A. mearnsii bark
超声波辅助技术提取黑荆树皮原花色素,其粗提物得率高达50.21%,经香草醛-硫酸法测得含原花色素为40.75%。黑荆树皮提取物先通过石油醚萃取除去皂苷和生物碱类物质,水层用乙酸乙酯再次萃取,最终得乙酸乙酯层与水层质量比为5.3 ∶4.3。原花色素属于热敏性物质,传统的热水浸提会导致原花色素发生自聚,从而降低提取物中低聚原花色素的含量。超声波辅助提取技术采用低温提取,使得到低聚原花色素(乙酸乙酯萃取物)的量明显增多,以乙酸乙酯萃取物为原料进行下一步分离纯化。黑荆树皮提取物乙酸乙酯层HPLC图,如图1所示。
2.2 黑荆树皮原花色素的分离纯化
2.2.1 Sephadex LH-20柱层析结果 乙酸乙酯萃取后物质过Sephadex LH-20柱(3 cm×30 cm)层析,样品前沿到达柱长4/5时开始收集流出组分。2.0 g乙酸乙酯层样品通过Sephadex LH-20,乙醇为洗脱液进行分离纯化,通过液相色谱-质谱分析流出物质并合并相同组分。结果表明:第106号~125号管为相同物质且样品纯度均大于50%,该组分记为组分I,如图2所示。组分I得率约5%,合并后该组分含有纯度约60%的二聚体(相对分子质量578)。纯化过程简单、便捷、快速且效果显著,组分I旋蒸后冷冻干燥,备用。
由于黑荆树皮原花色素单体组成成分多,二聚体、三聚体结构复杂,不同的二聚体以及三聚体可能极性相似,不同物质间相似的极性给样品的分离纯化带来困难,因此选用葡聚糖凝胶对黑荆树皮的乙酸乙酯萃取物进行粗分离是得到原花色素纯品至关重要的一步。
2.2.2 FPLC纯化结果 FPLC对植物组分的制备分离原理与制备液相一致,按峰将目标组分进行收集。以组分I为原料进行FPLC分离纯化,组分I中目标组分(原花色素二聚体)纯度大于60%。按照1.3.2节FPLC分离纯化方法,根据色谱图(图3)的出峰情况,用自动收集器收集流出组分,并用液质进行检测分析。合并相同组分后旋蒸冷冻干燥得粉末。

图2 Sephadex LH-20柱层析所得组分I的HLPC图
Fig.2 HPLC chromatogram of sample I purified by Sephadex LH-20

图3 原花色素二聚体的FPLC制备图谱
Fig.3 Preparation of proanthocyanidins dimer by FPLC
由图3分析发现:横坐标为82~95 min时流出物含量最高,每4 mL收集组分,经液相色谱分析后发现该部分物质为二聚体578。
2.3 HPLC-MS分析结果
二聚体578的HPLC-MS图如图4所示,根据面积归一法计算得二聚体578纯度为91.72%。

图4 FPLC制备的二聚体的HPLC-MS图
为进一步确定该二聚体578的结构,对其进行二级质谱分析,如图5所示。

图5 m/z 577.5离子的二级质谱图
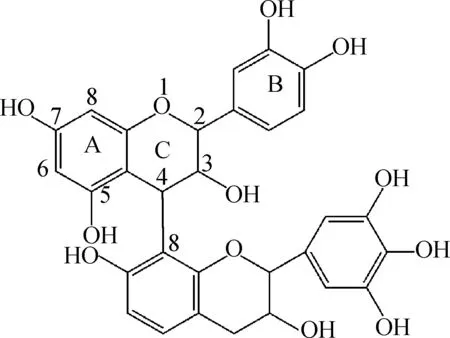
图6 相对分子质量578二聚体结构图Fig.6 Chemical structure of dimer with the relative molecular weight of 578
从图5可以看出,[M-H]-m/z577.5的碎片峰主要有m/z558.6、534.2、467.4、425.4、409.5、289.2和245.2。m/z558.6主要是原花色素失去一分子H2O得到的碎片峰;m/z534.2主要是原花色素失去A环的一个中性分子CO2(相对分子质量44);m/z467.4主要是原花色素失去B环上的C6H6O2结构(相对分子质量为110);m/z409.5主要是由于逆Diels-Alder(RDA)反应,在黄酮骨架结构的C环上发生RDA反应后失去一个中性的C8H8O4结构(相对分子质量168),由此碎片峰可以初步确定该二聚体中单体结构可能存在原刺槐定;m/z289.2是由于C—C连接键的断裂出现的单分子离子峰;m/z245.2则是经过上述断裂后失去A环的一个中性分子CO2(相对分子质量44)。裂变规律与刘国强等的研究一致[15],猜测相对分子质量为578的二聚体是由原花青定的C- 4键与原刺槐定的C- 8键相连,其可能的结构如图6所示。
200mg组分Ⅰ经FPLC纯化分离,纯度91.72%的二聚体得率约13%,纯化制备过程操作简单、快速、高效且重复性好。
2.4 抗氧化活性结果

图7 原花色素对DPPH·清除率Fig.7 The free radical-scavenging ability of proanthocyanidins
采用DPPH法对分离得到的原花色素二聚体以及儿茶素、EGCG标样进行抗氧化活性分析,结果如图7所示。由图7可以看出,分离得到的二聚体抗氧化活性高于儿茶素及EGCG;在10 μmol/L浓度下,儿茶素对DPPH自由基清除率约10%,二聚体578及EGCG对其清除率约为15%;随着浓度的增加,各物质对DPPH自由基的清除率均明显增加,当浓度为60 μmol/L时,二聚体578对DPPH自由基清除率大于80%,EGCG对其清除率约为68%,儿茶素对其清除率约为50%。
儿茶素含有4个酚羟基,二聚体578含有8个酚羟基,根据结构对比,基本确定酚羟基越多,物质的抗氧化活性越高。EGCG含有8个酚羟基,其抗氧化活性低于二聚体578,结构差别在于EGCG上含有没食子酸酯上的3个酚羟基,猜测二聚体578的B环上的酚羟基具有较强的抗氧化活性。本研究从原花色素构效关系出发,研究其抗氧化活性,为寻找活性位点奠定基础,具有一定的药学意义。
3 结 论
3.1 以黑荆树皮为原料,采用超声波辅助提取技术提取原花色素,并利用溶剂萃取法得到低聚原花色素含量较高的乙酸乙酯萃取物;进一步通过葡聚糖凝胶Sephadex LH-20柱和快速蛋白液相色谱(FPLC)分离纯化制备黑荆树原花色素二聚体,并采用HPLC-MS对产物结构进行了鉴定。结果表明:超声波辅助提取原花色素的粗提物得率高达50.21%,其中含原花色素为40.75%,乙酸乙酯萃取物经葡聚糖凝胶Sephadex LH-20柱可得液相纯度约为60%的组分I(得率约为5%);组分I 经FPLC分离,水-甲醇为流动相,得到纯度为91.72%的原花色素二聚体(得率约为13%);HPLC-MS分析表明,原花色素二聚体相对分子质量为578,可能是由原花青定的C- 4键与原刺槐定的C- 8键相连。
3.2 黑荆树原花色素二聚体对DPPH自由基的清除率分析表明:原花色素二聚体的抗氧化活性总体高于儿茶素以及表没食子儿茶素没食子酸酯(EGCG)标样,二聚体浓度为60 μmol/L时对DPPH自由基清除率大于80%,此时EGCG的清除率约为68%,儿茶素的清除率约为50%。
3.3 葡聚糖凝胶柱层析结合快速蛋白液相色谱法是一种简单、快速、高效的原花色素二聚体制备方法,该方法分离效果好、绿色环保;所得二聚体的抗氧化活性高、水溶性好,可进一步开发黑荆树的药用价值,从而拓宽该树种的应用领域,具有重要的经济价值和实践意义。
[1]石碧, 杜晓. 植物原花色素研究利用进展与发展趋势[J]. 四川大学学报:工程科学版, 2006, 38(5): 16-24. SHI B, DU X. The progress on research and utilization of plant proanthocyanidins[J]. Journal of Sichuan University: Engineering Science Edition, 2006, 38(5): 16-24.
[2]伍丽娜, 孙皓, 孙娜. 分光光度法测原花色素抗氧化活性条件研究[J]. 农业机械, 2012(21): 110-112. WU L N, SUN H, SUN N. Study on antioxidant activity of proanthocyanidins by spectrophotometry[J]. Farm Machinery, 2012(21): 110-112.
[3]张长贵, 董加宝, 王祯旭. 原花色素及其开发应用[J]. 四川食品与发酵, 2006(1): 8-12. ZHANG C G, DONG J B,WANG Z X. Proanthocyanidin and it′s development & application[J]. Sichuan Food and Fermentation, 2006(1): 8-12.
[4]张长贵, 董加宝, 谢伍容. 原花色素抗氧化生物活性研究进展[J]. 粮食与油脂, 2009(6): 10-12. ZHANG C G, DONG J B, XIE W R. Research progress on antioxidative bioactivities of proanthocyanidins[J]. Cereals & Oils, 2009(6): 10-12.
[5]CHU H, TANG Q, HUANG H, et al. Grape-seed proanthocyanidins inhibit the lipopolysaccharide-induced inflammatory mediator expression in RAW264.7 macrophages by suppressing MAPK and NF-κb signal pathways [J]. Environmental Toxicology and Pharmacology, 2016, 41:159-166.
[6]WOOD J E, SENTHILMONAN S T, PESKIN A V. Antioxidant activity of procyanidin-containing plant extracts at different pHs [J]. Food Chemistry, 2002, 77(2): 155-161.
[7]OLDONI T L, MELO P S, MASSARIOLI A P, et al. Bioassay-guided isolation of proanthocyanidins with antioxidant activity from peanut (Arachishypogaea) skin by combination of chromatography techniques [J]. Food Chemistry, 2016, 192: 306-312.
[8]何有节, 狄莹, 赵宇,等. 黑荆树皮单宁降解产物的抑菌性能 [J]. 林产化学与工业, 1999,19 (2): 3-9. HE Y J, DI Y, ZHAO Y, et al. Antibacterial study of degradations of tannis from black wattle bark [J].Chemistry and Industry of Forest Products, 1999, 19(2): 3-9.
[9]时国庆. 葡萄籽中原花色素的提取,分离与抗氧化性研究[D]. 郑州:郑州大学硕士学位论文, 2004. SHI G Q.The study of extraction, separation and antioxidant from grape seeds proanthocyanidins[D]. Zhengzhou: Master Degree Thesis of Zhengzhou University, 2004.
[10]孙达旺. 植物单宁化学 [M]. 北京: 中国林业出版社, 1992. SUN D W. Chemistry of Vegetable Tannins [M]. Beijing: China Forestry Publishing House, 1992.
[11]KUSANO R, OGAWA S, MATSUO Y, et al. Alpha-amylase and lipase inhibitory activity and structural characterization of acacia bark proanthocyanidins [J]. Journal of Natural Products, 2011, 74(2): 119-128.
[12]李田田, 王飞. 超声波辅助提取黑荆树皮原花色素工艺优化 [J]. 林产化学与工业, 2012, 32(5): 56-62. LI T T, WANG F. Investigation on ultrasonic-assisted extraction of proanthocyanidins from black wattle bark[J].Chemistry and Industry of Forest Products, 2012, 32(5): 56-62.
[13]姚开, 吕远平, 石碧,等. 黑荆树皮单宁不同级分的抑菌性能 [J]. 精细化工, 2000(7): 398-401. YAO K, LV Y P, SHI B, et al. Antibacterial study of different samples of proanthocyanidins from black wattle bark [J]. Fine Chemicals, 2000(7): 398-401.
[14]刘夏睿, 王飞. 黑荆树树皮原花色素生物活性的研究(英文) [J]. 林产化学与工业, 2007,27( 3): 43-48. LIU X R,WANG F. Investifation on biological activities of proanthocyanidins from black wattle bark [J]. Chemistry and Industry of Forest Products, 2007, 27(3): 43-48.
[15]刘国强, 董静, 王弘, 等. 4种儿茶素类化合物电喷雾质谱裂解规律的研究 [J]. 高等学校化学学报, 2009, 30(8): 1566-1570. LIU G Q, DONG J,WANG H, et al. ESI fragmentation studies of four tea catechins[J]. Chemical Journal of Chinese Universities, 2009, 30(8): 1566-1570.
Preparation and Antioxidant Activity of Proanthocyanidins Dimers fromAcaciamearnsiiDe Willd
ZHOU Meng1,2, LIU Gongjun1,2, HE Lingxiao1,2, WANG Fei1,2
(1. Jiangsu Co-innovation Center of Efficient Processing and Utilization of Forest Resources, Nanjing Forestry University, Nanjing 210037, China; 2. College of Chemical Engineering, Nanjing Forestry University;Jiangsu Key Lab. of Biomass-based Green Fuels and Chemicals, Nanjing 210037,China)
Proanthocyanidins were ultrasonic extraction was adopted to extract proanthocyanidins (PC) fromAcaciamearnsiiDe Willd bark powders. Oligomeric proanthocyanidins (OPC) (ethyl acetate extract) were obtained by solvent extraction. Sephadex LH-20 and fast protein liquid chromatography (FPLC) were applied to the separation and purification of PC dimers. The compound was characterized by HPLC-MS. The results indicated that the yield of PC was about 50.21%. The extract was separated by Sephadex LH-20 to obtain the sample Ⅰ with the purity of 60% and the yield of about 5%. The sample Ⅰ was further separated by FPLC with water-methanol as mobile phase, and then the dimer were obtained with the purity of 91.72% and the yield of about 13%. The result of HPLC-MS analysis showed that the relative molecular weight of dimer was 578 and the structure was supposed to be procyandin-(4, 6)-prorobinetinidin. Meanwhile, the results of radical scavenging ability assay indicated that the antioxidant activity of PC dimer was higher than that of catechin and epigallocatechin gallate (EGCG). The scavenging rate of dimer (60 μmol/L) was ≥80% which is higher than that of EGCG (68%) and catechin (50%).
AcaciamearnsiiDe Willd bark;proanthocyanidins; preparation; antioxidant activity
10.3969/j.issn.0253-2417.2017.02.018
2016-12-19
国家重点研发计划(2016YFD0600801);国家林业公益性行业科研专项(201104019)
周 蒙(1991— ),女,江苏南通人,硕士生,主要从事天然产物分离及其活性方面的研究
*通讯作者:王 飞,教授,博士,博士生导师,主要研究领域为生物质能源与生物质化学品;E-mail:hgwf@njfu.edu.cn。
TQ35
A
0253-2417(2017)02- 0135- 06
周蒙,刘功骏,何凌霄,等.黑荆树原花色素二聚体的分离制备及抗氧化活性研究[J].林产化学与工业,2017,37(2):135-140.

