重组人生长激素对重症急性胰腺炎肠黏膜屏障、肠道菌群及炎症因子的影响
李虎年,何 婷
湖北医药学院附属人民医院危重病医学科,湖北 十堰 442000
重组人生长激素对重症急性胰腺炎肠黏膜屏障、肠道菌群及炎症因子的影响
李虎年,何 婷
湖北医药学院附属人民医院危重病医学科,湖北 十堰 442000
目的探讨重组人生长激素对重症急性胰腺炎(severe acute pancreatitis,SAP)肠黏膜屏障、肠道菌群及炎症因子的影响。方法选择湖北医药学院附属人民医院2012年6月-2016年2月收治的80例SAP患者作为研究对象,按随机数字表分为观察组(43例)与对照组(37例)。对照组采取常规综合治疗并应用生长抑素粉针剂,观察组在对照组基础上加用重组人生长激素冻干粉针剂。比较两组治疗前后小肠黏膜绒毛高度、陷窝深度、肠杆菌、双歧杆菌、乳酸杆菌、IL-6、IL-8、TNF-α。结果治疗前两组小肠黏膜绒毛高度、陷窝深度、肠杆菌、双歧杆菌、乳酸杆菌、IL-6、IL-8、TNF-α比较,差异无统计学意义(P>0.05);与治疗前相比,对照组治疗后小肠黏膜绒毛高度与陷窝深度差异均无统计学意义(P>0.05),观察组治疗后小肠黏膜绒毛高度及陷窝深度均高于治疗前及对照组治疗后(P<0.05)。治疗后两组肠杆菌数量、IL-6、IL-8、TNF-α降低,双歧杆菌及乳酸杆菌增多(P均<0.05),治疗后观察组肠杆菌数量、IL-6、IL-8、TNF-α低于对照组,双歧杆菌及乳酸杆菌多于对照组(P均<0.05)。结论重组人生长激素在SAP患者中的应用可减轻肠黏膜损伤,修复胃肠道黏膜,调整肠道菌群,抑制早期细胞因子的瀑布效应,下调IL-6、IL-8、TNF-α,抑制炎症进展,从而促进病情缓解。
重症急性胰腺炎;重组人生长激素;肠黏膜屏障;肠道菌群;炎症因子
重症急性胰腺炎(severe acute pancreatitis,SAP)为外科危重急腹症,主要表现为胰腺坏死及全身性炎症反应,严重者可出现多器官功能障碍。该病起病急,病情进展迅速,并发症多。有研究[1]表明,患者并发多器官功能衰竭后的死亡风险为40%~70%。该病发病机制复杂,推测有多种因素参与,病因多与酗酒、暴饮暴食、胆管疾病等有关[2]。机体正常状态下,胰液中酶原无生物学活性,在十二指肠中被激活后才可起到消化作用。若机体处于创伤、饮酒过量、十二指肠液反流、合并胆管疾病等情况下,胰液中酶原便提前被激活,致胰腺及周围组织发生“自身消化”,从而引起胰腺功能紊乱,胰腺水肿、出血、坏死,最终导致渗透性增大与炎性因子释放[3]。本文以我院收治的SAP为例,探析重组人生长激素对SAP肠黏膜屏障、肠道菌群及炎症因子的影响。
1 资料与方法
1.1 一般资料选择湖北医药学院附属人民医院2012年6月-2016年2月收治的SAP患者80例作为研究对象,均符合纳入及排除标准。按照随机数字表法分为观察组(43例)与对照组(37例),两组性别、年龄、病程、合并症等基线资料比较,差异均无统计学意义(P>0.05,见表1),具有可比性。
1.2 纳入及排除标准纳入标准:(1)符合《急性胰腺炎诊治指南(2014)》[4]中诊断标准,急性发作;(2)Ronson标准[5]判定为重度;(3)经医院伦理委员会同意,患者签署知情同意书。排除标准:(1)心、肝、肾功能异常者;(2)合并腹部外伤者;(3)免疫系统疾病者;(4)未按规定用药者;(5)妊娠或哺乳期女性。
表1 两组基本资料比较
Tab 1 Comparison of the general data between two groups

组别例数性别(男/女)年龄(x±s,岁)病程(x±s,h)合并症[n(%)]高血压糖尿病高血脂症观察组4325/1849.2±8.24.6±1.03(6.98)2(4.65)4(9.30)对照组3720/1749.5±7.84.3±1.24(10.81)3(8.11)3(8.11)
1.3 治疗方法
1.3.1 对照组:采取常规综合治疗方案,包括禁食、吸氧、胃肠减压、纠正酸碱及水电解质平衡、对症处理、预防感染及脏器衰竭等,如有必要可酌情手术。在此基础上应用生长抑素粉针剂(瑞士雪兰诺有限公司生产,注册证号:H20090930,规格3 mg/支)进行治疗:首先通过静脉推注方式予以0.25 mg(溶入1 ml生理盐水配制而成),之后以0.25 mg/h速度进行持续静脉滴注,至血淀粉酶水平恢复至正常范围时停药。
1.3.2 观察组:在对照组基础上联合应用重组人生长激素冻干粉针剂(商品名思真,瑞士雪兰诺有限公司生产,注册证号:S20080036,规格4 IU/支),于治疗第2天开始应用,皮下注射,8 IU/次,1次/d,连续用药1周。
1.4 观察指标
1.4.1 肠黏膜屏障:分别于治疗前后通过胃镜以活检钳钳取2处十二指肠降段黏膜标本(包括黏膜全层及部分黏膜下层),用CMIAs系列多功能真彩色病理图像分析系统进行分析。每个标本分别取3个点测量小肠黏膜绒毛高度及陷窝深度,最后取平均值。
1.4.2 肠道菌群:应用肠道选择性培养基进行菌落培养,检测肠道优势菌,每克标本活菌数计数方法[4]:活菌数(g)=平均菌落数×47×稀释倍数标本重量,结果用对数值表示。
1.4.3 炎症因子:于两组患者入院时、入院第1天及第7天抽取50 ml外周静脉血检测IL-6、IL-8、TNF-α等炎症因子水平。IL-6、IL-8、TNF-α均应用放射免疫法检测,检测步骤严格执行试剂盒说明书。

2 结果
2.1 治疗前后肠黏膜屏障治疗前两组小肠黏膜绒毛高度与陷窝深度差异无统计学意义(P>0.05);对照组治疗后小肠黏膜绒毛高度与陷窝深度均无明显变化(P>0.05),观察组治疗后小肠黏膜绒毛高度与陷窝深度均高于治疗前及对照组治疗后(P<0.05,见表2)。
2.2 治疗前后肠道菌群治疗前两组肠杆菌、双歧杆菌、乳酸杆菌差异无统计学意义(P>0.05);治疗后两组肠杆菌数量减少、双歧杆菌与乳酸杆菌数量增多(P<0.05),治疗后观察组肠杆菌数量少于对照组,双歧杆菌及乳酸杆菌数量多于对照组(P<0.05,见表3)。
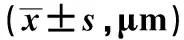
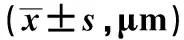
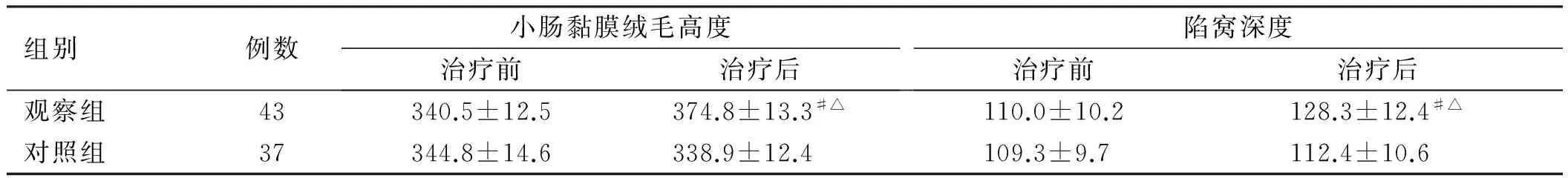
组别例数小肠黏膜绒毛高度治疗前治疗后陷窝深度治疗前治疗后观察组43340.5±12.5374.8±13.3#△110.0±10.2128.3±12.4#△对照组37344.8±14.6338.9±12.4109.3±9.7112.4±10.6
注:与本组治疗前比较,#P<0.05;与对照组治疗后比较,△P<0.05。
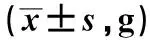
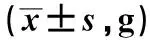
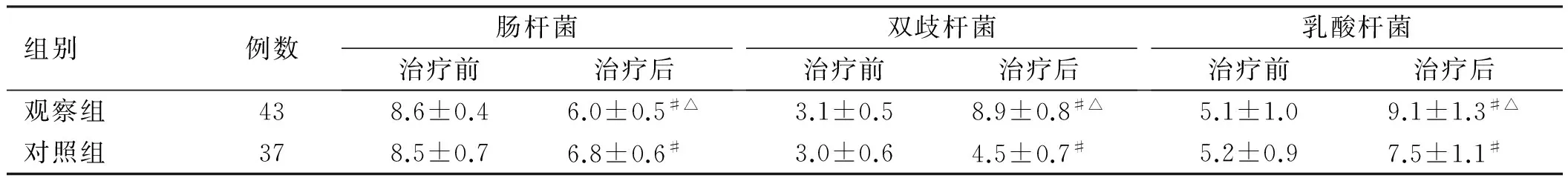
组别例数肠杆菌治疗前治疗后双歧杆菌治疗前治疗后乳酸杆菌治疗前治疗后观察组438.6±0.46.0±0.5#△3.1±0.58.9±0.8#△5.1±1.09.1±1.3#△对照组378.5±0.76.8±0.6#3.0±0.64.5±0.7#5.2±0.97.5±1.1#
注:与本组治疗前比较,#P<0.05;与对照组治疗后比较,△P<0.05。
2.3 治疗前后炎症因子水平治疗前两组IL-6、IL-8、TNF-α水平差异无统计学意义(P>0.05);治疗后两组IL-6、IL-8、TNF-α均降低(P<0.05),观察组IL-6、IL-8、TNF-α均低于对照组(P<0.05,见表4)。
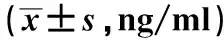
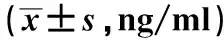

组别例数IL-6治疗前治疗后IL-8治疗前治疗后TNF-α治疗前治疗后观察组4384.3±7.130.3±5.5#△93.3±7.635.7±5.6#△42.2±6.020.0±4.5#△对照组3784.9±7.642.5±5.8#93.8±10.049.5±5.9#42.5±5.431.1±4.1#
注:与本组治疗前比较,#P<0.05;与对照组治疗后比较,△P<0.05。
3 讨论
研究[6]显示,SAP病情与炎症反应程度有较大关联,临床治疗过程中炎症反应的抑制非常关键。本研究中两组经治疗后IL-6、IL-8、TNF-α均大幅降低,且观察组下降幅度大于对照组,提示重组人生长激素的应用可强化对炎症反应的抑制。TNF-α为胰腺损伤的始发因子,对炎症反应有明显推动作用,通过激发一系列级联反应而诱导IL-6、IL-8水平增加,使毛细血管通透性不断升高[7]。IL-6除可增加血管通透性外,且会加速胰腺坏死,对IL-8与TNF-α等炎症因子的释放也有较大促进作用,形成恶性循环,加重病情。IL-8为趋化性细胞因子,可诱导炎症细胞的增殖与趋化,引起机体局部炎症反应。生长抑素为一种肽激素,在胰岛、胃黏膜、垂体后叶、胃肠道神经、中枢神经系统中广泛存在,可抑制胃分泌及蠕动,抑制胃蛋白酶、胃泌素释放,促进下丘脑/垂体中促生长激素的释放[8]。针对急性胰腺炎发病机制,个体化治疗方案已取得共识,尤其生长抑素的应用已经得到广泛认可,可抑制胆囊收缩及消化酶分泌,防止胰腺外分泌,从而有效抑制早期炎症反应发展为瀑布效应。此外生长抑素还可刺激网状内皮系统,对TNF-α诱导的IL-6、IL-8分泌增加进行抑制,并起到肝细胞、胃肠道黏膜保护作用,最终抑制全身性炎症反应的发展。
特殊状态(应激、低血压、严重感染)下,机体肠黏膜屏障可能被破坏,引起肠道细菌移位,若进一步渗透至腹腔内,则易导致严重腹膜炎或中毒。同时肠道内细菌进入门静脉与淋巴系统后还会加重全身感染及炎症反应,引起免疫功能紊乱[9]。本研究中两组治疗前的小肠黏膜绒毛高度、陷窝深度与肠道菌群无显著性差异,治疗后观察组小肠黏膜绒毛高度与陷窝深度均增大,对照组无明显改变;两组治疗后肠杆菌数量减少、双歧杆菌与乳酸杆菌增多,同时观察组肠杆菌下降幅度与优势菌双歧杆菌、乳酸杆菌的增加幅度均明显大于对照组。SAP患者的肠黏膜屏障功能往往因通透性增加而遭到严重破坏,观察组治疗后肠黏膜屏障功能优于对照组、优势菌多于对照组,提示重组人生长激素的应用在降低胃肠通透性方面具有较好的效果,可有效恢复肠黏膜屏障功能,保护小肠绒毛结构完整性。研究[10]认为,肠杆菌为SAP内源性感染重要原因,致使优势厌氧菌双歧杆菌与乳酸杆菌减少。本研究观察组经治疗后肠杆菌减少、优势厌氧菌双歧杆菌与乳酸杆菌大幅增加,也提示对肠道菌群的改善利于患者病情的缓解。有研究[11]指出,重组人生长激素不仅可减少毛细血管外渗、降低胃肠通透性,还可对胰酶分泌情况进行抑制,并促进磷脂酶A2活性的提高与肝网状内皮系统清除内毒素能力的增强,利于预防急性胰腺炎多器官功能衰竭,对胰腺细胞也有良好保护作用。
综上所述,重组人生长激素在急性重症胰腺炎患者中的应用可有效减轻肠黏膜损伤、修复胃肠道黏膜功能、调整肠道菌群,并通过抑制胆囊收缩及消化酶分泌而抑制早期细胞因子的瀑布效应,下调IL-6、IL-8、TNF-α,抑制炎症进展,促进病情缓解。
[1]崔俊风, 李哲浩, 李浩, 等. 重组人生长激素对阻塞性黄疸大鼠肠黏膜IL-6变化的影响[J]. 现代预防医学, 2014, 41(12): 2229-2233. Cui JF, Li ZH, Li H, et al. The effect of recombinant growth hormone on the change of intestinal mucosa IL-6 in rats with obstructive jaundice [J]. Modern Preventive Medicine, 2014, 41(12): 2229-2233.
[2]邹华新, 张宏伟. 重组人生长激素(rhGH)与肠黏膜屏障和免疫屏障关系的研究[J]. 内蒙古中医药, 2010, 29(24): 137-138. Zou HX, Zhang HW. Study on the relationship between recombinant human growth hormone (rhGH) and intestinal mucosal barrier and immune barrier [J]. Nei Mongol Journal of Traditional Chinese Medicine, 2010, 29(24): 137-138.
[3]黄莉, 陈建丽, 靳蓉, 等. 重组人生长激素对全身炎症反应综合征患儿细胞免疫及炎症因子的影响[J]. 临床儿科杂志, 2012, 30(1): 33-36. Huang L, Chen JL, Jin R, et al. The effects of recombinant human growth hormone on cellular immunity function and serum inflammatory cytokine levels in patients with systemic inflammatory response syndrome [J]. J Clin Pediatr, 2012, 30(1): 33-36.
[4]中华医学会外科学分会胰腺外科学组. 急性胰腺炎诊治指南(2014)[J]. 中华普通外科杂志, 2015, 30(1): 69-72. Department of Pancreatic Surgery, Chinese Academy of Medical Sciences. Guidelines for the diagnosis and treatment of acute pancreatitis (2014) [J]. Chin J Gen Surg, 2015, 30(1): 69-72.
[5]向珂, 田伏洲, 汤礼军, 等. 两种途径应用乌司他丁治疗重症急性胰腺炎的实验研究[J]. 西南国防医药, 2013, 23(8): 827-829. Xiang K, Tian FZ, Tang LJ, et al. Experimental study on two treatment ways of severe acute pancreatitis with ulinastatin [J]. Medical Journal of National Defending Forces in Southwest China, 2013, 23(8): 827-829.
[6]王海燕. 乌司他丁联合生长抑素治疗老年急性重症胰腺炎患者的疗效及对血清炎症因子的影响[J]. 中国老年学杂志, 2015, 35(19): 5554-5555. Wang HY. The efficacy of Ulinastatin combined with somatostatin in the treatment of elderly patients with severe acute pancreatitis and the effect on serum inflammatory factors [J]. Chinese Journal of Gerontology, 2015, 35(19): 5554-5555.
[7]孙兴龙, 鲁晓燕, 孟静, 等. 乌司他丁治疗急性重症胰腺炎效果及对IL-6、CRP和免疫球蛋白的影响[J]. 现代消化及介入诊疗, 2015, 20(6): 629-631. Sun XL, Lu XY, Meng J, et al. The effects of ulinastatin in the treatment of severe acute pancreatitis and the effect on IL-6, CRP and immunoglobulin [J]. Modern Digestion & Intervention, 2015, 20(6): 629-631.
[8]唐姝, 陈志祥, 陆伟根, 等. 重组人生长激素制剂制备中的稳定性研究进展[J]. 中国医药工业杂志, 2014, 45(11): 1072-1077. Tang S, Chen ZX, Lu WG, et al. Research progress in stability of recombinant human growth hormone in preparation process [J]. Chinese Journal of Pharmaceuticals, 2014, 45(11): 1072-1077.
[9]吴祖煌, 宋斌, 黄永新, 等. 添加重组人生长激素的营养支持对烧伤脓毒症危重患者营养状况的影响[J]. 肠外与肠内营养, 2011, 18(4): 207-210, 214. Wu ZH, Song B, Huang YX, et al. Altered nutrition state in the severe burn sepsis patients with adjuvant recombinant human growth hormone nutritional support therapy [J]. Parenteral & Enteral Nutrition, 2011, 18(4): 207-210, 214.
[10]许士叶, 张萌, 毛淑华, 等. 重组人生长激素对大鼠急性胰腺炎的治疗作用[J]. 华西药学杂志, 2008, 23(4): 431-433. Xu SY, Zhang M, Mao SH, et al. Effects of recombinant human growth hormone on acute pancreatitis in rats [J]. WCJPS, 2008, 23(4): 431-433.
[11]占小平. 重组人生长激素联合生长抑素治疗急性胰腺炎28例[J]. 中国药业, 2013, 22(11): 80-81. Zhan XP. Recombinant human growth hormone combined with somatostatin in the treatment of 28 cases of acute pancreatitis [J]. China Pharmaceuticals, 2013, 22(11): 80-81.
(责任编辑:李 健)
Effect of recombinant human growth hormone on intestinal mucosal barrier, intestinal flora and inflammatory factors in patients with severe acute pancreatitis
LI Hunian, HE Ting
Department of Critical Care Medicine, the People’s Hospital Affiliated to Hubei Medical College, Shiyan 442000, China
Objective To invesigate the effect of recombinant human growth hormone on intestinal mucosal barrier, intestinal flora and inflammatory factors in patients with severe acute pancreatitis (SAP).Methods Eighty patients with SAP who were admitted to the People’s Hospital Affiliated to Hubei Medical College from Jun. 2012 to Feb. 2016 were selected as study subjects, and they were divided into observation group (43 cases) and control group (37 cases). The control group was treated with routine comprehensive therapy and somatostatin powder-injection, and the observation group were additionally treated with recombinant human growth hormone freeze-dried powder injection. The small intestinal mucosal villus height, crypt depth, enterobacteria, bacillus bifidus, lactic acid bacillus, IL-6, IL-8 and TNF-α were compared between two groups before and after treatment.Results Before treatment, there was no significant difference in small intestinal mucosal villus height, crypt depth, enterobacteria, bacillus bifidus, lactic acid bacillus, IL-6, IL-8 and TNF-α between two groups (P>0.05). There was no significant change in small intestinal mucosal villus height and crypt depth in the control group before and after treatment (P>0.05). The small intestinal mucosal villus height and crypt depth in observation group after the treatment were significantly higher than those in observation group before treatment and the control group after treatment (P<0.05). After treatment, the number of enterobacteria, IL-6, IL-8 and TNF-α in the two groups were significantly decreased, bacillus bifidus and lactic acid bacillus were significantly increased (P<0.05). The number of enterobacteria, IL-6, IL-8 and TNF-α in the observation group were significantly lower than those in the control group, bacillus bifidus and lactic acid bacillus were significantly more than those in the control group (P<0.05).Conclusion Application of recombinant human growth hormone in patients with SAP can alleviate intestinal mucosa injury, repair gastrointestinal mucosa, adjust intestinal flora, inhibit water fall effect of early cell factor, downgrade IL-6, IL-8 and TNF-α, and inhibit inflammatory process, thus promote remission of disease.
Severe acute pancreatitis; Recombinant human growth hormone; Intestinal mucosal barrier; Intestinal flora; Inflammatory factor
李虎年,硕士,主治医师,研究方向:危重病医学科有关。E-mail:beasttu@163.com
何婷,主管护师,研究方向:神经危重症护理。E-mail:37717192@qq.com
10.3969/j.issn.1006-5709.2017.03.023
R576
A 文章编号:1006-5709(2017)03-0331-04
2016-07-14

