转移性胃癌预后因素和手术指征的初步探讨
李 合,陈兴超
海南医学院附属医院普通外科,海南 海口 570102
转移性胃癌预后因素和手术指征的初步探讨
李 合,陈兴超
海南医学院附属医院普通外科,海南 海口 570102
目的探讨转移性胃癌患者的预后因素与手术指征。方法收集2007年1月-2015年1月海南医学院附属医院收治的85例转移性胃癌患者的临床病例资料。回顾性分析其相关临床病理因素与患者预后的关系。结果所有患者的中位总生存期为9.7个月。68例接受了化疗,18例接受了胃切除+转移灶切除,39例接受了单纯胃切除,28例未切除,患者的中位总生存期分别为11.1个月、13.7个月、9.1个月和7.8个月(P<0.05)。单因素预后分析显示,手术组总生存期优于未手术组(P<0.05),胃切除+转移灶切除组总生存期优于单纯胃切除组(P<0.05)。多因素预后分析显示,未手术、中性粒细胞-淋巴细胞比值(NLR)>3.1、CA-199>37 U/ml为不良预后因素。手术治疗的患者中,NLR和CA-199仍为独立预后因素。结论治疗前较高的NLR、CA-199水平与转移性胃癌患者的不良预后相关。在NLR、CA-199水平相对较低的患者中,胃切除可安全实施,并可能与更长的生存期相关。
转移性胃癌;预后;手术
胃癌是世界第四大常见恶性肿瘤和第二大癌症相关死亡病因[1]。转移性胃癌预后差,无统一治疗标准。早期临床试验显示,与最佳支持治疗相比,化疗可提高晚期胃癌患者的生存期和生活质量[2]。尽管越来越多的证据显示化疗可提高转移性胃癌患者的生存期,但转移性胃癌患者仅接受化疗的预后仍然很差,中位总生存期约1年[3]。手术切除(加/不加转移灶切除)是否会给转移性胃癌带来生存受益仍不明确。研究[4]显示,手术可改善转移性胃癌患者的生存期、症状及生活质量,但另有研究[5]显示接受手术的转移性胃癌患者预后更差。目前尚无随机临床试验将手术与其他已报道的治疗进行对比。
本研究探讨了与转移性胃癌预后相关的临床病理因素,并对接受了胃切除合并/不合并转移灶切除的患者分别进行分析,以进一步认识手术切除对延长转移性胃癌的生存意义。
1 资料与方法
1.1 一般资料收集海南医学院附属医院2007年1月-2015年1月确诊的85例转移性胃癌患者的临床病例资料。所有患者均表现为治疗前同时性原发灶和转移灶。排除经剖腹手术首诊为转移性胃癌的患者。
纳入患者的资料包括年龄、性别、体力状态(performance status,PS)评分[6]。肿瘤相关因素包括分化程度(非低分化、低分化)、邻近器官侵犯(有或无)、转移的器官数。实验室资料包括中性粒细胞-淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR;>3.1定义为升高)、血红蛋白(<12 g/dl定义为降低)、癌胚抗原(carcinoembryonic antigen,CEA;>6 ng/ml定义为升高)、糖类抗原-199(carbohydrate antigen-199,CA-199;>37 U/ml定义为升高)。NLR=中性粒细胞数÷淋巴细胞数。原发灶对邻近器官侵犯、淋巴结肿大、有无远处转移采用增强CT进行评估。淋巴结肿大定义为单个淋巴结直径≥3 cm。
1.2 手术情况有足够器官功能且PS评分≤2分的患者考虑行胃切除加/不加转移灶切除。肿瘤播散广泛(如广泛的腹膜转移)不考虑行胃切除。患者存在原发肿瘤直接导致的梗阻、穿孔、出血等严重症状,考虑行胃切除不加转移灶切除。若基线CT结果显示完全的切除在技术上可行,手术则被选为初始治疗,且行开腹手术是以达到完全切除原发灶和转移灶为目的。若手术探查发现完全切除不可行,则切除原发灶并给予化疗。手术范围分为胃大部切除、全胃切除、扩大胃切除、未切除。未切除组包括胃分流术、空肠营养管置入、切开活检。在肝转移的患者中,完全切除定义为通过手术或射频消融完整地清除了肝转移灶。腹膜种植的患者按照日本胃癌分期[7](英文第1版)分为P1(转移至邻近的腹膜,如大网膜或小网膜,而未转移至远处腹膜)和P2(远处腹膜存在少数或一些散在转移灶),完全切除定义为完整地切除了所有腹膜转移结节[8]。在腹腔内远处淋巴结转移的患者中,完全切除定义为淋巴结切除且切缘无肿瘤。肿瘤切除且无肉眼残留癌归类为胃切除+转移灶切除,肿瘤切除而有肉眼残留癌归类为胃切除而无转移灶切除。
1.3 随访CT评估疗效在化疗开始后的1个月进行,且每3个月1次。在每次CT评估时再次评价患者完全切除的可行性。患者自确诊为转移性胃癌起开始随访,直至死亡或2015年12月31日。总生存期定义为从确诊到死亡(无论何种原因)或最后一次随访的时间。
1.4 统计学方法采用SPSS 17.0软件进行分析。切除组和未切除组间的临床病理因素比较采用χ2检验。单因素预后分析采用Log-rank检验,与预后相关的因素纳入Cox比例风险模型进行多因素预后分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征分析85例患者的中位生存期为9.7个月。其中行手术切除者57例,未行手术切除者28例。与未手术组相比,手术组患者的PS评分更佳、邻近器官侵犯比例、多器官转移比例更低(P<0.05,见表1)。
表1 85例转移性胃癌患者的临床病例特征
Tab 1 Clinical features of 85 cases of metastatic gastric cancer
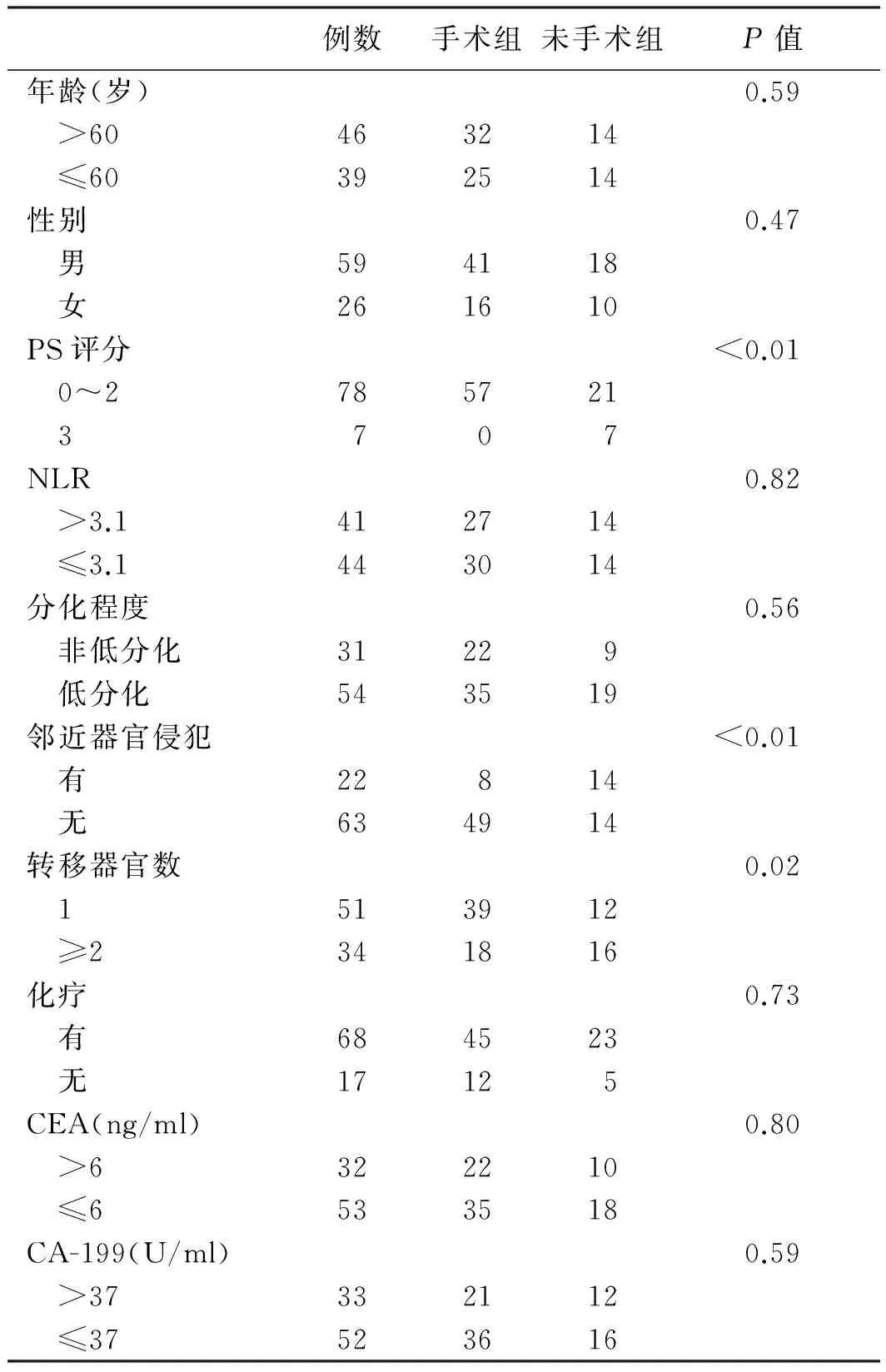
例数手术组未手术组P值年龄(岁)0.59 >60463214 ≤60392514性别0.47 男594118 女261610PS评分<0.01 0~2785721 3707NLR0.82 >3.1412714 ≤3.1443014分化程度0.56 非低分化31229 低分化543519邻近器官侵犯<0.01 有22814 无634914转移器官数0.02 1513912 ≥2341816化疗0.73 有684523 无17125CEA(ng/ml)0.80 >6322210 ≤6533518CA-199(U/ml)0.59 >37332112 ≤37523616
2.2 单因素、多因素分析结果结果显示,85例转移性胃癌患者NLR>3.1、CA-199>37 U/ml、未手术、有邻近器官侵犯、未行化疗与不良预后相关(见表2)。转移器官数与预后有相关趋势,差异无统计学意义(P>0.05)。将单因素分析鉴定出的预后因素纳入多因素分析,结果显示,NLR>3.1、CA-199>37 U/ml与不良预后显著相关;手术组患者的生存期比未手术患者明显更长(见表3、图1~3)。
表2 85例转移性胃癌患者的单因素预后分析
Tab 2 Univariate prognostic analysis of 85 cases of metastatic gastric cancer

中位生存期(月)95%CIP值年龄(岁)0.078 >609.18.3~9.9 ≤6011.87.6~16.0性别0.234 男10.27.7~12.7 女9.38.2~10.4PS评分0.665 0~29.78.7~10.7 39.26.4~12.0NLR0.001 >3.19.18.2~10.0 ≤3.111.910.0~13.8分化程度0.203 非低分化11.88.3~15.3 低分化9.58.5~10.5手术0.001 有11.89.1~14.5 无7.86.7~8.9邻近器官侵犯0.006 有9.57.4~11.6 无11.88.0~15.6转移器官数0.145 19.99.2~10.6 ≥29.28.0~10.4化疗0.012 有11.19.0~13.2 无6.24.2~8.2CEA(ng/ml)0.077 >69.17.5~10.7 ≤611.98.1~15.7CA-199(U/ml)<0.001 >377.75.4~10.0 ≤3711.98.4~15.4
表3 85例转移性胃癌患者的多因素预后分析
Tab 3 Multivariate prognostic analysis of 85 cases of metastatic gastric cancer
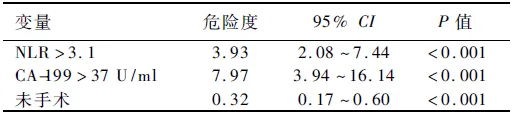
变量危险度95%CIP值NLR>3.13.932.08~7.44<0.001CA-199>37U/ml7.973.94~16.14<0.001未手术0.320.17~0.60<0.001
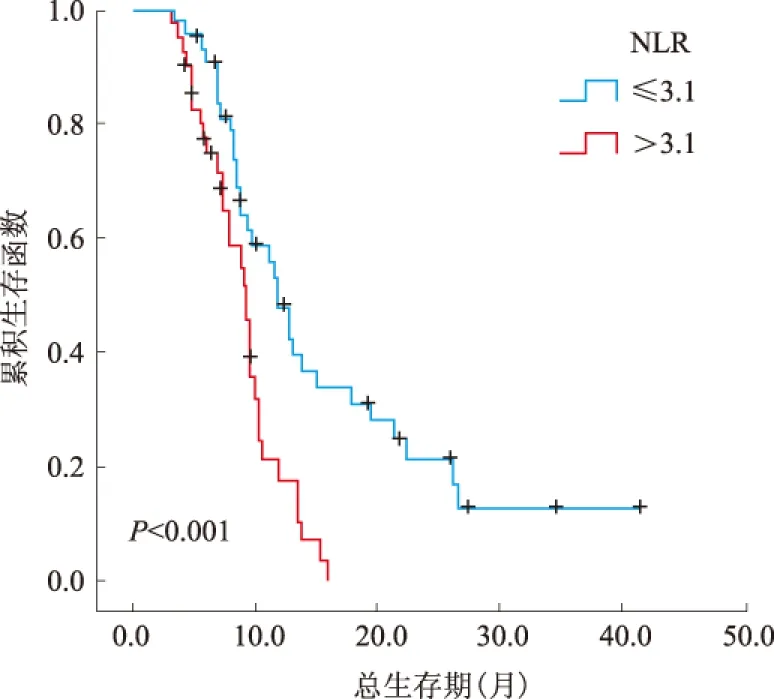
图1 NLR与患者预后的关系Fig 1 Relationship between NLR and the prognosis of patients
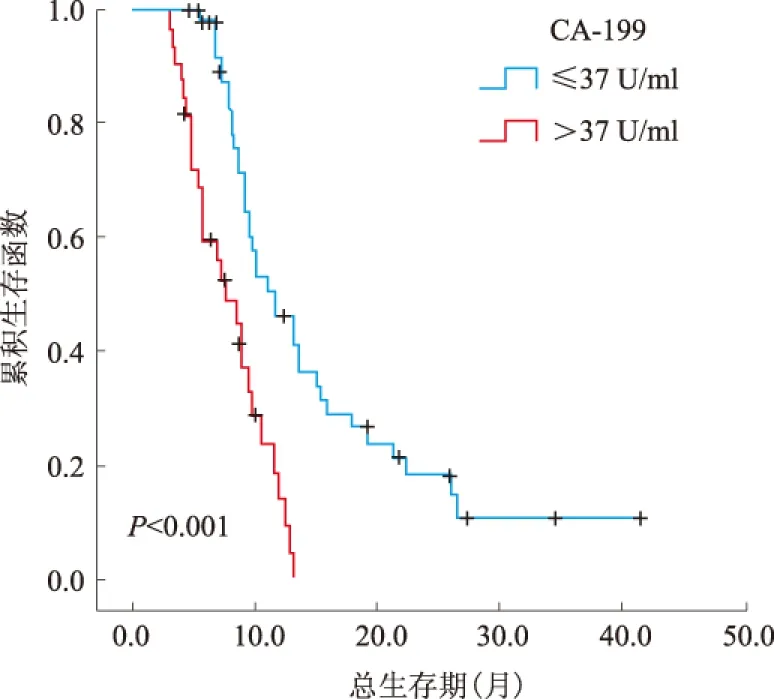
图2 CA-199与患者预后的关系Fig 2 Relationship between CA-199 and the prognosis of patients
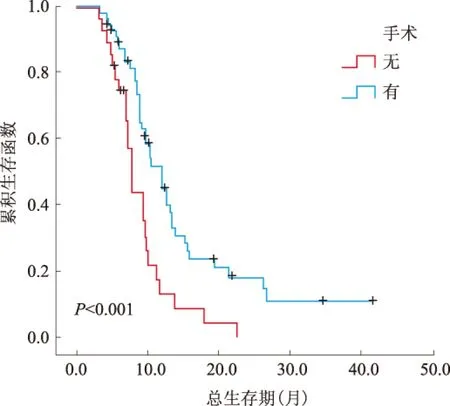
图3 手术与患者预后的关系Fig 3 Relationship between surgery and the prognosis of patients
2.3 手术治疗手术治疗的57例患者中,14例行全胃切除,43例行次全胃切除。8例患者将肿瘤与一个邻近器官一并切除,其中5例侵犯脾脏或脾门,2例为胰体尾,1例横结肠,最常见的邻近器官为脾脏和胰腺远端。24例患者行D2及以上的淋巴结清扫。18例患者行转移灶切除,其中1例行主动脉旁淋巴结切除,6例行肝叶切除或肝转移射频消融,11例因腹膜转移行腹膜切除。术后并发症包括伤口感染3例、腹腔脓肿1例、腹腔内漏1例、小肠梗阻2例,多数患者并发症不严重,无手术相关的围手术期死亡。
16例患者接受术前化疗,其中10例接受顺铂+5-FU化疗,4例接受紫杉类+5-FU化疗,2例接受伊立替康+顺铂化疗;16例患者中,3例接受了预期的胃切除,但因胃梗阻、出血、穿孔并未接受转移灶切除,9例患者成功地接受了胃切除+转移灶切除(完全切除),4例因手术探查过程中发现转移灶肿瘤负荷过大而仅接受胃切除。41例患者以手术为初始治疗,其中20例为缓解梗阻或出血仅接受胃切除,9例患者接受胃切除+转移灶切除,12例接受手术探查过程中发现转移灶肿瘤负荷过大而仅接受胃切除。
18例接受胃切除+转移灶切除的患者均接受术后辅助化疗。39例仅接受胃切除的患者中,13例因病因拒绝或器官功能下降而未接受术后化疗。
2.4 术后单因素、多因素分析手术治疗的57例患者中,行转移灶切除的患者(中位总生存期13.7个月)预后明显优于未行转移灶切除的患者(中位总生存期9.1个月)。单因素预后分析显示NLR>3.1、CA-199>37 U/ml、未化疗、不同手术方式与不良预后相关。将单因素分析鉴定出的预后因素纳入多因素分析,结果显示,NLR>3.1、CA-199>37 U/ml与不良预后显著相关(见表4~5、图4)。
表4 57例转移性胃癌患者的单因素预后分析
Tab 4 Univariate prognostic analysis of 57 cases of metastatic gastric cancer
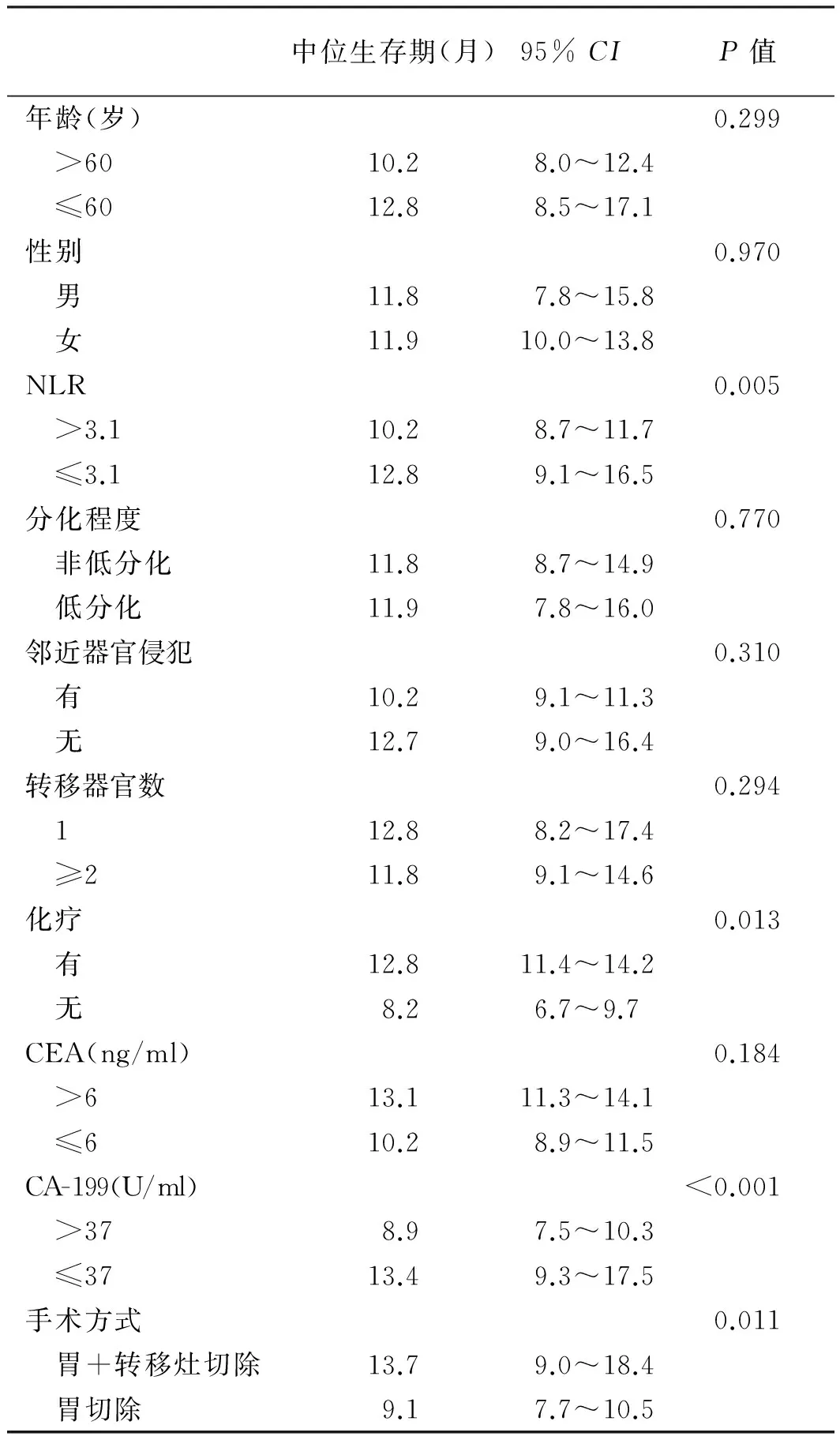
中位生存期(月)95%CIP值年龄(岁)0.299 >6010.28.0~12.4 ≤6012.88.5~17.1性别0.970 男11.87.8~15.8 女11.910.0~13.8NLR0.005 >3.110.28.7~11.7 ≤3.112.89.1~16.5分化程度0.770 非低分化11.88.7~14.9 低分化11.97.8~16.0邻近器官侵犯0.310 有10.29.1~11.3 无12.79.0~16.4转移器官数0.294 112.88.2~17.4 ≥211.89.1~14.6化疗0.013 有12.811.4~14.2 无8.26.7~9.7CEA(ng/ml)0.184 >613.111.3~14.1 ≤610.28.9~11.5CA-199(U/ml)<0.001 >378.97.5~10.3 ≤3713.49.3~17.5手术方式0.011 胃+转移灶切除13.79.0~18.4 胃切除9.17.7~10.5
表5 57例转移性胃癌患者的多因素预后分析
Tab 5 Multiple prognostic analysis of 57 cases of metastatic gastric cancer
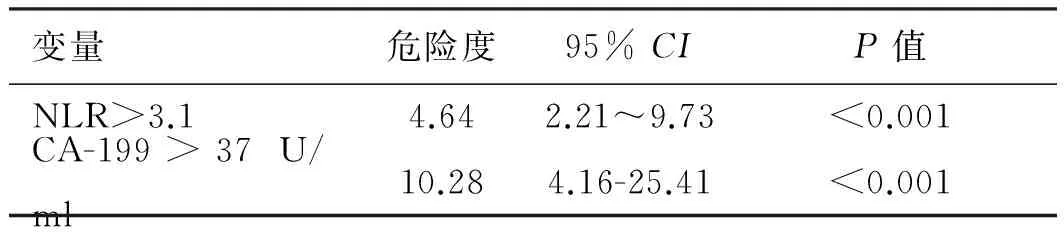
变量危险度95%CIP值NLR>3.14.642.21~9.73<0.001CA-199>37U/ml10.284.16-25.41<0.001
图4 转移灶切除与患者预后的关系
Fig 4 Relationship between resection of metastatic foci and the prognosis of patients
3 讨论
本研究结果证实,与未行手术干预的患者相比,胃切除加/不加转移灶切除可延长转移性胃癌患者的生存期。转移性胃癌行胃切除加/不加转移灶切除的原因通常如下:(1)切除原发肿瘤以缓解可能威胁生命的症状,如梗阻、穿孔、出血;(2)清除了大比例的肿瘤负荷后,残留肿瘤对辅助治疗的反应增加;(3)肿瘤产生的免疫抑制因子减少所带来的免疫获益[9]。已有研究[10]报道胃切除加/不加转移灶切除可延长转移性胃癌患者的生存期。在本研究中,手术干预的指征包括:(1)足够的器官功能和可接受的PS评分;(2)原发肿瘤未广泛侵犯邻近器官;(3)没有广泛的转移。我们的结果与之前的研究大致相符,提示我们的手术指征是可行的,并且手术干预对转移性胃癌患者有益。
关于转移性胃癌的预后因素,通常认为更大的肿瘤负荷、更高的PS评分与不良预后相关。然而,治疗前实验室数据与预后的关系尚无定论。本研究发现治疗前NLR和CA-199水平与转移性胃癌患者的预后相关。CEA和CA-199水平反映了肿瘤的生物学并被普遍地用作胃癌的标志物[11]。研究[12]发现CEA和CA-199与接受了根治术的胃癌患者的预后相关,另有研究[13]显示胃癌患者CA-199水平升高与各种转移相关。本研究发现治疗前高水平的CA-199为独立预后因素。癌症患者的结局不仅受肿瘤相关因素的影响,还受宿主反应因素的影响。NLR水平在包括胃癌在内的多种实体肿瘤中与宿主反应相关。本研究发现NLR水平升高为转移性胃癌患者的独立预后因素。NLR和CA-199水平在所有患者和接受了手术切除的患者中均为独立预后因素。因此,我们认为治疗前NLR和CA-199水平可用于筛选适合手术的转移性胃癌患者。本研究还发现,行胃切除+转移灶切除的患者预后优于行单纯胃切除的患者,这进一步提示依据NLR和CA-199水平选择性地行胃切除+转移灶切除可能改善转移性胃癌患者的预后。外科医师应慎重考虑对NLR和CA-199水平升高的转移性胃癌患者实施手术干预,因为无论有无手术干预,这一类患者的预后都不良。
局部治疗如胃切除、转移灶切除、射频消融或这些治疗的组合可有效减少肿瘤负荷。然而,转移性胃癌患者接受手术后的不良反应也被许多临床医师所关注。即便是在大的癌症中心,转移性胃癌的胃切除也被报道有较高的并发症发生率(50%)和病死率(6%~12%)[14]。而近期有研究[15]显示,转移性胃癌行胃切除后的并发症发生率和病死率可被接受。本研究中,严重的术后并发症并不常见,也没有手术相关的围手术期死亡。因此,之前的研究与本研究的结果提示转移性胃癌的胃切除+转移灶切除在有一定经验的机构可以安全进行。
许多研究已证实化疗可提高转移性胃癌患者的总生存期,因此,化疗已成为转移性胃癌患者的主要治疗手段。然而,关于手术切除对转移性胃癌的价值、手术指征及手术方式的选择始终存在争议。本研究努力排除选择性偏倚。首先,所有患者均采用CT确定术前分期。其次,所有患者依据有无接受化疗进行分层。尽管化疗在单因素预后分析中与总体人群的预后相关,但并不是独立预后因素。因此,化疗在本研究中的预后影响很小。然而,对本研究结果的解读仍需考虑到回顾性研究的固有特点及手术组与非手术组之间患者的特点差异。此外,决定是否适合手术很大程度上受邻近器官侵犯、转移器官数量、PS评分的影响。在本研究中,与未接受手术的患者相比,接受胃切除加/不加转移灶切除的患者有着更佳的PS评分、更少的邻近器官侵犯比例与多器官转移比例。这些选择偏倚可能促进了两组患者间的预后差异。因此,是否应在转移性胃癌患者中考虑手术干预有待前瞻性随机临床试验来进一步确定。
[1]Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2]Wöhrer SS, Raderer M, Hejna M. Palliative chemotherapy for advancedgastric cancer [J]. Ann Oncol, 2004, 15(11):1585-1595.
[3]Koizumi W, Narahara H, Hara T, et al. S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (SPILITS trial): a phase Ⅲ trial [J]. Lancet Oncol, 2008, 9(3): 215-221.
[4]Medina-Franco H, Contreras-Saldívar A, Ramos-De La Medina A, et al. Surgery for stage Ⅳ gastric cancer [J]. Am J Surg, 2004, 187(12): 543-546.
[5]Martin RC 2nd, Jaques DP, Brennan MF, et al. Achieving R0 resection for locally advanced gastric cancer: is it worth the risk of multiorgan resection [J]. J Am Coll Surg, 2002, 194(5): 568-577.
[6]张敏, 史云科, 刘苓, 等. 倦怠对急性冠脉综合征患者体力恢复的影响[J]. 中国全科医学, 2015, 18(26): 3142-3147. Zhang M, Shi YK, Liu L, et al. Influence of burnout on the physical strength recovery of patients with acute coronary syndrome [J]. Chinese General Practice, 2015, 18(26): 3142-3147.
[7]陈锐, 车向明, 常帅, 等. 新版日本胃癌分期及治疗指南修定的概念及主要修改内容[J]. 现代肿瘤医学, 2012, 20(8): 1535-1537. Chen R, Che XM, Chang S, et al. New Japanese classifications and treatment guidelines for gastric cancer: revision concepts and major revised points [J]. Modern Oncology, 2012, 20(8): 1535-1537. [8]Japanese Research Society for Gastric Cancer. Japanese classification of gastric carcinoma [M]. Tokyo: Kanehara, 1996, 31(5): 476-480.
[9]Saidi RF, ReMine SG, Dudrick PS, et al. Is there a role for palliative gastrectomy in patients with stage Ⅳ gastric cancer? [J]. World J Surg, 2006, 30(1): 21-27.
[10]Shridhar R, Almhanna K, Hoffe SE, et al. Increased survival associated with surgery and radiation therapy in metastatic gastric cancer: a surveillance, epidemiology, and end results database analysis [J]. Cancer, 2013, 119(9): 1636-1642.
[11]Webb A, Scott-Mackie P, Cunningham D, et al. The prognostic value of serum and immunohistochemical tumor markers in advanced gastric cancer [J]. Eur J Cancer, 1996, 32A(1): 63-68.
[12]Kochi M, Fujii M, Kanamori N, et al. Evaluation of serum CEA and CA19-9 levels as prognostic factors in patients with gastric cancer [J]. Gastric Cancer, 2000, 3(4): 177-186.
[13]Kodera Y, Yamamura Y, Torii A, et al. The prognostic value of preoperative serum levels of CEA and CA19-9 in patients with gastric cancer [J]. Am J Gastroenterol, 1996, 91(1): 49-53.
[14]Hartgrink HH, Putter H, Klein Kranenbarg E, et al. Value of palliative resection in gastric cancer [J]. Br J Surg, 2002, 89(11): 1438-1443.
[15]Kulig P, Sierzega M, Kowalczyk T, et al. Non-curative gastrectomy for metastatic gastric cancer: rationale and long-term outcome in multicenter settings [J]. Eur J Surg Oncol, 2012, 38(6): 490-496.
(责任编辑:王豪勋)
A preliminary investigation of prognostic factors and surgical indications in metastatic gastric cancer
LI He, CHEN Xingchao
Department of General Surgery, Affiliated Hospital of Hainan Medical University, Haikou 570102, China
Objective To investigate prognostic factors and surgical indications in patients with metastatic gastric cancer.Methods Eighty-five metastatic gastric cancer patients were collected from Jan.2007 to Jan.2015, the relationship between clinicopathological factors and prognosis was analyzed.Results Median overall survival time for all patients was 9.7 months. Chemotherapy was administered in 68 patients. Eighteen patients received gastrectomy with metastasectomy, 39 patients received gastrectomy alone, 28 patients received no resection. Median overall survival for patients who experienced chemotherapy, gastrectomy with metastasectomy, gastrectomy alone, and no surgery were 11.1 months, 13.7 months, 9.1 months and 7.8 months, respectively (P<0.05). Univariate analysis demonstrated that surgery group showed better overall survival than no surgery group (P<0.05), and gastrectomy with metastasectomy group showed better overall survival than gastrectomy alone group (P<0.05). Multivariate analysis confirmed that no surgery, neutrophil-to-lymphocyte ratio (NLR)>3.1, and carbohydrate antigen-199 (CA-199) level>37 U/ml were predictive of poor survival. Furthermore, NLR and CA-199 were still independent prognostic indicators for overall survival in the subtype of patients who experienced surgery. Conclusion Higher pretreatment NLR and CA-199 levels predict poor prognosis in patients with metastatic gastric cancer. In patients with low NLR and CA-199 levels, gastrectomy can be safely performed, and may contribute to longer survival.
Metastatic gastric cancer; Prognosis; Surgery
李合,主治医师,研究方向:胃肠外科。E-mail:lhanouba520@163.com
10.3969/j.issn.1006-5709.2017.03.005
R735.2
A 文章编号:1006-5709(2017)03-0261-05
2016-06-21

