血清降钙素原与腹水乳铁蛋白在自发性细菌性腹膜炎患者中的临床价值
王志远,高 峰
新疆维吾尔自治区人民医院消化科,新疆 乌鲁木齐 830000
血清降钙素原与腹水乳铁蛋白在自发性细菌性腹膜炎患者中的临床价值
王志远,高 峰
新疆维吾尔自治区人民医院消化科,新疆 乌鲁木齐 830000
目的探讨血清降钙素原(procalcitonin,PCT)与腹水乳铁蛋白(lactoferrin,LF)在肝硬化合并自发性细菌性腹膜炎(spontaneous bacterial peritonitis,SBP)中的临床价值。方法纳入肝硬化并腹水患者91例,其中SBP患者 61例,无菌性肝硬化腹水(sterile ascites,SA)患者30例。血、腹水标本送至实验室进行细胞计数、生化指标测定,免疫层析法检测血清PCT和腹水LF。结果SBP组与SA组PCT、LF水平比较,差异有统计学意义(P均<0.05),其中SBP组PCT、LF浓度均高于SA组。PCT、LF与SBP患者Child-Pugh分级呈显著正相关(r=0.763、0.728,P均<0.05)。Child-Pugh A级PCT、LF水平最高,Child-Pugh B级次之,Child-Pugh C级最小。结论血清PCT、腹水LF水平对肝硬化合并SBP与SA有鉴别诊断意义,尤其对SBP的早期诊断和治疗有重要价值。PCT与LF可以预测SBP患者Child-Pugh分级,为疾病的临床评估提供依据。
自发性细菌性腹膜炎;降钙素原;乳铁蛋白;肝硬化
自发性细菌性腹膜炎(spontaneous bacterial peritonitis,SBP)是晚期肝病所并发的腹膜急性细菌性感染,发病率占肝硬化的10%~30%,它的出现提示预后极差[1]。对SBP的诊断仍需借助腹水细菌学培养、腹水多形核白细胞(polymorphonuclear cells,PMN)计数等进行综合分析。然而受多种因素影响,腹水培养阳性率低,PMN计数很依赖操作者,且检查周期较长,不利于疾病早期诊疗。降钙素原(procalcitonin,PCT)是临床上常用的炎性指标,与细菌感染和预后密切相关,能够指导临床使用抗生素[2]。乳铁蛋白(lactoferrin,LF)是一种铁结合蛋白,广泛存在于人体黏膜分泌物中,可以作为一种炎性标志物[3]。目前国内外对两者在SBP中的报道相对较少,其作用机制也尚未有定论。本研究通过检测SBP患者血清PCT、腹水LF水平,探讨PCT和LF对SBP的诊断价值。
1 资料与方法
1.1 一般资料回顾性选取2013年1月-2015年12月在新疆维吾尔自治区人民医院消化内科住院的肝硬化失代偿期并腹水患者91例,包括乙肝后肝硬化、酒精性肝硬化,其中合并SBP患者61例,单纯性肝硬化腹水即无菌性肝硬化腹水(sterile ascites,SA)患者30例。SBP组年龄(52.16±11.36)岁(33~78岁),男43例,女18例;SA组年龄(54.60±13.17)岁(31~79岁),男19例,女11例。根据肝功能Child-Pugh分级标准将SBP组分为Child-Pugh A级7例、Child-Pugh B级17例、Child-Pugh C级37例。所有患者均经过详细询问病史、体格检查及相关辅助检查,研究对象均签署知情同意书。各组间性别差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准肝硬化的诊断标准符合《慢性乙型肝炎防治指南(2010年版)》[4]及《酒精性肝病诊疗指南(2010年修订版)》[5],肝组织活检发现弥漫性肝纤维化和假小叶形成是诊断肝硬化的金标准,对无法行肝脏活检的患者综合生化(转氨酶、胆红素升高)、凝血(血小板计数、凝血酶原活动度)、影像学(肝表面呈颗粒状、脾大、门静脉增宽、腹水)、内镜(门脉高压性胃肠病、食管胃底静脉曲张)等进行综合诊断。SBP的诊断标准:(1)肝硬化患者有感染的症状和体征,如发热(体温>37.8 ℃)、腹痛、腹部压痛、反跳痛;(2)腹水白细胞计数增多,PMN>250×106个/L;(3)腹水细菌培养阳性。具备上述诊断标准中的2项,并除外结核、肿瘤性腹水及腹腔内其他感染灶、继发性腹膜炎等。
1.3 排除标准肝硬化:排除肝纤维化的继发因素,如慢性肾功能衰竭、系统性红斑狼疮、糖尿病等;肝硬化合并恶性肿瘤;近1个月行血液透析、腹膜透析的患者。SBP:排除近1个月使用抗生素患者;慢性阻塞性肺疾病急性发作期患者;合并上消化道出血;合并重症感染、菌血症。
1.4 实验方法PCT的检测:所有纳入对象抽取静脉血4 ml,离心10 min,3 000 r/min,离心半径为17.5 cm,收集血清备用。样品在4 h内检测,如待检可保存至-20 ℃冰箱中。PCT定量测定试剂盒及上转发光免疫分析仪UPT-3A均购自北京热景生物技术有限公司,试验方法采用双抗体夹心免疫层析法。
LF的检测:所有患者在未使用抗生素的情况下,严格按照腹腔穿刺术步骤进行操作,抽取腹水标本50 ml。离心20 min, 2 000 r/min,离心半径为12.0 cm,收集上清。LF酶联免疫分析(ELISA)试剂盒购自上海索宝生物技术有限公司,试验方法采用双抗原夹心法。所有试验均由检验科医师严格按照操作步骤完成。

2 结果
2.1 一般资料比较SBP组体温、血WBC、总胆红素、直接胆红素、D-二聚体、PMN均值均高于SA组,差异有统计学意义(P均<0.05);SBP组与SA组年龄、谷草转氨酶、谷丙转氨酶、白蛋白、凝血酶原时间相比,差异无统计学意义(P均>0.05,见表1)。


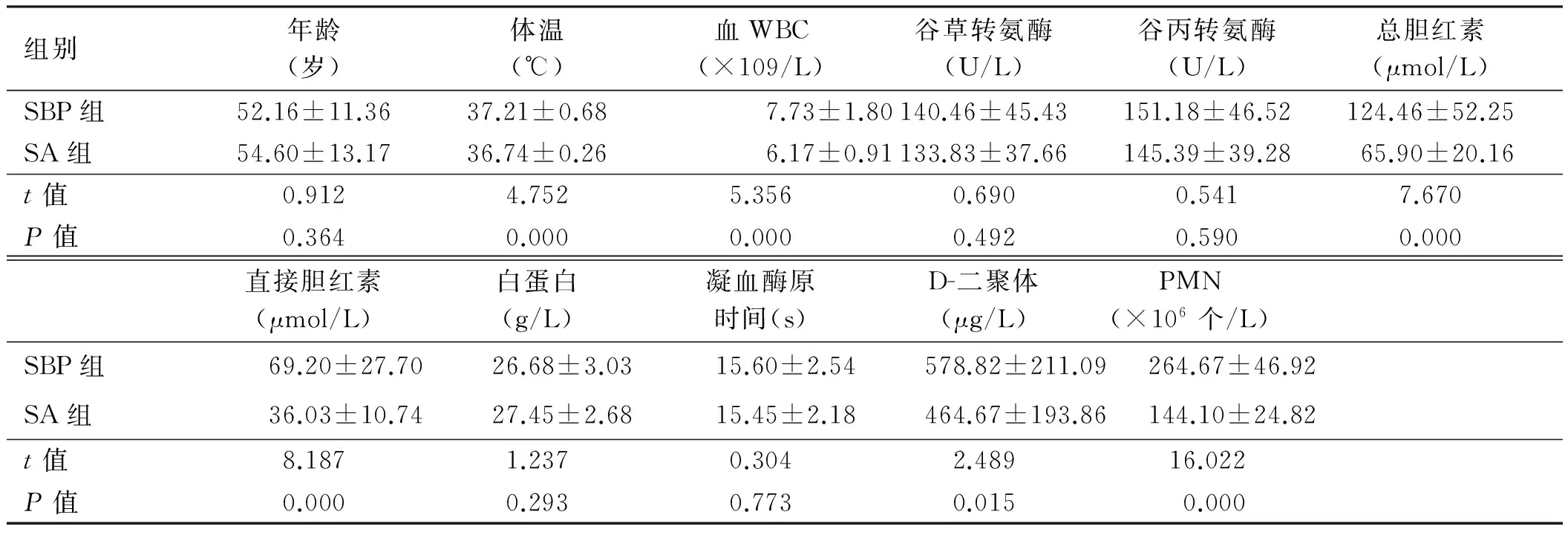
组别年龄(岁)体温(℃)血WBC(×109/L)谷草转氨酶(U/L)谷丙转氨酶(U/L)总胆红素(μmol/L)SBP组52.16±11.3637.21±0.687.73±1.80140.46±45.43151.18±46.52124.46±52.25SA组54.60±13.1736.74±0.266.17±0.91133.83±37.66145.39±39.2865.90±20.16t值0.9124.7525.3560.6900.5417.670P值0.3640.0000.0000.4920.5900.000直接胆红素(μmol/L)白蛋白(g/L)凝血酶原时间(s)D-二聚体(μg/L)PMN(×106个/L)SBP组69.20±27.7026.68±3.0315.60±2.54578.82±211.09264.67±46.92SA组36.03±10.7427.45±2.6815.45±2.18464.67±193.86144.10±24.82t值8.1871.2370.3042.48916.022P值0.0000.2930.7730.0150.000
2.2 SBP组与SA组PCT、LF水平比较血清PCT与腹水LF水平不服从正态分布,采用秩和检验分析得出,SBP组与SA组PCT、LF水平差异有统计学意义(Z=-7.709、-7.030,P均<0.05)。SBP组血清PCT水平高于SA组,腹水LF水平也高于SA组(见表2)。
2.3 PCT、LF与SBP组Child-Pugh分级的相关性采用Spearman等级相关分析得,血清PCT、腹水LF水平与SBP患者Child-Pugh分级呈显著正相关(见表3)。组间比较,Child-Pugh C级PCT、LF水平最高,Child-Pugh B级次之,Child-Pugh A级最小(见表4)。
表2 SBP组与SA组PCT、LF水平比较
Tab 2 Comparison of PCT and LF levels between SBP group and SA group

组别例数PCT阳性(%)PCT(ng/ml)LF阳性(%)LF(ng/ml)SBP组6151(83.61)0.65±0.1555(90.16)161.34±41.14SA组3000.17±0.105(16.67)77.37±16.86Z值-7.709-7.030P值0.0000.000
表3 PCT、LF与SBP组Child-Pugh分级的相关性
Tab 3 The correlation of PCT, LF with Child-Pugh classifications of SBP group

组别例数PCT阳性(%)PCT(ng/ml)LF阳性(%)LF(ng/ml)Child-PughA级73(42.86)0.49±0.094(57.14)112.43±44.88Child-PughB级1713(76.47)0.51±0.0715(88.24)126.82±26.00Child-PughC级3735(94.59)0.74±0.1036(97.30)186.46±22.55r值0.7630.728P值0.0000.000
表4 PCT、LF在不同组别间的比较
Tab 4 Comparison of PCT and LF in different groups

组别PCT(ng/ml)中位数四分位距95%CILF(ng/ml)中位数四分位距95%CISBP组0.680.280.61~0.69177.0060.00150.81~171.88 Child-PughA级0.450.150.41~0.5789.0060.0070.92~153.94 Child-PughB级0.500.110.48~0.54130.0048.50113.46~140.19 Child-PughC级0.750.100.71~0.78190.0019.00178.94~193.98SA组0.150.160.13~0.2076.5021.5071.07~83.66
3 讨论
细菌感染是肝硬化失代偿期最严重且最常见的并发症之一,可导致全身多器官功能衰竭,危及患者生命。虽然抗生素发展至今已经历了近百年的历史,但仍不能有效控制SBP的发病率和病死率[6]。由于肝硬化SBP患者腹水生化特性往往与临床表现不一致,再加上诊断“金标准”的局限性,使很多患者延误了治疗时机[7]。因此,寻找到一种简单、快速的早期诊断方法,对提高疗效、改善预后至关重要。
我们认为PCT与SBP的发生、发展密切相关,一方面SBP患者血清及腹水中存在大量革兰氏阴性杆菌,刺激机体免疫系统产生免疫应答,并参与细胞因子(如PCT、IL-6)的释放,以增强免疫防御力[8];另一方面肝硬化合并SBP时大量细菌繁殖、移位,导致血内毒素水平明显升高,单核巨噬细胞产生PCT增加,因此患者血PCT水平较高。Yuan等[9]对42例SBP患者进行随访研究发现,SBP患者血清PCT浓度高于非SBP患者,与PMN呈显著相关性,当PCT临界值>0.48 ng/ml 时,对SBP有诊断意义。Lippi等[10]也认为基于经济条件和侵入性检查之间的合理关系,PCT是一种重要的检查手段,对SBP有早期诊断意义。最近一项大样本量回顾性研究[11]表明,SBP患者血清PCT水平在治疗后显著降低,其灵敏度和特异度分别为83.7%和94.9%,最佳临界值为0.462 ng/ml,而腹水细菌培养阳性率仅为4.6%,远低于PCT,说明血清PCT是终末期肝硬化患者腹腔细菌感染的特征性标志物,也可用于抗生素疗效的评价。Cekin等[12]指出,SBP患者血清PCT阳性率、ROC曲线下面积均高于C-反应蛋白,提示PCT在诊断肝硬化SBP方面有更高的准确性。
本研究中,SBP组血清PCT浓度的中位数为0.68 ng/ml,明显高于PCT的正常值上限(0.05 ng/ml),说明PCT可以作为预测肝硬化SBP的良好指标。研究还发现PCT与肝功能Child-Pugh分级有一定关联,PCT浓度越大,Child-Pugh评分就越大,病情就越重。SBP组血清PCT阳性率为83.61%(51/61),与PMN阳性率88.52%(54/61)相比差异不大,且价格便宜、操作简单方便、能重复检测,因此对SBP的早期诊断有重要意义。
LF是在中性粒细胞演变过程中产生,其在体液中的含量与中性粒细胞的数量呈正比,因此可以反映机体炎症反应程度。LF具有抗菌活性,除了能抑制大肠埃希菌等病原微生物的生长外,还能刺激免疫细胞,加强巨噬细胞、淋巴细胞对细菌的吞噬作用。正常情况下,白细胞产生的LF很少,合并感染时,LF合成会迅速增多。最初有学者报道[13]粪便LF能鉴别炎症性肠病与肠易激综合征,随后有研究[14]表明腹水LF在诊断肝硬化SBP方面有较高的灵敏度和特异度,可以作为疾病初筛的试验。Ali等[15]研究发现,腹水LF具有较高的稳定性和抗降解作用,它在SBP患者中有较高水平,与PMN呈显著正相关,灵敏度为100%,特异度为91.7%,是一种很有价值的诊断指标。还有一项最新的研究[16]显示,SBP合并脓毒症时,腹水LF水平会显著升高,经过抗生素治疗后,SBP患者LF水平也高于非SBP组。
本研究中,LF水平与SBP Child-Pugh分级显著相关,在SBP与SA组中存在明显差异,尤其在SBP中有较高的阳性率(90.16%),说明LF对SBP有诊断与鉴别诊断价值,可作为早期筛查的指标。
综上所述,我们认为血清PCT和腹水LF对SBP有临床意义,它们有可能在肝硬化失代偿期合并感染中起关键作用。因此,在感染初期诊断尚不明确时,我们建议尽早检测肝硬化患者PCT和LF水平。目前关于PCT、LF在SBP中的报道有限,结果也不乏矛盾之处,有待更多的研究以进一步明确其临床价值;另外,关于PCT对疾病并发症、治疗、预后和复发的价值研究还需不断完善。
[2]Lipińska-Gediga M, Mierzchala-Pasierb M, Durek G. Procalcitonin kinetics-prognostic and diagnostic significance in septic patients [J]. Arch Med Sci, 2016, 12(1): 112-119.
[3]唐慧娴, 张振海, 赵志英, 等. 乳铁蛋白作为药物载体的研究进展[J]. 药学学报, 2015, 50(6): 675-681.
[4]中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙型肝炎防治指南(2010年版) [J]. 中华肝脏病杂志, 2011, 19(1): 13-24.
[5] 中华医学会肝病学分会脂肪肝和酒精性肝病学组. 酒精性肝病诊疗指南(2010年修订版) [J]. 中华肝脏病杂志, 2010, 18(3): 167-170.
[6]Fernández J, Acevedo J, Castro M, et al. Prevalence and risk factors of infections by multiresistant bacteria in cirrhosis: a prospective study [J]. Hepatology, 2012, 55(5): 1551-1561.
[7]Shalimar, Acharya SK. Difficult to treat spontaneous bacterial peritonitis [J]. Trop Gastroenterol, 2013, 34(1): 7-13.
[8]Wong F, Bernardi M, Balk R, et al. Sepsis in cirrhosis: report on the 7th meeting of the International Ascites Club [J]. Gut, 2005, 54(5): 718-725.
[9]Yuan LY, Ke ZQ, Wang M, et al. Procalcitonin and C-reactive protein in the diagnosis and prediction of spontaneous bacterial peritonitis associated with chronic severe hepatitis B [J]. Ann Lab Med, 2013, 33(6): 449-454.
[10]Lippi G, Danese E, Cervellin G, et al. Laboratory diagnostics of spontaneous bacterial peritonitis [J]. Clin Chim Acta,2014, 430: 164-170.
[11]Wu J, Jiang F, Zeng T, et al. Role of serum procalcitonin assay for diagnosis of spontaneous bacterial peritonitis in end-stage liver diseases [J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2014, 36(1): 37-41.
[12]Cekin Y, Cekin AH, Duman A, et al. The role of serum procalcitonin levels in predicting ascitic fluid infection in hospitalized cirrhotic and non-cirrhotic patients [J]. Int J Med Sci, 2013, 10(10): 1367-1374.
[13]Otten CM, Kok L, Witteman BJ, et al. Diagnostic performance of rapid tests for detection of fecal calprotectin and lactoferrin and their ability to discriminate inflammatory from irritable bowel syndrome [J]. Clin Chem Lab Med, 2008, 46(9): 1275-1280.
[14]Parsi MA, Saadeh SN, Zein NN, et al. Ascitic fluid lactoferrin for diagnosis of spontaneous bacterial peritonitis [J]. Gastroenterology, 2008, 135(3): 803-807.
[15]Ali FM, Shehate IH, Elsalam A, et al. Diagnostic value of lactoferrin ascitic fluid levels in spontaneous bacterial peritonitis [J]. Egyptian Liver J, 2013, 3(2): 54-61.
[16]Wu CH, Chen TH, Lin CY, et al. Analysis of ascitic fluid lactorerrin levels in the diagnosis of spontaneous bacterial peritonitis after systemic antibiotic treatment [J]. Adv Dig Med, 2015, 2: 123-127.
(责任编辑:王全楚)
Clinical value of serum procalcitonin and ascitic lactoferrin in spontaneous bacterial peritonitis patients
WANG Zhiyuan, GAO Feng
Department of Gastroenterology, the People’s Hospital of Xinjiang Uyghur Autonomous Region, Urumchi 830000, China
Objective To evaluate the clinical value of serum procalcitonin (PCT) and ascitic lactoferrin (LF) in spontaneous bacterial peritonitis (SBP) patients with hepatic cirrhosis.Methods A total of 91 cirrhotic patients with ascites were collected, including 61 patients with SBP, and 30 patients with sterile ascites (SA). Blood and ascites samples were sent to the laboratory for cell count and measurement of chemical elements. Serum PCT and ascitic LF were detected by immunochromatographic assay.Results There were significant differences of PCT and LF levels between SBP group and SA group (P<0.05). The concentrations of PCT and LF in SBP group were higher than those in SA group. PCT and LF were positively related to Child-Pugh classification in SBP patients (r=0.763, 0.728,P<0.05). The PCT and LF levels were the highest in Child-Pugh A class, Child-Pugh B class took the second place, and Child-Pugh C class was minimum.Conclusion The levels of serum PCT and ascitic LF make significance in differential diagnosis of SBP and SA with hepatic cirrhosis, especially have great value in the early diagnosis and treatment of SBP. PCT and LF can predict Child-Pugh classification in patients with SBP, and provide basis for clinical evaluation of the disease.
Spontaneous bacterial peritonitis; Procalcitonin; Lactoferrin; Hepatic cirrhosis
王志远,住院医师,研究方向:胃肠、肝胆疾病的诊治。E-mail:wzy03181@163.com
高峰,主任医师,博士生导师,研究方向:胃肠、肝胆疾病的诊治。E-mail:xjgf@sina.com
10.3969/j.issn.1006-5709.2017.03.018
R572.2;R575
A 文章编号:1006-5709(2017)03-0311-04
2016-07-03

