同步原位检测CTC多重瘤标蛋白表达与染色体异倍体的意义及应用
由 磊,赵 烨,阚 秀,李一林,王东民,张爱群,王红霞,刘 颖,王丹丹,林 平4,,0,郑 直,4
·综 述·
同步原位检测CTC多重瘤标蛋白表达与染色体异倍体的意义及应用
由 磊1,赵 烨2,阚 秀3,4,李一林5,王东民4,6,张爱群7,王红霞4,8,刘 颖9,王丹丹9,林 平4,9,10,郑 直2,4
循环肿瘤细胞(circulating tumor cell, CTC)及播散肿瘤细胞(disseminated tumor cell, DTC)的可靠检测主要取决于有效的细胞分离与鉴别,目前最为新颖的“差相富集-多重瘤标免疫荧光染色-染色体荧光原位杂交 (SE-iFISH)”技术平台,首次将CTC/DTC的富集方法与后续的原位、同步检测肿瘤细胞染色体异倍体的核型分析及多种肿瘤标志物的表型分析等进行有效整合,并成功应用于肿瘤细胞的基础分析与临床检测。大量临床实验证明,独特的SE-iFISH可以为分析CTC/DTC在肿瘤早期诊断、疗效快速评估、肿瘤耐药与复发的实时监测等提供可靠的技术保障。该文阐述SE-iFISH在不同瘤种患者及人源肿瘤动物模型体内的有效检测方法,并锁定具有不同临床意义的不同表型与核型的CTC/DTC亚类细胞,为后续的肿瘤单细胞分析与实验提供指导。
肿瘤转移;染色体异倍体;肿瘤标志物;CTC亚类;文献综述
1 CTC概述
循环肿瘤细胞(circulating tumor cell, CTC)是从实体肿瘤脱落入外周循环血液的具有特殊性状的肿瘤细胞,它与肿瘤的转移、复发等有着极为密切的关系。播散肿瘤细胞(disseminated tumor cell, DTC)则是存在于患者体液中(如肿瘤患者骨转移的骨髓、脑脊液、胸腹水等)的源自实体肿瘤的肿瘤细胞。与CTC相似,DTC也有着重要的临床意义[1]。经过多年研究,人们对CTC及DTC的临床意义已经有了较为清晰的认知。按治疗前、中、后不同阶段, CTC检测的临床应用及意义详见图1。其中,辅助诊断、疗效快速评估(包括手术、放化疗及靶向药物疗效)、预后判断以及肿瘤耐药与复发的实时监测等尤为重要,为肿瘤患者个体化的精准医疗提供了有效的技术手段和有力保障。CTC 检测目前已被公认为是最具代表性的“液体活检”技术,其可提供的各种信息完整性与临床意义远非其它检测所能比拟。
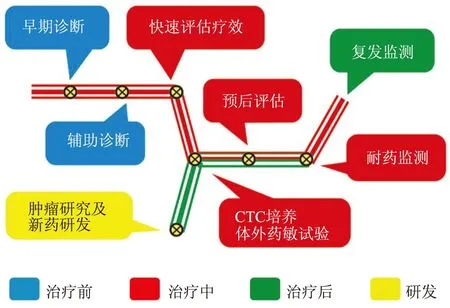
图1 CTC检测的意义
CTC与DTC的检测手段相似,主要由分离与鉴别两个主要环节组成,即“抓得着”与“看得见”两个关键步骤。两者相辅相成,缺一不可。分离与鉴别方法的有效性决定了CTC检测的灵敏度与特异性。目前有关CTC检测的各技术手段繁多,为了便于大家对此能有一个比较全面的了解,本文将目前国内外较常见的CTC检测手段,以及在病理科广为开展的荧光原位杂交(fluorescence in situ hybridization, FISH)方法基础上研发的iFISH技术,在CTC临床检测与基础研究方面的应用及意义做一扼要介绍[2]。
2 CTC分离
目前,国内外各种分离CTC的技术手段基本可归纳为3大类,即过滤法、捕获法以及富集法,最近一种有别于常规阴性富集的新颖富集方法-差相富集技术(subtraction enrichment, SE)已被报道。
2.1 过滤法(细胞筛法) 该方法的技术原理基于一种假设,即CTC的大小与培养的肿瘤细胞近似,可达50 μm。过滤法使用孔径为6.5~8 μm的细胞筛过滤,去除体积较小的白细胞,从而试图达到分离较大的CTC目的;主要代表技术为iSET[3],其最大优点在于便捷。随着近年来人们对CTC了解的不断加深,发现很多CTC实际上与白细胞一样大,有些甚至只有白细胞的一半或更小。这些小的CTC细胞即可常见于肿瘤患者[4-5],同时也大量存在于肿瘤动物模型(包括人源肿瘤动物模型)体内[5-6]。应用此方法在CTC分离过程中势必会造成大量小细胞CTC的丢失[7]。在目前进行的多中心CTC筛查过程中发现,小细胞CTC在相当一些重要瘤种中占50%。鉴于CTC形成过程中的肿瘤细胞上皮-间质转化(epithelial-mesenchymal-transition, EMT)造成细胞体积变小[8],且很多其它小细胞CTC的特殊临床意义已经越来越引起人们的极大关注[6,9],因而对使用过滤法分离CTC及DTC过程中造成的大量小细胞丢失,甚至假阴性结果,应受到重视。
2.2 捕获法(钓鱼法) 该技术主要依赖肿瘤细胞表面各种标志物的表达(如上皮细胞标志物EpCAM),利用偶联在固相载体(如磁珠、芯片等)上的相应抗体或多肽对CTC/DTC进行直接捕获;主要代表技术为Cell Search及微流体。该方法亦可被形象比喻为钓鱼法,可以从血液中快速分离表达相应表面标志物的部分特定肿瘤细胞。
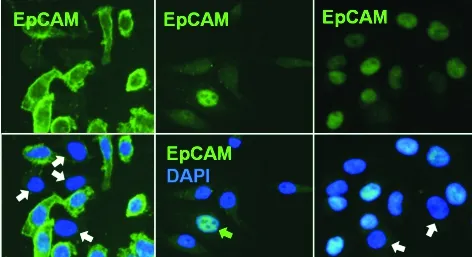
近年,国内外一系列研究指出,肿瘤细胞表面标志物(如EpCAM)无论在细胞内的分布或表达上均有极高的异质性。EpCAM的完整蛋白或其胞内的片段可分布于细胞膜上、溶酶体中[10]或细胞核内。来源于不同组织的肿瘤细胞或同一标本内的不同肿瘤细胞的EpCAM也呈高异质性表达[10-11]。据文献报道[12],在134种检测的实体瘤中,只有70%的肿瘤有EpCAM表达,而另外30%则检测不到EpCAM阳性细胞。最近发表的利用流式细胞仪定量分析EpCAM表达的实验结果与以往的报道一致。与乳腺癌细胞EpCAM的高表达相比,膀胱癌及恶性黑色素肿瘤细胞分别呈低表达及不表达(图2A)[5]。利用免疫荧光染色方法进一步比较EpCAM在不同肿瘤细胞上的表达强度与定位的结果显示,结肠癌细胞的细胞膜上可见EpCAM的高表达,而胰腺癌及非小细胞肺癌细胞则仅显现与已往报道相一致的细胞核及细胞质内的异质性弱表达[13],而在细胞膜上不表达(图2B)。EpCAM在胰腺癌及肺癌细胞膜上的极低或不表达可部分解释为何基于抗EpCAM抗体的相关技术(如Cell Search等方法)不能有效检测多种肿瘤的CTC。Gires等[10]指出,虽然部分肿瘤原发灶或转移灶的细胞可表达极高的EpCAM,但其在CTC上的表达却较低。这些不表达EpCAM的CTC亚类细胞具有特殊生物学及临床意义,并与肿瘤转移及EMT密切相关[14-15]。
A

B
结肠癌SW480 胰腺癌PANC-1 肺癌A549
图2 EpCAM在不同肿瘤细胞上的异质性表达 A.流式细胞仪定量分析:乳腺癌细胞的EpCAM呈高表达,而膀胱癌及恶性黑色素肿瘤细胞分别呈低表达及不表达;B.免疫荧光染色结果显示,绝大部分结肠癌细胞的细胞膜上EpCAM呈强表达;胰腺癌及肺癌细胞的EpCAM表达较弱,且在细胞膜上无表达;个别胰腺癌细胞的细胞核可见EpCAM表达(绿色箭头),而大部分肺癌细胞的细胞核中EpCAM呈弱表达,但有些细胞不表达EpCAM (白色箭头)
除EpCAM阴性CTC亚类细胞外,对EpCAM在某些肿瘤上的阳性亚型细胞的报道较多。然而在利用抗EpCAM抗体捕获CTC的过程中,因抗体交联了细胞表面EpCAM蛋白,从而导致细胞内一系列信号传导通路(如Wnt通路)的激活[16],因而通过利用抗EpCAM抗体与细胞表面极为活跃的信号传导诱发因子EpCAM相结合,进而捕获的CTC或DTC已不再是自然状态的细胞,故已不适于多种后续的功能性分析。最近,抗EpCAM抗体已被报道可诱导肺癌A549细胞增殖,并调控其基因表达[17]。其它依赖于肿瘤细胞表面标志物的CTC捕获技术(如多肽纳米磁珠)存在类似问题的可能性亦不可忽视。
2.3 富集法 人们熟知的阴性富集是此类方法的常见代表性技术。阴性富集通过低渗裂解红细胞及使用偶联抗CD45抗体的免疫磁珠去除白细胞以达到富集非血源性肿瘤细胞的目的。然而低渗裂解红细胞同样也会对CTC造成极大的损害与丢失[18],获取的CTC已不再适于肿瘤细胞的原代培养、功能性研究及RNA测序等。目前国内常见的阴性富集法基本以3~4 mL血液为主,但较少的血样量势必造成CTC检出数目的降低,从而对试图利用CTC数目准确评估肿瘤治疗前后的疗效造成严重干扰,主要表现为很多肿瘤患者的CTC数目治疗前后差异无显著性。
2.4 SE法 该方法与阴性富集法相比,两者间最大的区别在于SE使用了特殊的非血源性细胞分离介质去除红细胞,而不是通过低渗裂解溶破红细胞。在6~8.5 mL血样的白细胞去除过程中,多种抗白细胞抗体的组合群(而非单一抗CD45抗体)与特殊包被的磁珠相偶联,从而确保了对白细胞的最大特异性去除,及对肿瘤细胞最小的非特异性黏附。相对于钓鱼法,SE技术不依赖于肿瘤细胞表面标志物的表达,对不同瘤种的肿瘤细胞均具有较高且稳定的回收率。通过SE法富集的保持自然状态的CTC,无低渗损伤且未与抗体结合,仍保持生物学活性,是新型生物标本库的重要组成。大量实验已证明,这些富集得到的CTC及DTC可适于后续一系列的研究,包括CTC原代细胞培养及构建肿瘤模型、CTC单细胞RNA与DNA分析(包括全基因组、全外显子或基因突变[19])等。
2007年美国癌症研究协会(AACR)大会上,SE原代技术被首次报道可以有效富集肺癌[20]及胰腺癌[21]患者体内的CTC之后,不断改进的SE技术已被广泛应用于国内外多中心的肿瘤动物模型[6]或不同瘤种肿瘤患者的CTC、DTC及癌栓的检测与研究。检测瘤种涵盖了小细胞肺癌及非小细胞肺癌[5]、肝癌、食管癌、神经胶质瘤[5]、乳腺癌[22]、结直肠癌[23]、胃癌[24]等;标本来源包括血液、胸腹水、骨髓、尿液、脑脊液、淋巴穿刺等。待检肿瘤细胞不受细胞大小及肿瘤标志物高度异质性表达的限制[2,5]。2009年国际上首次报道应用SE技术可以在86%的肺癌复发患者中有效检测到CTC[25],且发现肺癌患者CTC数目与血液中角蛋白CK19 的裂解片段CYFRA21-1含量呈正相关[26]。
3 CTC鉴别
多年前人们曾经尝试使用非特异的HE染色法鉴别经细胞筛过滤得到的部分大细胞CTC[3],但后续实验结果证实,此种根据核质比例判别肿瘤细胞的方法不能有效区分血中的单核细胞与CTC,因而该方法未被接受为CTC检查方法,近年来也不再有相关报道。目前,常规的CTC鉴别方法主要为核酸检测及免疫染色。
3.1 核酸检测 基于核酸检测判别CTC的方法报道较多。PCR、RT-PCR或二代测序 等多种方法已被广泛用于测定CTC的DNA或mRNA。美国Affymetrix公司发明的RNA原位杂交技术(RNAish)可在CTC细胞内同时可视性检测多种mRNA。迄今报道的各种核酸检测相关技术较好地应用于确定了的CTC或DTC的相关功能性研究。然而作为CTC或DTC的鉴别手段,其待检肿瘤相关基因的选择(包括有效性与及特异性等),以及对阳性或阴性检测结果的客观准确解释还有待进一步验证与完善。此外,对肿瘤细胞功能最终起主导作用的蛋白表达及相关的转录后蛋白修饰是不能用核酸法进行检测的。
3.2 免疫染色 实体肿瘤细胞一般均为上皮来源,细胞内通常表达角蛋白。目前,被广泛应用的技术手段是借助免疫组化或免疫荧光法对来自实体瘤细胞中的CK进行染色[5],从而达到鉴别CTC/DTC的目的。大量文献报道[10,27],在CTC形成的EMT阶段中,与EpCAM相同,肿瘤细胞内的CK也会降解,并导致肿瘤的浸润性与转移能力增加。CTC内的CK降解不可避免地造成“看不见”的CTC假阴性,严重干扰CTC的准确检测。因此,人们迫切需要寻找一种不依赖于CK表达及肿瘤类型与分期的替代技术,以有效鉴别各式各样的高异质性CTC及DTC。
EpCAM与CK目前在CTC/DTC的检测过程中,主要是被用作肿瘤细胞的上皮标志物。但这两种蛋白的高异质性及在EMT过程中的降解等特征,造成了不容忽视的大量“抓不着”与“看不见”的假阴性结果,极大地限制了在CTC与DTC检测过程中的应用。然而除上皮标志物的特性外,EpCAM及CK作为肿瘤细胞的生物学标志物已受到人们的密切关注。EpCAM的过量表达与前列腺癌的早期进展和转移密切相关[28],而胃癌肿瘤细胞EpCAM与CD44的持续高表达预示胃癌患者较高的10年生存率[29]。而在乳腺癌及结直肠患者中,随着细胞内EpCAM的降低或消失则与肿瘤的进展、出芽、迁移能力及远端转移的增强密切相关[14-15]。除此之外,CK18的一系列生物学功能近来也被广泛报道。CK18在肿瘤细胞内的转录后修饰与肝癌细胞的分化密切相关[30],其蛋白水平的降低将促进乳腺癌、鼻咽癌、结肠癌的癌细胞迁移[31]及肿瘤进展[32],而CK18蛋白的升高则与肺癌、肾细胞癌、口腔癌、食管鳞癌的低分化、高分期、肿瘤转移及复发密切相关。血浆中CK18的半胱天冬酶(Caspase)的酶切片段是公认的肿瘤细胞凋亡的生物学标志物。作为其细胞内的对应物,CTC/DTC内完整的CK18蛋白具有同样重要的生物学与临床意义。但迄今为止,尚未有CTC/DTC内CK18蛋白特异性表达及相关功能研究的报道。
3.3 染色体FISH技术 目前,国内医院病理科早已普及使用FISH技术在肿瘤组织标本上检测肿瘤细胞。利用8号染色体着丝粒探针(centromere probe 8, CEP8)的FISH法检测已被文献广泛报道于肺癌、食管癌、胰腺癌、胃癌、结直肠癌、膀胱癌和肝癌等肿瘤的诊断。然而由于血液样本中的大量血源性白细胞、红细胞、血浆蛋白及非血源性肿瘤细胞的内在生物学特性,以往用于检测组织标本的FISH法不适于直接检测CTC及DTC。此外,与单一核酸检测的局限性相同,常规的FISH法不能对肿瘤细胞内起决定作用的各种瘤标蛋白的表达与修饰进行观察与检测。
3.4 iFISH法 鉴于对CTC/DTC原位同步进行染色体核型与瘤标蛋白表型分析具有极其重要的意义,将免疫荧光染色与FISH进行有效整合成为一种新颖的检测方法,以便有效检测非血源性异倍体CTC/DTC 的iFISH技术已被报道[5]。
iFISH的原理及如何有效同步检测多重肿瘤标志物与异倍体详见图3。图3A描述了对使用SE法富集的标本进行CD45染色,其中1个细胞为CD45阳性的血源性白细胞,剩余2个细胞为CD45阴性的非血源性细胞。瘤标免疫荧光染色显示这两个非血源性细胞中,细胞1瘤标表达阳性。而FISH检测则显示非血源性细胞1、2均为异倍体。iFISH合成图像显示,细胞1 为瘤标表达阳性的三倍体细胞,而细胞2则为瘤标表达阴性的三倍体细胞。单一抗体染色显然不能检测出瘤标阴性的CTC/DTC。而单一FISH检测亦无法检测出瘤标表达阴性的二倍体肿瘤细胞。相对于单一使用免疫荧光染色或FISH法,iFISH可将染色体及瘤标单一异常或双异常的CTC有效检测出来,从而极大地提高了检测的灵敏性与特异性。图3B展示了单瘤标 (如CK、EpCAM或HER-2)-iFISH (4色通道)。图3C则显示了在骨髓DTC 癌栓(≥2肿瘤细胞)上原位进行双瘤标 (CK 及EpCAM)-iFISH(5色通道)检测,以帮助人们了解两种肿瘤标志物在CTC/DTC中的形态学分布、生物学功能及特殊临床意义等方面是如何协调的。

图3 iFISH原理 A.1个细胞为CD45阳性(红色)的血源性白细胞, 2 个细胞为CD45阴性的非血源性细胞;其中,细胞1瘤标表达阳性(绿色);而FISH检测则显示非血源性细胞1、2均为异常的染色体三体;iFISH合成图像显示,细胞1 为瘤标表达阳性的染色体3体细胞,而细胞2则为瘤标表达阴性的三体细胞;B.单瘤标-iFISH(4色通道):CK、EpCAM或HER-2-iFISH;C.双瘤标-iFISH (5色通道): 在骨髓DTC癌栓(≥2肿瘤细胞)上原位同步进行细胞核 (蓝色)+ EpCAM (黄色) + CK18(绿色) + CD45(红色) + CEP8(橙色)-iFISH检测
有别于常规的组织样本-FISH法,该iFISH可以理解为“细胞样本-FISH”。iFISH 技术对锁定的非血源性细胞(CD45染色阴性)进行染色体异倍体FISH及各种肿瘤标志物的免疫荧光染色检测。不同于目前常规使用的CK单瘤标荧光染色鉴别CTC,iFISH可在FISH的基础上,进一步提供可自由选择(如CK、EpCAM、HER-2、vimentin、CD44V6、CD133、CA19-9、GFAP、EGFR Ⅷ、Methothelin等)与组合的双色双瘤标蛋白表达检测(如CK+EpCAM、HER-2+EpCAM、vimentin+EpCAM等)。待检的瘤标蛋白即可位于细胞核内,也可位于细胞质或细胞膜上。iFISH法为人们根据不同瘤种的CTC/DTC自由选取想要研究的任意染色体或任意瘤标提供了便利。这些扩大的信息量势必会为提高CTC检测的敏感度与特异性,以及为人们研究不同肿瘤标志物在CTC上如何协调发挥生物学功能提供极大的帮助。
根据同一CTC上的瘤标表达与染色体倍体不同,可将CTC进行亚类分型,如在CTC大小及CK18阳性或CK18阴性的前提下,每类可包含染色体单体、二倍体、三倍体、四倍体以及≥5倍体的亚类CTC细胞[5,24]。对每一不同亚类CTC细胞的肿瘤耐药、药敏、转移与复发等不同临床意义的阐明[24],可为后续的CTC单细胞分析[19, 33]提供积极的指导意义。
此外,与常规的耗时较长(20 h)的FISH法相比,优化的iFISH实验操作(包括抗体染色)可在3~4 h内完成,从而为临床快速诊断提供了便利。
4 SE-iFISH用于检测及分类CTC/DTC的意义与应用
长期以来,人们一直试图从分离(抓得着)或是鉴别(看得见)两个角度分别进行优化,以期提高CTC/DTC检测的敏感性。然而有效的CTC检测方法是由密不可分的分离及鉴别两个方面共同组成 (图4),两者同等重要[2]。目前常规的CTC检测方法对大量EpCAM和CK阴性的CTC/DTC 具有“抓不着”与“看不见”的内在缺陷。经过大量临床样本验证过的SE-iFISH整合技术在CTC/DTC检测过程中则已显示一系列特殊优势[5,6,24]。
无论CTC/DTC是否具有很高的异质性、CK及EpCAM蛋白是否降解或不表达以及CTC细胞大、小的巨大差异[4,7],借助德国蔡司公司、德国MetaSystems公司、美国Cytelligen公司及国内赛特生物公司联合开发的 Metafer-iFISH CTC全自动扫描、图像采集与分析系统,利用SE-iFISH可以从富集与鉴别两方面对来源于血液、胸水、腹水、骨髓、尿液、脑脊液、淋巴穿刺等样本中的各种实体肿瘤的CTC/DTC和癌栓进行快速有效的检测、分类及数理统计,其中包括肺癌、肝癌、胃癌、乳腺癌、胰腺癌、食管癌、子宫颈癌、卵巢癌、结直肠癌、膀胱癌、肾细胞癌、神经胶质瘤、骨肉瘤、黑色素瘤、嗜铬细胞瘤、甲状旁腺肿瘤等。部分CTC检测的阳性率结果详见表1。
北京大学肿瘤医院新近发表的临床比对实验显示,CellSearch 在已确诊的胃癌患者中的CTC(EpCAM+/CK+)检出率为54.8%,而SE-iFISH在同一临床实验相同患者中的检出率为90.5%(包括EpCAM+/CK+、EpCAM+/CK-、EpCAM-/CK+及 EpCAM-/CK-等不同类别的染色体异倍体 CTC)[24]。

图4 不同的CTC捕获与鉴别技术汇总

肿瘤类型n阳性率(%)乳腺癌7597.3肺癌20588.3肝癌31496.2食管癌5687.0骨肉瘤18100.0胃癌51888.6胰腺癌26280.6肾癌7686.3嗜铬细胞瘤14100.0胶质瘤34280.7
北京大学肿瘤医院针对胃癌患者CTC亚类细胞进行的同位表型与核型分析发现,CK18阴性/8号染色体三体的CTC对顺铂具有内源性耐药的特征,而CK18阴性 /8号染色体四倍体或以上的CTC则具有继发性耐药的特性[24]。类似的结果在利用转移性人源肿瘤动物模型 (metastatic patient derived xenograft, mPDX)的实验中也得到证实[6]。实验结果显示,人们可以对这些经过多次给药(顺铂)的神经内分泌型胃癌肺转移人源肿瘤动物模型小鼠进行数次采血,以实时动态监测CTC的数目变化,从而进一步精确锁定对顺铂敏感或耐受的CTC亚类细胞。
使用SE获取肺癌患者CTC后,在相应寡细胞CTC上开展EGFR点突变检测以评估靶向药物易瑞沙治疗的可靠性已被报道[19]。
综上所述,不同于其它根据单一瘤标表达(如CK蛋白)或单纯的核酸探针杂交方法检测CTC,SE-iFISH可以帮助人们根据不同瘤种以及临床或研究的具体不同需求,将自由选取的检测肿瘤细胞内各种生物标志物的免疫荧光染色与染色体FISH相结合,在进一步提高CTC检测的敏感性与特异性的基础上,还能获取其它单一技术手段所不能提供的CTC及其亚类的重要临床意义与生物信息,并进一步确定不同瘤种的CTC亚类与各种临床指标相关性。目前,应用多种单一或双瘤标组合-iFISH在不同瘤种间的大样本、多中心的临床实验正在积极开展过程当中。这些临床实验将深入探讨、分析各种CTC亚类细胞与肿瘤患者的预后、转移、耐药、复发的相关性,并以此指导下一步利用RNA及DNA单细胞测序技术对锁定的CTC亚类单细胞与原发灶、转移灶的肿瘤细胞进行深入比对。相关研究将会为人们寻找新的肿瘤标志物,加深对肿瘤形成、转移、复发的认知,以及提高肿瘤的临床治疗疗效提供更多的帮助。
[本文承蒙北京协和医院呼吸科、胰腺外科、胸外科、消化内科、骨科、病理科,中国医学科学院肿瘤医院肿瘤研究所,华西医科大学肿瘤中心,北京大学第一医院泌尿外科,北京大学泌尿研究所,北京大学肿瘤医院胸外科,中国人民解放军军事医学科学院,中国人民解放军全军肿瘤中心,清华大学北京清华长庚医院,首都医科大学北京天坛医院神经外科,首都医科大学北京朝阳医院胸外科,首都医科大学肿瘤学院胸外科,天津医科大学肿瘤医院胰腺外科,上海瑞金医院内分泌科,上海华山医院神经外科,复旦大学药学院与药物基因组学研究中心,中美冠科生物技术公司(CrownBio),赛特生物(Cytointelligen)等单位提供的帮助及技术支持;本文得到北京协和医院肺癌中心李龙芸教授及北京大学肿瘤医院沈琳教授的大力支持,特此一并致谢!]
[1] Pantel K, Brakenhoff R H, Brandt B. Detection, clinical relevance and specific biological properties of disseminating tumour cells[J]. Nat Rev Cancer, 2008,8(5):329-340.
[2] Lin P P. Integrated EpCAM-independent subtraction enrichment and iFISH strategies to detect and classify disseminated and circulating tumors cells[J]. Clin Transl Med, 2015,4(1):38.
[3] Vona G, Sabile A, Louha M,etal. Isolation by size of epithelial tumor cells: a new method for the immunomorphological and molecular characterization of circulatingtumor cells[J]. Am J Pathol, 2000,156(1):57-63.
[4] Attard G, Bono J. Utilizing circulating tumor cells: challenges and pitfalls[J]. Curr Opin Genet Dev, 2011,21(1):50-58.
[5] Ge F, Zhang H, Wang D D,etal. Enhanced detection and comprehensive in situ phenotypic characterization of circulating and disseminated heteroploid epithelial and glioma tumor cells [J]. Oncotarget, 2015,6(29):27049-27064.
[6] Jiang J, Wang D D, Yang M,etal. Comprehensive characterization of chemotherapeutic efficacy on metastases in the established gastric neuroendocrine cancer patient derived xenograft model[J]. Oncotarget, 2015,6(17):15639-15651.
[7] Alunni-Fabbroni M, Sandri M T. Circulating tumour cells in clinical practice: methods of detection and possible characterization[J]. Methods, 2010,50(4):289-297.
[8] Ito H, Inoue H, Kimura S,etal. Prognostic impact of the number of viable circulating cells with high telomerase activity in gastric cancer patients: a prospective study[J]. Int J Oncol, 2014,45(1):227-234.
[9] Coumans F A, Doggen C J, Attard G,etal. All circulating EpCAM+CK+CD45- objects predict overall survival in castration-resistant prostate cancer[J]. Ann Oncol, 2010,21(9):1851-1857.
[10] Gires O, Stoecklein N H. Dynamic EpCAM expression on circulating and disseminating tumor cells: causes and consequences[J]. Cell Mol Life Sci, 2014,71(22):4393-4402.
[11] Mikolajczyk S D, Millar L S, Tsinberg P,etal. Detection of EpCAM-Negative and cytokeratin-negative circulating tumor cells in peripheral blood[J]. J Oncol, 2011,2011:252-361.
[12] Went P T, Lugli A, Meier S,etal. Frequent EpCam protein expression in human carcinomas[J]. Hum Pathol, 2004,35(1):122-128.
[13] Maetzel D, Denzel S, Mack B,etal. Nuclear signalling by tumour-associated antigen EpCAM[J]. Nat Cell Biol, 2009,11(2):162-171.
[14] Driemel C, Kremling H, Schumacher S,etal. Context-dependent adaption of EpCAM expression in early systemic esophageal cancer[J]. Oncogene, 2014,33(41):4904-4915.
[15] Zhang L, Ridgway L D, Wetzel M D,etal. The identification and characterization of breast cancer CTCs competent for brain metastasis[J]. Sci Transl Med, 2013,5(180):189-195.
[16] Veillette A, Bookman M A, Horak E M,etal. The CD4 and CD8 T cell surface antigens are associated with the internal membrane tyrosine-protein kinase p56lck[J]. Cell, 1988,55(2):301-308.
[17] Maaser K, Borlak J. A genome-wide expression analysis identifies a network of EpCAM-induced cell cycle regulators[J]. Br J Cancer, 2008,99(10):1635-1643.
[18] Liu Z, Fusi A, Klopocki E,etal. Negative enrichment by immunomagnetic nanobeads for unbiased characterization of circulating tumor cells from peripheral blood of cancer patients[J]. J Transl Med, 2011,9:70.
[19] Ran R, Li L, Wang M,etal. Determination of EGFR mutations in single cells microdissected from enriched lung tumor cells in peripheral blood[J]. Anal Bioanal Chem, 2013,405(23):7377-7382.
[20] Shi W, Reid T, Tang M,etal. Detection of circulating cancer cells from patient blood samples and correlation with anti-cancer therapy[J]. Cancer Res, 2007,67:5444.
[21] Ren C, He P, Zhang J,etal. Detecting circulating tumor cells in peripheral blood of pancreatic cancer patients using a negative selection strategy[J]. Cancer Res, 2007,67:5445.
[22] Wang D, Liu Y, Liu Y,etal. Enrichment and detection of circulating tumor cells in breast cancer patients[J]. Cancer Res, 2008,68:3692.
[23] Chen Y, Bao H, Zhou C,etal. Detection of circulating tumor cell in patients with colorectal cancer and its potential implication[J]. Cancer Res, 2008,68:3696.
[24] Li Y, Zhang X, Ge S,etal. Clinical significance of phenotyping and karyotyping of circulating tumor cells in patients with advanced gastric cancer[J]. Oncotarget, 2014,5(16):6594-6602.
[25] Wu C, Hao H, Li L,etal. Preliminary investigation of the clinical significance of detecting circulating tumor cells enriched from lung cancer patients[J]. J Thorac Oncol, 2009,4(1):30-36.
[26] Chen Q, Ge F, Cui W,etal. Lung cancer circulating tumor cells isolated by the EpCAM-independent enrichment strategy correlate with cytokeratin 19-derived CYFRA21-1and pathological staging[J]. Clin Chim Acta, 2013,419:57-61.
[27] Willipinski-Stapelfeldt B, Riethdorf S, Assmann V,etal. Changes in cytoskeletal protein composition indicative of an epithelial-mesenchymal transition in human micrometastatic and primary breast carcinoma cells[J]. Clin Cancer Res, 2005,11(22):8006-8014.
[28] Massoner P, Thomm T, Mack B,etal. EpCAM is overexpressed in local and metastatic prostate cancer, suppressed by chemotherapy and modulated by MET-associated miRNA-200c/205[J]. Br J Cancer, 2014,111(5):955-964.
[29] Songun I, Litvinov S V, van de Velde C J,etal. Loss of Ep-CAM (CO17-1A) expression predicts survival in patients with gastric cancer[J]. Br J Cancer, 2005,92(9):1767-1772.
[30] Zulehner G, Mikula M, Schneller D,etal. Nuclear beta-catenin induces an early liver progenitor phenotype in hepatocellular carcinoma and promotes tumor recurrence[J]. Am J Pathol, 2010, 176(1):472-481.
[31] Fortier A M, Asselin E, Cadrin M. Keratin 8 and 18 loss in epithelial cancer cells increases collective cell migration and cisplatin sensitivity through claudin1 up-regulation[J]. J Biol Chem, 2013, 288(16):11555-11571.
[32] Woelfle U, Sauter G, Santjer S,etal. Down-regulated expression of cytokeratin 18 promotes progression of human breast cancer[J]. Clin Cancer Res, 2004,10(8):2670-2674.
[33] Polzer B, Medoro G, Pasch S,etal. Molecular profiling of single circulating tumor cells with diagnostic intention[J]. EMBO Mol Med, 2014,6(11):1371-1386.
时间:2017-3-16 14:23
http://kns.cnki.net/kcms/detail/34.1073.R.20170316.1423.014.html
1北京协和医院基本外科,北京 1007302中国医学科学院基础医学研究所/北京协和医学院基础学院生物化学与分子生物学系及中心实验室,北京 1000053北京大学人民医院病理科,北京 1000444北京博雅医学健康研究所,北京 1000055北京大学肿瘤医院消化内科,北京 1000446北京大学第一医院乳腺癌中心,北京 1000447中国人民解放军总医院(301医院)肝胆中心,北京 1008538上海第一人民医院肿瘤中心,上海 2000809赛特生物医药科技有限公司,江苏 泰州 22530010Cytelligen, San Diego, California, USA
由 磊,女,博士,副研究员 郑 直,男,博士,教授,通讯作者。E-mail: zhizheng100@126.com
R 362
A
1001-7399(2017)03-0297-06
10.13315/j.cnki.cjcep.2017.03.014
接受日期:2017-01-12

