液相色谱–核磁共振联用技术研究进展
张何,黄桂兰,袁铃,李腾
(防化研究院,国民核生化灾害防护国家重点实验室,北京 102205)
液相色谱–核磁共振联用技术研究进展
张何,黄桂兰,袁铃,李腾
(防化研究院,国民核生化灾害防护国家重点实验室,北京 102205)
介绍了液相色谱–核磁共振(LC–NMR)联用技术发展状况。讨论了LC–NMR技术应用中面临的问题和解决方法,评述了LC–NMR和LC–SPE–NMR两种工作模式。介绍了LC–NMR在天然产物分析、生物代谢、异构体的鉴定和多聚物分析领域的应用情况,对其发展动态进行了展望。
液相色谱;核磁共振;综述
核磁共振技术是有机结构鉴定中适用性强、结果准确可靠的分析方法,其局限性主要体现在核磁共振要求高纯度的样品,如果被分析物质是混合物,会对1H谱图产生严重的信号干扰和重叠,给解谱工作带来困难,甚至无法解析。因此对混合物的分析,一般要先进行分离和纯化。色谱技术是目前最常用的分离手段,按照流动相不同分为气相色谱(GC)、液相色谱(LC)、超临界流体色谱(SFC)、毛细管电泳色谱(CEC)等,其中以液相色谱在分离复杂的混合物方面的应用最为广泛,适用于70%以上的化合物分离。如果把液相色谱出色的分离能力同核磁共振技术有效的结构解析能力结合到一起,实现在线检测,不仅能简化样品前处理过程,提高自动化程度,缩短检测时间,而且能够建立相关化合物色谱和核磁数据之间的对应关系[1–5],在分子分离鉴定领域有非常大的应用潜力。
液相色谱–核磁共振(LC–NMR)联用技术始于20世纪80年代[6],但LC–NMR联用技术的普及程度远不及已经成熟的LC–MS和LC–MS–MS技术。要实现LC–NMR联用需要克服两大难点:一是NMR的低检测灵敏度与LC分离容量兼容的问题,二是LC洗脱溶剂给NMR检测带来严重干扰的问题。经过几十年的NMR仪器和实验方法的发展,现已出现了更高场强的NMR仪器,设计出了更先进的NMR探头,发展了功能更丰富的脉冲序列技术,很大程度上解决了LC–NMR联用中NMR灵敏度低、干扰过多等传统问题,使得LC–NMR的相关应用在近年的报道中迅速增多,技术更加实用化。笔者对LC–NMR的工作模式、存在的问题和解决方法进行了评述,并简单介绍了LC–NMR在天然产物鉴定[7–12]、药物代谢[13–17]、异构体研究[18–20]和多聚物分析[21]等领域的应用情况。
1 LC–NMR工作模式
LC与NMR在线联用的方式可以为LC与内置样品流动检测池的NMR探头直接联用(LC–NMR);样品从LC到全自动固相萃取仪,再到NMR探头的在线联结(LC–SPE–NMR)。常规探头与内置流动检测池探头的结构对照如图1所示[8]。
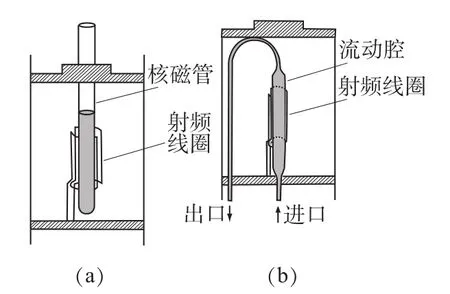
图1 常规NMR探头(a)和连续流动NMR液相探头(b)的构造对比
1.1 LC–NMR直接在线联用
LC–NMR在线联用的通用配置有进样器、泵、色谱柱、检测器、核磁共振仪[22],配置液相探头的NMR系统通过接口与常规的LC系统联用。其主要有3种工作模式,即:连续流动操作(on-flow)、停流操作(stop-flow)、环路收集(loop collection)和环路分析(loop analysis)。
LC–NMR的通用配置包括一个常规的HPLC系统、联用接口和配备流动探头的NMR系统[22]。
1.1.1 连续流动操作模式
连续流动操作也称作在流模式,即样品从检测器流入核磁探头后保持流动状态,液相色谱正常工作,流动探头中的检测腔为图1(b)所示的内径为2~4 mm的玻璃管,玻璃管两端连接LC导管作为流体的进口和出口。在这种模式下,样品进入LC系统,经色谱柱分离后,流经检测器(如紫外、DAD等),进入到核磁探头中,被检测采集信号,再从探头流出,收集或作废液处理。核磁数据的采集与色谱运行同时开始,连续进行,可得到一系列检测信号。信号的处理结果是横轴为化学位移,纵轴为洗脱时间的二维堆积图或等高线图[23]。这种模式存在几个问题:(1)短时采样使得灵敏度变差。在常规的流速下,组分在检测线圈中保持的时间很短,使得NMR的采样时间受限,造成NMR谱的信噪比很差,通常只使用于检测灵敏度高的1H和19F核。(2)流速慢造成色谱峰扩散。若将流速降低3~10倍,将延长组分在在检测线圈中保持的时间,NMR的采样时间也得以增加,使得NMR信噪比可以增强,但流速减慢导致的扩散会影响色谱峰形。
1.1.2 停流操作模式
停流操作所使用的探头与连续流动模式相同,不同之处在于样品流经检测器进入核磁探头之后,液相色谱流动相停止流动。最早的停留操作模式是一种基于“时间分割”[24]的工作模式:HPLC先开始运行,起初的流动方向与在线模式的方向相同;当检测器检测到目标组分时,停流延迟计数器被激活,完成等待时间后,流动相停止流动,此时NMR被激活,开始采集信号;信号采集完毕后,再开启流动,完成NMR信号采集的组分流出探头。下一个组分按同样操作方式采集。在此模式下采集的NMR谱与常规NMR谱相同。和连续流动模式相比,停留操作测试得到的核磁共振信号更强,改善了连续流模式中短时采样导致的信噪比差的问题,但由于没有组分的富集过程,对于低浓度的样品组分,需要高的NMR检测灵敏度。这是因为停泵后,洗脱液中的后续组分很容易横向扩散造成峰展宽严重,从而降低了分离效率。
1.1.3 环路收集模式/峰存贮模式
环路收集模式也称为峰存贮(peak parking)模式,属于停流操作的一种,分收集和分析两个阶段。首先是收集,在这一阶段,当HPLC检测器检测到一个组分峰时,环路延迟计数器被激发,将此组分收集到某一环路中,直至延迟完毕,切换阀将通道切换至下一个环路,收集下一个组分。此操作均可自动和手动进行。第二阶段是环路分析,在液相泵的驱动下,一个环路中的组分流入探头的检测池内,停泵,开始NMR采样;采样结束后,重启液流,将下一个环路的组分推入探头分析[22]。这样的好处是将组分分开后分别存储在不同的环路中,没有停流操作带来的色谱峰展宽,并且使得NMR的检测时间不受到限制。而且检测时,状态稳定,更容易获得高信噪比和高分辨率的谱图,实现一维谱和二维谱检测,大大增加了在复杂样品中发现目标峰的几率。不足之处是样品进入管路之后被管路里的溶液稀释,浓度下降,检测信号变弱。
1.2 LC–SPE–NMR在线联用
2013年,Lorena等[25]展示了HPLC–UV–SPE–NMR的在线联用,LC分离采用普通的流动相溶剂分离,以紫外检测器监测组分出峰,再利用自动固相萃取(SPE)仪捕捉富集HPLC分离的组分,SPE柱用氮气吹干后,再用氘代乙腈洗脱进入核磁液相探头分析。HPLC–UV–SPE–NMR工作系统的组成为液相色谱系统、紫外检测器、固相微萃取系统和核磁共振仪等4部分。
LC–SPE–NMR在线联用方式中,完成LC分离和SPE收集组分后,组分的洗脱进入NMR检测有两种方式:第一种是流动进入检测池方式,即探头中安装流动检测池,氘代溶剂将一个组分从SPE柱洗脱并通过管路流入探头内检测池,完成检测后,用氮气从检测池中吹出组分,用溶剂清洗检测池,氮气吹干后,再进行下一个组分的分析。这种方式的优点是减少样品转移步骤,因此样品的损失也更少,但是这种方式的缺点也非常明显:检测池占用了探头,不能执行常规的核磁管样品测试。第二种方式是采用自动洗脱液转移装置(Tube Transfer)将目标组分从SPE柱洗脱下来之后转移至核磁管中,之后可以进行常规核磁共振分析操作。相比第一种方式而言,这样做增加了转移样品的步骤,过程中可能有样品的损失,并且时间成本增加,但是这样做的好处是不影响常规的核磁管样品测试,而且自动进样器可以照常使用,因此更具有实用价值[26–31]。
2 LC–NMR存在的问题和解决方法
2.1 NMR检测灵敏度问题
NMR与色谱技术在线联用至今未达到普及的主要瓶颈在于NMR的检测灵敏度。相比于质谱(MS)、红外光谱(IR)、紫外光谱(UV)等检测器μg级的检测灵敏度,目前NMR常规室温探头检测需要的化合物量是mg级,而分析型的液相色谱的分离容量是μg级,因此解决LC–NMR在线联用的核心是提高NMR的检测灵敏度。硬件上提高NMR检测灵敏度的途径有两个:(1)提高超导磁体的磁场强度;(2)改进探头的设计。表1为不同磁体系统场强及探头的检测灵敏度指标,从表1中可见,随着磁场强度的升高,质子的共振频率增加,各检测核的灵敏度指标也随之提高,在使用相同类型探头的情况下,500 MHz比200 MHz谱仪的1H,19F,13C,31P四种核的检测灵敏度提高了3~5倍。2009年,Bruker公司推出了全球首台1 000 MHz的超导核磁共振波谱仪,使得NMR进入了GHz时代,磁体的场强达到了23.5特斯拉,进一步提高了各种核的检测灵敏度。单纯提高磁场强度来提高检测灵敏度的效果是有限的,而通过优化和改进探头的设计,可以显著地提高检测核的灵敏度。通过探头设计提高灵敏度有3种方式:(1)采用大径的核磁管。如表1所示,对于相同类型的探头,随着所检测核磁管管径的增大,相同浓度的样品在检测线圈范围内检测到的核数量更多,信号响应更强,灵敏度是10 mm > 5 mm > 3 mm。微量探头通过减少溶剂的体积增加样品浓度提高灵敏度;超微量探头的设计,可使检测样品的体积低至40 μL,但核的检测灵敏度低于常规的5 mm探头。(2)探头线圈位置的优化设计。表1中,相同场强的1H核在反式检测探头的检测灵敏度比相同频率的宽带探头高了一倍以上,其设计原理是将1H核检测线圈最靠近样品而具有最高检测灵敏度,但代价是牺牲了其它杂核的检测灵敏度。(3)利用超导原理降低电子噪声。超低温探头的设计原理是利用低温的氦气来冷却探头检测线圈到25 K,前放电子线圈到70 K附近,可最大程度降低检测到的电子噪声,可使所有检测核都比同频率的常温探头的灵敏度提高3~5倍。超低温微量探头结合了超低温探头和微量探头的优点,可以在样品量很少的情况下仍然保持较高的检测灵敏度。

表1 不同磁体系统场强及探头的检测灵敏度指标1)
2.2 LC分离和NMR需要长时间累加的矛盾
即便是提高了磁场强度和采用更高灵敏度的超低温微量流动探头(并且目前商品化的仪器可以达到秒数量级,使得在流模式的LC–NMR可以在样品流动的情况下检测样品的信息),但对于13C,15N这类低丰度杂核的检测,低浓度样品的一维谱、二维谱的分析测试,仍然需要NMR长时间累加。慢流模式和停流模式的LC–NMR虽可以延长分离的组分在检测池中停留的时间,但会造成色谱峰展宽,影响色谱分辨率。解决LC分离和NMR累加矛盾的方式:一是从色谱分离上解决,二是从NMR进样检测方式上解决。这可以通过维持常规的LC分离、分离组分分别存储的环路收集模式或固相萃取柱(SPE)收集模式实现。从色谱端提高样品检测浓度的方法:一是采用半制备色谱柱,增大一次分离的进样量[32–34];二是多次LC进样分离后先通过SPE富集,再进行NMR检测。
2.3 溶剂峰抑制的问题
液相色谱中的流动相溶剂如甲醇、乙腈、水等均含质子,会在核磁共振氢谱过程中产生非常强的吸收信号,这些溶剂产生的NMR信号高于样品中目标化合物1万倍以上[4],会抑制或掩盖目标化合物的信号。解决方法是在进行1H–NMR检测时,采用溶剂峰压制的脉冲程序技术和采用氘代溶剂作为流动相。
主要的溶剂峰压制技术有三种:预饱和(pre-saturation)技术、软脉冲多重激发(Soft pulse multiple irradiation)和通过增强纵向弛豫(T1)效应的水峰压制(WET pre-saturation)技术。溶剂峰压制技术的局限性是可能导致其附近的核磁共振信号丢失。
全程采用氘代溶剂作为流动相的问题是成本过于昂贵而难以实施。解决这个问题主要围绕减少氘代洗脱液用量和提高样品浓度来考虑。一种方法是采用毛细管HPLC来大幅度减小流动相的消耗量,使得全程采用氘代溶剂成为可能,避免溶剂峰压制技术造成的目标信号丢失问题[35–36]。另一种方法是采用普通流动相溶剂进行分离,组分利用固相萃取柱进行收集,氮气吹干溶剂后,用氘代溶剂洗脱后进行核磁共振检测的LC–SPE–NMR模式。这样能完成样品富集和净化,节省氘代溶剂用量,提高NMR检测灵敏度。
2.4 LC分离组分的识别收集问题
LC–NMR联用的一个关键问题是混合物经LC分离后的组分如何被识别和收集。在LC的常用检测器中,LC–MS是通过总离子流色谱图来观察到所分离的组分的,LC–UV 或DAD是通过组分产生紫外吸收响应信号来识别组分的。而NMR的检测原理是原子核的共振,其信号响应谱图表征了分子的结构信息,作用类似于质谱图,因此NMR作为检测器,目前并不具备在一定时间域内对每一个化合物产生一个单一响应信号的功能,也就无法得到类似于总离子流色谱图这样的组分分离效果图。所以在NMR检测前需要一个能识别每个组分的“眼睛”,并将分离的组分分别收集后,再分别进行NMR检测。UV和DAD是最常规的LC检测器,但属于选择性检测器,价格便宜,适用于具有紫外吸收的化合物,而对于无发色团的化合物则是盲区。MS属于通用型检测器,适用于不同类型化合物,还具有波谱鉴定结构的功能,灵敏度高,LC–MS–NMR联用是最理想的组合,但存在设备购置和使用成本过高的问题。随着蒸发光散射检测(ELSD)技术的发展,ELSD已实现了商品化,成为一种LC的新型通用型质量检测器,弥补了常规紫外检测器的缺陷,与同样适用于无紫外吸收化合物检测的示差折光检测器(RID)相比,具有灵敏度略高、受温度影响小和可用于梯度洗脱的优点[37–38],在购买和维护成本上也比MS便宜许多。可以预期,LC–ELSD–NMR的联用是一种发展趋势。
3 LC–NMR的应用
3.1 天然产物分析
天然产物分析是LC–NMR最重要的应用领域,这是由于天然产物的特点和LC–NMR分析鉴定能力共同决定的。为了寻找新的化合物,天然植物或动物组织的粗提产品都要经过多步的分离过程,采用不同的分离方法提纯组分,以便进行NMR的结构鉴定,而天然产物的粗提液中往往含有大量结构相近、很难分离的化合物,传统的分离方法费时费力,而采用LC–NMR则大大简化了这个过程。另外,传统的离线分离方法由于缺乏在线监控,容易导致重复,而LC–NMR可以在分析的早期就对粗提物进行识别判断,去掉不想要的或已知化合物,集中精力在可能出现新结构目标的分离上。在这方面,更为便利的是LC–MS–SPE–NMR的联用。在LC分离后,5%的流出液分离至MS检测器,95%的流出液经过SPE富集,再用氘代溶剂洗脱,用于NMR分析。一次进样分离即可同时获得MS和NMR两种数据,提高了天然产物的分析效率,成为了天然产物研究的重要技术手段。2012年Alexander等人[39]采用LC–MS和LC–NMR等技术鉴定野生山葡萄花青素,通过LC–NMR在线联用明确鉴定出了样品中33种花青素的结构信息,特别是面对顺式异构体香豆素衍生物结构的鉴定过程中多手性中心对结构的确定带来了很大困难的情况下,采用LC–MS和LC–NMR两种联用技术结果互相验证,对顺式异构体香豆素衍生物结构的最终确定发挥了重要作用。2013年Johansen等[11]发展了HPLC–SPE–NMR在线检测技术,使用超低温探头可以对两组混合的天然产物进行区分,得到的谱图杂峰信息很少,并且容易区分。2015年Brkljaca等[12]使用HPLC–NMR 和HPLC–MS 在海洋褐藻中的提取物中,找到4种未报道的化合物和8种已经报道的化合物,其中5种化合物具有选择抗菌活性。Brkljaca等人在整个实验的设计思路:高效液相色谱时间切片分离的组分被依次富集在固相萃取柱上,之后被洗脱获得NMR谱图,通过数据库对比,得到多种化合物结构信息。
3.2 药物代谢研究
LC–NMR的另一个主要应用领域是药物分析,涉及化学药物中杂质的定性定量分析、中药及天然药物中药用成分异构体的分析及新化合物的结构鉴定、海洋生物及生化大分子的分析、药物代谢分析等。
2001年Daykin等[40]提出脂蛋白复合物的分析方法,采用HPLC–NMR 技术分离检测了3种脂蛋白,分离检测时间只耗费90 min,并且HPLC分离也没有造成蛋白质分子结构的损伤。2001年Scarfe等[41]研究2,3,5,6-四氟-4-三氟甲基苯胺在鼠体内的代谢,通过19F NMR,HPLC–NMR和HPLC–MS分析了鼠尿中的各种代谢物,发现38%的2,3,5,6-四氟-4-三氟甲基苯胺转化5种代谢物随尿液排出,并研究了代谢物的转化途径。2010年Durand 等人[14]通过LC–NMR,NMR,LC–MS等技术手段,分析了甲基磺草酮为主要成分的农药的生物降解产物,其中LC–NMR识别出6种代谢产物化学结构,为预测其化学环境行为提供了依据。2010年Akiraa等[15]利用LC–NMR技术鉴定了一种遗传性高血压大鼠体内牛黄酸代谢物,发现在遗传性高血压大鼠尿液中检测到这种与降压有关的牛磺酸代谢物要比正常大鼠尿液中多很多,实验结果在病理学中有重要意义。2013年Braunberger等[16]使用LC–NMR,NMR,LC–MS等技术鉴定茅膏中黄酮和鞣花酸衍生物,并采用LC–DAD对衍生物进行定量。2015 年Mallikarjun等[17]使用LC–MS/TOF、LC–NMR等技术鉴定压力下药物西拉普利在酸性和碱性条件下的降解产物,并根据降解产物对药物作用机理做出了概述。
3.3 异构体分析
2011年Haroune等[19]使用LC–NMR技术鉴定爆炸危险品三过氧化三丙酮(TATP)的构象。由于立体构象的不同,三过氧化三丙酮可以存在两种结构。LC–NMR 联用实验中,根据液相色谱分离出峰情况可以确定主要构象,NMR谱图显示主要构象化学位移在δ1.38 附近,次要构象化学位移在δ1.67 和δ1.13附近。通过长时间测量流动腔中TATP不同化学位移处积分面积的变化情况可以检测两种构象转变的动力学关系。2015年Baranovsky等[20]使用LC–DAD–SPE–NMR和LC–MS技术,分离鉴定反应混合物中的微量组分,研究了化合物3-甲氧基-14,17-亚乙烯基-16α-硝基-1,3,5(10)三烯基-17β-乙酸(3-methoxy-14,17-etheno-16α-nitroestra-1,3,5(10)-trien-17β-yl acetate)在 NaHCO3存在下的乙醇溶剂分解作用,揭示了内酰胺的形成途径。
3.4 聚合物分析
合成的聚合物是高度复杂的多组分物质,由不同链长、不同化学组分和不同结构的大分子所组成。考虑到化学组分、组合和末端功能团等因素,合成聚合物的组分相当复杂。
HPLC–NMR技术是聚合物分析重要的手段之一。通过HPLC的分离不仅能根据聚合物的分子量对聚合物进行分离,而且能够区分相同分子量但是采用不同枝节方式的聚合物。之后的分析检测中,根据末端官能团的差异可以进行NMR的鉴定。
2005年Hiller等[42]使用LC–NMR分析了包含不同末端官能团的PEO混合物。在采用溶剂峰压制技术之后,对每一个峰都可以进行归属和指认。并且面对特异的末端官能团,峰的信号强度还可以作为定量的依据。
4 结语
LC–NMR联用技术发展到现在,相比该技术被提出之时,无论从仪器分辨率、联用的接口技术,还是去除溶剂信号干扰能力、提高信号强度等方面都有了质的飞跃和提高。此外,也在相当大的程度上扩展了LC–NMR联用技术的应用领域。相信今后随着技术的发展,从改进探头、设计更加合理的检测线圈流动腔、使用普适性的液相色谱检测器、寻求更有效的富集方法等方面进一步改进LC–NMR联用技术,会使得LC–NMR联用技术在分离分析和结构鉴定领域发挥更大的作用。
[1]Clarkson C,Sibum M,Mensen R,et al. Evaluation of on–line solid–phase extraction parameters for hyphenated,high–performance liquid chromatography–solid-phase extraction–nuclear magnetic resonance applications[J]. Journal of Chromatography A,2007,1 165: 1–9.
[2]Wasim M,Brereton R G. Application of evolving factor analysis to on–flow LC–NMR data using spectral windows [J]. Chemometrics and Intelligent Laboratory Systems,2005,78: 51–62.
[3]刘江疆,林金明.高效液相色谱–核磁共振联用技术[J]. 生命科学仪器,2005,3(3): 3–8.
[4]刘西哲,生宁,李飞高,等.液相色谱–质谱–核磁共振联用技术及其在药物代谢与结构鉴定中的应用[J]. 中国医院药学杂志,2012,32(12): 972–974.
[5]杨婷婷,段续,金松子,等. 液相色谱–核磁共振联用技术在药物分析中的应用[J].现代药物与临床,2012,27(6): 635–641.
[6]Bayer E,Albert K,Nleder M,et al. On-line coupling of liquid chromatography and high-field nuclear magnetic resonance spectrometry [J]. Analytical Chemistry,1982,54: 1 747–1 750.
[7]Hooft J,Mihaleva V,Vos R,et al. A strategy for fast structural elucidation of metabolites in small volume plant extracts using automated MS-guided LC–MS–SPE–NMR[J]. Magnetic Resonance in Chemistry,2011,49: 55–60.
[8]Albert K. On-line LC–NMR and related techniques[M]. New York,John Wiley & Sons Inc,2002.
[9]Wubshet G S,Moresco H H,Tahtah Y,et al. High-resolution bioactivity profiling combined with HPLC–HRMS–SPE–NMR: a-Glucosidase inhibitors and acetylated ellagic acid rhamnosides from Myrcia palustris DC[J]. Phytochemistry,2015,116: 246–252.
[10]Iwasa K,Wenhua C,Takahashi T,et al. Biotransformation of Phenolic Tetrahydroprotoberberines in Plant Cell Cultures Followed by LC–NMR,LC–MS,and LC–CD[J]. Journal of Natural Products,2010,73: 115–122.
[11]Johansen K T,Wubshet S G,Nyberg N T. HPLC–NMR revisited: using time–slice high–performance liquid chromatography–solidphase extraction–nuclear magnetic resonance with databaseassisted dereplication[J]. Analytical Chemistry,2013,85: 3 183–3 189.
[12]Brkljaca R,Urban S. HPLC–NMR and HPLC–MS investigation of antimicrobial constituents in Cystophora monilifera and Cystophora subfarcinata[J]. Phytochemistry,2015,117: 200–208.
[13]Singh S,Handa T,Narayanam,et al. A critical review on the use of modern sophisticated hyphenated tools in the characterization of impurities and degradation products[J]. Journal of Pharmaceutical and Biomedical Analysis,2012,69: 148–173.
[14]Durand S,Sancelme M,Pascale B H,et al. Biodegradation pathway of mesotrione: Complementarities of NMR,LC–NMR and LC–MS for qualitative and quantitative metabolic profiling [J]. Chemosphere,2010,81: 372–380.
[15]Akiraa K,Mitome H,Imachi M,et al. LC–NMR identification of a novel taurine-related metabolite observed in1H NMR-based metabonomics of genetically hypertensive rats[J]. Journal of Pharmaceutical and Biomedical Analysis,2010,51: 1 091–1 096.
[16]Braunberger C,Zehl M,Conrad J,et al. LC–NMR,NMR,and LC–MS identification and LC–DAD quantification of flavonoids and ellagic acid derivatives in Drosera peltata[J]. Journal of Chromatography B,2013,932: 111–116.
[17]Narayanam M,Sahu A,Singh S. Use of LC–MS/TOF,LC–MS,NMR and LC–NMR in characterization of stress degradation products: Application to cilazapril [J]. Journal of Pharmaceuticaland Biomedical Analysis,2015,111: 190–203.
[18]Pursch M,Strohschein S,Handel H,et al. Temperature–dependent behavior of C30interphases: a solid-state NMR and LC–NMR study[J]. Analytical Chemistry,1996,68(2): 386–393.
[19]Haroune N,Crowson A,Campbell B. Characterisation of triacetone triperoxide (TATP) conformers using LC–NMR[J]. Science and Justice,2011,51: 50–56.
[20]Baranovsky A V,Bolibrukh D A,Schneider B. Solvolysis of 14,17-etheno-bridged 16a-nitroestratrienyl acetate and lactam formation pathways studied by LC–NMR and LC–MS Structures of minor products[J]. Steroids,2015,104: 37–48.
[21]Hiller W,Pasch H,Macko T,et al. On-line coupling of high temperature GPC and1H NMR for the analysis of polymers[J]. Magnetic Resonance in Chemistry,2006,183: 290–302.
[22]Hiller W,Sinha P,Hehn M,et al. Online LC–NMR–From an expensive toy to a powerful tool in polymer analysis [J]. Progress in Polymer Science,2014,39: 979–1 016.
[23]Wasim M,Brereton R G. Application of multivariate curve resolution methods to on-flow LC–NMR[J]. Journal of Chromatography A,2005,1 096: 2–15.
[24]曲峻,罗国安,吴筑平. 高效液相色谱–核磁共振联用技术最新进展[J]. 分析化学,1999,27(8): 976–981.
[25]Silva Lorena M A,Filho Elenilson G A,Thomasi S S,et al. Use of diffusion–ordered NMR spectroscopy and HPLC–UV–SPE–NMR to identify undeclared synthetic drugs in medicines illegally sold as phytotherapies[J]. Magnetic Resonance in Chemistry,2013,51: 541–548.
[26]Capistrano I R,Wouters A,Foubert K,Balde A M,et al. Phytochemical characterisation of a cytotoxic stem bark extract of Steganotaenia araliacea and identification of a protoflavanone by LC–SPE–NMR[J]. Phytochemistry letters,2015,12: 119–124.
[27]Fritsche J,Angoelal R,Dachtler M. On-line liquidchromatography–nuclear magnetic resonance spectroscopy–mass spectrometry coupling for the separation and characterization of secoisolariciresinol diglucoside isomers in flaxseed[J]. Journal of Chromatography A,2002,972: 195–203.
[28]Godejohann M,Tseng L H,Braumann U,et al. Characterization of a paracetamol metabolite using on-line LC–SPE–NMR–MS and a cryogenic NMR probe[J]. Journal of Chromatography A,2004,1 058: 191–196.
[29]Hendrawati O,Woerdenbag H J,Michiels Paul J A,et al. Identification of lignans and related compounds in anthriscus sylvestris by LC–ESI–MS/MS and LC–SPE–NMR[J]. Phytochemistry,2011,72: 2 172–2 179.
[30]Tatsis E C,Boeren S,Exarchou V,et al. Identification of the major constituents of Hypericum perforatum by LC/SPE/NMR and/or LC/MS[J]. Phytochemistry,2007,68: 383–393.
[31]Yongjiang Xu,Foubert K,Dhooghe L,et al. Rapid isolation and identification of minor natural products by LC–MS,LC–SPE–NMR and ECD: isoflavanones,biflavanones and bisdihydrocoumarins from ormocarpum kirkii[J]. Phytochemistry,2012,79: 121–128.
[32]Miliauskas G,Miliauskas G,Beek T A,et al. Comparison of analytical and semi-preparative columns for high–performance liquid chromatography–solid-phase extraction–nuclear magnetic resonance[J]. Journal of Chromatography A,2006,1 112: 276–284.
[33]Rinaldi F,Junying Fan,Pathirana C,et al. Semi-preparative LC–SPE-cryoflow NMR for impurity identifications: use of mother liquor as a better source of impurities[J]. Magnetic Resonance in Chemistry,2013,51: 517–522.
[34]Feng Xu,Alexander A J. The design of an on-line semipreparative LC–SPE–NMR system for trace analysis[J]. Magnetic Resonance in Chemistry,2005,43: 776–782.
[35]Hentschel P,Krucher M,Grynbaum M D,et al. Determination of regulatory phosphorylation sites in nanogram amounts of a synthetic fragment of ZAP–70 using microprobe NMR and online coupled capillary HPLC–NMR[J]. Magnetic Resonance in Chemistry,2005,43: 747–754.
[36]Lewis R J,Bernstein M A,Duncan S J,et al. A comparison of capillary-scale LC–NMR with alternative techniques: spectroscopic and practical considerations[J]. Magnetic Resonance in Chemistry,2005,43: 783–789.
[37]Cruz A,Hilbert G,Riviere C,et al. Anthocyanin identification and composition of wild vitis spp.accessions by using LC–MS and LC–NMR[J]. Analytica Chimica Acta,2012,732: 145–152.
[38]王巧娥,丁明玉. 蒸发光散射检测技术研究进展[J]. 分析测试学报,2006,25(6): 126–132.
[39]苏本正,都波,石典花. 发光散射检测器与紫外检测器用于人参中皂苷类成分检测的比较研究[J]. 药学研究,2013,32(6): 333–335.
[40]Daykin C A,Corcoran O,Hansen S H,et al. Application of directly coupled HPLC NMR to separation and characterization of lipoproteins from human serum[J]. Analytical Chemistry,2001,73: 1 084–1 090.
[41]Nicholson J K,Lindon J C,Scarfe G B. High–performance liquid chromatography linked to inductively coupled plasma mass spectrometry and orthogonal acceleration time-of-flight mass spectrometry for the simultaneous detection and identification of metabolites of 2-Bromo-4-trifluoromethyl-[13C]-acetanilide in rat urine[J]. Analytical Chemistry,2001,73: 1 491–1 494.
[42]Hiller W,Brull A,Argyropoulos D,et al. HPLC–NMR of fatty alcohol ethoxylates[J]. Magnetic Resonance in Chemistry,2005,43: 729–735.
Advances of Liquid Chromatography Coupled with Nuclear Magnetic Resonance Spectrometer
Zhang He,Huang Guilan,Yuan Ling,Li Teng
(State Key Laboratory of NBC Protection for Civilian, Research Institution of Chemical Defense, Beijing 102205,China)
The development of liquid chromatography–nuclear magnetic resonance (LC–NMR) technology was introduced. The problems encountered in application and comment the working model of LC–NMR and LC–SPE–NMR were discussed. The application of LC–NMR technology in the field of biological metabolism,natural product analysis,isomer identification and polymers analysis was introduced. The development trend of LC–NMR was put forward.
liquid chromatography; nuclear magnetic resonance; review
O657.7
A
1008–6145(2017)02–0117–06
联系人:张何;E-mail: pkuxiaoxiaohe@163.com
2016–12–20
10.3969/j.issn.1008–6145.2017.02.028

