骨髓间充质干细胞分离鉴定及在糖尿病大鼠肾脏保护中的机制研究①
康 岩 李志杰 王丽娜 郭玉卿 刘 璠 张 洁
(河北医科大学第一医院,石家庄050031)
骨髓间充质干细胞分离鉴定及在糖尿病大鼠肾脏保护中的机制研究①
康 岩 李志杰 王丽娜 郭玉卿 刘 璠 张 洁
(河北医科大学第一医院,石家庄050031)
目的:观察骨髓间充质干细胞分离、鉴定方法及在糖尿病大鼠肾脏保护中的机制。方法:取大鼠31只,1只大鼠采用贴壁培养法分离大鼠骨髓间充质干细胞,利用相差显微镜观察细胞形态,Real-time PCR检测培养细胞表面分子量。30只大鼠采用链脲佐菌素腹腔注射构建糖尿病大鼠模型。根据处理方法不同分为对照组(n=15)和干细胞治疗组(n=15)。对照组大鼠采用胰岛素联合普罗布考治疗,干细胞治疗组植入干细胞治疗,治疗前、后检测2组大鼠空腹血糖、24 h尿蛋白排泄、肌酐清除率、肾重比体重;采用PAS染色观察2组肾组织情况;采用Western blot检测肾脏组织相关基因和蛋白水平。结果:原代骨髓间充质干细胞培养24 h后换液时可见细胞分布不均匀,在培养瓶呈分片聚集,形态不规则。培养7 d后细胞集落多,细胞规则,呈长梭形、椭圆形,折光性强,细胞间相互融合铺满瓶底;骨髓间充质干细胞传代培养后细胞形态均一,呈长梭形,轮廓清除,折光性强,生长迅速,部分细胞呈漩涡状;Real-time PCR检测结果显示:SH2、CD44、CD31呈阳性表达,CD34呈阴性表达;观察组治疗后空腹血糖、24 h尿蛋白排泄、肌酐清除率、肾重比体重,显著低于对照组(P<0.05);干细胞治疗组大鼠肾脏组织PAS染色结果显示:肾小球结构清晰,形态规则,肾小球内细胞排列规则,基底膜和包曼氏囊清晰。对照组大鼠肾小球体积增大,系膜区增宽,基质明显增多;干细胞治疗组治疗后Bcl-2蛋白水平得到显著提高,Bax和Caspase-3蛋白水平得到显著下降。对照组Bcl-2蛋白水平得到显著降低,Bax和Caspase-3蛋白水平得到提高(P<0.05)。2组治疗前氧化应激ROS、MDA、SOD指标差异无统计学意义(P>0.05);干细胞治疗组治疗后氧化应激ROS、MDA、SOD指标,低于对照组(P<0.05)。结论:利用贴壁培养法能分离大鼠骨髓间充质干细胞并利用绿色荧光蛋白进行体外标记,植入骨髓间充质干细胞能保护机体肾脏,抑制糖尿病肾脏的氧化应激反应。
糖尿病肾病;骨髓间充质干细胞;肾脏保护;相链脲佐菌素;PAS染色;Real-time PCR法;Western blot
糖尿病肾病(Diabetic nephropathy,DN)属于糖尿病主要微血管并发症,在糖尿病患者中具有较高的发病率和病死率。目前的治疗手段主要是严格控制血糖、血压,这些方法虽然能改善患者症状,但是不能消除DN的发生、发展[1]。因此临床上寻找积极有效地方法延缓甚至阻断DN进展的新治疗策略具有重要的意义。文献报道显示[2]:慢性炎症在DN的发生、发展中发挥重要的作用,而巨噬细胞则是介导肾脏炎症的关键炎症细胞。相关学者研究显示[3]:在糖尿病动物和糖尿病患者肾脏组织中均会出现巨噬细胞的明显增加,并且细胞数量与肾损伤的进展和肾功能的下降关系密切。因此,采取有效的措施直接或间接抑制巨噬细胞发生浸润能有效地防止或改善糖尿病肾脏损伤[4]。
氧化应激属于DN重要的发病机制,它主要由机体活性氧(Reactive oxygen species,ROS)成分产生增加,从而能引起抗氧化系统之家的平衡,当机体发生氧化应激时,容易造成机体中蛋白质、脂质、碳水化合物甚至DNA发生氧化[5]。在人体中糖是ROS产生的主要原料,机体持续高糖下能进一步诱导肾小球系膜细胞产生ROS,从而能引起TGF-β及细胞外机制蛋白水平上调,而外源性H2O2或由葡萄糖氧化酶连续催化引起的H2O2则能上调系膜细胞中的TGF-β及FN表达。因此,加强糖尿病患者血糖控制能降低氧化应激反应[6]。文献报道显示:降低机体内血糖水平能减少GLUT膜定位,从而能实现机体肾脏保护[7]。大量研究显示:间充质干细胞能降低机体血糖,减少尿蛋白,改善肾小球损伤。但是,其具体机制尚不完全知晓[8]。从间充质干细胞功能来说,细胞具有免疫调节功能,能有效地抑制T细胞增殖,从而能影响DC细胞功能,抑制B细胞的增殖和终末分化等[9]。研究结果显示:骨髓间充质干细胞作为免疫调节细胞在一系列疾病中发挥了重要作用[10]。但是骨髓间充质干细胞在糖尿病肾脏保护中的机制尚不完全知晓。
于2014年12月~2016年6月在河北医科大学第一医院实验,成功分离鉴定骨髓间充质干细胞并完成大鼠糖尿病模型建立,探讨骨髓间充质干细胞分离、鉴定方法及在糖尿病大鼠肾脏保护中的机制。
1 对象与方法
1.1 主要仪器和试剂 为了保证试验的顺利完成,采用的主要仪器和试剂主要有细胞培养超净台(美国Thermo Fisher)、移液器(德国Eppendorf公司)、离心机(德国Eppendorf公司)、倒置相差显微镜(日本Olympus公司)及DMEM/F12(美国Gibco公司)等。
1.2 方法
1.2.1 设计 细胞分离鉴定及动物对比试验。时间及地点:31只大鼠,雌雄随机,体重200~250 g,平均(231±6)g,所选动物均由河北医科大学第一医院动物实验中心提供。实验过程中对大鼠饲养、处理均符合《关于善待实验动物的指导下意见》相关规则[11]。31只大鼠中,1只用于骨髓间充质干细胞分离,根据处理方法不同分为对照组(n=15)和干细胞治疗组(n=15)。
1.2.2 骨髓间充质干细胞分离培养 ①骨髓间充质干细胞分离及原代培养:取1只大鼠,颈椎脱臼处死,采用浓度为75%乙醇进行10 min消毒,从股骨干、胫骨干两端间断,利用PBS完成骨髓腔冲洗,利用200目不锈钢过滤筛去除大块细胞后充分吹打制备细胞悬液[12]。采集细胞悬液将其转入15 ml离心管中进行5 min离心,速度1 000 r/min。向细胞悬液中加入浓度为10.0%FBS的α-MEM培养重悬,调整细胞密度1×106/cm2接种在25 cm2的培养瓶上,5%CO2,37℃下进行过夜培养,每2 d半量换液1次[13];②骨髓间充质干细胞传代培养。待细胞融合80.0%~90.0%时,去除培养基,采用 PBS进行3次冲洗,去除培养品中的混杂细胞,加入2 ml浓度为0.25%胰蛋白酶进行4 min消化,倒置显微镜下观察细胞形态,待细胞脱落时采用完全培养基终止反应,利用吸管吸取培养基细胞制备细胞悬液,转入15 ml离心管中,1 000 r/min 离心10 min,去除上层清夜,加入浓度为10.0%FBS的α-MEM培养重悬,根据1∶3比例进行传代培养,倒置显微镜下观察细胞形态[14]。
骨髓间充质干细胞鉴定:流式鉴定第三代骨髓间充质干细胞,用胰酶进行消化收集,细胞计数后根据1×106/管的密度分装到流式管中,采用PBS缓冲液进行2次冲洗,将获得的沉淀移入焦碳酸二乙酯处理过的Eppendorf管,采用Tsizol法提取细胞总RNA,逆转录合成cDNA,将cDNA作为模板,加入FITC标记的CD44、CD34、CD31及SH2标记的抗体标本,同时设置一管为空白对照组。采用PBS进行两次洗涤,10 min离心,速度为1 500 r/min,去除上层清夜,加入200 μl PBS吹打制备细胞悬液,对扩展产物进行1.2%的琼脂糖凝胶进行电泳,拍照[15]。糖尿病大鼠模型建立:本研究中共有30只大鼠参加糖尿病模型建立。入选大鼠均进行适应性喂养1周,禁食12 h后称重并经尾静脉采血测定基础血糖值,采用STZ用柠檬酸缓冲液进行溶解,根据25 mg/kg的剂量腹腔注射到大鼠中,STZ应事先溶解在pH4.2~4.5的柠檬酸缓冲液中,避光保存,配置后30 min内使用完毕,注射时必须速度要快。72 h后开始尾静脉采血测定大鼠血糖,连续测定3 d,对于测定血糖>16.77 mmol/L、IPGTT和HOMA-IR值提示大鼠存在胰岛素抵抗视为糖尿病大鼠造模成功。建模2周后,对照组大鼠采用胰岛素联合普罗布考治疗,干细胞治疗组植入干细胞治疗方法:经尾静脉注射1×106cm2骨髓间充质干细胞,每周注射1次,连续注射12周[16-17]。
1.2.3 观察指标 ①细胞形态。观察骨髓间充质干细胞原代形态及传代培养后细胞形态;②生化指标检测。每周检测2组空腹血糖、24 h尿蛋白排泄、肌酐清除率、肾重比体重。采用日立7600-020全自动生化分析仪及血糖测定仪检测空腹血糖、24 h尿蛋白排泄、肌酐清除率、肾重比体重[18]。③大体情况。观察2组大鼠大体情况,包括:症状、精神、反应等。④PAS染色。治疗12周后杀死大鼠,切片脱蜡,采用过碘酸水溶液进行10 min氧化,Schiff试剂染色30 min,流水清洗10 min,苏木精复染5 min,中性树胶封固,光镜下观察并拍照[19]。⑤肾脏组织相关基因和蛋白水平。从液氮中取出组织剪碎,加入裂解液,混合均匀后利用RT-PCR检测培养细胞表面分子Bcl-2蛋白、Bax和Caspase-3蛋白水平,相关操作步骤必须严格遵循仪器、试剂盒操作说明进行[20]。⑥氧化应激指标测定。观察2组大鼠治疗前、治疗后氧化应激ROS、MDA、SOD指标变化情况,采用ELISA法进行测定,血液采集后2 h内进行10 min 离心,速度3 000 r/min,相关操作步骤必须严格遵循仪器、试剂盒操作说明进行。
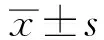
2 结果
2.1 实验动物数量分析 参加的30只大鼠,30大鼠全部进行结果分析数量,中途无脱落。
2.2 骨髓间充质干细胞原代形态学观察 原代骨髓间充质干细胞培养24 h后换液时可见细胞分布不均匀,在培养瓶呈分片聚集,形态不规则(图1A)。培养7 d后细胞集落多,细胞规则,呈长梭形、椭圆形,折光性强,细胞间相互融合铺满瓶底(图1B)。
骨髓间充质干细胞传代培养后细胞形态均一,呈长梭形,轮廓清除,折光性强,生长迅速,部分细胞呈漩涡状,见图2。

图1 骨髓间充质干细胞原代形态学观察(×100)Fig.1 Bone marrow mesenchymal stem cells in primary morphology (× 100)Note: A.Bone marrow mesenchymal stem cells cultured 24 h morphology;B.For bone marrow mesenchymal stem cells cultured 7 d cell morphology.

图2 传代后骨髓间充质干细胞形态(×100)Fig.2 Biography generations mesenchymal stem cell morphology (× 100)
2.3 骨髓间充质干细胞鉴定 利用RT-PCR检测培养细胞表面分子SH2、CD44、CD34、CD31表达情况,结果显示:SH2、CD44、CD31呈阳性表达,CD34呈阴性表达,见图3。
2.4 2组糖尿病大鼠大体情况 干细胞治疗组治疗后大鼠精神良好,反应敏捷,毛发光泽鲜艳,多食、多饮、多尿等症状得到改善;对照组大鼠表现为多食、多饮、多尿,精神萎靡,反应迟钝,伴有消瘦症状。
2.5 2组大鼠治疗前、后生化指标检测水平比较 2组治疗前空腹血糖、24 h尿蛋白排泄、肌酐清除率、肾重比体重差异无统计学意义(P>0.05);观察组治疗后空腹血糖、24 h尿蛋白排泄、肌酐清除率、肾重比体重,显著低于对照组(P<0.05),见表1。
2.6 2组大鼠氧化应激ROS、MDA、SOD指标比较2组治疗前氧化应激ROS、MDA、SOD指标差异无统计学意义(P>0.05);干细胞治疗组治疗后氧化应激ROS、MDA、SOD指标,低于对照组(P<0.05),见表2。

图3 细胞表面分子SH2、CD44、CD34、CD31表达情况Fig.3 Cell surface molecule SH2,CD44,CD34,CD31 expressionNote: 1.Blank control;2.β-actin;3.SH2;4.CD44;5.CD31;6.CD34.
2.7 2组大鼠PAS染色结果比较 干细胞治疗组大鼠肾脏组织PAS染色结果显示:肾小球结构清晰,形态规则,肾小球内细胞排列规则,基底膜和包曼氏囊清晰。对照组大鼠肾小球体积增大,系膜区增宽,基质明显增多,见图4。
2.8 2组大鼠肾脏组织相关基因和蛋白水平比较 干细胞治疗组治疗后Bcl-2蛋白水平得到显著提高,Bax和Caspase-3蛋白水平得到显著下降。对照组Bcl-2蛋白水平得到显著降低,Bax和Caspase-3蛋白水平得到提高(P<0.05),见图5。

图4 2组大鼠PAS染色结果(×200)Fig.4 2 groups of rats PAS staining(×200)Note: A.The result of PAS staining in renal tissue of rats treated with stem cells;B.The result of PAS staining in control group.


GroupsTimeGLU(mmol/L)24hurinaryalbuminexcretion(mg/d)Creatinineclearancerate[ml/(min·kg)]Kidneyweightthanweight(g/kg)StemcelltreatmentgroupBeforetreatment7.18±1.2210.31±0.836.14±1.057.01±1.02Aftertreatment6.19±1.31)2)6.36±0.591)2)4.04±0.951)2)6.12±0.981)2)ControlgroupBeforetreatment7.21±1.2910.29±0.796.15±1.117.03±1.03Aftertreatment6.93±1.412)8.42±0.912)5.24±1.252)6.57±1.022)
Note:Compared with the control group,1)P<0.05;compared with before treatment,2)P<0.05.


GroupsTimeROS(U/ml)MDA(nmol/ml)SOD(ng/ml)StemcelltreatmentgroupBeforetreatment493.91±141.816.80±2.12132.21±35.31Aftertreatment351.09±198.601)2)4.67±2.801)2)163.91±41.651)2)ControlgroupBeforetreatment475.21±121.576.78±2.11128.39±31.24Aftertreatment440.93±140.192)6.00±2.112)142.75±31.472)
Note:Compared with the control group,1)P<0.05;compared with before treatment,2)P<0.05.

图5 2组大鼠肾脏组织相关基因和蛋白水平比较Fig.5 Comparison of two groups of rats kidney tissue related genes and protein levels
3 讨论
骨髓间充质干细胞是一类特殊的细胞,除了具有参与构成血管微环境外,还具备多项分化潜能,在特定的条件下能分化为较多中胚层细胞、内胚层细胞等[21]。目前,对于骨髓间充质干细胞分离培养方法相对较多,如:贴壁法、密度梯度离心法、流式细胞仪分选法等,这些方法各有优缺点,均能获得一定浓度的骨髓间充质干细胞[22,23]。传统的贴壁筛选法获得的原代细胞虽然纯度较低,但是骨髓中可以分泌出滋养骨髓间充质干细胞的细胞因子,能促进肝细胞的生长[24]。本研究主要利用贴壁培养法能分离大鼠骨髓间充质干细胞,获得的原代骨髓间充质干细胞培养24 h后换液时可见细胞分布不均匀,在培养瓶呈分片聚集,形态不规则。培养7 d后细胞集落多,细胞规则,呈长梭形、椭圆形,折光性强,细胞间相互融合铺满瓶底,细胞传代培养后细胞形态均一,呈长梭形,轮廓清除,折光性强,生长迅速,部分细胞呈漩涡状。骨髓细胞主要分为两类,即:造血干细胞和骨髓间充质干细胞,而骨髓间充质干细胞占大部分[25]。由于骨髓间充质干细胞并非造血类细胞,因此细胞分离后不会在细胞表面表达相关抗原,如:CD14、CD11a、CD38等,但是骨髓间充质干细胞形态与骨髓中纤维细胞十分类似[26]。为了完成对细胞的鉴定,研究中采用RT-PCR检测培养细胞表面分子SH2、CD44、CD34、CD31表达情况,结果显示:SH2、CD44、CD31呈阳性表达,CD34呈阴性表达。由此看出:制备的细胞为骨髓间充质干细胞。
糖尿病肾病属于糖尿病中最为常见的微血管并发症,该疾病相对隐匿,起初主要以微量白蛋白为主。当机体微量白蛋白发生变化后将会引起肾脏受损,部分患者甚至出现蛋白外漏。患者临床上一旦发生蛋白尿时,肾功能将会出现急剧恶化并难以逆转,患者需要采用肾脏透析或肾移植等维持生命,增加患者家庭及社会经济负担[27]。从病理角度来说[28]:DN患者发病后主要表现为肾脏容积和体积的增大,导致肾小球率过滤升高,从而引起毛细血管基底膜增厚,最终演变为肾小球硬化,引起肾衰竭。本研究中,干细胞治疗组治疗后大鼠精神良好,反应敏捷,毛发光泽鲜艳,多食、多饮、多尿等症状得到改善;对照组大鼠表现为多食、多饮、多尿,精神萎靡,反应迟钝,伴有消瘦症状。目前,普遍认为引起DN细胞凋亡的途径有三种:死亡受体途径、内质网应激及线粒体途径。将骨髓间充质干细胞植入DN大鼠体内后将会抑制机体组织细胞发生凋亡,能抵抗多种形式的细胞死亡刺激,促进细胞生存,从而能实现对大鼠肾脏的保护[29]。本研究中,观察组治疗后空腹血糖、24 h尿蛋白排泄、肌酐清除率、肾重比体重,显著低于对照组(P<0.05)。由此看出:干细胞的植入能有效地抑制机体组织细胞的产生、增殖,充分发挥细胞刺激作用,能降低机体炎性反应,改善机体症状,缓解病情。
足细胞是构成肾小球滤过膜屏障的重要成分,相邻的足突之间又规则的指状交叉,并以裂孔膈膜相互连接,属于肾小球滤过的最后屏障。文献报道显示:DN在发生、发展过程中会引起足细胞凋亡、数目的减少,从而出现蛋白尿。由此看出:足细胞凋亡在DN的发生、发展中发挥了重要的作用。本研究中, 2组治疗前氧化应激ROS、MDA、SOD指标差异无统计学意义(P>0.05);干细胞治疗组治疗后氧化应激ROS、MDA、SOD指标,低于对照组(P<0.05)。当机体植入骨髓间充质干细胞后细胞能减少高糖对足细胞固有分子结构的损伤,能保护足细胞,从而能抑制Caspase-3蛋白活化,从而能发挥大鼠肾脏保护作用[30]。本研究中,干细胞治疗组大鼠肾脏组织PAS染色结果显示:肾小球结构清晰,形态规则,肾小球内细胞排列规则,基底膜和包曼氏囊清晰。对照组大鼠肾小球体积增大,系膜区增宽,基质明显增多;干细胞治疗组治疗后Bcl-2蛋白水平得到显著提高,Bax和Caspase-3蛋白水平得到显著下降。对照组Bcl-2蛋白水平得到显著降低,Bax和Caspase-3蛋白水平得到提高(P<0.05)。
综上所述,利用贴壁培养法能分离大鼠骨髓间充质干细胞,采用STZ一次性付清内注射建立糖尿病大鼠,并植入骨髓间充质干细胞能保护机体肾脏,降低其血糖,抑制糖尿病肾脏的氧化应激反应。
[1] Li D,Wang N,Zhang L,etal.Mesenchymal stem cells protect podocytes from apoptosis induced by high glucose via secretion of epithelial growth factor[J].Stem Cell Res Ther,2013,4(5):103.
[2] Guan JJ,Niu X,Gong FX,etal.Biological characteristics of human-urine-derived stem cells:potential for cell-based therapy in neurology[J].Tissue Eng(Part A),2014,20:1794-1806.
[3] 张创杰,张连峰,周 琳.自噬相关蛋白Beclin1、LC3和P62在进展期胰腺癌中的表达及临床意义[J]. 世界华人消化杂志,2015,35(2):318-323.
[4] Fu Y,Guan J,Guo S,etal.Human urine-derived stem cells in combination with polycaprolactone/gelatin nanofibrous membranes enhance wound healing by promoting angiogenesis[J].J Translational Med,2014, 12:274.
[5] Wang S,Li Y,Zhao J,etal.Mesenchymal stem cells ameliorate podocyte injury and proteinuria in a type 1 diabetic nephropathy rat model[J].Biol Blood Marrow Transplant,2013,19:538-546.
[6] 仇志富,吴晓光,祖炳学,等.补阳还五汤对脑出血模型大鼠脑组织 CXCR4-PI3K自噬信号传导通路及 Beclin-1 的影响[J].中国组织工程研究,2016,20(27):3992-3998.
[7] Qi S,Wu D.Bone marrow-derived mesenchymal stem cells protect against cisplatin-induced acute kidney injury in rats by inhibiting cell apoptosis[J].Int J Molec Med,2013,32(21):1262-1272.
[8] Vlassov AV, Magdaleno S,Setterquist R,etal.Exosomes: current knowledge of their composition,biological functions,and diagnostic and therapeutic potentials[J].Biochim Biophy Acta,2012, 1820(7):940-948.
[9] 范芳芳,霍 勇.高血压疾病防治的中国特点[J].中国实用内科杂志,2015,35(4):276-281.
[10] 李 萍,赵树明,胡亚男,等.脑出血发病机制研究进展[J].中华老年心脑血管病杂志,2015,17(2):214-215.
[11] Tan CC,Yu JT,Tan MS,etal.Autophagy in aging and neurodegenerative diseases:implications for pathogenesis and therapy[J].Neurobiol Aging,2013, 12(7):369-373.
[12] 关雪莲,侯丽淳,毕 胜,等.大鼠脑出血周边组织脑水含量、细胞凋亡和Bax表达的变化及粒细胞集落刺激因子的影响[J].中风与神经疾病杂志,2015,32(4):328-331.
[13] Datan E,Shirazian A,Benjamin S,etal.mTOR/p70S6K signaling distinguishes routine,maintenance-level autophagy from autophagic cell death during influenza A infection[J].Virology,2014,7(6):452-453.
[14] 李 俊,刘晓渝,江歌丽,等.自噬相关基因在乳腺癌ET方案新辅助化疗疗效预测中的作用[J].重庆医学,2015,44 (3):337-339.
[15] Yu YB,Duan JC,Yu Y,etal.Silica nanoparticles induce autophagy and autophagic cell death in HepG2 cells triggered by reactive oxygen species[J].J Hazard Mat,2014,8(12):252-257.
[16] 仇志富,吴晓光,丁 方.姜黄素对大鼠脑缺血损伤时脑组织PI3K/AKT信号通路、caspase-3表达的影响[J]. 湖北民族学院学报(医学版),2015,32(3):7-9.
[17] 仇志富,吴晓光,孟 杰,等.补阳还五汤提取物灌胃对脑出血大鼠脑组织中PI3K、AKT Caspase-3表达的影响[J].山东医药,2016,56(9):29-31.
[18] 庞月珊,罗 勇,谢宸宸.胸腺素β4通过提高Akt磷酸化促进局灶脑缺血/再灌注大鼠大脑皮质eNOS和CD31表达[J].基础医学与临床,2014,34(7):921-926.
[19] 徐慧敏,刘玉茹,万琪琳,等.PTEN 基因沉默骨髓间充质干细胞移植治疗急性心肌梗死[J].中国组织工程研究,2016,20(23):3400-3406.
[20] Alessio N,Bohn W,Rauchberger V,etal.Silencing of RB1 but not of RB2/P130 induces cellular senescence and impairs the differentiation potential of human mesenchymal stem cells[J].Cell Mol Life Sci,2013,70(9):1637-1651.
[21] Kotini AG,Mpakali A,Agalioti T.Dnmt3a1 upregulates transcription of distinct genes and targets chromosomal gene clusters for epigenetic silencing in mouse embryonic stem cells[J].Mol Cell Biol,2011, 31(7):1577-1592.
[22] Ackermann M,Lachmann N,Hartung S,etal.Promoter and lineage independent anti-silencing activity of the A2 ubiquitous chromatin opening element for optimized human pluripotent stem cell-based gene therapy[J].Biomaterials,2014,35(5):1531-1542.
[23] 刘家良,华 平,杨淞然,等.沉默caspase-3基因影响骨髓间充质干细胞的增殖和凋亡[J].中国组织工程研究,2013,17(14):2480-2487.
[24] 张 伟,刘雪芹,苗 苗,等,20S蛋白酶体β5亚单位基因沉默对人骨髓间充质干细胞增殖能力的影响[J].解剖学杂志,2015,38(2):153-156.
[25] Jägle S,Rönsch K,Timme S,etal.Silencing of the EPHB3 tumor-suppressor gene in human colorectal cancer through decommi-ssioning of a transcriptional enhancer[J].Proc Natl Acad Sci U S A,2014,111(13):4886-4891.
[26] Moniri MR.TRAIL-engineered pancreas-derived mesenchymal stem cells:characterization and cytotoxic effects on pancreatic cancer cells[J].Cancer Gene Ther,2012,19(9):652-658.
[27] 李丽丽,王巧燕,代克强,等.人脐带间充质干细胞的分离、培养及其肝细胞生物学特性分析[J].郑州大学学报(医学版),2015,50(2):187-191.
[28] 刘建平,朱 静,田 杰,等.肿瘤微环境中过表达的IL-6对大鼠间充质干细胞恶性转化的影响[J].解放军医学杂志,2012,37(10):930-934.
[29] 任莉莉,陈丽娟,齐 晖,等.胎胰蛋白促进人脂肪来源的间充质干细胞向胰岛素及C-肽阳性细胞的分化及细胞鉴定[J].吉林大学学报(医学版),2013,39(1):19-24.
[30] Hao H,Liu J,Shen J,etal.Multiple intravenous infusions of bone marrow mesenchymal stem cells reverse hyperglycemiaB in experimental type 2 diabetes rats[J].Biochem Biophys Res Commun,2013,436(3):418-423.
[收稿2016-10-27 修回2016-12-07]
(编辑 许四平)
Mesenchymal stem cell isolation,identification and protection mechanism in kidney of diabetic rats
KANGYan,LIZhi-Jie,WANGLi-Na,GUOYu-Qing,LIUPan,ZHANGJie.
TheFirstAffiliatedHospitolofHebeiMedicalUniversity,Shijianzhuang05031,China
Objective:To observe the bone marrow mesenchymal stem cell isolation,identification methods and protection mechanisms in the kidney of diabetic rats.Methods: Thirty-one rats were used to isolate bone marrow mesenchymal stem cells (BMSCs) by adherent culture method.Cell morphology was observed by phase contrast microscope.The surface molecular weight of cultured cells was detected by Real-time PCR.30 rats were induced by intraperitoneal injection of streptozotocin to establish diabetic rat model (n=15).And stem cell treatment group (n=15) according to the different treatment methods.Rats in the control group were treated with insulin combined with probucol.Stem cell treatment group was implanted with stem cells.Before and after treatment,fasting blood glucose,24 h urinary protein excretion,creatinine clearance rate and kidney weight were measured.PAS staining.And the renal tissue was detected by Western blot.Results: The primary bone marrow mesenchymal stem cells (MSCs) were cultured for 24 hours,and the cells were irregularly distributed in the culture flask.After 7 days of culture,the cells were regular,elongated,elliptical,and strong refraction,and the cells were fused with each other.The morphology of BMSCs was uniform and showed a long fusiform shape,CD44,CD31 and CD34 were observed by RT-PCR.The levels of fasting blood glucose,24 h urine protein excretion and creatinine clearance rate in the observation group were significantly higher than those in the control group (P<0.05).The results of PAS staining showed that the glomerular structure was clear,the morphology was regular,the arrangement rules of glomerular cells,the basement membrane and the encapsulation of the glomerular membrane were significantly higher than those of the control group Man′s capsule clear (P<0.05).In the control group,the glomerular volume increased,the mesangial area widened and the stroma increased significantly.The Bcl-2 protein level and the Bax and Caspase-3 protein levels were significantly decreased in the stem cell treatment group.The levels of Bcl-2 and Bax and Caspase-3 protein in the control group were significantly decreased (P<0.05).The ROS,MDA and SOD levels in oxidative stress group were lower than those in control group (P<0.05).The difference of ROS,MDA and SOD between the two groups was not statistically(P>0.05).Conclusion: It is suggested that BMSCs can be isolated from rat bone marrow mesenchymal stem cells by using adherent culture method and labeled with green fluorescent protein in vitro.Bone marrow mesenchymal stem cells can protect the kidney and inhibit the oxidative stress of diabetic kidney.
Diabetic nephropathy;Bone marrow mesenchymal stem cells;Renal protection;Streptozotocin;PAS staining;Real-time PCR;Western blot
10.3969/j.issn.1000-484X.2017.05.008
康 岩(1983年-),女,硕士,主治医师 ,主要从事糖尿病并发症方面的研究。
R392
A
1000-484X(2017)05-0673-06
①本文为河北省卫生厅重点科技研究计划(160211K102)。

