碱性成纤维生长因子对大鼠成肌细胞氧化应激损伤的作用及其机制*
毛挺挺, 方红波, 王晓慧, 潘莹莹, 谢浩煌, 张宏宇, 肖 健, 姜丽萍
(1. 宁波市医疗中心李惠利东部医院, 浙江 宁波 315000; 2. 温州医科大学, 浙江 温州 325035;3. 上海交通大学附属新华医院, 上海 200092)
碱性成纤维生长因子对大鼠成肌细胞氧化应激损伤的作用及其机制*
毛挺挺1, 方红波1, 王晓慧2, 潘莹莹2, 谢浩煌2, 张宏宇2, 肖 健2, 姜丽萍3△
(1. 宁波市医疗中心李惠利东部医院, 浙江 宁波 315000; 2. 温州医科大学, 浙江 温州 325035;3. 上海交通大学附属新华医院, 上海 200092)
目的:探讨碱性成纤维生长因子(bFGF)下调氧自由基水平在大鼠成肌细胞氧化应激中的保护作用。方法:采用对数生长期大鼠成肌细胞,随机分为四组(n=6):正常对照组(control),单纯bFGF组(bFGF),氧化应激组(H2O2),干预组(bFGF+H2O2)。氧化应激组采用含100 μmol/L H2O2的培养基继续孵育4 h。免疫组化检测B淋巴细胞瘤-2基因(Bcl-2)阳性沉积颗粒;免疫荧光观察活性氧自由基(ROS)水平、Bcl-2、B淋巴细胞瘤-2基因相关X蛋白(Bax)及细胞色素C (Cyt.C)表达;Western blot检测Cyt.C、聚腺苷二磷酸核糖聚合酶(PARP)蛋白表达情况。结果:与正常组比较,氧化应激组成肌细胞Bcl-2表达降低,ROS、Cyt.C表达显著增加(P<0.05)。与氧化应激组比较,bFGF干预后的成肌细胞Bcl-2表达增加,ROS及Cyt.C表达减少(P<0.05)。结论:bFGF对成肌细胞氧化应激具有保护作用,其机制可能与bFGF下调氧自由基水平、Bcl-2蛋白增加、Cyt.C表达减少有关。
压疮深部组织损伤;氧化应激;大鼠成肌细胞;bFGF
【DOI】 10.12047/j.cjap.5446.2017.040
压疮深部组织损伤(deep tissue injury,DTI)好发于受压骨隆突处,为压疮中最为恶性分型,亦是临床护理重难点[1]。此类压疮以皮肤深部组织肌层损伤为特点,局部持续受压时,血流灌注受阻,产生大量自由基造成肌细胞损伤。研究表明[2,3]相比
单纯压力性损伤,缺血再灌注损伤对压疮深部组织损伤的形成更为重要,反复再灌注中加剧的自由基可使压疮深部肌细胞在短时间内发生凋亡。过氧化氢(H2O2)为典型的活性氧自由基,同机体氧化应激主要成分一致,目前已见于体外DTI研究之中[4]。碱性成纤维生长因子(basic fibroblast growth factor,bFGF)是一种多能细胞生长因子,对多种损伤效果确切,已广泛用于多种外伤治疗中,尚未见相关体外DTI的研究,因此探讨bFGF调控成肌细胞氧化应激作用及其相关蛋白表达,或许可以深入了解深部组织损伤机理,为其防治提供新视野。
1 材料与方法
1.1 大鼠成肌细胞的培养及分组
大鼠成肌细胞购自中国科学院上海生科院细胞资源中心,采用1%青/链霉素及10%胎牛血清的高糖DMEM培养液,置细胞培养箱(37℃,5% CO2)进行常规培养,2~3 d传代1次,待生长至对数期时,分为4组(n=6):正常对照组(control):正常培养的大鼠成肌细胞,未做任何处理,培养时间同其他组;单纯bFGF组(bFGF):取对数生长期成肌细胞,提前2 h加入终浓度为100 ng/ml的bFGF,继续培养4 h;氧化应激组(H2O2):取对数生长期成肌细胞,加入终浓度为100 μmol/L的H2O2,继续培养4 h;干预组(bFGF+H2O2):取对数生长期成肌细胞,提前2 h加入终浓度为100 ng/ml bFGF,其后加入终浓度为100 μmol/L的H2O2继续培养4 h。
1.2 主要试剂
bFGF由温州生物与天然药物研究所提供,H2O2购自Sigma公司;胎牛血清、胰蛋白酶、青/链霉素、DMEM高糖基础培养基均为Gibco公司产品;Hoechst 33258,活性氧自由基检测试剂盒购自碧云天生物科技有限公司;兔多克隆抗体B淋巴细胞瘤-2基因(B-cell lymphoma-2, Bcl-2 sc-492)、B淋巴细胞瘤-2基因相关X蛋白(Bcl-2 associated X protein, Bax sc-493),鼠多克隆抗体细胞色素C(Cytochrome C,Cyt.C sc-13156)、聚腺苷二磷酸核糖聚合酶(Poly ADP-ribose polymerase,PARP sc-7150)及实验中所用的二抗羊抗鼠IgG-辣根过氧化物酶(HRP)、羊抗兔IgG- HRP、驴抗兔IgG-FITC(异硫氰酸荧光素),驴抗鼠IgG-PE(藻红蛋白)均由Santa Cruz公司提供。
1.3 主要检测方法
1.3.1 成肌细胞中ROS表达检测 取各组细胞避光加入活性氧自由基荧光探针,置细胞培养箱中继续孵育15 min。PBS清洗3次以除去未进入细胞内荧光探针更换完全培养基,倒置荧光显微镜下观察各组细胞氧化应激水平。
1.3.2 免疫组化检测Bcl-2表达 采用链霉亲和素-生物素复合物法(strept avidin-biotin complex, SABC),4%多聚甲醛固定,3% H2O2-甲醇溶液抑制内源性过氧化物酶,5% BSA封闭30 min,Bcl-2一抗浓度均为1∶200,常规设立阴性对照(用PBS代替一抗),于4℃冰箱过夜。滴加1∶1 000稀释的二抗,置于37℃恒温箱孵育2 h。PBS洗去未结合抗体,DAB显色,苏木素染核,干燥后中性树胶封片,镜下阳性结果为棕黄色颗粒沉积。
1.3.3 免疫荧光检测Cyt.C等蛋白表达情况 4%多聚甲醛4℃固定,Triton X-100静置15 min后,5% BSA室温封闭15 min,滴加1∶200稀释的Bcl-2、Bax、Cyt.C一抗,4℃过夜。PBS 3次5 min洗去未结合抗体,避光滴加1∶300稀释的荧光二抗,黑色湿盒内37℃孵育1 h。Hoechst 复染7 min,PBS清洗3次5 min,滴加抗荧光淬灭剂并封片。荧光显微镜下随机选取3个高倍视野(×400),采用Image-Pro Plus图像分析软件处理图片,统计任意单位内平均荧光亮度。
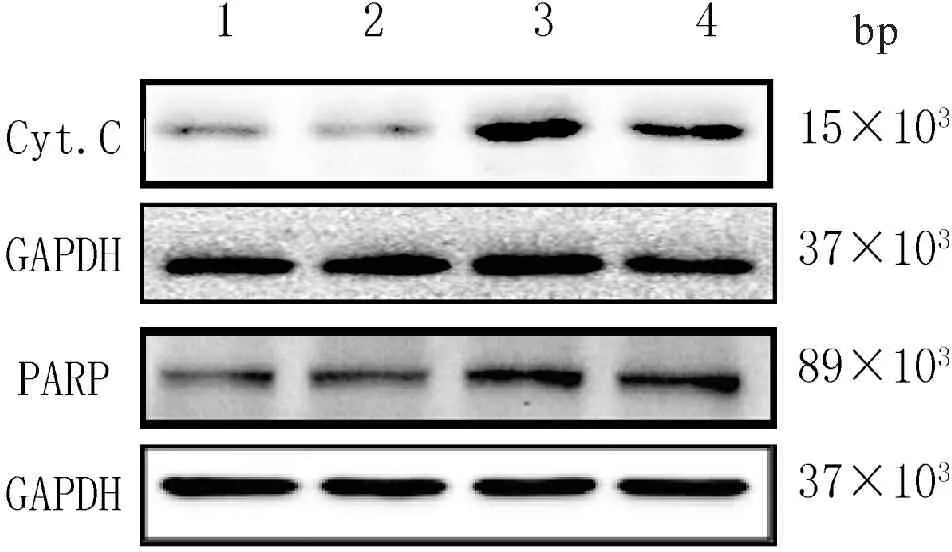
1.3.4 蛋白免疫印迹检测Cyt.C、PARP蛋白表达 收集不同批次肌细胞,加裂解液后刮取蛋白液,离心取上清,采用考马斯亮蓝测定蛋白浓度。通过SDS-PAGE 电泳分离蛋白后电转至PVDF膜上。5%脱脂奶粉封闭1.5 h,TBST 3×7 min洗去脱脂奶,鼠多克隆Cyt.C、PARP、GAPDH抗体4℃摇床孵育过夜,TBST洗膜3×7 min,HRP标记IgG二抗(1∶5 000) 室温孵育1 h,最后加入ECL显色液于凝胶成像仪器曝光。GAPDH作为内参照,实验重复3次。运用Quantity one凝胶图像分析系统对结果进行灰度扫描,统计各蛋白相对灰度值。
1.4 统计学处理

2 结果
2.1 各组成肌细胞中ROS的水平
正常对照组及单纯bFGF组成肌细胞ROS荧光强度较弱。氧化应激组在H2O2刺激4 h 后,成肌细胞ROS荧光呈强阳性表达,细胞质明显收缩,突触变短。与应激组相比,干预组预给bFGF 2 h显著下调氧化应激强度 (图1,表1) 。

Fig. 1 ROS of myoblasts induced by 100 μmol/L hydrogen peroxide post 4 hours(×400) A: Control; B: bFGF; C: H2O2; D: bFGF+H2O2; bFGF: Basic fibroblast growth factor; ROS: Reactive oxygen species
2.2 bFGF对成肌细胞Bcl-2表达的影响
Bcl-2免疫阳性产物为棕黄色颗粒,主要位于胞浆。正常对照组及单纯bFGF组成肌细胞可见胞质内含有大量Bcl-2阳性颗粒;氧化应激组Bcl-2阳性细胞数锐减;干预组采用bFGF预处理2 h,可见Bcl-2阳性颗粒增多,细胞损伤减小(图2,表1)。
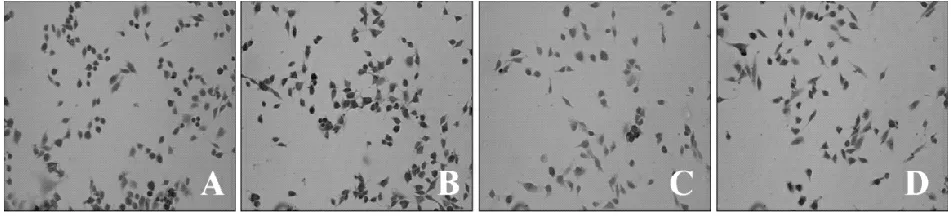
Fig. 2 Immunohistochemistry for Bcl-2 (×200) A: Control; B: bFGF; C: H2O2; D: bFGF+H2O2; Bcl-2: B-cell lymphoma-2
2.3 bFGF对成肌细胞Cyt.C表达的影响
免疫荧光检测结果可见:正常对照组及单纯bFGF组Cyt.C荧光较弱。氧化应激组Cyt.C荧光明显增强,同时胞外存在红色弥漫性荧光颗粒。干预组胞Cyt.C荧光局限于胞质内且荧光颗粒染色较浅,预给bFGF能够稳定Cyt.C并减少胞外释放量(图3)。
2.4 bFGF对成肌细胞Cyt.C和PARP表达影响
结果可见:正常对照组及单纯bFGF组Cyt.C,PARP蛋白表达较少,氧化应激组Cyt.C,PARP蛋白表量明显增加。预给bFGF 2小时,氧化应激中成肌细胞Cyt.C及PARP表达量下调。(图4,表1)
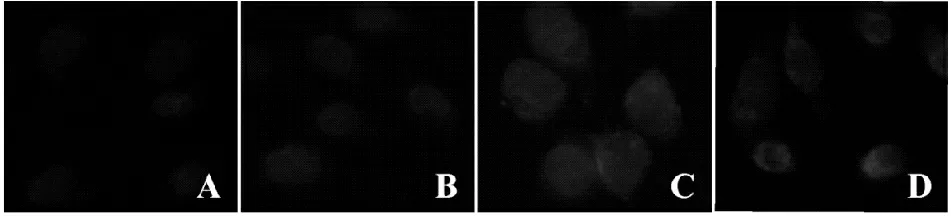
Fig. 3 Immunofluorescence expression of Cyt.C post 4 hours (×400) A: Control; B: bFGF; C: H2O2; D: bFGF+H2O2; Cyt.C: Cytochrome C

Tab. 1 Relative expression for ROS,Cyt.
Con: Control; ROS: Reactive oxygen species; Cyt.C: Cytochrome C; PARP: Poly ADP-ribose polymerase; Bcl-2: B-cell lymphoma-2; Bax: Bcl-2 associated X protein
**P<0.01vsCon;?#P<0.05,##P<0.01vsH2O2
3 讨论
压疮为临床护理质控重点部分,压疮分期中以DTI最为严重。研究表明[5],压疮并非急性高压力性损伤,而是由间歇性较低压力重复作用造成局部不完全缺血再灌注损伤。作为与在体研究互补的细胞水平,具有分离分析氧化应激对肌细胞损伤的优点,能够在微观水平实时监测分析bFGF对肌细胞氧化应激性损伤作用,亦可开拓压疮深部组织损伤研究思路。
当前体外细胞氧化应激模型可有单纯缺氧模型及过氧化氢刺激性模型等,缺氧模型在一定程度上也能产生氧自由基。研究发现[6,7],缺血再灌注造成大鼠压疮肌肉组织病变比单纯缺血缺氧损伤更为严重,丙二醛、乳酸脱氢酶等指标皆显著高于同期缺血组。氧化应激造成压疮深部组织损伤产生为缺血基础上不完全再灌注的反复发生,单单缺氧尚不能产生DTI。过氧化氢[8]作为氧化应激典型活性氧自由基,为机体细胞氧化应激的主要成分,目前外源性双氧水引起损伤过程同体内反应相似,在体外氧化应激应用中最为普遍。我们前期已应用不同浓度H2O2及多个时间点发现100 μmol/L浓度以下的H2O2在2 h内具有促细胞增殖效应,而此浓度以上的肌细胞2 h后表现为应激性损伤,其损伤与过氧化氢浓度具有量效关系。因此,100 μmol/L H2O2浓度可能是体外肌细胞损伤阈值,至4 h细胞活性降至75%可作为本研究应激组[4]。
Tai等[9]研究表明真核动物在正常生理状态下仍会生成少量氧自由基作为介导生命活动的信号。应激组肌细胞自由基荧光呈强阳性表达,细胞皱缩,突触变短。相比应激组,结果显示bFGF干预的成肌细胞氧自由基表达下调具有统计学意义,提示bFGF缓解肌细胞损伤与其下调氧自由基过程相关。
目前认为机体90%以上的氧自由基皆来自线粒体,线粒体作为机体氧化磷酸化的最主要部位,正常条件下处于稳态状态,当发生氧化应激时,线粒体为自由基攻击,致使功能受损,发生细胞凋亡[10]。文献表明[11,12],Bcl-2抗凋亡基因家族对ROS的调节最为重要,Bcl-2拮抗应激过程中Bax凋亡蛋白,通过与Bax相互作用形成异源性多聚体调节线粒体通道孔隙,从而抑制凋亡发生。本实验正常成肌细胞及单纯给予bFGF的成肌细胞组较少表达Bax,在氧化应激过程中存在Bax激增现象,同沈王月等[13]研究报道一致,推测过多生成的Bax蛋白形成同源聚合体是启动肌细胞凋亡的重要因素。bFGF干预的肌细胞呈现Bcl-2蛋白水平上调,Bax蛋白表达下降现象,在一定程度上提示bFGF保护大鼠成肌细胞的作用可能与上调Bcl-2/Bax比值有关。
Cyt.C位于线粒体内膜外侧,当氧化应激发生时,促使细胞色素C释放进入胞浆,成为触发细胞凋亡的关键环节[14]。Kuwana等[15]研究发现重组Bax可以独自从完整脂质体中释放出用荧光标记的细胞色素C蛋白,且计算结果显示该通道是由4个Bax分子组成,它的直径正好使细胞色素C分子通过。Marsden等[16]进一步发现,在哺乳动物细胞质中,Cyt.C可在三磷酸腺苷(ATP)作用下结合凋亡蛋白激活因子形成复合物,最终激活特定凋亡蛋白酶诱发细胞凋亡。PARP作为细胞凋亡核心蛋白半胱氨酸蛋白酶(caspase)的切割底物,在DNA损伤修复与细胞凋亡中发挥着重要作用。研究显示[17],高度活化的PARP可反向加剧自由基生成,增加氧化应激水平。本实验氧化应激组成肌细胞细胞色素C免疫荧光外漏呈片状弥漫性分布,细胞凋亡水解产物PARP表达急剧增高。bFGF干预的成肌细胞,胞质内Cyt.C红色荧光颗粒分布均匀,染色较浅,PARP表达尚处较低水平,这与朱宇麟等[18]报道积极干预可减弱线粒体透性转换孔(MPTP)开放强度,细胞色素C释放下降,细胞凋亡减少的结果相似。
综上所述,本研究在体外细胞水平初步探讨了bFGF对大鼠成肌细胞氧化应激损伤的保护作用及其机制,或许可为压疮深部组织损伤提供新的防治思路。
[1] Loerakker S, Manders E, Strijkers GJ,etal. The effects of deformation, ischemia, and reperfusion on the development of muscle damage during prolonged loading[J].JApplPhysiol, 2011, 111(4 ): 1168-1177.
[2] Jiang LP, Tu Q, Wang Y,etal. Ischemia-reperfusion injury-induced histological changes affecting early stage pressure ulcer development in a rat model[J].OstomyWoundManage, 2011, 57(2): 55-60.
[3] 潘莹莹, 高歌心, 谢浩煌, 等. TNF-α、NF-κB在大鼠压疮深部组织损伤中的表达及其对细胞凋亡作用[J]. 中国应用生理学杂志, 2013, 29(5): 441-445.
[4] 毛挺挺, 王晓慧, 谢浩煌, 等. 大鼠骨骼肌细胞氧化应激损伤实验研究[J]. 护理学杂志, 2015, 30(20): 57-60.
[5] Peirce SM, Skalak TC, Rodeheaver GT. Ischemia-reperfusion injury in chronic pressure ucler formation: a skin model in the rat[J].WoundRepairRegengeration, 2000, 8(1): 68-76.
[6] 蔡福满, 姜丽萍, 杨晔琴, 等. 褥疮不完全性缺血再灌注损伤简易模型的建立[J]. 中国病理生理杂志, 2009, 25(4): 830-832.
[7] 杨晔琴, 姜丽萍, 蔡福满, 等. Lipo-PGE1对大鼠缺血-再灌注损伤压疮模型的干预作用[J]. 护理学杂志, 2007, 22(17): 10-12.
[8] Tinti F, Soory M. Oxidative actions of hydrogen peroxide in human gingival and oralperiosteal broblasts:responses to glutathione and nicotine, relevant to healing in a redox environment[J].RedoxBiol, 2013, 2: 36-43.
[9] Tai P, Ascoli M. Reactive oxygen species(ROS) play a critical role in the cAMP-induced activation of Ras and the phosphorylation of the ERK1/ 2 in Leydig cells[J].MolEndocrinol, 2011, 25(5): 885-893.
[10]Murphy MP. How mitochondria produce reactive oxygen species[J].BiochemJ, 2009, 417(1): 1-13.
[11]Gogada R, Prabhu V, Amadori M,etal. Resveratrol induces p53-independent, X-linked inhibitor of apoptosis protein (XIAP)-mediated Bax protein oligomerization on mitochondria to initiate cytochrome c release and caspase activation[J].JBiolChem, 2011, 286(33): 28749-28760.
[12]王艳艳, 姜丽萍, 张纯瑜, 等. 凋亡相关蛋白Bcl-2与Bax在早期压疮组织中的作用[J]. 中华烧伤杂志, 2011, 27(3): 197-199.
[13]沈 王月, 严玉澄, 路丽明, 等. H2O2抑制小鼠肾小管上皮细胞Klotho的表达[J].中国肾脏病杂志, 2015, 31(8): 598-603.
[14]冯 红, 刘 卫, 战 锐, 等. NGFI-B在应激损伤心肌细胞中的亚细胞定位及其生物学效应[J]. 中国应用生理学杂志, 2011, 27(3): 289-293.
[15]Kuwana T, Mackey MR, Perkins G,etal. Bid, Bax and lipids cooperate to form supramolecular openings in the outer mitochondrial membrane[J].Cell, 2002, 111(3): 331-342.
[16]Marsden VS, Kaufmann T, O'Reilly LA, et al. Apaf-1 and caspase-9 are required for cytokine withdrawal-induced apoptosis of mast cells but dispensable for their functional and clonogenic death[J].Blood, 2006, 107(5): 1872-1877.
[17]Schriewer JM, Peek CB, Bass J,etal. ROS-mediated PARP activity undermines mitochondrial function after permeability transition pore opening during myocardial ischemia-reperfusion[J].JAmHeartAssoc, 2013, 2(2): 1-15.
[18]朱宇麟, 李 静, 吕 毅, 等. 缺血后处理对大鼠肝缺血再灌注时肝细胞线粒体膜通透性转换和膜电位的影响[J]. 中华麻醉学杂志, 2011, 3l(3): 364-367.
*【基金项目】国家自然科学基金资助项目(81260111);内蒙古医科大学中青年人才团队项目(NYTD-2015003)
Effects and mechanism of bFGF on rat myoblast oxidative injury induced by hydrogen peroxide
MAO Ting-ting1, FANG Hong-bo1, WANG Xiao-hui2, PAN Ying-ying2, XIE Hao-huang2,ZHANG Hong-yu2, XIAO Jian2, JIANG Li-ping3△
(1. Ningbo Medical Center Lihuili Eastern Hospital, Ningbo 315000; 2. Wenzhou Medical University, Wenzhou 325035;3. Xinhua Hospital Affiliated to Shanghai Jiaotong University, Shanghai 200092, China)
Objective: To explore the protective role of basic fibroblast growth factor (bFGF) on attenuating hydrogen peroxide-induced injury in cultured rat myoblasts. Methods: Cultured rat myoblasts at growth phase were randomly divided into four groups (n=6): control group (control), bFGF group (bFGF), model group(H2O2) and the treatment group (bFGF+H2O2). Model group was treated with 100 μmol/L hydrogen peroxide for 4h. B-cell lymphoma-2 (Bcl-2) positive particles were detected by immunohistochemistry; Reactive oxygen species (ROS) and expression for Bcl-2 associated X protein (Bax), Bcl-2 and Cytochrome C (Cyt.C) fluorescence were observed under the invented microscope; Cyt.C and Poly ADP-ribose polymerase(PARP)protein were assessed by Western blot. Results: Compared with control group, the myoblats in the model group showed low expression of Bcl-2 positive particles, accompanied by high expression of ROS level and Cyt.C fuorescence (P<0.05); Compared with model group, bFGF enhanced Bcl-2 activity of the myoblasts, and significantly downregulated Cyt.C and PARP expression (P<0.05). Conclusion: bFGF could attenuate oxidative injury of rat myoblasts induced by hydrogen peroxide, which mechanism might be related to enhanced Bcl-2 and reduced ROS, Cyt.C levels.
pressure ucler; deep tissue injury; oxidative stress; rat myoblasts; bFGF
国家自然科学基金(81372064);上海市教委护理高原学科建设资助项目
2016-04-11
2016-11-22
R363.2; R471
A
1000-6834(2017)02-159-05
△【通讯作者】Tel: 13868311990; E-mail: ljpingj@shsmu.edu.cn

