壳寡糖对病理性卵巢衰退小鼠免疫功能和生殖功能的作用*
李小燕, 曹 璇, 刘心悦, 叶海峰, 苏 铁, 郑拓晨, 毛 自, 郑月慧△
(1. 南昌大学医学院实验教学部, 2. 江西省生殖生理与病理重点实验室, 南昌 330031)
壳寡糖对病理性卵巢衰退小鼠免疫功能和生殖功能的作用*
李小燕1, 曹 璇1, 刘心悦1, 叶海峰1, 苏 铁1, 郑拓晨2, 毛 自2, 郑月慧1△
(1. 南昌大学医学院实验教学部, 2. 江西省生殖生理与病理重点实验室, 南昌 330031)
目的:探讨壳寡糖促进病理性卵巢功能衰退小鼠生殖功能和免疫功能恢复的可能性。方法:选用43只生育旺盛期雌性小鼠,除正常对照组(n=8)外,其它通过白消安/环磷酰胺构建病理性卵巢功能衰退模型模拟卵巢功能早衰,随机选取3只,卵巢切片HE染色观察卵泡情况以判断不孕模型。构建成功后将余下32只随机平均分为4组(n=8),经不同剂量壳寡糖(0,100,200,300 mg/(kg·d))灌胃后,比较组间卵巢、脾脏、胸腺脏体比的变化,观察卵泡情况、检测腹腔巨噬细胞吞噬能力、外周血雌二醇(E2)及孕酮(P)水平,检测卵巢生殖上皮细胞中生殖细胞标志物小鼠血管同源物(MVH)、干细胞标志物OCT-4以及卵巢中免疫因子肿瘤坏死因子α(TNF-α)、白介素-2(IL-2)、白介素-6(IL-6)表达量的变化,并分析生殖干细胞标记物表达水平变化与免疫因子表达水平变化的相关关系。结果:随壳寡糖灌胃剂量的增加,卵巢、脾脏和胸腺脏体比同步增高;卵巢中总卵泡数及各级卵泡数都呈递增趋势;外周血E2水平递增,P水平呈递减趋势;腹腔巨噬细胞吞噬功能随剂量增高而增强;生殖干细胞标记物和免疫因子的表达水平均呈显著递增趋势,表明生殖干细胞标记物的表达水平与免疫因子表达水平的变化呈显著的正相关关系(P<0.05)。结论:壳寡糖可改善病理性卵巢功能早衰小鼠的免疫功能,促进雌性生殖干细胞增殖、分化,从而促进卵巢病理性早衰机体生殖功能在一定程度上的恢复。
壳寡糖;免疫;卵巢功能早衰;雌性生殖干细胞;卵巢功能重塑
【DOI】 10.12047/j.cnki.5457.2017.025
卵巢功能早衰(premature ovarian failure, POF)是指曾有自然月经周期的女性在40岁之前出现卵巢萎缩性持续闭经的一种疾病,其低雌激素水平可导致围绝经期相关症状的出现,常并发无排卵性不孕,严重影响女性的身心健康[1]。近年来,POF的发病率呈逐年上升趋势,并逐渐呈年轻化倾向[1, 2]。如何有效地预防及治疗卵巢功能早衰已成为全球瞩目的热点问题。近年来的研究证实,雌性哺乳动物在出生后仍具备生产生殖细胞的能力,即在出生后的哺乳动物卵巢内存在一定数量的卵巢生殖干细胞(ovarian germline stem cells,OGSCs)或雌性生殖干细胞(female germline stem cells,FGSCs),并认为卵巢功能衰退是由于卵巢上皮(ovarian surface epithelia, OSE)产生的FGSCs未能增殖分化形成卵子以补充各种原因导致的卵泡衰减所致[3-5]。FGSCs增殖、分化调控的机理尚不明确。已有研究表明,机体免疫功能与卵巢功能息息相关。在人类妊娠中期,胎儿组织细胞的增殖、分化就已经受到机体自淋巴(免疫)系统的调控[6];先天胸腺缺陷小鼠由于原始卵泡数的减少,在两月龄时卵泡缺失已非常明显,且在四月龄就停止排卵[7]。近年来有研究者认为,免疫因子和免疫细胞能影响FGSCs和颗粒细胞的形成、增殖、分化及原始卵泡的发生[8]。由此推测,通过免疫增强剂增强机体免疫功能,增加相关免疫细胞的生成及免疫因子的分泌,能通过调控FGSCs增殖、分化,促进卵巢卵泡发生,使卵巢功能早衰患者恢复排卵,恢复生殖功能。壳寡糖(chitosan oligosaccharide,COS)是天然糖中唯一大量存在的碱性氨基寡糖,水溶性好、安全无毒、生物活性高、易被人体吸收,被广泛认为是一种极具利用价值和利用可能的免疫增强剂[9,10]。
本文以生育旺盛期小鼠受药物环磷酰胺/白消安(cyclophosphamide/busulfan, C/B)影响形成病理性卵巢功能衰退模型为研究对象,以壳寡糖梯度剂量灌胃治疗,观察阶段性治疗后免疫器官脏体比、卵巢脏体比组间差异,卵巢卵泡生长发育情况,腹腔巨噬细胞吞噬功能,小鼠外周血雌、孕激素水平,OSE中生殖干细胞标记物及免疫因子表达水平,为探讨壳寡糖是否能通过增强机体免疫力从而促进卵巢干细胞的增殖、分化继而恢复病理性衰退卵巢功能提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 2月龄生育旺盛期的昆明种雌性小鼠43只,体重约25~30 g,由南昌大学医学院动科部提供。规律光照、恒温恒湿、充足食物与水适应性喂养。
1.1.2 主要药品及试剂 COS购自大连中科格莱克生物科技有限公司,纯度>90%,聚合度2~6。白消安购自中国西亚试剂,环磷酰胺购自合肥博美生物科技有限责任公司,小鼠雌二醇、孕酮ELISA试剂盒均购自达科为生物技术有限公司,SDS-PAGE凝胶试剂盒购自普利莱基因技术有限公司,所用一抗均购自美国Abcam,二抗均购自Proteintech。
1.2 方法
1.2.1 模型制备及分组 环磷酰胺/白消安构建不孕不育模型法因其可操作性强、效果好等特点被广泛用于不孕不育模型动物的制备[11]。C/B病理性卵巢功能衰退模型分别按照环磷酰胺120 mg/kg、白消安12 mg/kg剂量腹腔注射给药构建,21 d后随机选取3只小鼠,取卵巢切片做HE染色,卵巢卵泡极少或几乎不可见表明不孕模型构建成功。将病理性卵巢功能衰退小鼠随机分成4组(n=8):对照组(0 mg/(kg·d))、壳寡糖低剂量治疗组(100 mg/(kg·d))、壳寡糖中剂量治疗组(200 mg/(kg·d))、壳寡糖高剂量治疗组(300 mg/(kg·d))。壳寡糖纯水配制,根据小鼠体重及每只小鼠灌胃体积为0.3 ml/d确定配置浓度。连续灌胃21 d后处理。同时,选取一组两月龄正常小鼠(n=8)每天灌胃0.3 ml纯水作为正常对照。
1.2.2 小鼠血清、腹腔巨噬细胞及脏器的收取 处理前3 d腹腔注射胎牛血清(0.5 ml),处理当天称重后取血,断颈处死,75%酒精浸泡2 min,固定四肢,腹腔注射预冷的不含血清的RPMI-1640培养液5 ml,刺激腹腔巨噬细胞逸出,轻柔按摩小鼠腹部5 min后充分收集腹腔液。收取卵巢、脾脏及胸腺,剥离干净,吸水纸吸去组织表面液体,称重记录。
1.2.3 卵巢组织的观察 将收取好的卵巢组织置于4%多聚甲醛中固定过夜,梯度酒精脱水,50%、70%、80%、95% Ⅰ、95% Ⅱ、100% Ⅰ、100% Ⅱ各1 h,二甲苯Ⅰ、Ⅱ透明各30 min,二甲苯石蜡(V二甲苯∶V石蜡=1∶1)30 min,石蜡Ⅰ、Ⅱ各90 min,浸蜡完成后包埋。2 μm切片,切片37℃过夜,置于58℃ 2 h后开始染片。二甲苯Ⅰ、Ⅱ各5 min,梯度酒精各1 min,脱蜡后苏木素滴染1.5 min,自来水冲洗1 min,盐酸乙醇分化3~5 s,自来水冲洗返蓝5~10 min,伊红滴染30 s,自来水冲洗,95%乙醇调色10 s,100% Ⅰ、100% Ⅱ脱水各1 min,二甲苯Ⅰ、Ⅱ各2 min,中性树脂封片,显微镜下观察拍照。
1.2.4 ELISA检测外周血E2、P水平 取血后室温静置2 h,4℃ 3 000 r/min离心10 min,分离血清,按试剂盒说明书操作测定小鼠外周血E2、P水平。
2.3 两组患者治疗前后tPSA、fPSA及睾酮水平比较 常规治疗组患者治疗前后tPSA、fPSA水平比较差异无统计学意义(P>0.05)。非那雄胺组患者治疗后tPSA、fPSA水平均较治疗前明显降低,差异有统计学意义(P<0.05)。非那雄胺组患者治疗后tPSA水平较常规治疗组低,差异有统计学意义(P<0.05)。两组患者治疗后睾酮水平均较治疗前降低,但差异无统计学意义(P>0.05),见表2。
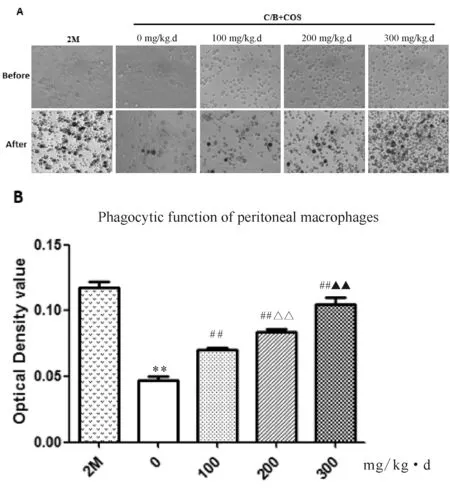
1.2.5 腹腔巨噬细胞吞噬功能检测 用不含血清的RPMI-1640培养液将收集到的腹腔液洗涤2次,台盼蓝染色计数活细胞> 95%后用含10%胎牛血清的RPMI-1640培养液调整细胞浓度至1×106cells/ml,以每孔100 μl接种于96孔培养板,5% CO237℃培养2 h后,洗去未贴壁细胞( D-Hanks液洗3次),培养8 h后,每孔加入0.1%中性红溶液(空白对照孔加等量生理盐水),继续培养30 min后弃去上清液,D-Hanks洗3次,每孔加入细胞溶解液(V冰醋酸∶V乙醇=1∶1)100 μl,室温下放置2 h,待细胞溶解后测550 nm吸光度。
1.2.6 Western blot检测OSE中生殖干细胞因子及免疫因子蛋白表达变化 用Trizol法提取卵巢组织蛋白,测定蛋白浓度,样品经10%SDS-PAGE凝胶泳分离后转移至PVDF膜(Millipore Corp.,Bedford,MA)上,封闭1 h后孵育一抗GAPDH (1∶2 500,ab8245,Abcam)、OCT-4 (1∶1 000,ab18976,Abcam)、MVH (1∶500,ab27591,Abcam)、TNF-α(1∶1 000,ab1793, Abcam)、IL-2(1∶2 500,ab11510,Abcam)、IL-6(1∶200,ab7737,Abcam),一抗4℃过夜后孵育相应二抗(1∶5 000),凝胶成像系统观察条带并拍照,Gelscan软件分析条带,结果至少重复3次。
1.3 统计分析
2 结果
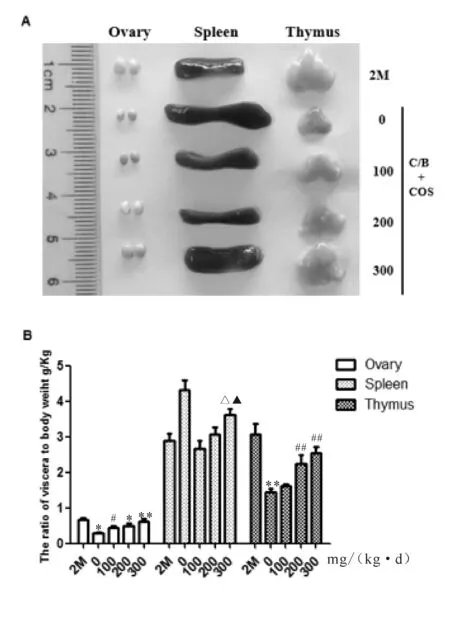
2.1 壳寡糖对药物不孕小鼠卵巢及主要免疫器官脏体比的影响
不孕对照组与正常对照相比,卵巢与胸腺脏体比明显降低,而脾脏脏体比有所升高;壳寡糖灌胃组与不孕对照组相比,卵巢、胸腺脏体比明显提高,而脾脏脏体比有所降低。不同剂量组间比较,灌胃剂量越大,卵巢、脾脏、胸腺脏体比均越大。200 mg/(kg·d)治疗组的脾脏体比最接近正常对照组,而卵巢脏体比及胸腺脏体比最接近正常对照组的均是300 mg/(kg·d)治疗组(图1)。
2.2 壳寡糖对药物不孕小鼠腹腔巨噬细胞吞噬功能的影响
2.3 壳寡糖对药物不孕小鼠外周血E2、P水平的影响
ELISA检测小鼠外周血雌、孕激素水平结果显示,不孕对照组和各处理组的外周血雌二醇水平均低于正常对照组(P<0.05)。各剂量壳寡糖灌胃治疗组外周血雌二醇水平高于不孕对照组(P<0.05),孕酮水平则均显著低于不孕对照组。壳寡糖治疗组组间相比,随着灌胃剂量增加,E2水平呈递增趋势,高剂量组P水平则低于低剂量及中剂量组(P<0.01, 表1)。
2.4 壳寡糖对药物不孕小鼠卵巢卵泡发育、生长情况的影响
环磷酰胺/白消安对机体生殖功能的破坏作用导致小鼠卵巢卵泡闭锁,与正常对照组相比,不孕对照组小鼠卵巢中,卵泡数明显减少至状态良好的卵泡几乎不可见,大部分为闭锁的黄体;低剂量治疗组卵巢可见少许正在生长的卵泡;中剂量组卵巢卵泡数明显增多,且明显可见各级卵泡;高剂量组卵巢卵泡数增加最为显著,且原始卵泡较其他处理组明显增多(图3)。
2.5 不同剂量组OSE中免疫因子蛋白表达情况
对蛋白条带统计分析可知,TNF-α、IL-2、IL-6表达量,不孕对照组及各处理组均低于正常对照组(P<0.05),各COS治疗组则均高于不孕对照组(P<0.05,图4)。在药物处理组间,各蛋白表达量均与治疗剂量呈显著的正相关关系。
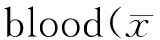
*P<0.05,**P<0.01vsC/B+0 group
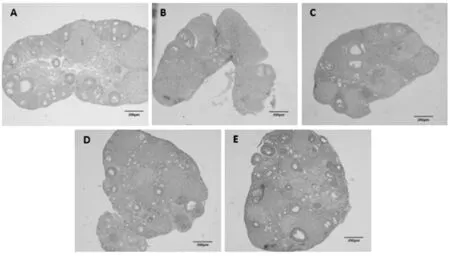
Fig. 3 Effect of different dosages of COS on the mice ovaries showing by HE staining (×40) A: Ovary of two-month-old normal mice; B: Ovarytreated with 0 mg/(kg·d) of COS(control); C: Ovary treated with 100 mg/(kg·d) of COS; D: Ovarytreated with 200 mg/(kg·d) of COS; E: Ovarytreated with 300 mg/(kg·d) of COS
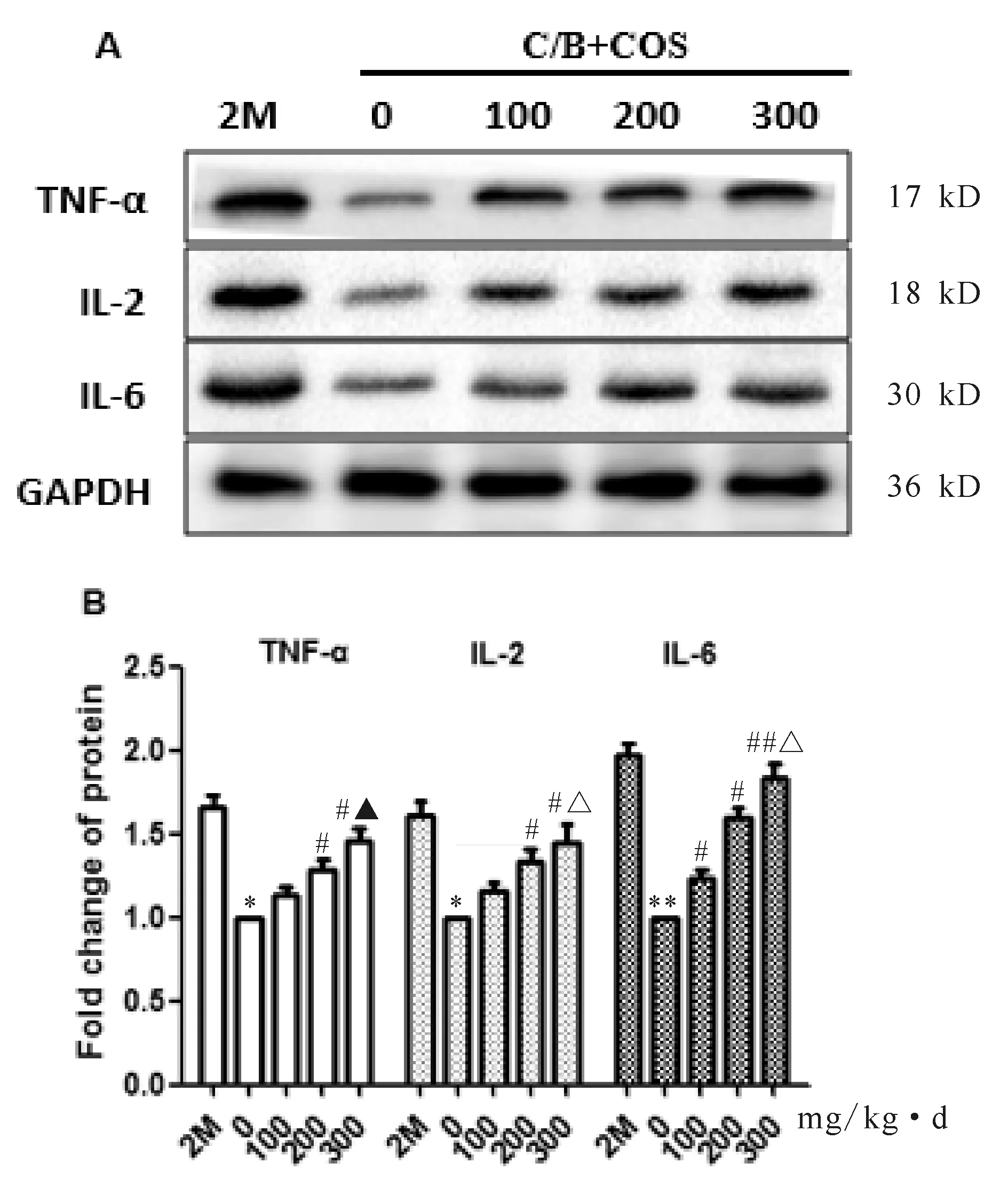
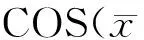
2.6 不同剂量组OSE中生殖干细胞因子蛋白表达情况
经不同剂量壳寡糖灌胃治疗后OSE中生殖细胞标志物MVH及干细胞标志物OCT-4共表达情况,对蛋白表达条带灰度值的统计分析显示,各组小鼠OSE都明显表达MVH及OCT-4,正常对照组高于不孕对照组及各处理组(P<0.05,图5)。药物处理组间比较,MVH及OCT-4表达量的变化趋势一致,均与治疗剂量呈显著的正相关关系。
3 讨论
壳寡糖是一种碱性氨基寡糖,水溶性好、安全无毒、生物活性高、易被人体吸收。其被报道的增强机体免疫功能的机制包括:促进淋巴细胞增殖,增大免疫器官使其加强免疫作用[9],增强T细胞表面表达IL-2受体,进而进一步刺激T细胞成熟并释放更多的IL-2,活化T细胞,刺激分泌IL-6[12],增强巨噬细胞吞噬功能并诱导其分泌TNF-α[13, 14]。
卵巢干细胞衰老后停止增殖、分化,使卵巢卵泡池无法得以补充,从而导致卵巢功能衰退停止排卵[3, 5, 15]。可见,卵巢干细胞衰老可能是卵巢功能衰退的根本原因。诸多研究表明[16-18],卵巢干细胞增殖、分化受机体免疫因素(免疫细胞、免疫因子)的调控。本实验中,经壳寡糖灌胃治疗后,高、中、低剂量组与对照组相比,免疫器官指数增大、免疫因子(TNF-α、IL-2、IL-6)蛋白表达量明显较高及巨噬细胞功能增强的同时,FGSCs的标志物(MVH、OCT-4)的蛋白表达量梯度增加、卵巢卵泡数同步增多,验证了免疫功能调控生殖功能的同时,表明壳寡糖具有增强雌性生殖功能的作用。
壳寡糖灌胃治疗在增加了小鼠外周血雌激素水平的同时降低了孕激素水平。Gaytan等[19]在不同动情周期小鼠卵巢上检测雌、孕激素水平并检测OSE增殖情况的结果表明,雌激素促OSE增殖、分化,而孕激素抑OSE增殖、分化。
综上,壳寡糖可改善病理性卵巢功能早衰小鼠的免疫功能,促进雌性省直干细胞增殖、分化,从而促进卵巢病理性早衰集体生殖功能在一定程度上的恢复。
[1] Kovanci E, Schutt AK. Premature ovarian failure: clinical presentation and treatment[J].ObstetGynecolClinNorthAm, 2015, 42(1): 153-161.
[2] Kawamura K, Kawamura N, Hsueh AJ. Activation of dormant follicles: a new treatment for premature ovarian failure[J].CurrOpinObstetGynecol, 2016, 28(3): 217-222.
[3] Xiong J, Lu Z, Wu M,etal. Intraovarian Transplantation of Female Germline Stem Cells Rescue Ovarian Function in Chemotherapy-Injured Ovaries[J].PloSOne, 2015, 10(10): e0139824.
[4] Ozakpinar OB, Maurer AM, Ozsavci D. Ovarian stem cells: From basic to clinical applications[J].WorldJStemCells, 2015, 7(4): 757-768.
[5] Smith JA, Daniel R. Stem cells and aging: a chicken-or-the-egg issue[J].AgingDis, 2012, 3(3): 260-268.
[6] Klein J. Immunology: The science of self-nonself discrimination[M].NewYork:JohnWileyandSons, Inc: 1982.
[7] Lintern-Moore S, Pantelouris EM. Ovarian development in athymic nude mice. The size and composition of the follicle population[J].MechAgeingDev, 1975, 4(5-6): 385-390.
[8] Bukovsky A, Caudle MR. Immunoregulation of follicular renewal, selection, POF, and menopause in vivo, vs. neo-oogenesis in vitro, POF and ovarian infertility treatment, and a clinical trial[J].ReprodBiolEndocrinol, 2012, 10: 97.
[9] Synowiecki J, Al-Khateeb NA. Production, properties, and some new applications of chitin and its derivatives[J].CritRevFoodSciNutr, 2003, 43(2): 145-171.
[10]杜昱光, 白雪芳, 金宗濂, 等. 壳寡糖抑制肿瘤作用的研究[J]. 中国海洋药物, 2002, 86(2): 18-21.
[11]Johnson J, Bagley J, Skaznik-Wikiel M,etal. Oocyte generation in adult mammalian ovaries by putative germ cells in bone marrow and peripheral blood [J].Cell, 2005, 122(2): 303-315.
[12]Suzuki K, Mikami T, Okawa Y,etal. Antitumor effect of hexa-N-acetylchitohexaose and chitohexaose[J].CarbohydrRes, 1986, 151: 403-408.
[13]Feng J, Zhao L, Yu Q. Receptor-mediated stimulatory effect of oligochitosan in macrophages[J].BiochemBiophysResCommun, 2004, 317(2): 414-420.
[14]Han Y, Zhao L, Yu Z,etal. Role of mannose receptor in oligochitosan-mediated stimulation of macrophage function[J].IntImmunopharmacol, 2005, 5(10): 1533-1542.
[15]Ozakpinar OB, Maurer AM, Ozsavci D. Ovarian stem cells: From basic to clinical applications[J].WorldJStemCells, 2015, 7(4): 757-768.
[16]Bukovsky A. Ovarian stem cell niche and follicular renewal in mammals[J].Anatomicalrecord(Hoboken), 2011, 294(8): 1284-1306.
[17]Pate JL, Toyokawa K, Walusimbi S,etal. The interface of the immune and reproductive systems in the ovary: lessons learned from the corpus luteum of domestic animal models[J].AmJReprodImmunol, 2010, 64(4): 275-286.
[18]Havran WL, Jameson JM, Witherden DA. Epithelial cells and their neighbors. III. Interactions between intraepithelial lymphocytes and neighboring epithelial cells[J].AmJPhysiolGastrointestLiverPhysiol, 2005, 289(4): G627-630.
[19]Gaytan M, Sanchez MA, Morales C,etal. Cyclic changes of the ovarian surface epithelium in the rat[J].Reproduction, 2005, 129(3): 311-321.
Effects of COS on promoting the pathological ovarian aging mice ovarian function by regulating immune function
LI Xiao-yan1, CAO Xuan1, LIU Xin-yue1, YE Hai-feng1, SU Tie1, ZHENG Tuo-chen2, MAO Zi2, ZHENG Yue-hui1△
(1. Department of Experimental Medicine Teaching,2. Jiangxi Provincial Key Laboratory of Reproductive Physiology and Pathology, Nanchang 330031, China)
Objective: To determine whether the immunopotentiator chitosan oligosaccharide(COS)can recover the reproductive functions of pathological ovarian recession mice and improvetheir immunity. Methods: Forty-three fertile female mice (at around 2 months),in addition to a normal control group (n=8), injected intraperitoneally with busulfan and cyclophosphamide to construct premature ovarian failure models. Three of them were used to test whether the infertility model was constructed successfully by HE staining.Then the models were randomly divided into four groups (n=8) and treated with different dosages of COS by gavage, after which compared different groups’ organ ratios (the weight of immune organs and ovary/ body weight), ovarian follicles and peritoneal macrophages’ phagocytosis as well as estragon(E2) and progesterone(P) levels in peripheral blood. In addition, we measured the expression dynamics of the ovarian protein reproductive cell marker mouse vasa homolog(MVH), germ stem cell marker OCT-4 in ovarian surface epithelium (OSE) and part of immune factors including tumor necrosis factor (TNF-α),interleukin-2(IL-2)as well as IL-6 to analyze the correlativity between germline stem cells marker dynamics and immune factors expression changes. Results: With increasing dosages of COS, organ ratios of ovaries, thymus and spleen both went up synchronously; The whole number of follicles and every stages of follicles are all presenting with progressive tendency; E2level in peripheral blood ascends, however, progesterone level declined relatively; Neutral red experiment revealed the phagocytosis ability of peritoneal macrophages became stronger with increasing dosages of COS; the results of Western blot had shown that no matter the expression level of germ stem cells marker or immune factors were all presenting increasing tendency, which means that the expression level dynamics of germ stem cell marker has a positive correlation with immune factors expression changes. The results were statistically significant. Conclusion: COS could improve the immunity of mice with pathological ovarian recession and at the same time it would promote the proliferation and differentiation of female germ line stem cells (FGSCs), and then helped saving ovarian functionsto some extent.
COS; immunity; POF; FGSCs; restoration of ovarian function
国家自然科学基金项目(81360100);江西省自然科学基金项目(20152ACB20023);江西省赣鄱英才555工程项目
2016-05-19
2016-11-22
R339.2
A
1000-6834(2017)02-097-06
△【通讯作者】Tel: 0791-83827148; E-mail: yuehuizheng@163.com

