氧糖剥夺对人脐静脉内皮细胞通透性的影响*
韩 雪, 黄 欣, 朱玲玲△, 范 明,△
(1. 首都医科大学神经生物学系, 北京 100069; 2. 军事医学科学院基础医学研究所认知科学研究室, 北京 100850)
氧糖剥夺对人脐静脉内皮细胞通透性的影响*
韩 雪1, 黄 欣2, 朱玲玲2△, 范 明1,2△
(1. 首都医科大学神经生物学系, 北京 100069; 2. 军事医学科学院基础医学研究所认知科学研究室, 北京 100850)
目的:建立体外氧糖剥夺模型模拟脑缺血缺氧损伤, 探讨氧糖剥夺对人脐静脉内皮细胞(HUVECS)屏障功能的影响。方法:细胞培养至完全融合后换成无糖培养基置于低氧手套箱(0.3% O2)分别处理0.5 h、1 h、2 h和4 h后, 利用CCk-8法检测细胞存活,利用跨内皮细胞电阻 (trans-endothelial electrical resistant, TEER)方法检测HUVECs细胞通透性的变化,以及Western blot检测紧密连接相关蛋白的表达。结果:氧糖剥夺处理0.5 h、1 h、2 h和4 h后, HUVECs细胞存活率逐渐下降,TEER值逐渐降低,紧密连接蛋白Occludin、VE-cadherin的表达明显降低。结论:氧糖剥夺破坏内皮细胞间的紧密连接功能,增加HUVECs细胞的通透性,导致细胞的存活率明显降低。
氧糖剥夺;紧密连接;通透性;HUVEC
【DOI】 10.12047/j.cjap.5407.2017.027
脑缺血发病率高,轻则影响患者的生活质量,重则威胁患者的生命健康[1]。目前对于脑缺血损伤的预防和治疗仍然缺少有效的手段和措施。以往的研究策略大多集中在保护神经元,近年来“神经-血管单元(neurovascular unit, NVU)”概念的提出,成为脑保护和可塑性研究的新关注点,靶向调节神经-血管单元也是脑损伤修复的新策略[2]。NVU是指由神经元、血脑屏障(blood brain barrier, BBB)、小胶质细胞以及维持脑和神经组织完整性的细胞外基质(extracellular matrix, ECM)共同构成的一个动态的结构复合体,它也是构成神经系统细胞-细胞间
信号传递和细胞-基质间相互作用的框架, 是神经系统结构和功能的基本单位。研究发现:脑缺血损伤破坏血脑屏障,进而导致脑组织内环境紊乱,引起神经元功能障碍,最终导致神经元的坏死[3]。脑血管内皮细胞是神经血管单元重要的组成细胞,在脑缺血损伤过程中发挥至关重要的作用,成为该过程中神经保护的新靶点[4]。而脑血管内皮细胞主要通过限制细胞旁转运和跨细胞转运来维持脑内环境稳态,其中由紧密连接蛋白限制的细胞旁转运尤为重要。研究表明,缺血缺氧可激活VEGF、MMP2等导致紧密连接蛋白磷酸化,使其表达下调或重组[5,6,7],可激活MMP9降解内皮细胞细胞外基质[8],最终使其通透性降低。
目前常用于血脑屏障功能研究的内皮细胞模型大多为大、小鼠来源的原代细胞或者细胞系[9,10],缺少人源脑血管内皮细胞。人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)是具有完整的内皮屏障功能的一种人源内皮细胞,可以较好地模拟人源内皮细胞的屏障功能,是一种理想的用于屏障功能研究的细胞模型。本研究旨在观察体外模拟脑缺血损伤的氧糖剥夺模型中对HUVECs细胞内皮屏障功能及细胞存活的影响,为研究血脑屏障在脑缺血的预防治疗中的作用提供实验基础。
1 材料与方法
1.1 主要试剂
胎牛血清、青链霉素购自Hyclone公司,无糖培养基、高糖DMEM培养基、胰酶购自Gibco公司,CCK-8购自Dojindo公司,anti-VE-cadherin购自eBioscience公司,anti-Occludin购自invitrogen公司,anti-β-actin购自Sigma公司,其他生化试剂均为国产分析纯。
1.2 HUVECs的培养
HUVEC细胞系为军事医学科学院施明老师惠赠。细胞培养基含有10%胎牛血清,1%青链霉素的高糖DMEM 培养基。细胞在37℃,5% CO2环境下培养,平均3 d传代。
1.3 氧糖剥夺细胞模型的建立
细胞随机分成常氧对照组,氧糖剥夺组(低氧1 h组,低氧2 h组,低氧4 h组,总计4组)。培养3 d后细胞汇合约100%,低氧实验组换成无糖无血清培养基放入低氧手套箱(COY laboratory products公司),即在37℃、0.3%O2、5%CO2环境培养。
1.4 CCK-8法检测细胞存活率
细胞随机分成常氧对照组,氧糖剥夺组(按1.3分组)。将细胞接种于96孔板中,每组5个复孔,终密度为1×104cells/孔。氧糖剥夺处理后,每孔培养基100 μl,加入10 μl CCK-8,孵育4 h,于酶联免疫检测仪(Thermo公司)450 nm 波长处检测吸光度(OD) 值。
1.5 跨内皮细胞电阻(TEER值)的测定
细胞接种入insert小室(1 μm,6孔板,millipore公司)中,以未接种细胞仅在小室内加入等量相同培养基的样品为空白对照,培养3 d后细胞完全汇合,利用Millicell-ESR电阻仪(millipore公司)测TEER值,每个insert均取不同方向的3个点,每点重复测定3次,方法严格参照仪器说明书。TEER值是公认的测定内皮细胞物理屏障功能最精确的工具。TEER值下降表明内皮细胞通透性增加,屏障功能受损。TEER值(Ω·cm2)=(实验组-空白组)×4.5 。
1.6 Western blot检测紧密连接蛋白Occludin和介导细胞粘附连接的VE-cadherin蛋白表达
氧糖剥夺处理完毕的细胞,用预冷的PBS洗2遍,再刮下来移到1.5 ml EP管中,3 000 r/min 4℃离心5 min,弃上清,向细胞沉淀中加入含Cocktail(1∶50,Roche公司)的RIPA裂解液(普利莱公司)在冰上裂解30 min,再加入5×loading buffer,100℃煮10 min。SDS-PAGE电泳分离蛋白,湿转法转移蛋白到PVDF膜上,脱脂牛奶封闭2 h,加入一抗,4℃孵育过夜。PBST 漂洗PVDF膜3次,每次10 min。二抗室温孵育2 h,然后用PBST充分洗膜,漂洗3次,每次10 min。将显影液ECL加于PVDF 膜上,用保鲜膜将膜包好。暗室中在X 光胶片曝光,调整曝光时间,直至出现最佳条带。
1.7 统计学处理
2 结果
2.1 氧糖剥夺对HUVECs细胞存活的影响
随着氧糖剥夺处理时间的延长,细胞边界模糊,折光度较差, 细胞密度明显减少,部分细胞发生皱缩。利用CCK-8法检测氧糖剥夺后HUVECs细胞的存活率,结果显示:与正常培养组比较,氧糖剥夺各处理组细胞存活率明显降低,且随着氧糖剥夺时间的延长细胞存活率逐渐降低,氧糖剥夺处理30 min,60 min和120 min的细胞存活率依次为85.2%±4.67%,80.88%±4.08%,71.20%±3.27%,较正常组均具有显著统计学意义(P<0.01,图1)。上述结果表明:氧糖剥夺对HUVECs细胞的损伤呈时间依赖性,随着氧糖剥夺时间的延长,HUVECs细胞损伤越严重。


2.2 氧糖剥夺对HUVECs细胞通透性的影响
HUVECs细胞培养3 d后,TEER值稳定至(93.5±2.78)Ω·cm2进行氧糖剥夺实验,结果显示:氧糖剥夺可导致HUVECs细胞TEER值以时间依赖性方式下降。与0 h(93.5±2.78Ω·cm2)相比, 氧糖剥夺0.5 h后, TEER值开始下降至(46.5±2.60)Ω·cm2, 氧糖剥夺4 h时降至最低水平(10.5±3.97)Ω·cm2, 氧糖剥夺各组较正常培养组细胞通透性均明显减低, 具有显著统计学意义(P<0.01, 图2)。以上结果表明:随着氧糖剥夺时间的延长,HUVECs细胞TEER值逐渐降低;氧糖剥夺导致HUVECs细胞通透性升高,屏障功能受损。

Fig. 2 The effects of oxygen-glucose deprivation on transendothelial electrical resistance (TEER) of HUVECs (n=3) The permeability of HUVECs was assessed by TEER measurements**P<0.01vs0 h
2.3 氧糖剥夺后HUVECs细胞间紧密连接相关蛋白的表达降低
Western blot结果显示,紧密连接蛋白Occludin的表达在OGD处理1 h后开始减弱,4 h下降最为明显,较正常组具有显著统计学差异(P<0.01)。此外介导细胞粘附连接的VE-cadherin也随着氧糖剥夺时间的延长而表达下降,OGD处理4 h后下降最为明显,具有显著统计学差异(P<0.05, 图3)。上述结果表明:氧糖剥夺破坏HUVECs细胞间的紧密连接和粘附连接,增加细胞的通透性,破坏内皮细胞的屏障功能。
3 讨论
HUVECs细胞是人脐静脉内皮细胞。我们通过检测其TEER值在100 Ω·cm2左右,与大多数目前发表的各种属脑血管内皮细胞的TEER值相当,这说明该HUVECs细胞具有良好的屏障功能,并且HUVECs细胞具有纯度高、稳定性好、传代快等诸多优点。
血管通透性增加是脑血管病的重要病理变化, 研究表明:紧密连接蛋白Occludin连接细胞内的细胞骨架,维持内皮细胞间通透性,缺氧可激活VEGF等使Occludin磷酸化导致其功能受损,下调Occludin
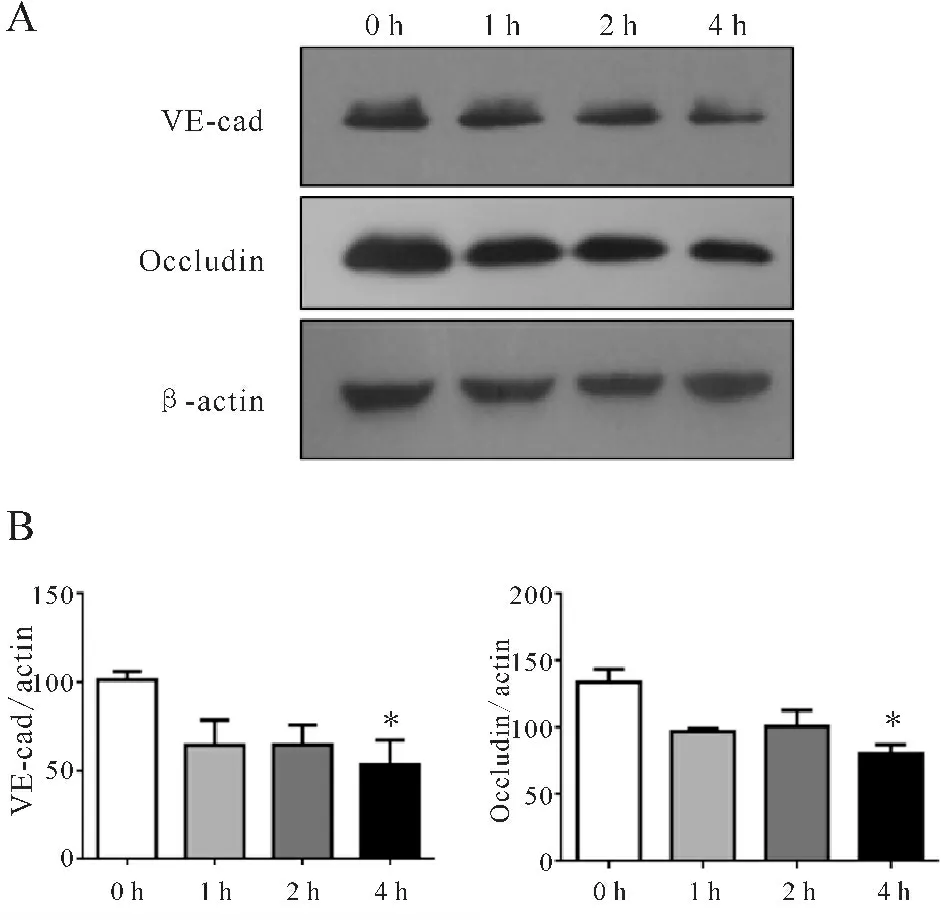
Fig. 3 The effects of oxygen-glucose deprivation on protein expressions of HUVECs (n=3) A: The protein expressions of VE-cadherin and Occludin detected by Western blot. β-actin was used as an internal control; B: The quantitative analysis of VE-cadherin and Occludin*P<0.05vs0 h
表达,增加内皮细胞通透性[11]。而紧密连接的形成同时也依赖粘附连接的存在。粘附连接蛋白VE-cadherin通过和胞内β-catenin相互作用维持细胞结构[12],VEGFR2的激活介导VE-cadherin内吞和降解,下调其表达影响正常功能[13],最终降低内皮细胞通透性。本研究发现氧糖剥夺影响HUVECs的存活及屏障功能,其通透性的变化尤为明显,Western blot结果表明紧密连接蛋白Occludin及粘附连接蛋白VE-cadherin在氧糖剥夺后均表达下调,尤其在4 h后最明显,说明Occludin和VE-cadherin的下调破坏内皮细胞的屏障功能。同时研究表明紧密连接相关蛋白可通过重排及表达下调影响内皮细胞的形态及其存活[14,15,16],本实验发现HUVECs的TEER值变化与细胞存活趋势相似,且蛋白表达的显著下调发生在氧糖剥夺4 h后,推测该紧密连接相关蛋白的重排在这其中也发挥重要作用。因此,探讨氧糖剥夺模型下内皮细胞屏障功能的变化及其作用机制对于脑缺血损伤屏障功能的通透性研究具有重要的意义。
综上所述, 本实验证明氧糖剥夺可以引起HUVECs细胞通透性升高, 细胞存活率降低,其机制为紧密连接蛋白Occludin和粘附连接蛋白VE-cadherin表达下调; 这些提示氧糖剥夺抑制内皮细胞紧密连接蛋白的表达,增加其细胞通透性,进而导致细胞的死亡。本研究为脑缺血损伤后血脑屏障通透性的研究提供理想的细胞模型和实验方法,为深入探讨脑缺血损伤后细胞紧密连接及其对通透性的研究提供依据。
[1] Donnan GA, Fisher M, Macleod M,etal. Stroke[J].Lancet, 2008, 371(9624): 1612-1623.
[2] del Zoppo GJ. The neurovascular unit in the setting of stroke[J].JInternMed, 2010, 267(2): 156-171.
[3] Bickler PE, Donohoe PH. Adaptive responses of vertebrate neurons to hypoxia[J].JExpBiol, 2002, 205(23): 3579-3586.
[4] Gursoy-Ozdemir Y, Yemisci M, Dalkara T. Microvascular protection is essential for successful neuroprotection in stroke[J].JNeurochem, 2012, 123 (Suppl 2): 2-11.
[5] Fischer S, Clauss M, Wiesnet M,etal. Hypoxia induces permeability in brain microvessel endothelial cellsviaVEGF and NO[J].AmJPhysiol, 1999, 276(4 Pt 1): C812-820.
[6] Luissint A C, Artus C, Glacial F,etal. Tight junctions at the blood brain barrier: physiological architecture and disease-associated dysregulation[J].FluidsBarriersCNS, 2012, 9(1): 23.
[7] Liu J, Jin X, Liu KJ,etal. Matrix metalloproteinase-2-mediated occludin degradation and caveolin-1-mediated claudin-5 redistribution contribute to blood-brain barrier damage in early ischemic stroke stage[J].JNeurosci, 2012, 32(9): 3044-3057.
[8] Rosenberg GA, Yang Y. Vasogenic edema due to tight junction disruption by matrix metalloproteinases in cerebral ischemia[J].NeurosurgFocus, 2007, 22(5): E4.
[9] Bauer AT, Bürgers HF, Rabie T,etal. Matrix metalloproteinase-9 mediates hypoxia-induced vascular leakage in the brain via tight junction rearrangement[J].JCerebBloodFlowMetab, 2010, 30(4): 837-848.
[10]Wang LW, Tu YF, Huang CC,etal. JNK signaling is the shared pathway linking neuroinflammation, blood-brain barrier disruption, and oligodendroglial apoptosis in the white matter injury of the immature brain[J].JNeuroinflammation, 2012, 9(1): 175.
[11]Hirase T, Kawashima S, Wong EY,etal. Regulation of tight junction permeability and occludin phosphorylation by Rhoa-p160ROCK-dependent and -independent mechanisms[J].JBiolChem, 2001, 276(13): 10423-10431.
[12]Dejana E, Vestweber D. The role of VE-Cadherin in vascular morphogenesis and permeability control[J].ProgMolBiolTranslSci, 2013, 116: 119-144.
[13]Nottebaum AF, Cagna G, Winderlich M,etal. VE-PTP maintains the endothelial barrierviaplakoglobin and becomes dissociated from VE-cadherin by leukocytes and by VEGF.[J].JExpMed, 2008, 205(12): 2929-2945.
[14]Dejana E, Tournier-Lasserve E, Weinstein BM. The control of vascular integrity by endothelial cell junctions: molecular basis and pathological implications[J].DevCell, 2009, 16(2): 209-221.
[15]薛凤麟, 张 旋, 贺国洋, 等. 核因子-κB在HUVEC细胞凋亡信号通路中的作用[J]. 中国应用生理学杂志, 2009, 25(3): 383-386.
[16]于 航, 贾庆波, 薛一雪. rhAng-1对局灶性脑缺血/再灌注大鼠血脑屏障血管内皮细胞间连接的影响[J]. 中国应用生理学杂志, 2013, 29(2): 147-152.
Effects of oxygen-glucose deprivation on the permeability of human umbilical vein endothelial cells
HAN Xue1, HUANG Xin2, ZHU Ling-ling2△, FAN Ming1,2△
(1. Department of Neurobiology, Capital Medical University, Beijing 100069;2. Department of Cognitive Science, Beijing Institute of Basic Medical Science, Beijing 100850, China)
Objective: To investigate the effects of oxygen-glucose deprivation (OGD) on the functions of blood-brain barrierinvitro, we established an OGD model to mimic cerebral ischemic injury in human umbilical vein endothelial cells (HUVECs). Methods: Cells were cultured in DMEM without glucose under hypoxic conditions (0.3% O2) for different time point. The survival rate of HUVECs was detected by CCK-8 assay. The permeability of HUVECs was measured by epithelial volt-ohm meter. The expression of tight junction protein was detected by Western blot analysis. Results: In OGD group, the survival rate of HUVECs was obviously decreased. The permeability of HUVECs also decreased in OGD-treated cells. And the expression of tight junction protein was reduced after OGD treatment. Conclusion: Our data indicate that OGD treatment disrupt the barrier function of tight junctions and increase permeability of HUVECs and finally accelerated cell death.
oxygen-glucose deprivation; tight junction; permeability; HUVEC
2016-03-29
2016-11-25
R743.31;R364.4
A
1000-6834(2017)02-105-04
△【通讯作者】Tel: 010-66931315; E-mail: fanmingchina@126.com; linglingzhu@hotmail.com

