不同干制方法对广叶绣球菌多糖提取率和分子量分布的影响*
张 迪,王宏雨,林衍铨
(福建省农业科学院食用菌研究所,福建 福州 350014)
不同干制方法对广叶绣球菌多糖提取率和分子量分布的影响*
张 迪,王宏雨,林衍铨**
(福建省农业科学院食用菌研究所,福建 福州 350014)
对广叶绣球菌(Sparassis latifolia)子实体的热风烘干品和真空冷冻干燥品的多糖提取率和多糖分子量构成进行了研究。实验结果表明,不论是采用超声循环提取还是热水提取方法,广叶绣球菌冻干子实体的多糖提取率都显著高于烘干品,所得多糖的分子量分布也显著不同,冻干子实体多糖主要成分的重均分子量为4.30× 105Da,烘干品多糖的主要成分重均分子量为2.52×104Da。
广叶绣球菌;多糖;提取;分子量
广叶绣球菌(Sparassis latifolia),属于担子菌亚门(Basidiomycotina) 异隔担子菌纲(Heterobasidiomycetes) 无(非) 褶菌目(ApHyllopHorales)绣球菌科(Sparassidacea)绣球菌属(Sparassis Fr.)。现代研究结果表明广叶绣球菌具有显著的辅助降糖、通便功效,其子实体中含有大量β-葡聚糖,能提高人体免疫力及机体造血功能,具有抗癌、防癌的特殊功效,对某些肿瘤也有一定的预防和抑制作用[1-4]。
广叶绣球菌子实体主要的功能性成分是真菌活性多糖。由于鲜广叶绣球菌含水量大于90%,现有研究表明子实体干品的干燥工艺对多糖的保留率有较大的影响[5],本实验主要对广叶绣球菌子实体的热风干燥品和真空冷冻干燥品的多糖提取率和所得多糖的分子量分布特性进行了研究。
1 材料与方法
1.1 供试材料
广叶绣球菌子实体鲜品购于福建天益菌业有限公司。
1.2 试剂与仪器设备
葡聚糖Dextran T20、T40、T70、T500、T1000、T2000,购自Pharmcia公司。其余试剂均为国产分析纯、色谱纯;实验用水为超纯水。
CTXNW-2B超声循环提取机,北京弘祥隆生物技术开发有限公司;日立U1900紫外扫描分光光度计,日本Hitachi公司;sp8800色谱泵,美国物理光谱公司;UM 5000蒸发光检测仪,北京通微分析仪器有限公司;TSKgel GMPxl色谱柱,日本东曹株式会社;Centrifuge 5804 R离心机;真空冷冻干燥机,北京博医康有限公司;超纯水器Milli-Q plus,Millipore公司。
1.3 实验方法
1.3.1 广叶绣球菌干品制备
生产企业提供的广叶绣球菌为带菌袋的未采鲜品。
热风烘干:广叶绣球菌鲜菌置于烘干盘上,于热风循环烘箱中干燥,干燥条件:50℃干燥5 h→60℃干燥2 h→45℃干燥12 h。
真空冷冻干燥:广叶绣球菌的鲜菇置于冷冻盘上,-35℃预冻24 h,开真空冷冻干燥机进行干燥,干燥条件:冷阱温度-60℃,搁板温度30℃,干燥时间30 h。
粉碎:获得的广叶绣球菌干品用高速粉碎机粉碎后过60目筛,备用。
1.3.2 广叶绣球菌多糖提取与处理
热水提取:准确称取广叶绣球菌干品粉末50 g,料液比1∶15,100℃水浴搅拌提取2 h。
超声提取:准确称取广叶绣球菌干品粉末50 g,料液比1∶15,超声功率600 W,超声工作间歇比2.5/ 1,提取温度60℃,全程提取时间90 min。
各种提取方法提取完成以后,将提取液在8 000 r·min-1离心10 min取上清,上清液减压浓缩至原体积的1/2,在浓缩液中加入4倍体积95%的乙醇醇沉过夜,8 000 r·min-1离心20 min取沉淀置于真空干燥箱中去除残余乙醇,即得广叶绣球菌粗多糖。广叶绣球菌粗多糖用蒸馏水复溶后,8 000 r·min-1离心10 min取上清,使用蒸馏水溶解配制成浓度为15 mg·mL-1的溶液备用。
脱蛋白:采用三氯乙酸法[6],样品的浓度为15 mg·mL-1,加入样品体积1/10的40%TCA溶液,混匀后静置30 min,8 000 r·min-1离心20 min法的取上清。重复2次后,上清加入4倍体积乙醇醇沉,再用丙酮洗涤沉淀2次,沉淀真空干燥后,得到广叶绣球菌多糖。
1.3.3 多糖含量的测定与多糖提取率计算
多糖含量测定采用硫酸-蒽酮法[7],所得数据经SPSS17.0统计分析。
多糖得率(P)公式为:
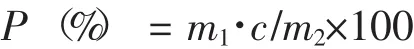
式中:m1表示多糖总质量;c表示多糖的糖含量(葡萄糖计);m2表示提取原料质量。
1.3.4 广叶绣球菌多糖样品的分子量分布测定
多糖分子量分布测定采用高效凝胶渗透色谱法[8]。
色谱条件:TSKgel GMPxl色谱柱(7.5 mm×300 mm);流动相为0.05 mol·L-1乙酸铵,流速为0.6 mL·min-1;柱温30℃;进样量20 μL;ELSD检测器:载气为空气;载气压力450 kPa。漂移管温度60℃。数据分析系统为Chrommanger5.8 GPC专用版。
标准品和待测样品的制备:取称冻干超声提取子实体多糖、烘干超声提取子实体多糖和葡聚糖对照品适量,用0.05 mol·L-1乙酸铵溶液溶解为浓度约4 mg·mL-1,作为待测溶液。
2 结果与讨论
2.1 不同广叶绣球菌提取原料的多糖提取率比较
不同干燥方法对广叶绣球菌子实体的多糖提取率的影响见图1。
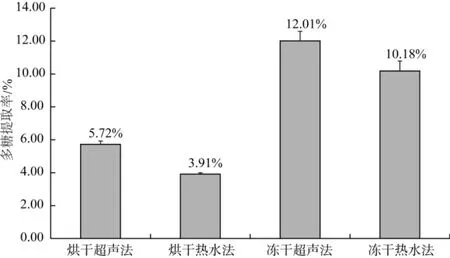
图1 采用不同干燥方法绣球菌子实体的多糖提取得率Fig.1 Yield of polysaccharide in Sparassia latifolia fruitbodies using different dried methods
对比广叶绣球菌子实体冻干品与热风干燥品相同条件下的多糖提取率发现,广叶绣球菌子实体冻干品的多糖提取率远大于热风干燥品,在超声提取法中冻干品的多糖提取率为12.01%;热水法中冻干品的提取率为10.18%,相比之下热风烘干品的提取率仅为5.72%和3.91%。对同一原料采用超声波循环法和常规热水法的提取效果进行对比,发现不论是冻干品还是烘干品,超声循环提取法提取绣球菌多糖的得率均显著高于热水提取法。
2.2 冻干品与烘干品提得多糖的分子量分布比较
取重均分子量分别为2 000 000 Da、1 000 000 Da、500 000 Da、70 000 Da、40 000 Da、20 000 Da的葡聚糖对照品溶液进样测定,记录峰值保留时间,标定色谱柱,以保留时间对分子量的对数作线性回归,得回归方程:Log(MW)=-0.4066+10.9773tR,MW为重均分子量,tR为保留时间(min),相关系数为r=0.9941。烘干品和冻干品提取的广叶绣球菌多糖的凝胶色谱图见图2和图3。
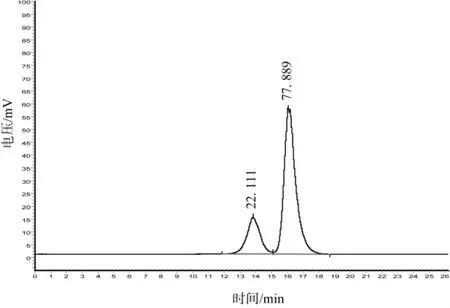
图2 烘干品提取的绣球菌多糖的凝胶色谱图Fig.2 Polysaccharide chromatogram of Sparassia atifolia fruitbodies sample dried by hot air drying
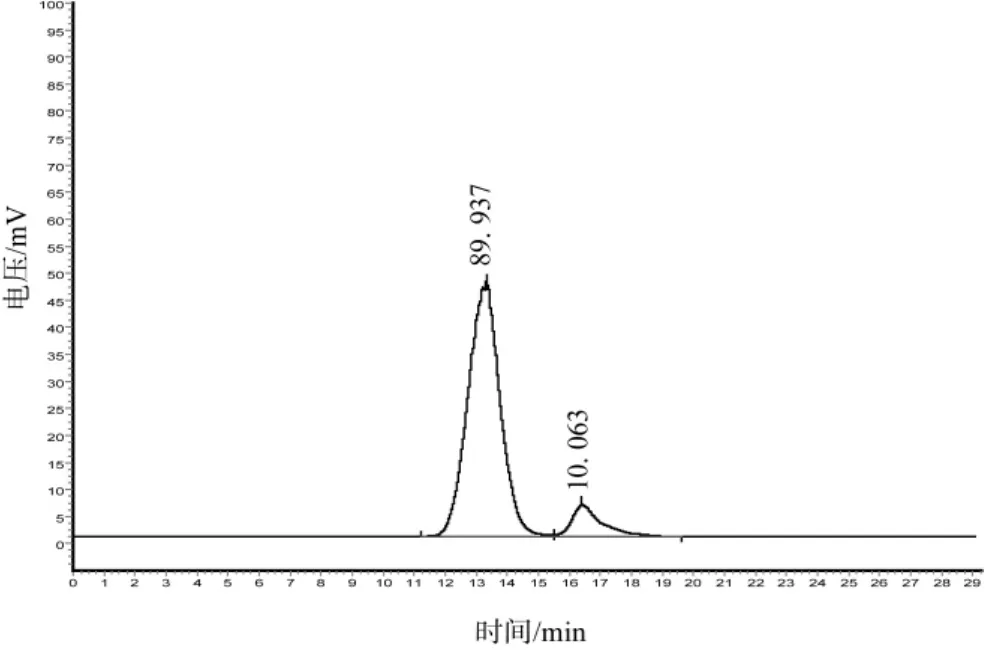
图3 冻干品提取的绣球菌多糖的凝胶色谱图Fig.3 Polysaccharide chromatogram of Sparassia atifolia fruitbodies sample dried by vacuum freeze-drying
从图2可以看出,烘干品提得的广叶绣球菌子实体多糖在色谱图上呈现2个主要色谱峰,其重均分子量分别为23.94×105Da和2.52×104Da,相对含量分别为22.11%和77.89%。从图3可以看出,冻干品提取的广叶绣球菌子实体多糖在色谱图上同样呈现2个主要色谱峰,其重均分子量分别为4.30×105Da和 2.30×104Da,相对含量分别为 89.94%和10.06%。通过对比可以发现,广叶绣球菌烘干品和冻干品提取的多糖分子量构成是有显著不同的,烘干品多糖中2.5×104Da左右小分子量多糖为其主要成分,而冻干品提取得的广叶绣球菌多糖中分子量在4.3×105Da左右大分子量多糖为其主要成分。
3 讨论
实验结果表明广叶绣球菌子实体冻干品的多糖保留率显著高于热风干燥品,这与白辰和宋文荣等[5]的研究结果是一致的,造成这种差异的原因尚不明确,有可能是高温脱水情况下4.0×104Da~5.0×104Da分子量部分的广叶绣球菌多糖降解造成的,也有可能与高分子量β葡聚糖分子之间氢键的作用形成的不溶性团有关,还有待进一步研究。
对比子实体冻干品和子实体烘干品多糖的分子量构成,烘干品多糖的主要成分为2×104Da左右的小分子量多糖,而冻干品多糖的主要成分为4.3×105Da左右的大分子量多糖,这种分子量构成上的差异对多糖的生物学活性有多大影响,尚不得而知。
[1]Kimura T.Natural products and biological activity of the pharmacologically active cauliflower mushroom Sparassis crispa[J].BioMed Research Intermational,2013,8 (3):501-508.
[2]Chandrasekaran G,Oh DS,Shin HJ.Properties and potential applications of the culinary-medicinal cauliflower mushroom, Sparassis crispa Wulf.:Fr.(Aphyllophoromycetideae):a review[J].International Journal of Medicinal Mushrooms,2011, 13 (2):177-183.
[3]Kim HS,Kim JY,Ryu HS,et al.Induction of dendritic cell maturation by β-glucan isolated from Sparassis crispa[J].International Immunopharmacology,2010,10 (10):1284-1294.
[4]Kim HH,Lee S,Singh TS,et al.Sparassis crispa suppresses mast cell-mediated allergic inflammation:Role of calcium, mitogen-activated protein kinase and nuclear factor-κB[J].Intermational Journal of Molecular Medicine,2012,30 (2): 344-350.
[5]白晨,宋文荣,杨剑飞,等.绣球菌子实体干燥条件与多糖保留率相关性研究[J].食品科学,2012,33(20):119-122.
[6]朱美静,童群义.猴头多糖脱蛋白方法的研究[J].河南工业大学学报:自然科学版,2005,26(4):25-27.
[7]王宏雨,毛方华,陈体强,等.竹荪抗氧化物质超声波循环提取工艺[J].福建农业学报,2012,27(7):743-746.
[8]钱正明,李文庆,孙敏甜,等.冬虫夏草化学成分分析[J].菌物学报,2016,35(4):476-490.
Effects of Different Drying Methods on Extraction Rate and Molecular Weight Distribution of Polysaccharides from Sparassis latifolia
ZHANG Di,WANG Hong-yu,LIN Yan-quan
(Institute of Edible&Medicinal Fungi,Fujian Academy of Agicultural Sciences,Fuzhou 350014,China)
Extraction rate and the molecular weight of the polysaccharides of different Sparassis latifolia samples were studied.The results showed that the extraction rate of the polysaccharides of the vacuum freeze dried fruitbodies was significantly higher than that of the hot air dried sample,and the molecular weight distribution of the polysaccharides was also significantly different.The molecular weight of the main polysaccharide of vacuum freeze dried fruitbodies and the hot air dried is 4.30×105Da and 2.52×104Da,respectively.
Sparassis latifolia;polysaccharide;extraction;molecular weight
S646.9
A
1003-8310(2017)03-0054-03
10.13629/j.cnki.53-1054.2017.03.013
福建省属公益类科研院所专项(2015R1020-7);福建省农科院PI项目(2016PI-44)。
张迪(1983-),男,硕士,助理研究员,主要从事食用菌天然产物研究。E-mail:photohost@126.com
**通信作者:林衍铨(1963-),男,大专,研究员,主要从事食(药)用菌栽培研究。E-mail:lyq-406@163.com
2017-03-10

