间歇运动对卵巢切除大鼠脊髓背角内吗啡肽2表达的影响
赵晓慧
间歇运动对卵巢切除大鼠脊髓背角内吗啡肽2表达的影响
赵晓慧
目的:探讨间歇运动对卵巢切除(ovariectomized,OVX)大鼠脊髓背角内吗啡肽2(endomorphin-2,EM-2)表达的影响。方法:体重180~200 g雌性SD大鼠,随机分为假手术组(Sham)、卵巢切除安静组(OVX)、卵巢切除+间歇运动组(OVXex),每组8只。建立模拟女性绝经后状况的卵巢切除模型,OVXex采用小动物跑台进行7周间歇训练。每周训练结束后次日,对各组大鼠进行热异常痛行为学检测,评定大鼠卵巢切除后的痛敏状况;7周训练结束后次日取腰膨大处脊髓背角,切片并进行EM-2免疫组织化学染色,检测其表达。结果:卵巢切除引起了明显的热异常痛敏,同时EM-2表达明显降低。间歇运动可有效改善热异常痛敏,同时上调脊髓EM-2的表达。结论:间歇运动可显著增加脊髓背角EM-2的表达,减弱卵巢切除引起的热异常痛敏。运动干预卵巢切除所引起的脊髓背角EM-2表达和热痛行为学反应的改变,将为绝经后女性的异常性痛敏提供治疗的新思路。
间歇运动;卵巢切除;脊髓背角;内吗啡肽2;热异常痛敏;绝经期
对于疼痛敏感性和疼痛应答来说,性激素(尤其是雌激素)是一种决定性的因素[11,12,20]。女性绝经期雌激素减少的极端状态与疼痛有着密切的关联[15,19]。与正常女性相比,绝经期女性中报道的疼痛几乎是她们的2倍[2]。在绝经期相关疼痛治疗中,激素替代疗法是一种临床常用的镇痛疗法。然而,这种疗法有着不可忽视的副作用,例如,使接受治疗的患者遭受各种疼痛的困扰[13,17,21]。运动疗法在预防及缓解骨质疏松症状疗法中占据一个很重要的位置[1],而运动疗法能否缓解绝经后骨质疏松导致的热异常疼痛鲜见研究。在本研究中,我们采用雌鼠双侧卵巢切除(ovariectomized,OVX)模型,模拟女性绝经期后状态,观察大鼠的热异常痛行为学变化,并通过对脊髓内吗啡肽2(endomorphin-2,EM-2)表达水平的检测,来探讨其与OVX热异常痛行为学反应之间的关联,通过对OVX大鼠进行间歇性运动训练,探讨运动疗法对OVX致热异常痛敏以及腰膨大处脊髓背角(Spinal dorsal horn,SDH)EM-2表达的影响。
1 材料与方法
1.1 主要仪器和试剂
主要试剂:EM-2多克隆抗体(美国Chemicon),DAB显色试剂盒(武汉博士德)。
主要仪器:冷冻切片机(德国Kryostat 1720),BX-51奥林巴斯光学显微镜,TC-1型疼痛反应测试仪(西安博邦化工)。
1.2 大鼠分组与OVX模型建立
采用清洁级雌性SD(Sprague Dawley,SD)大鼠(购于西安交通大学实验动物管理中心,动物质量合格证号:陕医动证字08-004),体重180~200 g。大鼠在标准环境下饲养,自由饮食饮水,环境温度22 ℃±1 ℃,湿度在55% ± 10%之间,12 h的昼夜节律(7:00~19:00开灯)。大鼠适应环境3天后,随机分为假手术组(Sham)、卵巢切除安静组(OVX)、卵巢切除+间歇运动组(OVXex),每组8只。各组大鼠行双侧卵巢切除手术。
OVX模型建立:手术依照文献中的操作方法进行[22],1%戊巴比妥钠(40 mg/kg,i.p.)腹腔注射麻醉,剪去大鼠中下背部被毛,取俯卧位于手术台。切口处常规碘伏消毒,大鼠肋弓与脊椎边缘夹角位置稍向下1 cm做与脊柱平行切口,向两侧分离皮肤、筋膜及肌肉,并于腹后壁肌肉层较薄弱处打开腹腔,切口长约1 cm,切口处暴露卵巢。用镊子牵起脂肪组织寻找卵巢,成熟卵巢为淡红色桑葚状,略大于绿豆,与子宫相连。以无齿镊探入腹腔将卵巢轻轻提出体外,小号止血钳夹闭卵巢与子宫相连部位,0号手术线结扎并以眼科剪移除卵巢,去掉止血钳并依次缝合肌肉层、皮肤层。同法去掉另一侧卵巢。假手术组暴露卵巢但不去除。
1.3 运动方案
方案依照文献中操作方法进行[2],OVXex组大鼠在OVX手术1周后开始动物跑台训练。训练起始负荷为10~15 m/min,30 min/天 × 5天/周,之后递进式训练。准备活动为10 m/min × 10 min;正式运动:25 m/min × 7 min和15 m/min × 3 min依次交替,训练持续60 min/天 × 5 天/周× 7 周。
1.4 大鼠的热异常痛行为学检测
每周训练结束1天后上午进行。实验采用双盲法进行,测试部位为大鼠的后足。应用改进的Hargreaves法,以TC-1型疼痛反应测试仪进行热刺激测试[22],出现缩足逃避反射所用时间即为热刺激反应潜伏期(Paw withdrawal thermal latency,PWL)。单次时间大于40 s而动物无反应则停止照射,以免造成组织损伤。
1.5 免疫组织化学检测脊髓EM-2表达
大鼠经1%戊巴比妥钠(100 mg/kg,i.p.)麻醉,以500 mL含4%多聚甲醛和2%饱和苦味酸的0.1 mol/L PB(pH 7.4)行主动脉灌注固定。取脊髓腰膨大(L4~L5)节段置入30%蔗糖(w/v)溶液中,4℃保存。在冷冻切片机中切片,片厚25 μm。EM-2免疫组织化学染色方法参考以前的报道进行[22]。所有切片依次进行以下步骤:1)兔抗EM-2抗血清孵育(4℃ 48 h);2)生物素酰化的羊抗兔IgG(室温4 h);3)卵白素—生物素—过氧化物酶复合物(ABC)试剂盒反应(1 h);4)置入含有0.04% 二氨基联苯四氢氧化物(DAB)和0.003% 双氧水(H2O2)的0.05 mol/L Tris-HCl 缓冲液(pH7.6)中反应,使EM-2-免疫反应阳性产物显色。每个步骤之间,切片要以0.01 mol/L PBS(pH 7.4)溶液清洗。并将切片贴到载玻片上,风干,梯度酒精脱水,二甲苯透明,封片并于光学显微镜下观察。
1.6 统计分析
2 实验结果
2.1 热异常性痛行为学测定结果
在进行OVX手术前,测量获得几组大鼠的PWL在同一水平(约21 s)。OVX手术后,与Sham组大鼠相比,OVX组大鼠的PWL明显降低(约10 s,P<0.05),这种降低趋势持续到手术后8周;与OVX组比较,OVXex组大鼠的PWL显著性增高(P<0.05,图1)。这个实验结果说明,OVX模型诱发出强烈的热异常性痛行为反应,而间歇运动可以减弱OVX诱发的热痛行为学反应。
2.2 脊髓背角的EM-2免疫组织化学染色结果
OVX手术8周后的免疫组织化学染色结果显示,与Sham组相比较,OVX组脊髓背角EM-2的表达降低了,而OVXex组的EM-2表达变化不大(图2)。对于这些图形的半定量分析显示,EM-2的表达在OVX手术后8周(P<0.05,vs Sham)显著性的降低;EM-2在OVXex组的表达则明显增多(P<0.05,vs OVX),与Sham组无明显差异(图3)。
3 讨论与分析
临床和实验研究均表明,伴随着女性月经周期的雌激素波动,女性的疼痛敏感性也随之波动。研究中对实验雌性大鼠伤害性刺激的痛觉评分结果表明,大鼠雌激素水平较低时,其痛觉评分高于雌激素水平较高时[9]。这说明雌激素在疼痛感受过程中有着极为重要的作用。因此,绝经后的女性更易于经历各种疼痛,如纤维肌痛、偏头疼和背痛等[15,19]。采用标准化骨质疏松大鼠模型——OVX模型所做的前期研究表明,雌激素降低到极端状态的OVX大鼠出现了明显的热痛敏行为学反应[22]。针对激素相关疼痛的镇痛,目前在临床上多采用激素替代疗法。这种疗法有着很好的镇痛效果,但同时又隐伏着使患者罹患背痛和颞颌关节病等疼痛的风险[18]。对于临床上作为镇痛金标准的吗啡,也因其引起强烈的副作用,如耐受性、成瘾性和戒断综合征等,而限制了其临床应用。于是,与吗啡有着相似作用途径的内吗啡肽(endomorphins,EMs)引起了研究者的重视。EMs或者在脊神经节处的初级感觉神经元处合成,继而运输到脊髓背角的浅层,通过其内源性配体发挥镇痛作用[14];或者由同侧传入纤维和起源于孤束核的下行纤维释放而发挥其镇痛作用[23]。进一步的研究表明,脊髓EM-2呈卵巢/性激素依赖性释放[10],即在雌鼠动情周期的各个阶段,雌激素水平呈周期性变化,与此相应,EM-2的释放也呈周期性变化[10]。所以在本研究中,我们采用模拟女性绝经期的常用大鼠OVX模型,探讨间歇运动对OVX大鼠热异常痛敏及其腰膨大处脊髓背角EM-2的表达所产生的影响。
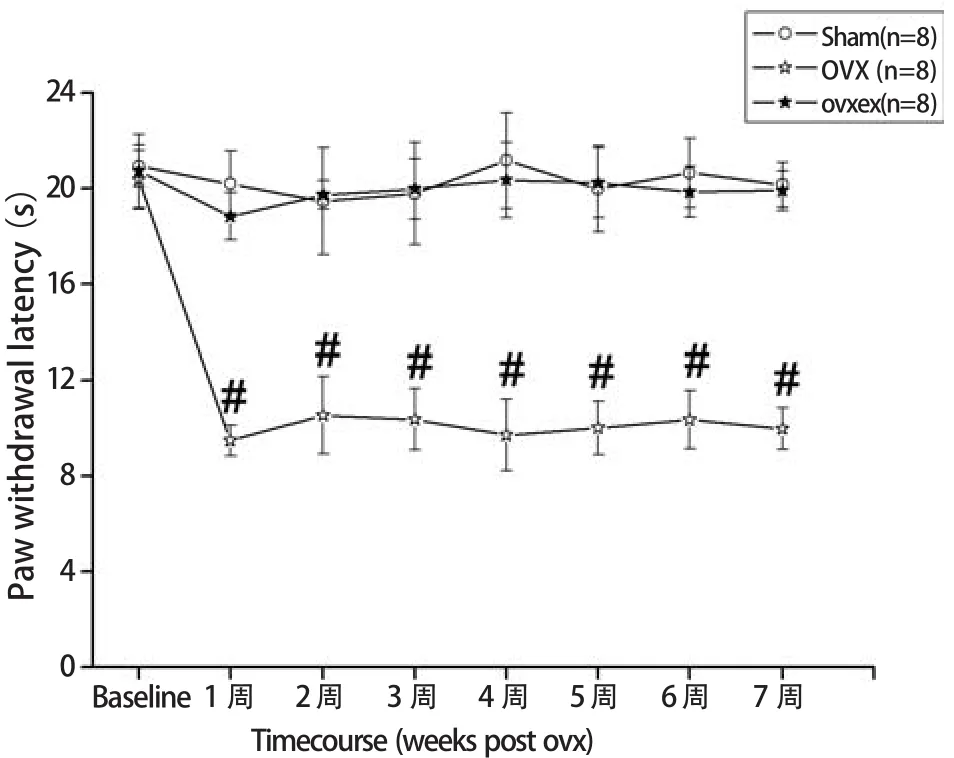
图1 各组大鼠的热痛行为学结果Figure 1 Graphs Showing Timecourse of PWL in the Thermal Hyperalgesia Test
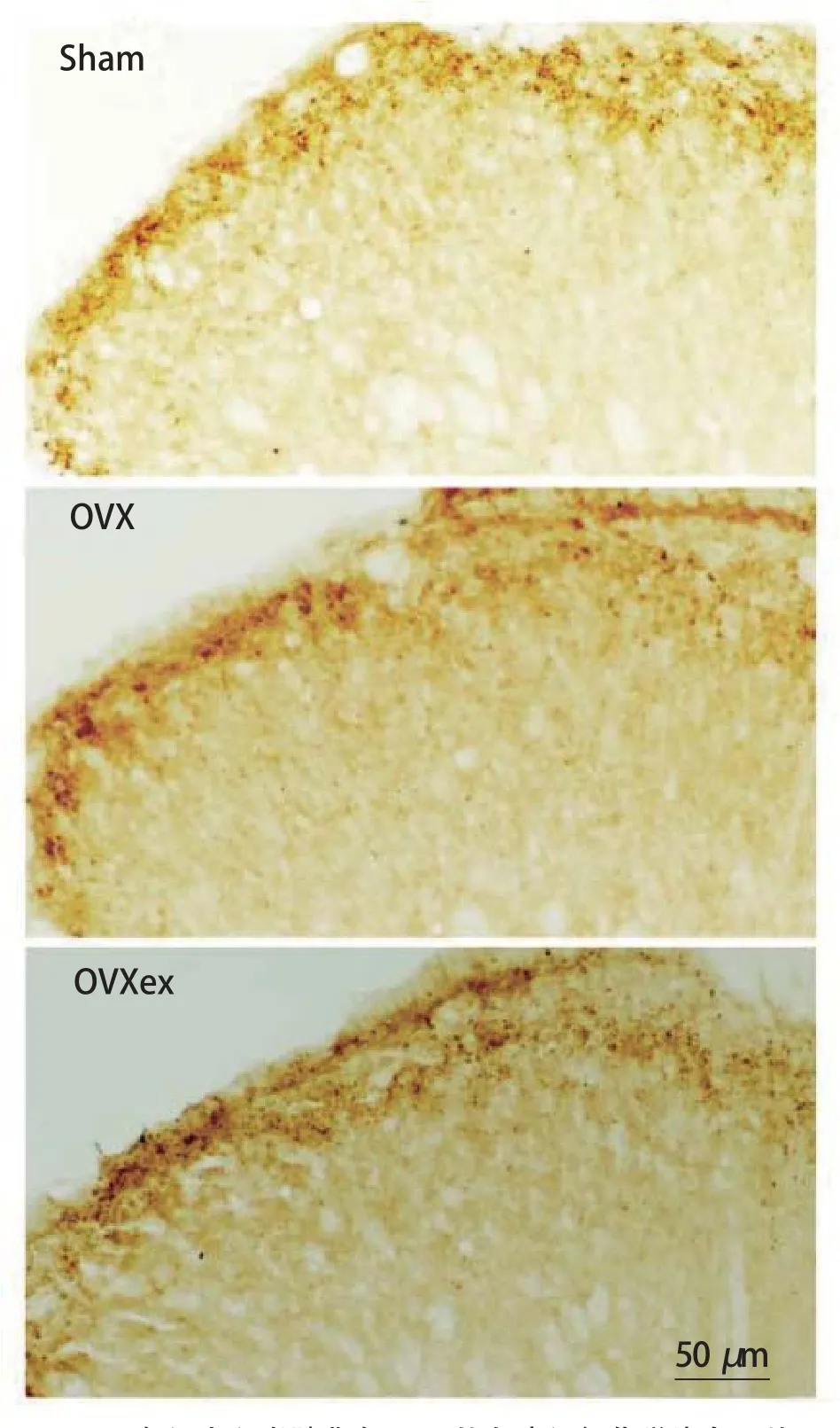
图2 各组大鼠脊髓背角EM-2的免疫组织化学染色图片Figure 2 Photomicrograph Showing the Immunohistochemicalstaining for EM-2 in SDH in the Sham,OVX and OVXex Group
前期[22]和本实验结果均显示,在雌激素极端下降的OVX状态,脊髓背角EM-2的表达呈明显的下降趋势,到OVX手术8周后,EM-2的表达呈一个稳定状态。这些数据说明,脊髓背角EM-2的减少可能是OVX诱导热异常痛敏的一个病理生理学机制。同时,我们对于OVX手术后大鼠,于每周末所进行的热痛行为学测试结果表明,从OVX手术1周后开始,大鼠出现了明显的热异常痛敏反应,此状态一直维持到手术后8周。这与女性更年期有更强的痛感研究结果相一致[15,19]。这些实验结果提示我们,增加脊髓EM-2可能作为一种针对OVX大鼠的热异常痛行为反应的镇痛措施。对OVX大鼠进行外源性鞘内注射EM-2,结果表明,EM-2能剂量依赖性地抑制OVX诱发的热痛敏,且不影响OVX大鼠的运动能力,也不引起OVX大鼠的焦虑情绪。在给予EM-2的拮抗剂后,鞘内注射EM-2的镇痛效果被屏蔽[22]。由此说明,针对OVX引起的大鼠热痛敏,EM-2是有希望作为一个强效镇痛剂的。但是,引起我们注意的是,鞘内注射EM-2有一个很大的缺陷,即由于EM-2在体内的快速降解,所以它的镇痛效用非常短暂,大约持续30 min[22]。与之相反,激素相关性疼痛常常是慢性,而且持久存在的,所以,怎样使EM-2镇痛能够持久发挥作用则是更应该受到关注的问题。
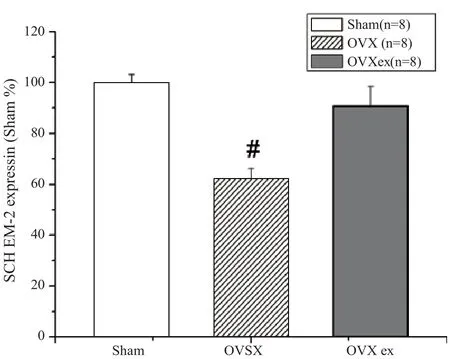
图3 EM-2表达的半定量分析柱形图Figure 3 The Semi-quantitative Analyses of the EM-2 Expression Presented in the Histograph
大鼠OVX模型除了被用于模拟雌激素降低的极端状态,也是标准的骨质疏松模型,在术后8周,可出现明显的骨密度降低等骨质疏松症症状。对于骨质疏松的疗法,除了激素替代疗法以外,运动疗法也是一种常见的治疗措施[3]。运动疗法可预防和改善骨质疏松症引起的骨密度降低等症状[6]。长期的合理运动改善了绝经后综合征的疼痛症状[7,8,16]。然而,关于运动对于OVX模型所引起的热异常痛敏,目前尚缺乏这方面的实验数据。因此,运动能否改善OVX模型所引起的热异常痛敏,能否影响脊髓背角的EM-2就成为本实验关注的焦点。
以前的研究显示,具有一定负荷的持续性运动(60 min/天,4~5/周)对于绝经后症状有更好的改善作用[8]。本实验所采用的运动模式为每日60 min,每周5天的间歇运动模式。结果表明,此负荷的间歇运动能减缓OVX引起的大鼠热异常痛敏,同时,EM-2的免疫组织化学检测结果显示,间歇运动也改善了脊髓背角EM-2的降低状况。与前期的实验相结合,似乎可以推测,热异常痛敏的缓解可能是因为间歇运动增加了脊髓背角EM-2的表达,使其发挥了强效的镇痛效果。而且这种EM-2的内源性增加与外源性鞘内注射EM-2不同,它是一种持续的增加效果,不受EM-2的快速降解影响。另外,从文献中了解到,不同的运动对于绝经期后女性的性激素水平的影响不同,与过度运动和不运动相比较,适当的运动可以引起性激素水平的升高[5]。鉴于脊髓EM-2的性激素依赖性,似乎可以推测运动与EM-2增高之间的关系,当然,这是需要更进一步探讨的问题。
4 结论
间歇运动可显著减弱OVX手术引起的热异常痛敏反应,这种减缓的机制可能与间歇运动诱发大鼠脊髓背角EM-2的增加相关,这个结论还需要进一步的实验来证实。本实验结果有利于证明开展运动干预骨质疏松症,不仅可改善骨密度状况,也可抑制骨质疏松引起的热异常痛敏症状。
[1] 步斌. 游泳运动对大鼠股骨和腰椎骨生物力学特性影响的研究[J]. 体育科学,2005,25(11):55-57.
[2] 田振军,贾单单,蔡梦昕,等. 间歇运动对心梗大鼠心肌LIF及其受体表征和细胞凋亡的影响[J]. 体育科学,2015,35(12):34-40.
[3] 章晓霜,李红,文质君. 不同强度运动和雌激素联合作用对去卵巢大鼠骨骼影响的形态计量学研究[J]. 体育科学,2006,26(8):48-52.
[4] ADERA T,DEYO R A,DONATELLE R J. Premature menopause and low back pain. A population-based study[J]. Ann Epidemiol,1994,4(5):416-422.
[5] BERTONE-JOHNSON E R,TWOROGER S S, HANKINSON S E. Recreational physical activity and steroid hormone levels in postmenopausal women[J]. Am J Epidemiol,2009,170(9):1095-1104.
[6] BOOTH F W,ROBERTS C K,LAYE M J. Lack of exercise is a major cause of chronic diseases[J]. Compr Physiol,2012,2(2):1143-1211.
[7] DALEY A J,STOKES-LAMPARD H J,MACARTHURC. Exercise to reduce vasomotor and other menopausal symptoms:a review[J]. Maturitas,2009,63(3):176-180.
[8] DE A G A C,BAPTISTA F. Inf l uence of habitual physical activity on the symptoms of climacterium/menopause and the quality of life of middle-aged women[J]. Int J Womens Health,2011,3:319-328.
[9] FILLINGIM R B,KING C D,RIBEIRO-DASILVA M C, et al. Sex,gender,and pain:a review of recent clinical and experimental fi ndings[J]. J Pain,2009,10(5):447-485.
[10] GUPTA D S,VON GIZYCKI H, GINTZLER A R. Sex-/ovarian steroid-dependent release of endomorphin 2 from spinal cord[J]. J Pharma Exp Ther,2007,321(2):635-641.
[11] IBIRONKE G F, AJI K E. Pain threshold variations in female rats as a function of the estrus cycle[J]. Nig J Physiol Sci 2011,26(1):67-70.
[12] KRAMER P R,BELLINGER L L. The effects of cycling levels of 17beta-estradiol and progesterone on the magnitude of temporomandibular joint-induced nociception[J]. Endocrinol,2009,150(8):3680-3689.
[13] LERESCHE L,SAUNDERS K,VON KORFF M R, et al. Use of exogenous hormones and risk of temporomandibular disorder pain[J]. Pain,1997,69(1-2):153-160.
[14] MARTIN-SCHILD S,GERALL A A, KASTIN A J, et al. Endomorphin-2 is an endogenous opioid in primary sensory afferent fi bers[J]. Pepts,1998,19(10):1783-1789.
[15] MERIGGIOLA M C,NANNI M,BACHIOCCO V, et al. Menopause affects pain depending on pain type and characteristics[J]. Menopause,2012,19(5):517-523.
[16] MORIYAMA C K, ONEDA B,BERNARDO F R,et al. A randomized,placebo-controlled trial of the effects of physical exercises and estrogen therapy on health-related quality of life in postmenopausal women[J]. Menopause,2008,15(4 Pt 1):613-618.
[17] MUSGRAVE D S, VOGT M T,NEVITT M C, et al. Back problems among postmenopausal women taking estrogen replacement therapy:the study of osteoporotic fractures[J]. Spine,2001,26(14):1606-1612.
[18] SIBILIA J. Corticosteroids and inflammation[J]. Rev Prat,2003,53(5):495-501.
[19] SHUSTER L T. The burden of pain with menopause[J]. Menopause. 2012,19(5):494-495.
[20] TEEPKER M,PETERS M,VEDDER H, et al. Menstrual variation in experimental pain:correlation with gonadal hormones[J]. Neuropsychobiology,2010,61(3):131-140.
[21] WISE E A,RILEY J L 3RD,ROBINSON M E. Clinical pain perception and hormone replacement therapy in post-menopausal females experiencing orofacial pain[J]. Clin J Pain,2000,16(2):121-126.
[22] ZHAO X H, ZHAO Y Q, ZHU C, et al. Different analgesic effect of intrathecal endomorphin 2 on thermal hyperalgesia and evoked inf l ammatory pain in ovariectomized rats[J]. Pain physician,2015,18(2):195-205.
[23] ZHU C, HUI R, CHEN T,et al. Origins of endomorphin-2 immunopositive fibers and terminals in the rat medullary dorsal horn[J]. Brain Res,2011,1410:38-47.
Effect of Interval Exercise on the Expression of Spinal Dorsal Horn Endomorphin-2 in Ovariectomized Rat
ZHAO Xiao-hui
Objectives:The present study was designed to test effects of interval exercise on expression of spinal dorsal horn endomorphin-2 (EM-2) in ovariectomized (OVX) rats. Methods:Female Sprague Dawley (SD) rats,180~200 g,were randomly divided into three groups:Sham-operated group (Sham,n=8),ovariectomized group (OVX,n=8) and OVX with interval exercise group (OVXex,n=8). The OVX model was established to simulating conditions of female menopause. The rats in OVXex were subjected to 7 weeks interval training. The thermal hyperalgesia was detected by behavioral tests 24 hour post each week training. The EM-2 expression of spinal dorsal horn (SDH) in lumbar enlargement was determined with immunohistochemistry staining 24 hour post the end of training. Results:The OVX operation induced obviously thermal hyperalgesia and signif i cantly decreased the EM-2 levels in the superf i cial layers of SDH. Meanwhile,the interval exercise up-regulated EM-2 expression and alleviated the pain behavioral responses in OVX rats. Conclusion:The interval exercise training attenuated the increased pain behavioral responses and might be used as an analgesic strategy for post menopause pain.
interval exercise;ovariectomized;spinal dorsal horn;endomorphin-2;thermal hyperalgesia;Menopause
G804.5
A
1002-9826(2017)03-0037-04
10. 16470/j. csst. 201703006
2016-07-07;
2017-04-18
西安建筑科技大学择优立项课程建设项目。
赵晓慧,女,讲师,博士,主要研究方向为痛与镇痛的神经机制,Tel:029-82202881,E-mail:zxh7612@126.com。
西安建筑科技大学 体育系,陕西 西安710055。Xi’an University of Architecture and Technology,Xi’an 710055,China.

