化疗联合深部热疗对乳腺癌协同抗肿瘤效应分析
廖亚勇+马蕊+姚金娥


摘 要 目的:探讨化疗联合深部热疗对乳腺癌患者的协同治疗效果。方法:选取我院2015年1月至2016年12月期间收治的60例乳腺癌患者,随机分为观察组和对照组各30例,对照组仅实施化疗,观察组使用化疗方案+深部热疗治疗。比较两组患者的临床疗效和不良反应,采用卡氏功能 (KPS)量表对生活质量进行评定。结果:观察组客观缓解率明显高于对照组(P<0.05),而两组间不良反应发生率差异不显著(P>0.05);观察组治疗后的生活质量优于对照组和治疗前(P<0.05)。结论:化疗联合深部热疗治疗乳腺癌患者的近期疗效确切,不增加毒副作用,且提高患者生活质量,具有一定的协同抗肿瘤效果。
关键词 深部热疗 化疗 乳腺癌 临床疗效
中图分类号:R737.9; R730.59 文献标识码:B 文章编号:1006-1533(2017)09-0030-03
Synergistic anti-tumor effect of chemotherapy combined with deep hyperthermia on breast cancer
LIAO Yayong*, MA Rui, YAO Jine
(The Peoples Hospital of Jiangmen City, Guangdong 529020, China)
ABSTRACT Objective: to study the synergy effect of chemotherapy combined with deep thermal therapy for the treatment of patients with breast cancer. Methods: Sixty cases of patients with breast cancer in our hospital from January 2015 to December 2016 were randomly divided into an observation group and a control group with 30 cases each. All the patients were treated by chemotherapy and the observation group was additionally treated by deep hyperthermia. The clinical efficacy and adverse reactions were compared between the two groups and the quality of life was assessed by KPS scale. Results: The objective remission rate was significantly higher in the observation group than in the control group (P<0.05), and the incidence of adverse reactions in both groups showed no significant differences (P>0.05). The quality of life in the observation group was better than that in the control group and before treatment (P<0.05). Conclusion: Recent curative effect of chemotherapy combined with deep hyperthermia on the treatment of patients with breast cancer is exact without the increase of adverse reactions, and it can help improve the quality of life of patients after treatment with certain synergistic anti-tumor effect.
KEy WORDS deep hyperthermia; chemotherapy; breast cancer; clinical curative effect
乳腺癌是女性最常見的恶性肿瘤之一,发病率较高,仅次于子宫癌,且近年来呈年轻化的发展趋势,给患者的生理和心理均带来了严重的影响[1-3]。在临床中,针对乳腺癌疾病的治疗多采用手术、放化疗以及靶向治疗等措施,均对改善患者的疾病起到了一定的效果。其中,化疗可以控制微小病灶,防止乳腺癌的转移和复发。尽管该方法对癌细胞的杀伤作用大,但依然对患者的身体造成了很大损伤。患者在接受化疗后可能会出现身体虚弱、造血和免疫等功能紊乱,毒副作用大,致使患者常难以耐受,进而加重病情[4-6]。因而目前强调多学科综合治疗模式。我院通过对收治的乳腺癌患者实施化疗联合深部热疗进行治疗,取得了良好的治疗效果。
1 资料与方法
1.1 一般资料
选取我院2016年1月至2016年12月期间收治的60例乳腺癌患者作为本研究对象。纳入标准[7-8]:①所有患者均经相关诊断和病理学明确诊断为乳腺癌;②预计生存期在6个月以上;③对本次研究知情同意,同时排除以往有化疗史、合并患有其他心、肾和肺等严重疾病患者。将符合标准的患者随机分为观察组和对照组各30例,其中观察组患者的年龄为39~58岁,平均年龄(47.7±9.2)岁,平均病程(2.0±0.7)年,浸润性导管癌11例,浸润性小叶癌7例,单纯癌6例,其它类型癌6例;临床分期:Ⅰ期2例、Ⅱ期12例、Ⅲ期16例;对照组患者的年龄为39~58岁,平均年龄(45.3±8.6)岁,平均病程(1.6±0.6)年,浸润性导管癌6例,浸润性小叶癌12例,单纯癌6例,其它类型癌6例;临床分期:Ⅰ期3例、Ⅱ期10例、Ⅲ期17例。经比较,两组患者的平均年龄、病程以及肿瘤分期等配对因素无统计学差异(P>0.05)。
1.2 方法
两组患者均采用TA化疗方案(紫杉醇+多柔比星)和5-HT(5-羟色胺)受体拮抗剂治疗。同时观察组再加以使用深部热疗进行治疗,于化疗后的第1天,采用NRL-004深部肿瘤热疗机(吉林迈达医疗器械公司生产)进行治疗,功率设定为500 W,稳定在40~41 ℃间,每周5次,3周为1个疗程。治疗时尽量避开心脏,并用毛巾覆盖眼部,并对治疗期间患者的生命体征进行监测。
1.3 观察指标
分别对两组患者的临床疗效和不良反应情况进行比较,同时采用卡氏功能(KPS)量表对两组患者治疗前后的生活质量进行评定。其中临床疗效采用肿瘤治疗评估标准:完全缓解(CR) 、部分缓解(PR)、无缓解(NR),客观有效率(CR+PR)。
1.4 统计学方法
2 结果
2.1 临床疗效比较
观察组患者的临床总有效率更高于对照组(P<0.05,表1)。
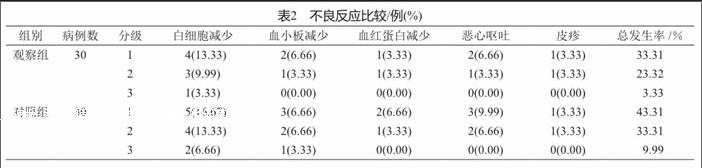
2.2 不良反应比较
观察组的不良反应发生与对照组相比差异无统计学意义(Z=0.566,P>0.05,表2)。
2.3 KPS量表评分比较
两组间治疗前后的KPS评分差异有统计学意义(P<0.05),其中观察组治疗后的评分显著优于对照组(P<0.05,表3)。
3 讨论
临床针对乳腺癌的治疗中,化疗是重要的治疗方法之一。乳腺癌患者采用化疗进行治疗,在一定程度上可以达到消除全身的微转移,防止原发病灶治疗后转移灶的快速发展,还可以避免克隆的出现,该方法具备以下优势[9-11]:①可对远处微转移灶进行早期治疗;②可对原发肿瘤的化疗反应进行综合有效评估;③可促进术后保乳。临床中亦有研究表明[12],采用化疗可以增加局部乳腺癌的无瘤存活率和总体存活率,对乳腺癌患者的治疗起到了有效的促进作用。但尽管如此,化疗亦存在一定的局限性,已有文献证明,该方法会引起卵巢功能受损,甚至造成不可逆的卵巢功能早衰,导致闭经等[2]。
临床实践证实[13-15],肿瘤细胞的生长通常在40 ℃时会受到抑制,41 ℃以上会死亡。热疗是一种可通过局部温差达到杀死肿瘤细胞的方法,其透热深度达25 cm,对各期肿瘤均有杀伤力,同时它还可以对肿瘤代谢、细胞周期和微循环产生作用,以及诱导细胞凋亡,抑制肿瘤侵袭转移等。该治疗方法的原理主要是根据人体温度升高会导致血管扩张,血流加速,散热快,进而不易损伤组织。而肿瘤的供血比正常组织少,所以肿瘤的散热不良、局部温度更高。肿瘤可被高能巨波导致的高热作用杀伤,而正常组织仍保持低温不易损伤。本研究中,对乳腺癌患者分别实施了单纯化疗和化疗联合深部热疗进行治疗,结果表明,同时实施热疗的观察组患者的临床疗效更优于对照组,且未明显增加毒副作用,这说明了热疗不仅不会增加不良反应,反而使各级不良反应总发生率更低于对照组;另外,两组间治疗前后的KPS评分明显升高,观察组的评分更高于对照组,这说明化疗和热疗均可以改善乳腺癌患者的治疗后的生活质量,但热疗的效果更为明显,这可能是热疗的持续恒温加热,可以改变细胞膜的通透性,使化疗药物容易渗入肿瘤细胞内并维持较高药物浓度,利于化疗药物和肿瘤细胞DNA发生交联,增强对肿瘤的杀伤力,进而为患者治疗后的生活质量改善起到一定的作用。
综上所述,深部热疗可以增加化疗的疗效,联合化疗发挥出抗肿瘤的协同作用,不良反应小,且对患者治疗后的近期生存质量具有促进作用。不过,本研究仍然存在一些不足之处,如样本量较小及随访时间较短等缺陷,今后将通过扩大样本量和延长试验观察时间进行再次研究。
参考文献
[1] 秦颖, 张同先, 张巍, 等. 青年乳腺癌临床病理特点分子分型及预后分析[J]. 中国肿瘤临床, 2014, 41(4): 231-236.
[2] Memmi EM, Sanarico AG, Giacobbe A, et al. p63 Sustains self-renewal of mammary cancer stem cells through regulation of Sonic Hedgehog signaling[J]. Proc Natl Acad Sci USA , 2015, 112(11):3499-3504.
[3] 郭鵬. 香菇多糖对缓解乳腺癌化疗后骨髓抑制的临床观察[J]. 河北医药, 2014, 36(22): 3411-3413.
[4] 刘兵雄, 孙圣荣. 改良根除术联合自体植皮术在乳腺癌手术中的应用价值[J]. 实用癌症杂志, 2016, 31(2): 280-282.
[5] 罗秀状, 黄芳艳, 李君丽, 等. 锁骨下静脉置管术在乳腺癌化疗期应用的优越性[J]. 中国医药导报, 2015(5): 36-38, 43.
[6] 刘丹丽, 邵喜英, 罗奇, 等. 乳腺癌患者化疗所致发热性中性粒细胞减少症的预防和治疗进展[J]. 中国肿瘤, 2015, 24(9): 779-784.
[7] 盛树海, 郑进, 刘广寅, 等. 乳腺癌患者化疗前后血脂和体质量指数的变化及其意义[J]. 实用肿瘤杂志, 2013, 28(4): 385-388.
[8] 马涛, 张君莹, 吴建中, 等. miR-342-3p对三阴性乳腺癌化疗敏感性的影响[J]. 中南大学学报(医学版), 2014, 39(5): 488-495.
[9] 林潇, 胡倩, 姚和瑞. 转移性乳腺癌的化疗策略[J/OL]. 中华临床医师杂志: 电子版, 2015, 9(6): 73-78. doi: 10.3877/ cma.j.issn.1674-0785.2015.06.019.
[10] 薛原, 陈永法. 两种乳腺癌化疗方案的药物经济学评价综述[J]. 中国药物经济学, 2013(6): 11-14.
[11] 李青剑, 丁林, 姚和瑞. 2015年乳腺癌辅助化疗进展[J].岭南现代临床外科, 2016, 16(1): 7-10.
[12] 艾中平, 高晓岚, 吴有凤, 等. 乳腺癌患者化疗期间焦虑、抑郁的变化趋势及其相关因素[J]. 重庆医科大学学报, 2013, 38(7): 677-682.
[13] 刘淑艳. 微波热疗联合化疗治疗晚期乳腺癌18例观察[J].中国社区医师: 医学专业, 2008, 10(5): 37-38.
[14] 黄乾鹏, 朱立新, 许小亮. 乳腺癌治疗中热疗的研究进展[J/OL]. 中华乳腺病杂志(电子版), 2013, 7(5): 50-53. doi: 10.3877/cma.j.issn.1674-0807.2013.05.012.
[15] 吴辰. 局部微波热疗与化疗联合应用于胸壁复发乳腺癌的近期疗效分析[J]. 临床和实验医学杂志, 2012, 11(24): 1940-1941.

