不同生境的长蕊木兰幼苗春季的光合特性1)
马加芳 李贵祥 柴勇 和丽萍 孟广涛
(昆明理工大学,昆明,650093) (云南省林业科学院)
不同生境的长蕊木兰幼苗春季的光合特性1)
马加芳 李贵祥 柴勇 和丽萍 孟广涛
(昆明理工大学,昆明,650093) (云南省林业科学院)
用Li-6400XT便携式光合仪对高黎贡山南段3种生境(荒草地、林下、苗圃)中生长的国家Ⅰ级保护植物长蕊木兰幼苗进行连续3d的光合特性测定,为其科学保护提供一定依据。结果显示:①3种生境下的幼苗净光合速率、蒸腾速率、气孔导度日变化未见“午休”现象,9:00—11:00所测值为1 d中最高;水分利用率无明显变化规律;胞间CO2摩尔分数与其他光合参数日变化相反。②相关性分析显示,光合有效辐射、相对湿度、空气温度、大气CO2摩尔分数对幼苗净光合速率的影响为,荒草地幼苗从大到小依次是光合有效辐射、相对湿度、空气温度、大气CO2摩尔分数;林下幼苗从大到小依次是光合有效辐射、空气温度、相对湿度、大气CO2摩尔分数;苗圃幼苗从大到小依次是光合有效辐射、相对湿度、大气CO2摩尔分数、空气温度。③荒草地幼苗光饱和点为(1 284.96±48.231)μmol·m-2·s-1、林下幼苗(1 052.31±24.746)μmol·m-2·s-1,苗圃幼苗(1 255.62±52.374)μmol·m-2·s-1;光补偿点分别为(28.65±1.094)、(17.09±0.828)、(6.75±0.317)μmol·m-2·s-1,饱和点后,三者均出现抑制现象。④CO2响应曲线差别较大,其中荒草地幼苗最高,三者CO2饱和点不明显,补偿点分别为荒草地幼苗(103.75±6.826)μmol·m-2·s-1、林下(102.67±5.081)μmol·m-2·s-1、苗圃(130.1±2.022)μmol·m-2·s-1,说明不同生境下的幼苗光合特性存在细微差别,苗圃环境下光合特性最强。
长蕊木兰;不同生境;光合特性
绿色植物中最重要的生理特性是光合作用,被称为地球上最重要的化合反应[1]。分析植物光合作用对于研究植物有重要指导意义。在近10 a间,研究者们已掌握了大量植物的光合特性,其中以木兰科植物为例,将濒危物种华木莲(Sinomanglietiaglauca.)与乳源木莲(ManglietiayuyuanensisLaw.)、巴东木莲(Manglietiapatungensis.)进行光合特性测定比较,发现同一环境下生长的华木莲需水量更大。这对于研究其濒危机制,增加其成活率起重要作用[2]。2012年,有研究者对杭州西湖公园绿地中最常见的6种木兰科植物:广玉兰(MagnoliaGrandifloraLinn.)、二乔玉兰(MagnoliasoulangeanaSoul.-Bod.)、白玉兰(MicheliaalbaDC.)、乐昌含笑(MicheliachapensisDandy.)、马褂木(LiriodendronchinenseHemsl. Sarg)、含笑(MicheliafigoLour. Spreng.)进行光合特性测定[3],由此推知6种植物的园林环境固碳等能力,有助于合理种植植物。
长蕊木兰(Alcimandracathcardii.)属木兰科中的单种属植物,现为国家Ⅰ级保护对象[4],研究长蕊木兰对于研究植物进化史有重大意义。但其在世界的分布范围窄,中国主要集中在云南西北部及西藏东部2 400 m的森林内[5],其天然更新能力弱,又遭到了人类的采伐破坏,导致其数目下降,为此目前的研究重心主要在繁育上。例如2006—2011年,研究者选用不同的贮藏和处理方法,对长蕊木兰的种子进行发芽试验,证实长蕊木兰种子适宜沙藏,层积催芽1个月能够显著提高种子发芽率[6]。但以往还未见关于长蕊木兰的光合特性的详细报道,笔者以高黎贡山为研究地,初步探究了高黎贡山大环境下不同小生境(荒草地、人工管理苗圃、原生森林)中长蕊木兰幼苗在春季开始生长时的光合参数日变化及其光合速率与环境因子的关系等相关光合特性,旨在为物种的科学研究、有效保护、合理开发提供相关指导。
1 研究地概况
实验地位于云南省高黎贡山南段,东经98°45′,北纬24°50′,属于亚热带高原季风气候。海拔2 000~2 400 m,年均气温15.5 ℃,年均降水量约为1 650 mm;降水集中,干湿季分明,5—10月份为湿季,11月份—翌年4月份为干季,干季日照时间全年最高[7]。实验荒草地以肾蕨(NephrolepisauriculataL. Trimen)为优势种,伴生有芒萁(Dicranopterisdichotoma)、黄毛草莓(FragarianilgerrensisSchltdl)等,无灌木与乔木,处于迎风坡;实验大棚也处于迎风坡,大棚内温度平均20 ℃以上,湿度在70%以上;实验森林位于背风坡,郁闭度大,以高大乔木薄片青冈(Cyclobalanopsislamellosa(Smith) Oerst)、毛柄槭(Acerpubipetiolatum)、硬壳柯(Lithocarpushancei(Benth.) Rehd)等为主,少灌木与草本。
2 材料与方法
2.1 材料
测量仪器选用美国生产的Li-6400便携式光合作用仪。在2016年3月典型晴朗天气下,选择了3种不同生境下生长的长蕊木兰幼苗各3株,每株平均高度50 cm;所选叶片大小一致,生长健康,无病虫害,避开使用残叶,分别对植株的第3—5叶位进行标记。
2.2 光合参数日变化测定
选择已经标记好的植株叶片,调整好仪器,8:00开始第一次测量,以后每1 h测一次,直到下午18:00。分别对每植幼苗的3片叶子依次进行测量,每片叶子标记3次。记录光合参数净光合速率、气孔导度、蒸腾速率、胞间CO2摩尔分数、光合有效辐射、水分利用率(水分利用率=净光合速率/蒸腾速率),并在连续的3 d典型晴天下重复测量。
2.3 光响应曲线和CO2响应曲线的测定
调整好仪器,选用日变化时标记的叶片,在上午9:00—11:00进行测定。
进行光响应测定时,控制叶温25 ℃,CO2摩尔分数400 μmol·mol-1,空气相对湿度50%,流速500 μmol·s-1,光合有效辐射设定梯度为2 000、1 500、1 000、500、250、120、60、30、15、0 μmol·m-2·s-1。光响应曲线拟合模型采用直角双曲线修正模型[8-10],表达式:
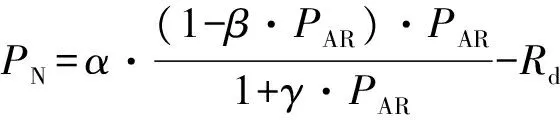
式中:PN为净光合速率;PAR为光合有效辐射;α为曲线初始斜率;β为修正系数;γ为α与最大净光合速率比值;Rd为暗呼吸速率。求出不同生境下长蕊木兰幼苗的光饱和点、光补偿点。
进行CO2响应测定时,控制叶温25 ℃,光合有效辐射1 200 μmol·m-2·s-1,空气相对湿度50%,流速500 μmol·s-1,CO2摩尔分数值设定梯度为2 000、1 800、1 500、1 200、1 000、800、600、400、300、200、150、100、50 μmol·mol-1。CO2曲线采用二次曲线回归方程进行分析,得出CO2补偿点。
2.4 数据处理
所得数据采用Microsoft Excel2010进行绘图,用Microsoft Word2010绘制表格,用IBM SPSS Statistics 19.0对相应数据进行方差分析,得出平均值±标准差,并对响应曲线相关分析。
3 结果与分析
3.1 净光合速率日变化
在图1中显示,3 d典型的晴天中,林下幼苗的净光合速率的日变化与荒草地及苗圃幼苗的净光合速率的变化无论在哪天的对比中都存在较大差异。林下幼苗净光合速率均在10:00—16:00变化小,均保持在1.0~2.0 μmol·m-2·s-1;在10:00之前与16:00之后则很低,并未出现双峰或单峰,午休现象未见。荒草地幼苗与苗圃幼苗的双峰也不明显,但二者在上午时段10:00—12:00净光合速率出现最高值,前者最高的一天是(4.231±0.689)μmol·m-2·s-1,后者是(4.153±0.342)μmol·m-2·s-1;中午12:00—14:00有个缓慢下降的趋势,则二者在下午又会出现一个略微的小高峰。其中,荒草地幼苗在第1天的下午15:00时出现急速下降,为(1.84±0.092)μmol·m-2·s-1,这与此时段天气出现少量云,影响光辐射强度有关。
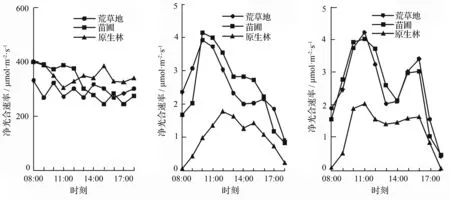
a.第1天 b.第2天 c.第3天
图1 不同生境下长蕊木兰幼苗净光合速率日变化
3.2 胞间CO2摩尔分数与气孔导度日变化
在测量时发现胞间CO2摩尔分数与净光合速率呈现一定的负相关性,这与濒危植物长序榆幼苗[11]、孑遗植物四合木[12]等日变化相似,3 d测量里林下幼苗的胞间CO2摩尔分数均略高于苗圃幼苗与荒草地幼苗的。从图2可知,3种生境下幼苗在3 d的天气测量中的胞间CO2摩尔分数最高值不明显,在第3天的测量中,胞间CO2摩尔分数都出现了3天测量的最低值,苗圃幼苗与林下幼苗出现在15:00—16:00,前者胞间CO2摩尔分数为(234.215±45.236)μmol·mol-1,后者胞间CO2摩尔分数值为(251.452±14.389)μmol·mol-1,而荒草地幼苗的胞间CO2摩尔分数最低值则出现在上午9:00—11:00,为(243.895±17.616)μmol·mol-1。
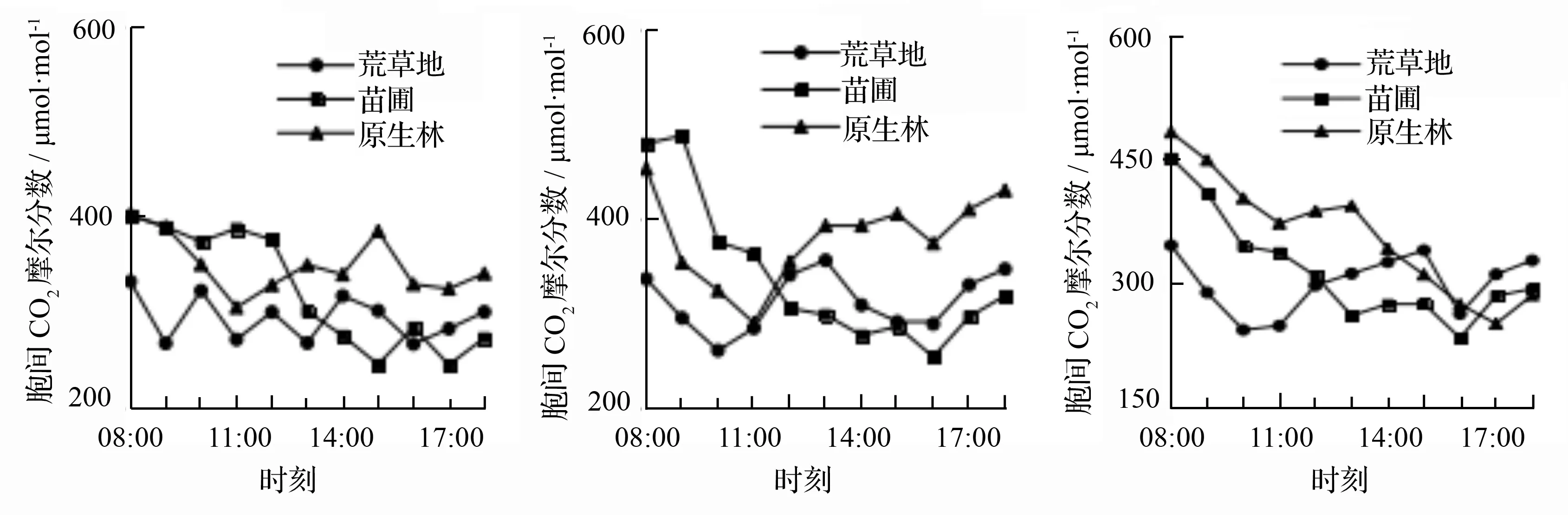
a.第1天 b.第2天 c.第3天
图2 不同生境下长蕊木兰幼苗胞间CO2摩尔分数日变化
用Li-6400测定的气孔导度处于0~1。从图3中总趋势可得,气孔导度与净光合速率呈现一定的复杂相关性,林下幼苗的气孔导度变化最稳定,第1天和第3天的最大值出现在10:00,第2天的测量最大值出现在11:00,对比3 d的气孔导度,最高为(0.067±0.002 3)mol·m-2·s-1,并都在下午时段出现平稳下降;荒草地幼苗的气孔导度也不稳定,3 d里最大值出现在了第2天11:00左右,为(1.0±0.025 3)mol·m-2·s-1;苗圃幼苗的气孔导度变化也不明显,在第2天12:00出现最高值,为(0.089±0.001 7)mol·m-2·s-1,而最低值在下午17:00后,这与濒危植物长序榆当年生幼苗[11]的气孔导度日变化相似。
3.3 蒸腾速率与水分利用率日变化
蒸腾速率的日变化与净光合速率变化趋势是一致的。林下幼苗的蒸腾速率在3次的测量里,每一次都在11:00前后出现一个小高峰,后续时段一直下降,均保持在较低状态;荒草地幼苗与苗圃幼苗的蒸腾速率出现了相似的变化趋势,二者每次测量的高峰值都在9:00—11:00,荒草地的最高值是第2天的11:00,为(1.154±0.004)mmol·m-2·s-1;苗圃幼苗的最高值在第3天的11:00左右,为(0.941±0.008)mmol·m-2·s-1,而在9:00之前与17:00之后都会出现一天中的最低值。
植物叶片的水分利用率是光合参数的重要数据,水分利用率的强弱与植物的抗旱能力有关,其值受净光合速率和蒸腾速率限制[13-14]。林下幼苗的水分利用率变化值最大,3次实验中都在15:00—17:00出现一天中的极大值,第3天的15:00达到(11.148±3.426)μmol·mmol-1;苗圃幼苗的变化值总体较为稳定,但在第2次的测量中数值相差较大,最大值在17:00,为(10.828±0.142)μmol·mmol-1,最小值在9:00,为(2.313±0.034)μmol·mmol-1;荒草地幼苗变化较为平稳,从3次测量结果来看,均呈现出了双峰趋势,在9:00—11:00出现一个高值,15:00—17:00出现第2个高值。
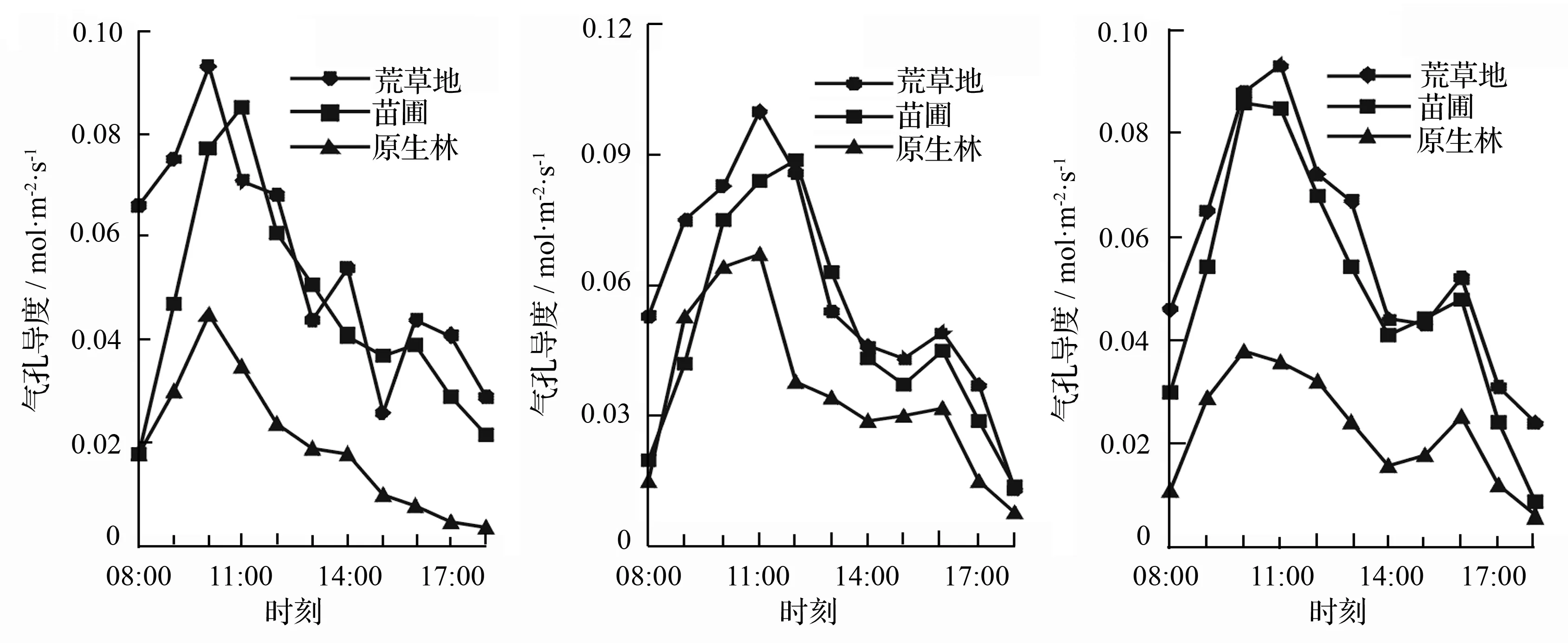
a.第1天 b.第2天 c.第3天
图3 不同生境下长蕊木兰幼苗气孔导度日变化
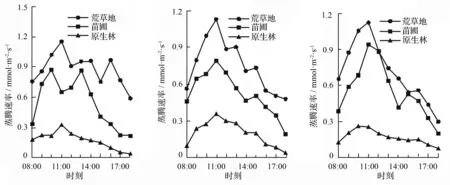
a.第1天 b.第2天 c.第3天
图4 不同生境下长蕊木兰幼苗蒸腾速率日变化
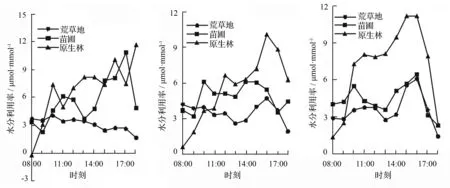
a.第1天 b.第2天 c.第3天
图5 不同生境下长蕊木兰幼苗水分利用率日变化
3.4 净光合速率与环境因子的相关性
生境不同环境因子的影响随之而变,在表1—3中分析了净光合速率与光合有效辐射、空气温度、大气CO2摩尔分数、相对湿度的显著相关性。可知,3种环境下幼苗的净光合速率与光合有效辐射的相关性最为显著,呈现正相关关系,这与日变化图的趋势一致,它与空气温度、大气CO2摩尔分数、相对湿度也呈现出正相关关系。三者对比来看,荒草地幼苗净光合速率值与各因子的影响从大到小为:荒草地幼苗从大到小依次是光合有效辐射、相对湿度、空气温度、大气CO2摩尔分数;苗圃幼苗从大到小依次是光合有效辐射、相对湿度、大气CO2摩尔分数、空气温度;林下幼苗从大到小依次是光合有效辐射、空气温度、相对湿度、大气CO2摩尔分数。
表1 荒草地长蕊木兰幼苗净光合速率与环境因子相关性分析
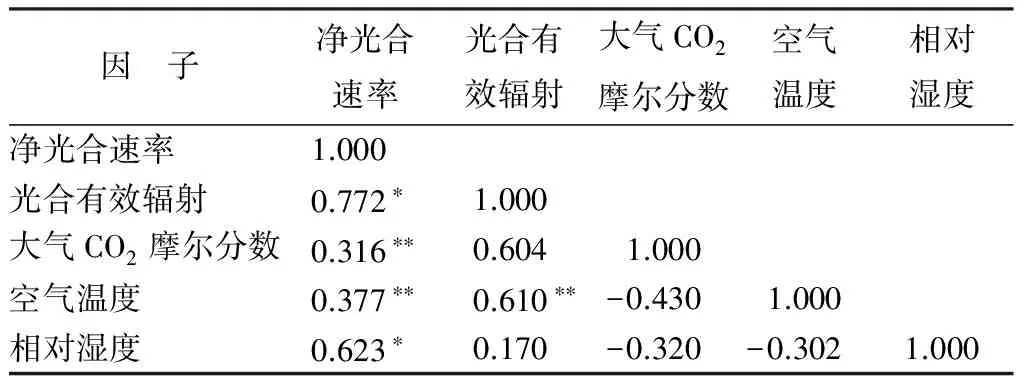
因 子净光合速率光合有效辐射大气CO2摩尔分数空气温度相对湿度净光合速率1.000 光合有效辐射0.772∗1.000大气CO2摩尔分数0.316∗∗0.6041.000空气温度0.377∗∗0.610∗∗-0.4301.000相对湿度0.623∗0.170-0.320-0.3021.000
注:*表示相关性显著(P<0.05);** 表示相关性极显著(P<0.01)。
表2 苗圃长蕊木兰幼苗净光合速率与环境因子相关性分析
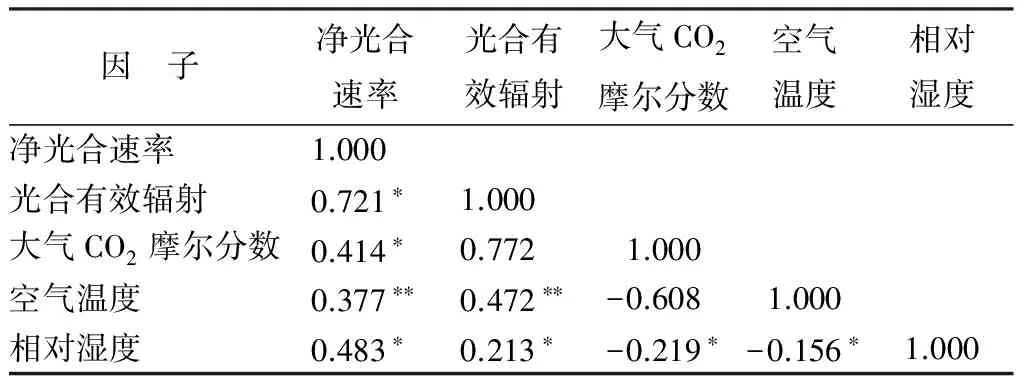
因 子净光合速率光合有效辐射大气CO2摩尔分数空气温度相对湿度净光合速率1.000 光合有效辐射0.721∗1.000 大气CO2摩尔分数0.414∗0.7721.000空气温度0.377∗∗0.472∗∗-0.6081.000相对湿度0.483∗0.213∗-0.219∗-0.156∗1.000
注:*表示相关性显著(P<0.05);** 表示相关性极显著(P<0.01)。
表3 林下长蕊木兰幼苗净光合速率与环境因子相关性分析
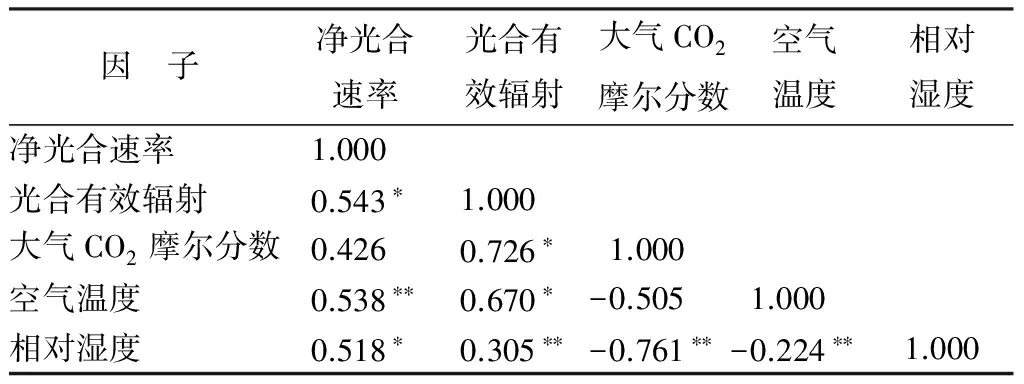
因 子净光合速率光合有效辐射大气CO2摩尔分数空气温度相对湿度净光合速率1.000 光合有效辐射0.543∗1.000 大气CO2摩尔分数0.4260.726∗1.000 空气温度0.538∗∗0.670∗-0.5051.000 相对湿度0.518∗0.305∗∗-0.761∗∗-0.224∗∗1.000
注:*表示相关性显著(P<0.05);** 表示相关性极显著(P<0.01)。
3.5 长蕊木兰幼苗光响应
从图6可知,3种生境下的幼苗对光的响应趋势具有一致性,在光合有效辐射低于500 μmol·m-2·s-1时,3者的净光合速率都呈现快速上升;净光合速率在500~1 000 μmol·m-2·s-1时上升趋势较缓慢,1 500~2 000 μmol·m-2·s-1时开始下降,发生了光抑制现象,其中苗圃幼苗这一现象较为显著。
用表中数据进行模型拟合,苗圃幼苗与荒草地幼苗的光饱和点高于林下幼苗,前二者分别是(1 284.96±48.231)、(1 255.52±52.374)μmol·m-2·s-1,林下为(1 052.31±24.741)μmol·m-2·s-1。
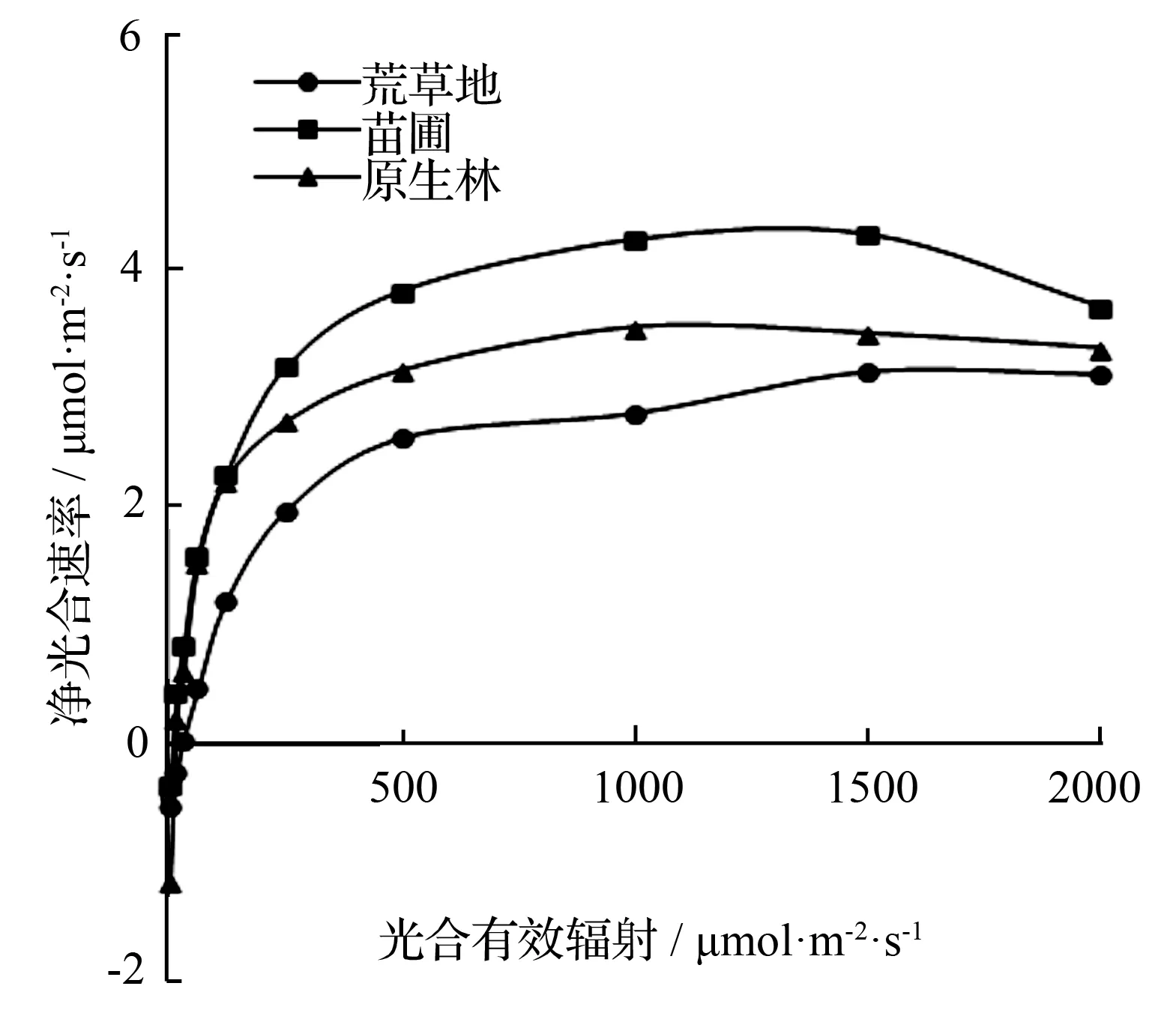
图6 不同生境下长蕊木兰幼苗光响应曲线

生 境光饱和点/μmol·m-2·s-1光补偿点/μmol·m-2·s-1荒草地幼苗1284.96±48.23128.63±1.904苗圃幼苗1255.62±52.3746.75±0.317林下幼苗1052.31±24.74617.09±0.828
注:表中数据为平均值±标准差。
3.6 长蕊木兰幼苗CO2响应
如图7所示,在相同CO2摩尔分数梯度下,3种生境下的长蕊木兰幼苗净光合速率都随着CO2摩尔分数的加大而不断上升;但三者又呈现出一个差异性,其中苗圃和林下的长蕊木兰幼苗对CO2摩尔分数的响应趋势是一致的,而荒草地幼苗则明显高于前二者,且从图上未能明显看出幼苗对CO2饱和点。
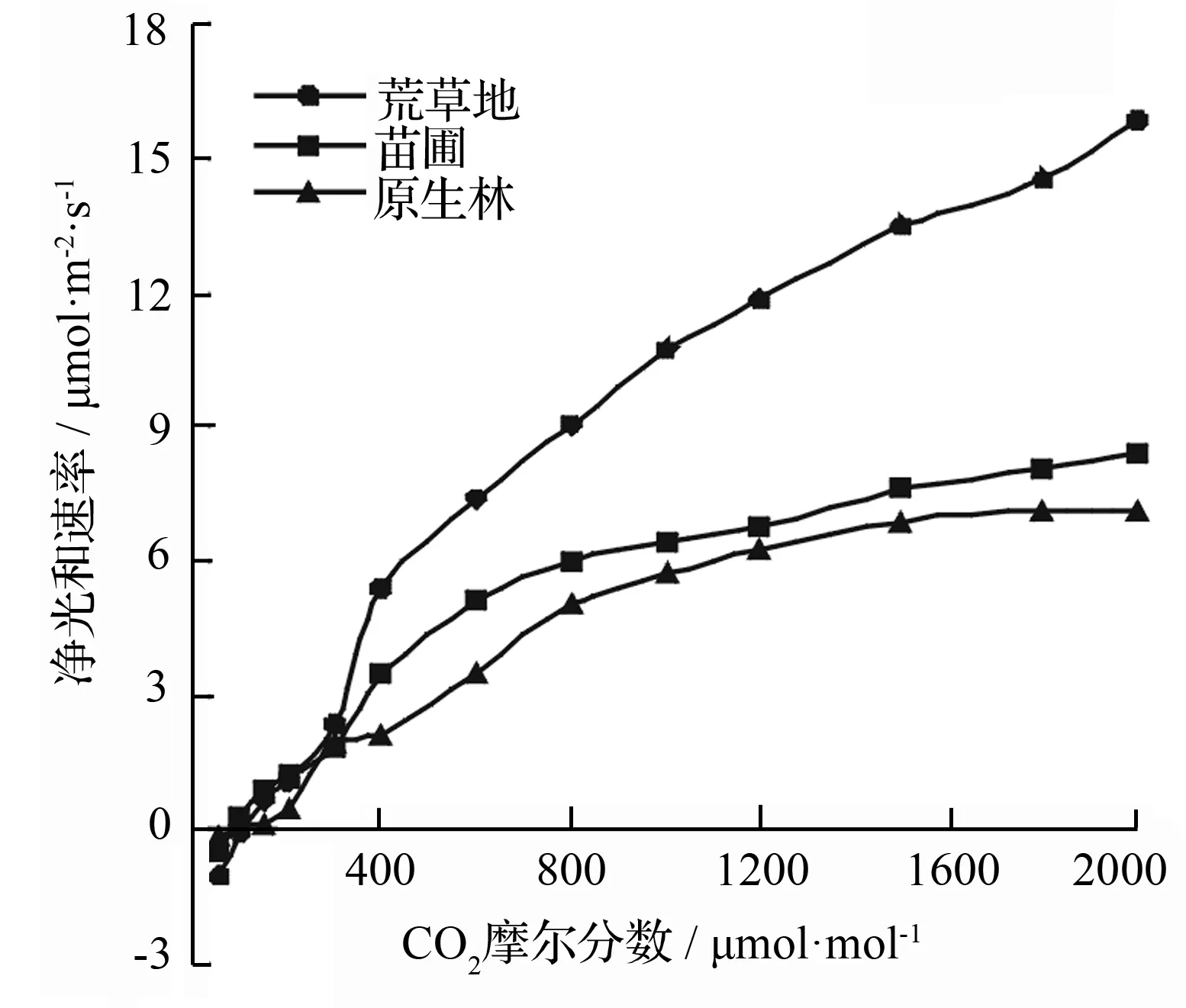
图7 不同生境下长蕊木兰幼苗CO2摩尔分数响应曲线
通过对曲线分析做出以下回归方程,苗圃:y=-0.000 002x2+0.009 21x-1.158 7;荒草地:y=-0.000 004x2+0.016 41x-1.654 9;林下:y=-0.000 003x2+0.009 12x-0.904 96。代入回归方程中计算,可以得出苗圃内种植的幼苗CO2补偿点为(130.1±2.022)μmol·mol-1,荒草地种植的幼苗CO2补偿点为(103.75±6.826)μmol·mol-1,原生林下幼苗的CO2补偿点为(102.67±5.081)μmol·mol-1。这样的数据表明长蕊木兰幼苗在春季生长时CO2补偿点都偏高。
4 讨论
连续对3种生境下生长的各3株长蕊木兰幼苗进行3 d的重复光合参数日变化测定,曲线的趋势变化都大体一致,幼苗均未出现“午休”现象,单峰或双峰趋势也不明显,日变化、光响应曲线、CO2响应曲线中净光合速率趋势不一致。结合光响应曲线而得出的光饱和点以及相关性分析中三者的净光合速率与光合有效辐射有明显相关性可推知:趋势不明显的主要原因与所测天气有关,虽然选测的日子在初春,理论上是晴朗的好天气,但实际上光合有效辐射不是太强,曲线的变化也就波动;特别是第一次测量里荒草地幼苗在15:00时段净光合速率曲线极速下降,这与这一时段云量较大有关。叶片的气孔是植物的重要超微结构[15],CO2、H2O、O2通过气孔进出植物,与光合作用密切相关。不同生境下幼苗的气孔导度日变化趋势与净光合速率日变化趋势都是一致的,即呈现出正相关;蒸腾速率与水分利用率是指示植物需水量的重要指标,蒸腾速率强弱与净光合速率也呈现正相关性,但水分利用率日变化规律却不明显,所以长蕊木兰幼苗具体的抗旱性还需进一步探究。胞间CO2摩尔分数的日变化与净光合速率呈现负相关,这与很多绿色植物的日变化趋势相似[16-18]。
在光响应实验中,三者的光饱和点都在1 000~1 300 μmol·m-2·s-1,说明长蕊木兰属于阳生植物,喜温,在人工育苗时可适量调整光照。三者的光补偿点最高的为荒草地幼苗(28.625±1.904)μmol·m-2·s-1,最低为苗圃幼苗(6.75±0.317)μmol·m-2·s-1,这也就导致了三者光补偿点与光饱和点有差值,其中苗圃幼苗最大,说明苗圃内的长蕊木兰幼苗能适应更大的光照幅度。
3生境下生长的幼苗,CO2补偿点都在1 000~1 300 μmol·m-2·s-1,偏高。同时在CO2饱和抑制阶段,CO2不再是光合作用的限制因子,RuBP(1,5-二磷酸核酮糖)的再生速率成了影响因子[19]。在本研究中,3种长蕊木兰幼苗CO2响应曲线在达到高值时也未见明显抑制现象,这可能与光合作用中RuBP的再生速率及Rubiscos(1,5-二磷酸核酮糖羧化酶/加氧酶)羧化效率有很关。
在实验中,选择的苗圃幼苗与林下幼苗的生长环境条件具有一定的特殊性,苗圃幼苗由于定期浇水,加盖有大棚调温调湿,形成最合适的生长小环境,所以长势最好,标准差值小,数据更具稳定性,光合特性参数也具有极优性。林下幼苗的光合日变化、光饱和点、CO2补偿点均低于其他二者,这与其生境郁闭度大、透光率低、空气流速低等有密切关系。相比来说,探究荒草地幼苗光合特性,使长蕊木兰幼苗能够适应人工种植荒草地区所处环境的机制,以提高其成活率,是更好地繁育保护该物种的一条途径。
[1] 潘瑞炽.植物生理学[M].7版.北京:高等教育出版社,2012.
[2] 郭起荣,李志雄,施建敏.华木莲与木莲属两树种光合生理生态研究[J].江西农业大学学报,2003,25(5):645-651.
[3] 饶显龙,王丹,吴仁武,等.杭州西湖公园6种木兰科植物固氮释氧能力[J].福建林业科技,2014(3):1-5.
[4] 闫双喜,李永华,位凤宇.中国木兰科植物的地理分布[J].武汉植物学研究,2008,26(4):379-384.
[5] 刘玉壶.中国木兰[M].北京:科学技术出版社,2004.
[6] 余新林.长蕊木兰发芽试验[J].基础科学,2012(9):91-93.
[7] 袁春明,孟广涛,方向京,等.珍稀濒危植物长蕊木兰种群的年龄结构与空间分布[J].生态学报,2012,32(12):3866-3872.
[8] 钟楚,朱勇.几种光合作用光响应模型对烟草的适应性分析[J].中国农业气象,2013,34(1):74-80.
[9] 宋佩东.5种光响应模型对小叶杨的适用性分析[J].辽宁林业科技,2015(3):9-12.
[10] 叶子飘,康华靖.植物光响应修正模型中系数的生物学意义研究[J].扬州大学学报(农业与生命科学版),2012,33(2):51-57.
[11] 高建国,徐根娣,李文巧,等.濒危植物长序榆(Ulmuselongata)幼苗光合特性的初步研究[J].生态环境学报,2011,20(1):66-71.
[12] 智颖飙,李红丽,崔艳,等.孑遗植物四合木(Tetraenamongolica)迁地保护中的光合作用日变化特征与生理生态适应性[J].生态环境学报,2015,24(1):14-21.
[13] ZHANG H N, SU P X, LI S J. Indicative effect of the anatomical structure of plant photosynthetic organ on WUE in desert region[J]. Acta Ecologica Sinica,2013,33(16):4909-4918.
[14] 刘周莉,赵明珠,秦娇娇,等.三种木质藤本植物光合特性比较研究[J].生态环境学报,2015(6):952-956.
[15] 王丽娟,李天来,马刚,等.苗期夜间低温对番茄叶片开张度日变化及叶片超微结构的影响[J].北方园艺,2011(11):1-4.
[16] DENG X, LI X M, ZHANG X M. The studies about the photosynthetic response of the four desert plants[J]. Acta Ecologica Sinica,2003,23(3):598-605.
[17] 周丽,杨学娇,陈诗.油松不同种群2年生苗木光合特性比较[J].西部林业科学,2014(3):153-158.
[18] 范玉龙,胡楠,丁圣彦.伏牛山自然保护区不同生长阶段栓皮栎(Quercusvariabilis)的光合生理生态特性[J].生态与农村环境学报,2015(5):684-689.
[19] 李合生,现代植物生理学[M].3版.北京:高等教育出版社,2011.
Photosynthetic Characteristics ofAlcimandracathcardiiSeedlings of Different Habitats in Spring//
Ma Jiafang(Kunming University of Science and Technology, Kunming 650093, P. R. China); Li Guixiang, Chai Yong, He Liping, Meng Guangtao(Yunnan Academy of Forestry)//
Journal of Northeast Forestry University,2017,45(4):43-48.
Photosynthetic characteristics of protected plantAlcimandracathcardiiseedlings of three habitats (wasteland, underforest, nursery) in Gaoligong Mountains southern section were measured by three successive days using Li-6400XT Portable Photosynthesis System. The results showed that: ①the diurnal courses of net photosynthetic rate, transpiration rate, stomatal conductance of seedlings under three habitats had no “midday depression”, and the highest at 9: 00-11: 00; the diurnal courses of intercellular CO2concentration was opposite to the net photosynthetic rate; water use efficiency had no significant change in the law. ②By correlation analysis, the net photosynthetic rate was influenced by environmental factors: light intensity, relative humidity, air temperature, atmospheric CO2concentration. According to descending order, seedlings of wasteland: light intensity, relative humidity, air temperature, atmospheric CO2concentration; seedlings of underforest: light intensity, air temperature, relative humidity, atmospheric CO2concentration; seedlings of nursery: light intensity, relative humidity, atmospheric CO2concentration, air temperature. ③Light saturation point of wasteland seedlings was (1 284.96±48.231)mol·m-2·s-1, underforest seedlings was (1 052.31±24.746)μmol·m-2·s-1, nursery seedlings was (1 255.62±52.374)μmol·m-2·s-1, light compensation point were (28.65±1.904), (17.09±0.828), (6.75 ±0.317)μmol·m-2·s-1, after the light saturation point, the three appeared caught inhibition; ④CO2response curves varied greatly, the highest was wasteland seedlings, three CO2saturation point was not obvious, the compensation point of wasteland seedlings was (103.75±6.826)μmol·m-2·s-1, underforest seedlings was (102.67±5.081)μmol·m-2·s-1, nursery seedlings was (130.1±2.022)μmol·m-2·s-1, therefore, there were nuances for the photosynthetic characteristics of seedlings under different habitats, and the nursery environment were the best.
Alcimandracathcardii; Seedlings; Different habitats; Photosynthetic characteristics
马加芳,女,1993年7月生,昆明理工大学环境科学与工程学院,硕士研究生。E-mail:1272093640@qq.com。
李贵祥,云南省林业科学院,研究员。E-mail:lguixiang7558@126.com。
2016年6 月14 日。
Q945.11
1)林业公益性行业科研专项(201304306)。
责任编辑:戴芳天。

