杨树MYB基因应答非生物胁迫的表达特性1)
冯波 朱腾飞 张弛 董博 周博如
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
杨树MYB基因应答非生物胁迫的表达特性1)
冯波 朱腾飞 张弛 董博 周博如
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
MYB转录因子以其含有的保守MYB结构域为特征,是植物转录因子中数量最多的家族之一,广泛参与植物生长发育和代谢的调节。利用生物信息学分析获得222条杨树MYB基因,用实时定量PCR筛选出8条对盐胁迫有强烈应答的基因,研究其在盐、干旱、ABA等非生物胁迫下的表达模式;结果表明:这8条MYB基因虽然在杨树根、茎、叶组织中均有表达,但是在不同胁迫条件和不同组织中的表达水平明显不同。在盐和干旱胁迫条件下,8个基因在根、茎、叶中均被诱导表达,表现为相似的表达模式。在ABA处理条件下,而多数基因无明显应答。说明杨树MYB基因在应答环境变化与激素调节中具有不同的作用,并且在不同组织中的作用有所差异。
MYB基因;胁迫; RT-PCR;干旱;盐;ABA
转录因子也称反式作用因子,是指能够与真核基因的顺式作用元件发生特异性相互作用,并对转录有激活或抑制作用的DNA结合蛋白[1]。转录因子是具有序列特异位点的结合活性或含有同已知DNA结合结构域相同特征的蛋白质,因而能保证目的基因以特定的强度、在特定的时间与空间表达。MYB转录因子存在于所有真核生物中,癌基因v-MYB是第一个在禽成髓细胞性白血病病毒中被鉴定出来的MYB基因[2]。在脊椎动物中,c-MYB,A-MYB和B-MYB 3个与v-MYB相关的基因与细胞增殖、分裂以及凋亡密切相关[3],在昆虫、真菌、黏性菌中也存在类似的同源基因[4]。来自玉米的MYB基因Zea mays C参与花青素合成,与脊椎动物c-MYB基因高度同源[5]。相对于真菌和动物的MYB基因家族,植物编码的MYB基因数量更多,是植物转录因子基因家族中最大的家族之一[6-9]。MYB转录因子的共同特征是含有MYB结构域,MYB结构域由51~52个氨基酸残基组成,包含一系列保守的氨基酸残基和间隔序列[10]。依据MYB转录因子含有的保守结构域数目和种类,分为MYB-related、R2R3-MYB、3R-MYB和4R-MYB四类。MYB转录因子在植物次生代谢、信号转导、应答生物胁迫和非生物胁迫过程中具有重要作用[11-12]。其中,R2R3-MYB基因参与植物对环境胁迫如干旱、盐、寒冷的应答反应[13]。过量表达OsMYB3R-2基因的转基因水稻的细胞分裂指数增加,表现出较强的耐冷能力[14]。过量表达OsMYB4基因的转基因拟南芥耐寒冷胁迫能力明显提高[15]。拟南芥AtMYB96属于R2R3-MYB转录因子,可以通过ABA和生长素信号调节植物对干旱胁迫的响应[16]。转AtMYB15基因拟南芥对外源ABA敏感性提高,抗干旱和耐寒冷能力明显增强[17]。本研究为探明杨树MYB基因在应答非生物胁迫中的作用,利用RT-qPCR方法从222个杨树MYB基因中鉴定出71个对盐胁迫应答的基因,选择其中8条应答盐胁迫最明显的基因,分析其在不同非生物胁迫下的表达模式,了解杨树MYB家族基因在响应非生物胁迫过程中的作用,为明确杨树MYB家族基因功能提供参考依据。
1 材料与方法
试验材料为培养1个月的小黑杨组培苗,在60%~70%相对湿度、14 h光/10 h暗、平均温度25 ℃条件下,在水中继续培养1个月后分为12组,每3组施以1种处理。分别用水(作为对照组)、0.15 mol/L NaCl、25% PEG(聚乙二醇)-6000、50 μmol/L ABA处理24 h后,分别将样本的根、茎、叶保存-80 ℃,用于后续RNA提取和基因表达分析,所有处理和对照均包含3个生物重复。
RNA提取:将样品于液氮中迅速研磨,按照柱式植物RNA提取试剂盒(北京天恩泽基因科技有限公司,中国)说明书操作,提取总RNA,用NanoDrop 2000c分光光度计(威尔明顿德分光光度计技术,美国)测定RNA浓度,检验RNA质量。
RT-qPCR反应:用PrimeScript RT reagent Kit with gDNA Eraser试剂盒(TaKaRa公司,大连,中国)反转录合成cDNA。将合成的cDNA用无菌水稀释100倍,作为后续实时定量PCR的模板。实时定量PCR在ABI7500荧光PCR仪(应用生物系统公司)上进行,所用MYB基因引物如表1,其中ACT、EF1为内参引物[11]。实时定量PCR反应体系如下:10 μL SYBR Premix Ex Taq II(TaKaRa)、0.4 μL LofROXRefer-enceDyeII(TaKaRa)、正反向引物各0.4 μmol/L、cDNA模板2 μL(相当于100 ng RNA)。反应程序如下:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火60 s,60 ℃延伸60 s,40个循环。用Kenneth和Thomas报道的2-ΔΔCt法[12]计算基因的相对表达量。

表1 RT-qPCR反应所用引物
2 结果与分析
2.1 应答盐胁迫杨树MYB家族基因的鉴定
从PlantTFDB数据库中得到222个杨树MYB转录因子cDNA序列[9],利用BIOXM软件设计引物,用RT-qPCR鉴定应答盐胁迫的基因,我们将相对表达量变化2倍以上定义为应答盐胁迫基因,结果有71个MYB基因应答盐胁迫,占32%。其中27个为上调表达基因,占12.16%;44个为下调表达基因,占19.82%。本研究选择在盐胁迫条件下相对表达量提高4倍以上的8个MYB基因,分析其在不同胁迫条件下的表达模式。这8个MYB基因分别是:PtrMYB17、PtrMYB96、PtrMYB139、PtrMYB162、PtrMYB164、PtrMYB168、PtrMYB185和PtrMYB212。比较这8个MYB蛋白质的理化性质可以看出,其氨基酸残基数在235~674之间,分子质量在32.78~73.67 Ku之间,等电点在5.91~8.75之间(表2)。用Bioedit软件进行氨基酸序列比对发现,除PtrMYB139,其余7个MYB转录因子均含有典型的R2R3-MYB结构域(图1)。
2.2 杨树MYB基因应答盐胁迫表达模式
在盐胁迫条件下,8个MYB基因在叶中均被诱导表达,但在根和茎中的表达水平与在叶中的表达水平有所不同,多数基因在根和茎中的表达水平明显比叶中的表达水平低。其中,PtrMYB139、PtrMYB164和PtrMYB185在叶中受盐胁迫诱导水平最高,均在8倍以上;PtrMYB162、PtrMYB168和PtrMYB212在根茎叶中均对盐胁迫表现出明显的应答反应;PtrMYB17、PtrMYB96只在叶中显著上调表达,而在茎和叶中表达水平无明显变化,说明PtrMYB17、PtrMYB96主要在叶中响应盐胁迫(表3)。可见,杨树MYB基因在盐胁迫条件下会表现出一定的组织特异性。
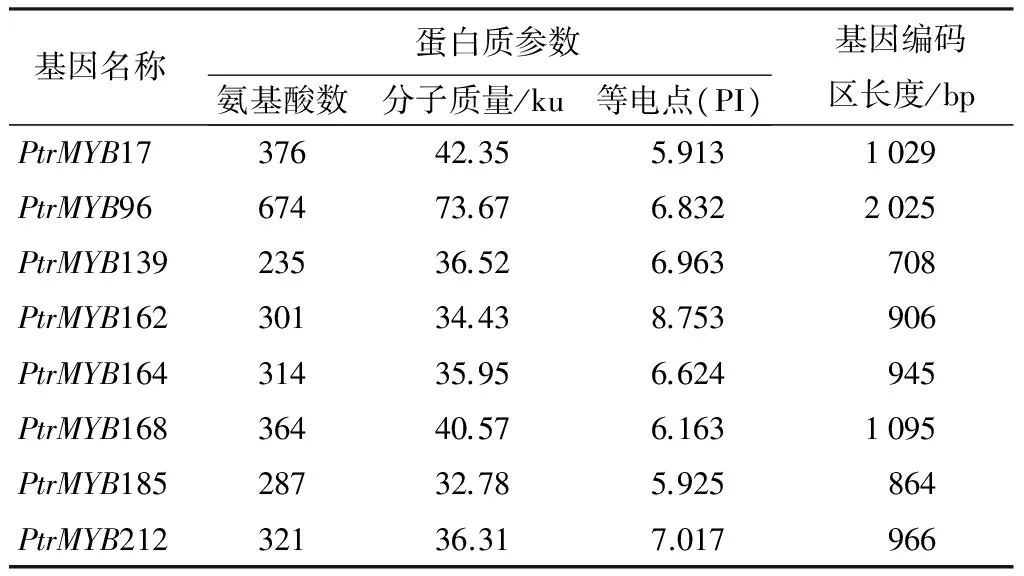
表2 杨树MYB基因蛋白质的理化性质

图1 杨树MYB结构域氨基酸序列比对

基因名称根的相对表达量茎的相对表达量叶相对表达量PtrMYB171.429±0.051.136±0.076.948±0.92PtrMYB961.244±0.101.265±0.357.101±0.48PtrMYB1391.609±0.621.392±0.388.052±0.99PtrMYB1626.704±0.212.918±0.024.262±0.43PtrMYB1649.501±1.262.427±0.0410.797±0.97PtrMYB1682.519±08.750±0.117.714±1.15PtrMYB1854.454±0.241.902±0.988.558±0.39PtrMYB2122.655±0.062.934±0.054.212±0.90
注:表中数据为平均值±标准差。
2.3 杨树MYB基因应答干旱胁迫表达模式
在干旱迫条件下,8个MYB基因在叶中均被诱导表达,但多数基因在根和茎中的表达水平比在叶中的表达水平低,这种基因表达趋势与在盐胁迫条件下的的表达趋势相似(表4)。PtrMYB17、PtrMYB139和PtrMYB168只在叶中被干旱诱导表达2倍以上,在根和茎中的表达水平变化不明显;PtrMYB164和PtrMYB185在根和叶中可被干旱诱导表达,而在茎中的表达水平则无明显变化;PtrMYB162在茎和叶中可被干旱诱导表达,而在根中的表达水平则无明显变化;PtrMYB96在干旱胁迫条件下,无论在根和茎中还是叶中,其表达水平变化不明显,均未超过2倍。可见PtrMYB96虽然响应盐胁迫,但对干旱胁迫无明显应答(表4)。说明有些杨树MYB基因在干旱胁迫条件下也表现出一定的组织特异性。
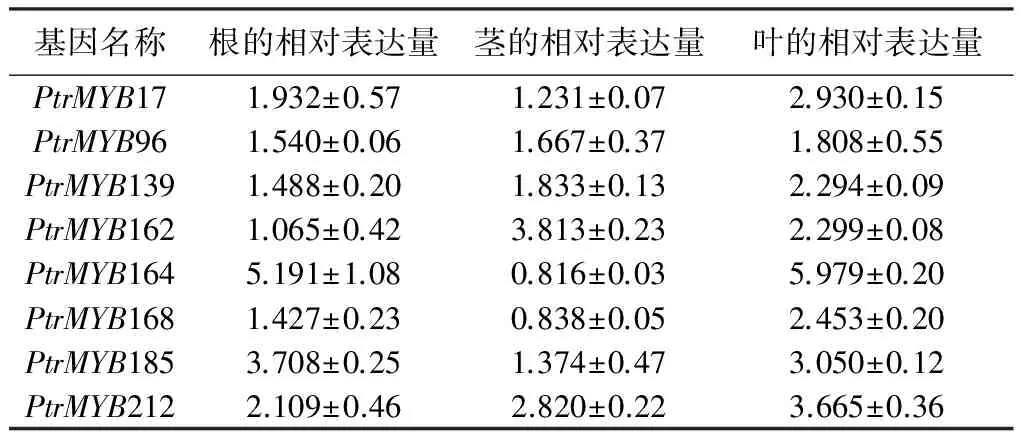
表4 杨树MYB基因应答PEG胁迫表达模式
注:表中数据为平均值±标准差。
2.4 杨树MYB基因应答ABA表达模式
在ABA处理条件下,多数基因表达水平的变化幅度都没有超过2倍。8个杨树MYB基因中PtrMYB164在根茎叶中均被诱导表达,其表达模式与在盐和干旱胁迫条件下的表达模式相似。PtrMYB17和PtrMYB168只在根中被诱导表达,在茎和叶中表达水平无明显变化。PtrMYB96表现出不同的表达模式,无论在根和茎还是叶中均为下调表达,在响应ABA激素诱导过程中参与负调控(表5)。说明受盐和干旱诱导表达的杨树MYB基因只有很少基因受ABA的影响。
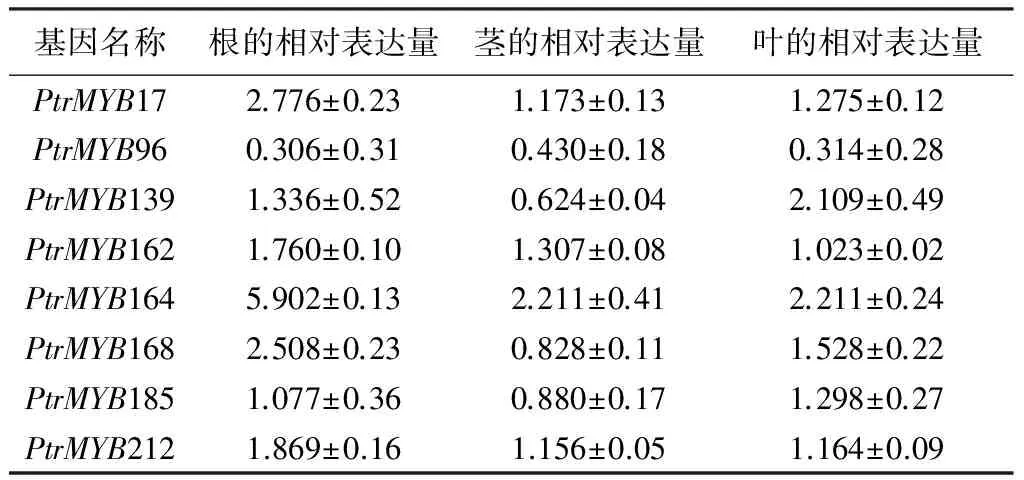
表5 杨树MYB基因应答ABA表达模式
注:表中数据为平均值±标准差。
3 结论与讨论
植物在生长发育过程中经常会受到各种生物胁迫和非生物胁迫的影响[18]。为了抵御各种逆境胁迫,植物通常会诱导激活一系列基因表达和一些信号转导途径[19]。MYB转录因子是植物转录因子家族中最大的家族之一[9],参与植物细胞内多种生理生化反应,参与一系列植物生长发育调控和应答非生物胁迫,如调控生长发育节奏和器官形成,影响代谢产物的形成和激素信号等[20-22]。本研究发现,当杨树受盐胁迫时,许多MYB基因被诱导表达,且呈现不同的表达模式。特别是PtrMYB164,无论在根、茎还是叶中,均是所有基因中上调水平最显著的。有关MYB基因参与盐胁迫应答以及调控植物耐盐胁迫能力的研究已有报道。拟南芥中AtMYB44和AtMYB2在mRNA水平上对盐胁迫均有应答响应,在转基因拟南芥中过表达AtMYB44和AtMYB2基因均能够提高转基因植株对盐胁迫的抗性[23-24]。拟南芥AtMYB41和AtMYB96基因在正常的生长条件下不表达,但在干旱、ABA及盐胁迫条件下则被诱导高水平表达[25-26]。在植物中过表达AtMYB41和AtMYB96基因可提高转基因植株抗旱和耐盐能力。这些研究说明MYB基因参与干旱和盐胁迫应答,并在提高植物抗旱和耐盐胁迫能力方面发挥重要作用。脱落酸(ABA)是一种重要植物激素,不仅参与调节生长发育和气孔开放,还协调各种逆境信号转导途径,在植物生长发育过程中和适应各种环境过程中起着至关重要的作用[27]。小麦TaMYB33基因受ABA介导的逆境响应信号调控,通过积累渗透压调节物和提高细胞活性氧清除能力来提高植物对干旱和盐的耐受性[28]。本研究发现在不同胁迫条件下杨树PtrMYB164基因在根茎叶中均被诱导表达。而PtrMYB96在盐胁迫条件下在叶片中大量表达,在干旱条件下在根和茎叶中变化不明显,在ABA条件下无论在根和茎还是叶中均为下调表达。说明杨树应答逆境胁迫的MYB基因和应答ABA诱导的MYB基因具有不同的表达模式。
本研究鉴定出71个应答盐胁迫的杨树MYB基因。其中,8个高表达MYB基因在不同组织中应答盐和干旱表达模式相似,但应答ABA的表达模式具有很大差异。杨树MYB基因在应答环境变化与激素变化中可能具有不同的作用,并且在不同组织中的作用也有所差异。
[1] PTASHNE M. How eukaryotic transcriptional activators work[J]. Nature,1988,335:683-689.
[2] LEMPNAUER K H, GONDA T J, BISHOP J M. Nucleotide sequence of the retroviral leukemia gene v-myb and its cellular progenitor c-MYB: the architecture of a transduced oncogene[J]. Cell,1982,31(31):453-463.
[3] WESTON K. Myb proteins in life, death and differentiation[J]. Curr Opin Genet Dev,1998,8(1):76-81.
[4] LIPSICK J S. One billion years of Myb[J]. Oncogene,1996,13(2):223-235.
[5] PAZ-ARES J, GHOSAL D, WIENAND U. The regulatory c1 locus of Zea mays encodes a protein with homology to MYB oncogene products and with structural similarities to transcriptional activators[J]. EMBO J,1987,6(12):3553-3558.
[6] RIECHMANN J L, HEARD J, MARTIN G. Arabidopsis transcription factors: genome-wide comparative analysis among eukaryotes[J]. Science,2000,290:2105-2110.
[7] MARTIN C, PAZ-ARES J. MYB transcription factors in plants[J]. Trends Genet,1997,13(2):67-73.
[8] KRANZ H, SCHOLZ K, WEISSHAAR B. c-MYB oncogene-like genes encoding three MYB repeats occur in all major plant lineage[J]. Plant J,2000,21(2):231-235.
[9] RIECHMANN J L, HEARD J, MARTIN. More than 80 R2R3-MYB regulatory genes in the genome of Arabidopsis thaliana[J]. Plant J,1998,14(3):273-84.
[10] KANEI-ISHII C, SARAI A, SAWAZAKI T. The tryptophan cluster: a hypothetical structure of the DNA-binding domain of the myb protooncogene product[J]. J Biol Chem,1990,265(32):19990-19995.
[11] ALLAN A C, HELLENS R P, LAING W A. MYB transcription factors that colour our fruit[J]. Cell,2008,13(3):99-102.
[12] COMINELLI E, TONELLI C. A new role for plant R2R3-MYB transcription factors in cell cycle regulation[J]. Cell Res,2009,19(11):1231-1232.
[13] AGARWAL M, HAO Y, KAPOOR A. A R2R3 type MYB transcription factor is involved in the cold regulation of CBF genes and in acquired freezing tolerance[J]. J Biol Chem,2006,281(49):37636-37645.
[14] MA Q, DAI X, XU Y. Enhanced tolerance to chilling stress in OsMYB3R-2 transgenic rice is mediated by alteration in cell cycle and ectopic expression of stress genes[J]. Plant Physiol,2009,150(1):244-256.
[15] VANNINI C, LOCATELLI F, BRACALE M. Overexpression of the rice OsMYB4 gene increases chilling and freezing tolerance of Arabidopsis thaliana plants[J]. Plant J,2004,37(1):115-127.
[16] SEO P J, XIANG F, QIAO M. The MYB96 transcription factor mediates abscisic acid signaling during drought stress response in Arabidopsis[J]. Plant Physiol,2009,151(1):275-289.
[17] DING Z, LI S, AN X. Transgenic expression of MYB15 confers enhanced sensitivity to abscisic acid and improved drought tolerance in Arabidopsis thaliana[J]. Cell Res,2008,36(1):1047-1060.
[18] ABE H, YAMAGUCHI-SHINOZAKI K, URAO T. Role of Arabidopsis MYC and MYB homologs in drought-and abscisic acid-regulated gene expression[J]. Plant Cell,1997 ,9(10):1859-1868.
[19] DIETZ K J, VOGEL M O, VIEHHAUSER A. AP2/EREBP transcription factors are part of gene regulatory networks and integrate metabolic, hormonal and environmental signals in stress acclimation and retrograde signalling[J]. Protoplasma,2010,245(1):3-14.
[20] HOEREN F U, DOLFERUS R, WU Y. Evidence for a role for AtMYB2 in the induction of the Arabidopsis alcohol dehydrogenase gene (ADH1 ) by low oxygen[J]. Genetics,1998,149(2):479-490.
[21] COMINELLI E, GALBIATI M, VAVASSEUR A. A guard-cell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance[J]. Curr Biol,2005,15(13):1196-2000.
[22] RUBIO V, LINHARES F, SOLANO R. A conserved MYB transcription factor in-volved in phosphate starvation signaling both in vascular plants and in unicellular algae[J]. Genes Dev,2001,15(16):2122-2133.
[23] YOO J H, PARK C Y, KIM J C. Direct interaction of a divergent CaM isoform and the transcription factor, MYB2, enhances salt tolerance in Arabidopsis[J]. J Biol Chem,2005,280(5):697-706.
[24] JUNG C, CHEONG J J. Overexpression of AtMYB44 enhances stomatal closure to confer abiotic stress tolerance in transgenic Arabidopsis[J]. Plant Physiology,2008,146(2):623-635.
[25] COMINELLI E, SALA T, CALVI D. Overexpression of the Arabidopsis AtMYB41 gene alters cell expansion and leaf surface permeability[J]. Plant J,2008,53(1):53-64.
[26] SEO P J, XIANG F, QIAO M. The MYB96 transcription factor mediates abscisic acid signaling during drought stress response in Arabidopsis[J]. Plant Physiology,2009,151(1):275-289.
[27] HIMMELBACH A, YANG Y, GRILL E. Relay and control of abscisic acid signaling[J]. Plant Biology,2003,6(5):470-479.
[28] SHAN H, CHEN S, JIANG J. Heterologous expression of the chrysanthemum R2R3-MYB transcription factor CmMYB2 enhancees drought and salinity tolerance, increases hypersensitivity to ABA and delays flowering in Arabidopsis thaliana[J]. Mol Biotechnol,2012,51(2):160-173.
Expression Characteristics of PoplarMYBGene in Response to Abiotic Stresses//
Feng Bo, Zhu Tengfei, Zhang Chi, Dong Bo, Zhou Boru(State Key Laboratory of Tree Genetics and Breeding, Northeast Forestry University, Harbin 150040, P. R. China)//
Journal of Northeast Forestry University,2017,45(4):19-22.
MYBtranscription factor is one of the largest number family in plant, which is widely involved in plant growth, development and metabolism regulation, and chartered by its conservedMYBdomain. The total of 222MYBgenes from Populus were obtained by bioinformatics analysis, and 8 of these has a strong response to salt stress by real-time RT-PCR. These 8MYBgenes were highly responsive to salt and drought stress in root, steam and leaf tissues, and showed a similar expression pattern. Whereas, their expression levels was markedly different in various tissues. Under ABA treatment, most of the genes had no obvious response. The poplarMYBgenes play an important role in response to different environments and hormone regulation with different effects in various tissues.
MYB; Stress; RT-PCR; Drought; Salinity; ABA
1)国家级大学生创新创业训练计划项目(201610225001)。
冯波,女,1990年5月生,林木遗传育种国家重点实验室(东北林业大学),硕士研究生。E-mail:1078182269@qq.com。
周博如,林木遗传育种国家重点实验室(东北林业大学),副教授。E-mail:boruzhou@yahoo.com。
2016年11月12日。
Q78;S332.1
责任编辑:潘 华。

