大青杨再生体系的优化1)
姜洋 刘焕臻 李开隆
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
大青杨再生体系的优化1)
姜洋 刘焕臻 李开隆
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
采用正交试验设计,研究不同培养基和不同激素质量浓度配比对大青杨无菌苗叶片植株再生体系的影响,优化大青杨植株再生体系。结果表明:对大青杨不定芽诱导的影响最大为激素NAA,其次是培养基类型,最后是激素6-BA;不定芽增殖的影响最大是NAA,其次是培养基类型,最后是6-BA;对丛生苗生根的影响最大是激素类型,然后是培养基类型;培养基类型和激素的质量浓度对大青杨再生体系有着较明显的影响。最适宜大青杨分化的培养基为:WPM+0.5 mg/L 6-BA+0.05 mg/L NAA,诱导率达100%;最适宜大青杨丛生芽增殖的培养基为:MS+0.05 mg/L 6-BA+0.01 mg/L NAA,芽健壮;最适宜大青杨生根的培养基为:1/2MS+0.1 mg/L IBA,经过14 d生根,生根率达100%。
大青杨;再生体系;培养基;正交试验设计
大青杨(PopulusussuriensisKom.)是东北林区的乡土树种[1],耐寒、速生,是分布区内山地营造速生丰产用材林的主要树种之一[2]。其木质较软,韧性好,材质洁白而致密,耐腐朽,是造纸及胶合板材极好的原料。随着东北天然林的停止采伐,可用于营造大青杨人工林的林地多是荒山荒地和退耕还林地等。地条件就需要抗旱、耐瘠薄、适应性强的大青杨新品种。分子育种与常规育种相比,具有目的性强、育种周期短、可以打破物种间杂交不亲和的界限等优点[3]。大青杨抗逆基因工程育种逐渐引起人们重视[4]。
建立高效的再生体系是进行遗传转化的基础[5]。尽管国内外对青杨的组织培养进行了大量的研究,但对大青杨的再生体系的研究却鲜有报道。仅李世承[6]以大青杨嫩叶、新梢为材料进行植物组织培养,而对影响不定芽诱导分化主要因子则没有进行相应的研究。郭斌[7]以美洲黑杨×大青杨的5个杂种无性系为对象建立离体培养体系及叶片再生体系,各个无性系的叶片再生能力差异显著,特别适合于177无性系,靳春莲对大青杨建立了组培体系,并对遗传转化作了研究,但其建立的组培体系转化率低,并对组培体系缺乏系统的研究。鉴于此,为了得到大青杨植株高效的再生体系。本文以大青杨无菌苗叶片为外植体,研究不同培养基类型、不同激素组合配比对其不定芽诱导、增殖和生根能力的影响,以期获得大量的优质的无菌苗,为大青杨遗传改良和快速繁育提供依据。
1 材料与方法
以东北林业大学林木遗传育种国家重点实验室保存的大青杨组培苗为材料,开展大青杨再生体系研究。
不定芽诱导:取生长3周的大青杨组培苗,用解剖刀把叶片组织切成0.5~1.0 cm2的小块,然后叶片背面向下接种在分化培养基上。培养基的种类和添加激素的配比按照三因素(培养基类型为第一因素A、6-BA不同质量浓度为第二因素B、NAA不同质量浓度为第三因素C)三水平的正交试验设计方法进行。培养基类型包括,MS、WPM、B5;激素6-BA设计3种不同质量浓度(0.3、0.5和0.8 mg/L),激素NAA设计3种不同质量浓度(0.02、0.05、0.10 mg/L)(表1)。每种处理接种6~10个外植体,每个处理重复3次。2周后观察并记录不定芽的生长状况。
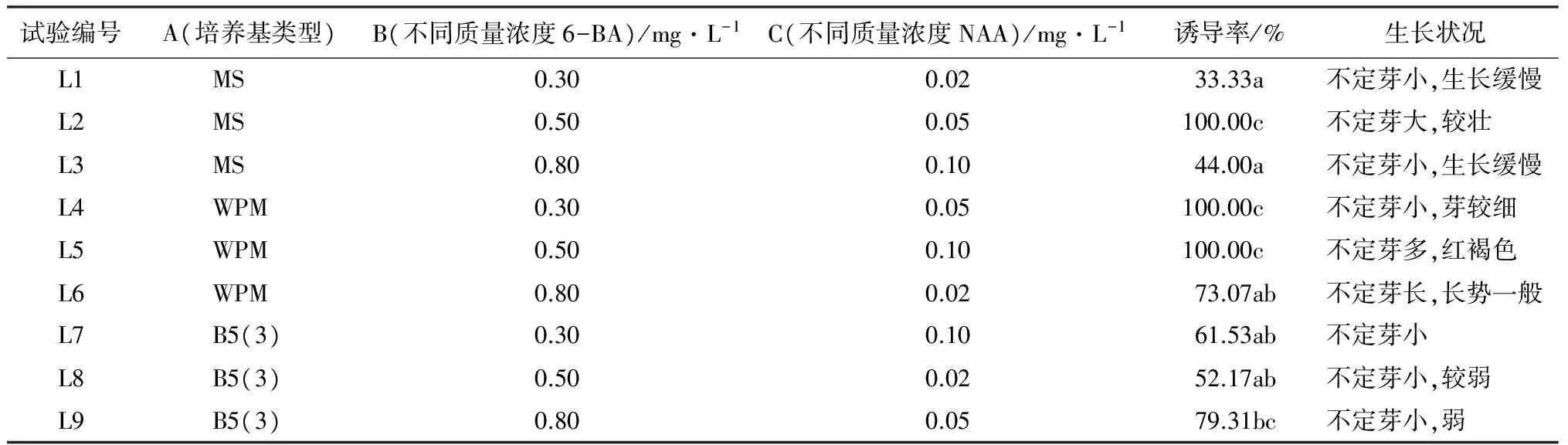
表1 不同培养基及激素配比对大青杨叶片不定芽诱导情况
注:表中同列不同字母表示差异显著(P<0.05)。
不定芽增殖:依据不定芽增殖(表2)在MS和WPM分别加入质量浓度为0.05、0.06、0.08、0.10 mg/L 6-BA和0.01、0.02、0.03、0.04 mg/L NAA(培养基类型为第一因素A、6-BA不同质量浓度为第二因素B、NAA不同质量浓度为第三因素C)配制培养基。将不定芽团接种于上述按照正交试验设计的不同处理组合培养基中。每种培养基放在3个不定芽增殖的培养瓶中,每个培养瓶中接种2个不定芽团,置于组培室中进行培养。2周后观察不定芽的增殖的情况。

表2 不同培养基及激素配比对大青杨不定芽增殖的影响
注:表中数据为平均值±标准差;同列不同字母表示差异显著(P<0.05)。
丛生苗生根培养:将经过不定芽增殖培养的大青杨,用消毒后的剪子剪下,转移到以MS和1/2MS为基本培养基并附加IBA和NAA 2种激素的培养基中(培养基类型为第一因素A、IBA不同质量浓度为第二因素B、NAA不同质量浓度为第三因素C)(表3),处理组合按照正交试验设计实施,每个处理配制10瓶,在每瓶中接种3棵大青杨幼苗,置于组培室中进行培养,2周之后统计大青杨组培苗的生根数量。
数据统计与分析:采用EXECL进行数据整理和平均数的计算,采用SPSS 19.0软件对试验结果进行方差分析和多重比较分析,试验数据为百分数,数据经过反正弦转化后,进行方差分析和多重比较,筛选适合大青杨再生体系每个时期适宜的培养基和激素配比。
不定芽诱导率=(产生的不定芽的叶片数/接种的叶片总数)×100%;
生根率=(生根的组培苗数/全部的组培苗数)×100%。
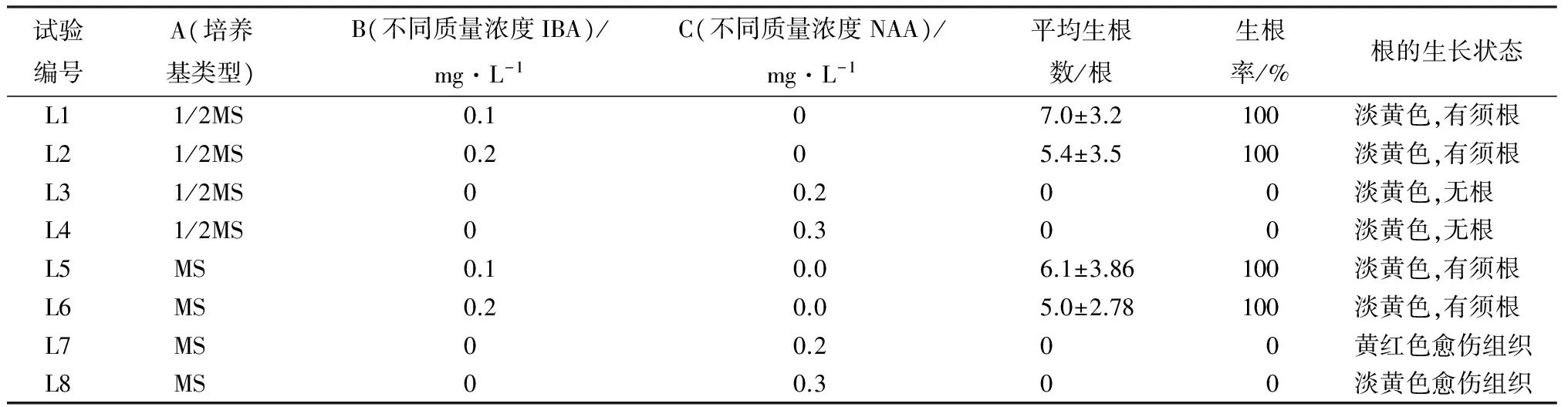
表3 同培养基及激素配比对大青杨生根的影响
注:表中部分数据为平均值±标准差。
2 结果与分析
2.1 大青杨叶片诱导不定芽组培体系
将带有伤口的大青杨无菌苗叶片接种到三因素、三水平的正交试验设计的培养基上,14 d后记录观察试验结果(表1和图1),结果说明,9个试验处理组合不定芽诱导率差异达到显著水平(0.05水平),其中L2、L4和L5组合最好,不定芽的诱导率达到100%。极差分析说明,NAA对大青杨叶片分化的影响最大,其次是6-BA,再次是培养基的种类。
方差分析(表4)说明,培养基种类激素6-BA、NAA等不同质量浓度对大青杨叶片分化诱导作用都有极显著水平的差异。通过多重比较说明,在大青杨不定芽诱导中,NAA的影响大于培养基类型的影响,大于6-BA的影响。从分析结果来看A2B2C2最高,即大青杨叶片诱导不定芽生成的最佳培养基为WPM+0.5 mg/L 6-BA+0.05 mg/L NAA。因为正交试验组合中没有出现在正交实验表中,所以单独将此组合单独做一个试验(图2)。从培养结果来看,该组合培养出的不定芽翠绿,生芽率到达100%。

图1 大青杨叶片不定芽诱导(组培14 d发芽的叶片)
表4 不同培养基及激素配比对大青杨叶片不定芽诱导的方差分析
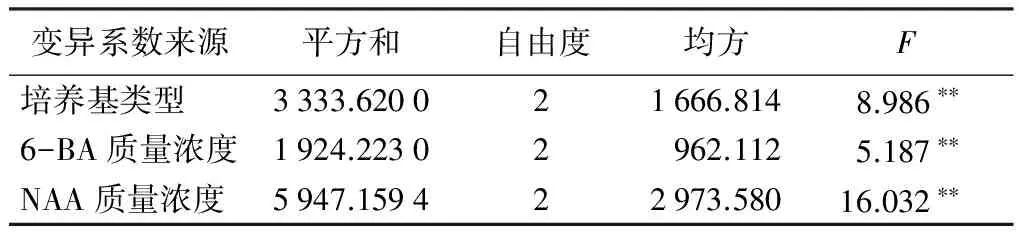
变异系数来源平方和自由度均方F培养基类型3333.620021666.8148.986∗∗6-BA质量浓度1924.22302962.1125.187∗∗NAA质量浓度5947.159422973.58016.032∗∗
注:** 表示在0.01水平差异显著。
2.2 大青杨不定芽增殖培养体系的优化
将分化14 d的丛生芽放入MS、WPM 2种不同培养基、添加不同质量浓度的6-BA和NAA的激素进行不定芽增殖培养,15 d后观察不定芽数、测定苗高并进行方差分析,结果(表5)表明,不同质量浓度的NAA对苗高和出芽数的影响都达到了极显著水平,而6-BA没有作用,不同培养基对苗高的影响达到极显著水平。培养中加入NAA能促进不定芽增殖,并且在每个组合中,NAA质量浓度为0.01时出芽数量最高。出芽数最多的是L1组合,平均苗高最高的是L14组合。从多重比较可以看出,L1与其他组合差异性显著。综上结果,在大青杨不定芽增殖培养基中,NAA的影响大于培养基类型的影响,大于6-BA的影响。大青杨不定芽增殖最佳培养基为MS+0.05 mg/L 6-BA+0.01 mg/L NAA,丛生苗粗壮且出芽较多,叶片嫩绿色。
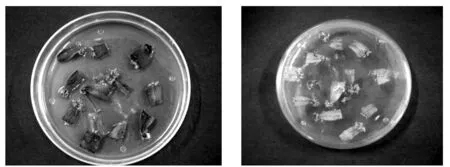
图2 WPM+0.5 mg/L 6-BA+0.05 mg/L NAA条件下不定芽诱导情况
表5 不同培养基及激素对大青杨不定芽增殖影响的方差分析

变异系数来源因变量离差平方和自由度均方F值培养基出芽数量23.8331 3.0001.027苗 高487.3581487.3587.341∗∗6-BA质量浓度出芽数量19.66736.5562.244苗 高86.229328.7431.183NAA质量浓度出芽数量53.500317.8336.106∗∗苗 高992.6763330.8926.131∗∗
注:** 表示在0.01水平差异显著。
2.3 大青杨生根体系的优化
在MS、1/2MS培养基及不同质量浓度的IBA、NAA对大青杨试管苗生根诱导15 d观察结果表明,L1 1/2MS+0.1 mg/L IBA的生根最好,平均生根数最高,达到7根。各个组合根生长情况(图3)中可以发现,L1、L2、L5、L6都长出须根且根健壮。加入NAA的L3、L4、L7、L8产生黄色愈伤小块或产生辐射性的短根。方差分析(表6)说明,激素类型极显著影响组培苗生根,IBA能促进试管苗须根的形成,而NAA对管苗根的形成没有作用。在大青杨生根培养中,激素类型的影响大于培养基类型的影响。综上分析,最适合大青杨组培苗生根的培养基为1/2MS+0.1 mg/L IBA。

图3 大青杨生根培养
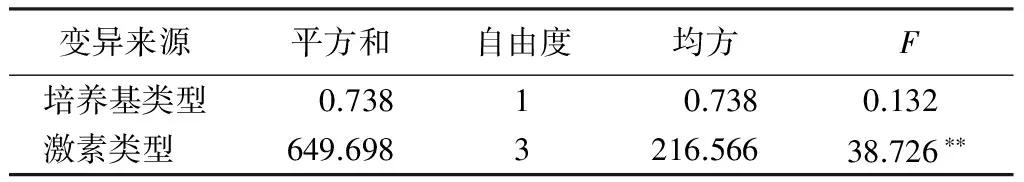
变异来源平方和自由度均方F培养基类型 0.7381 0.7380.132 激素类型649.6983216.56638.726∗∗
注:** 表示在0.01水平下差异显著。
2.4 移栽炼苗
大青杨生根苗经炼苗后移栽至由V(草泥炭)∶V(珍珠岩)∶V(蛭石)=3∶1∶1的混合基质中,30 d后幼苗开始长出新叶,根系牢固,长成成苗(图4)。
3 结论与讨论
组织培养方法的优化是基因工程育种的基础例如抗除草剂玉米[8]、抗虫杨树[9-10]等转基因新品种或新品系的获得,都是建立在一个行之有效的组培优化体系基础上。
虽然早在20世纪30年代,国外就开始了对杨属植物组织培养的研究[11],我国于20世纪70年代对杨属植物进行组织培养研究,分别开展了。小叶杨(PopulussimoniiCarr)、小黑杨(Populussimonii×Populusnigra)、青杨(PopuluscathayanaRehd.)等杨树离体花药培养研究[12]。近年来对青杨派植物组织培养的研究也取得了不少进展,李开隆[13]对香杨(Populuskoreana)的顶芽和腋芽进行组织培养和植株研究。李世承以大青杨嫩叶、新梢为材料进行植物组织培养。靳春莲建立大青杨组培体系。这些为大青杨的研究奠定了重要的基础,但对于大青杨再生体系优化研究还未有。组培体系的再生效率也亟需提高。

图4 大青杨生根苗移栽效果
在大青杨再生体系优化中,外源激素的配比和培养基类型对植物的生长发育影响较大。本实验中6-BA和NAA之间的质量浓度配比与培养基类型不同对不定芽分化、不定芽增殖的诱导率和出芽数影响不同。从不定芽分化实验中可以发现,培养基类型不同,组培苗所呈现出来的状态不同(表1,图1),加入MS培养基中的芽的状态呈现乳白色并且稀疏,而其他两种类型培养基在分化中,叶片愈伤部位首先出现黄色愈伤小块,其后在愈伤小块上长有芽点。在不定芽诱导过程中,通过不定芽诱导体系进行直观分析得出WPM+0.5 mg/L 6-BA+0.05 mg/L NAA有助于大青杨分化(表1,图1)。随后的验证实验中,证实了此组合出芽率为100%,芽点翠绿(图2)。章林[14]在对银中杨的组培研究中也发现,在质量浓度为0.5 mg/L 6-BA时,促进嫩芽的分化和生长,且达到最高的分化率。在不定芽增殖过程中,杜晓艳[15]等发现6-BA是适合青杨不定芽诱导分化的细胞分裂素,但是不定芽的质量下降,当6-BA质量浓度达到0.2 mg/L时出现了明显的苗徒长,茎细长现象。当NAA质量浓度达到0.1 mg/L时,不定芽发生黄化死亡现象,所以低浓度的NAA有助于青杨生长发育。所以,本研究试验设计中激素浓度都在此浓度最高值以下。实验结果说明,大青杨叶片在MS+0.05 mg/L 6-BA+0.01 mg/L NAA处理中培养出来的茎较嫩、较多,此处理是最高效的处理组合。IBA和NAA为最常用于木本植物生根的激素,结合本试验研究,发现杨树最基本的培养基为MS和1/2MS。在生根培养试验组合中,1号组合(1/2MS+0.1 mg/L IBA)对大青杨的生根最有利,且苗的长势较好,根系较为发达,叶片绿,茎段粗壮(表6,图3)。同时发现加入低质量浓度的IBA有助于大青杨的生根,加入NAA发现产生气生根和愈伤小块,不利于大青杨的生根培养。尤其是在对大青杨遗传转化过程,较多的根有利于植物筛选过程的培养,以及后期移栽过程中对充足养分的吸收。另外,本研究采用叶片作为外植体[17]材料,其便于裁剪,接触光的面积大,也便于农杆菌充分高效地侵染。所以,本研究优化的高效再生体系能为大青杨的遗传转化奠定良好的基础。
[1] 苏晓华,黄秦军,张香华,等.中国大青杨基因资源研究[J].林业科学研究,2001,14(5):472-478.
[2] 刘玉庭,方旭东.黑龙江省林区大青杨培育的研究[J].林业勘查设计,2001(3):37-38.
[3] 张美玲,陈洪伟,王红利,等.植物远缘杂交育种现状与展望[J].安徽农业科学,2015,43(1):11-17.
[4] 何承忠,张有慧,冯夏莲,等.我国青杨派杨树基因资源及其遗传育种研究进展[J].西北林学院学报,2005,20(2):124-129.
[5] 于志水,金红,苘胜军,等.黑杨派杨树组培再生系统的研究[J].辽宁林业科技,2002(6):11-13.
[6] 李世承,李晶,佟凤琴,等.山杨、大青杨、毛白杨组织培养的研究[J].辽宁大学学报(自然科学版),1995,22(2):59-62.
[7] 郭斌,游阳,季乐翔,等.美洲黑杨与大青杨杂种无性系离体培养和叶片再生体系的建立[J].中国农学通报,2011,27(25):13-19.
[8] 孙越,刘秀霞,李丽莉,等.兼抗虫、除草剂、干旱转基因玉米的获得和鉴定[J].中国农业科学,2015,48(2):215-228.
[9] 郭同斌,嵇保中,诸葛强,等.转Bt基因杨树(NL-80106)对杨小舟蛾抗虫性研究[J].南京林业大学学报(自然科学版),2004,28(6):5-9.
[10] 魏振.杨树抗虫性研究进展[J].中国森林病虫,2007,26(1):25-28.
[11] 朱大保.国外杨树组培微繁技术的进展[J].北京林业大学学报,1990,12(1):84-91.
[12] 栾鹖慧,苏晓华,张冰玉,等.杨属(PopulusL.)种质资源遗传学评价研究进展[J].植物学报,2011,46(5):586-595.
[13] 李开隆,靳春莲,李明德,等.香杨的组织培养和植株再生[J].植物生理学通讯,2009,45(3):281.
[14] 章林,陈建军,陆志民,等.银中杨组培快繁技术的研究[J].吉林林业科技,2003,32(3):7-10.
[15] 杜晓艳,韩素英,梁国鲁,等.青海青杨高效再生体系的建立[J].林业科学研究,2011,24(6):701-706.
OptimizingPopulusussuriensisRegeneration System//
Jiang Yang, Liu Huanzhen, Li Kailong(State Key Laboratory of Tree Genetics and Breeding, Northeast Forestry University, Harbin 150040, P. R. China)//
Journal of Northeast Forestry University,2017,45(4):28-32.
By orthogonal experiments, we studied the effects of different media and different hormone combinations on the regeneration system ofPopulusussuriensisleaves, and optimized the regeneration system. The concentration of NAA had the strongest inducing effect on adventitious buds, types of culture medium had the moderate, concentration of 6-BA had the weakest induding effect. The effects of concentration of NAA during proliferation of adventitious buds was more than types of culture medium, and more than concentration of 6-BA. The effect of hormone was more than culture medium type during rooting. The types of culture medium and the concentration of hormone had significant effect on the regeneration system. The most suitable medium for differentiation of adventitious buds was WPM+0.5 mg/L 6-BA+0.05 mg/L NAA, with the inducing rate of 100%. The most suitable medium for buds proliferation was MS+0.05 mg/L 6-BA+0.01 mg/L NAA, and the plantlets were healthy. The most suitable medium for rooting was 1/2 MS+0.1 mg/L IBA with the rooting rate of 100%.
PopulusussuriensisKom.; Regeneration system; Medium; Orthogonal experimental design
姜洋,男,1991年4月生,林木遗传育种国家重点实验室(东北林业大学),硕士研究生。E-mail:395121052@qq.com。
李开隆,林木遗传育种国家重点实验室(东北林业大学),教授。E-mail:likailongnefu@sohu.com。
2016年11月21日。
Q943.1
1)“十三五”国家科技计划课题(2016YFD0600404)。
责任编辑:潘 华。

