芒果露水斑病病原菌分离鉴定及其拮抗菌筛选
井敏敏,田亚琴,王润菡,邵远志
(海南大学食品学院,海南海口 570228)
芒果露水斑病病原菌分离鉴定及其拮抗菌筛选
井敏敏,田亚琴,王润菡,邵远志*
(海南大学食品学院,海南海口 570228)
目的:明确芒果“露水斑病”的病原菌,并对病原菌拮抗菌进行筛选,为病害的进一步防治提供理论基础。方法:采用扫描电镜观察病果表皮状况,通过组织分离法对发病样品进行病原菌分离,采用平板对峙法对病原菌拮抗菌进行筛选,最后对病原菌及拮抗菌进行形态学以及分子生物学鉴定。结果:明确“露水斑病”是由真菌引起,并鉴定为枝状芽枝霉(Cladosporiumcladosporioides)。针对病原菌从芒果果园土壤中分离筛选出8株对其具有拮抗效果的菌株,其中细菌JS-8、酵母菌Y-1拮抗效果最为显著(p<0.05),其抑菌圈直径分别达15.17 mm、14.93 mm。经形态特征、生理生化特征以及分子生物学将菌株JS-8、Y-1分别鉴定为唐菖蒲伯克霍尔德菌(Burkholderiagladioli)、汉逊德巴利酵母(Debaryomyceshansenii)。结论:“露水斑病”主要由枝状芽枝霉引起,唐菖蒲伯克霍尔德菌、汉逊德巴利酵母可作为该病害潜在生防菌株。
芒果露水斑病,病原菌,拮抗菌,鉴定,筛选
芒果(Mangifera indica.L)原产于印度以及马来半岛,属于漆树科芒果属,具有很高的经济价值和营养价值,被誉为“热带果王”。芒果果肉细腻多汁、风味独特、并且具有抗氧化、延缓衰老、抗癌、防治心脑血管疾病、去痰止咳、健胃止晕等保健功效[1]。我国芒果种植历史悠久,现栽培地区主要有广西、广东、四川、云南、海南、福建、台湾等地,成为芒果第二大生产国,但是病虫害日趋严重,使果实商品率下降,严重威胁我国芒果产业的发展[2]。近年来,海南芒果出现一种新的病害,在芒果表皮形成露水状病斑,因其形态得名芒果“露水斑病”,该病多在阴雨天气爆发,并且在地势低洼、通风不良、杂草众多的果园更易发病,而且常用农药难以将其控制,严重影响果实外观,情况严重时可造成整个果实呈现污渍状,造成芒果商品价值大大降低,对果农造成很大的经济损失,直接影响海南芒果产业的发展。目前对于该病害病原菌的分离鉴定、以及防治措施报道较少。目前,芒果生产上主要采用化学农药防治各类病害,由于化学农药的滥用,使得高残留、污染环境等不利影响日益严重[3-4]。并且我国已明令禁止在果蔬、果树、中草药材、茶叶上使用的高毒性农药有19种[5],如甲胺磷(methamidophos)、对硫磷(parathion)、克百威(carbofuran)、涕灭威(aldicarb)。随着国家对化学农药使用要求日趋严格,以及人们追求有机无公害食品和环境保护的意识日趋强烈,绿色环保的病虫害防控措施成为研究的重点,生物防治受到了高度重视[6]。目前,生物防治主要包括:诱导果蔬提高自身抗病性,从植物中提取物抑菌物质[7],筛选拮抗微生物来控制病原菌等。本研究从芒果“露水斑病”病果中分离鉴定了芒果“露水斑病”病原菌,并从芒果根系土壤中分离筛选出两株对芒果“露水斑病”病原菌具有较好拮抗效果的生防菌株,期望为芒果“露水斑病”的生物防治提供理论依据。
1 材料与方法
1.1 材料与仪器
供试果实:2015年3月至2015年5月,在海南昌江、三亚、乐东等芒果主要种植区分别采集典型发病果实各50个,同时采集健康芒果果实若干做为致病性测定用果;供试土壤:分别于2015年7月5日、7日在海南海口、昌江芒果园各选取10株不同果树采集根系离土表5~15 cm的土壤样品共40份,用密封袋封存,做好标记带回实验室,保存于4 ℃冰箱内,用于拮抗菌的分离。培养基:马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1000 mL,pH自然;牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 4 g,琼脂15 g,蒸馏水1000 mL。
BCM-1000生物净化工作台 苏州苏洁净化设备有限公司;FYL-YS-280L型恒温箱 北京福意电器有限公司;NRY-211恒温培养摇床 上海南荣实验室设备有限公司;AL-204电子天平 梅特勒-托利多仪器(上海)有限公司;ZEALWAYGR60DA高压灭菌器 厦门致微仪器有限公司;Nikon ECLIPSE Ci-s/Ci-L显微镜 南京衡桥仪器有限公司;HITACHI S-3000N扫描电子显微镜 苏州瑞测精密仪器有限公司;HCP-2临界点干燥仪 苏州瑞测精密仪器有限公司;TG16KR台式高速冷冻离心机 长沙东旺实验仪器有限公司。
1.2 实验方法
1.2.1 病斑扫描电镜的观察 参照潘洵操[8]的方法,选取新发病的芒果果实用无菌水冲洗2~3次,在病斑处切取2 mm×2 mm的果皮组织,经2.5% pH6.8的戊二醛于4 ℃下固定过夜,固定后的样品于0.1 mol/L pH6.8磷酸缓冲液中清洗3次,经系列乙醇逐级脱水,最后经乙酸异戊酯置换。样品于HCP-2型临界点干燥仪进行干燥,用导电胶粘贴于样品台上,喷金后在HITACHI S-3000N电镜下观察拍照,以健康果实果皮为对照。
1.2.2 病原菌分离纯化 采用常规组织分离法[9]。选取新发病的芒果果实,用75%的酒精进行表面消毒,随后用无菌水冲洗3次,在无菌条件下切取病健交界处3 mm×3 mm组织块,置于马铃薯葡萄糖琼脂培养基平板上,于28 ℃培养3~5 d,挑取菌落边缘菌丝少量于PDA培养基中划线纯化,重复上述步骤,直至菌落单一。纯化后的菌株保存于PDA斜面上,置于4 ℃备用。
1.2.3 致病性测定 采用科赫法则验证[10]。选取健康、大小、成熟度一致的芒果,用75%酒精进行表面消毒,取于PDA培养基上培养了3~5 d的病原菌,用无菌打孔器打成6 mm的病原菌圆片,小心地贴于芒果表面,每果接种3~5个,接种PDA培养基为对照,用无菌脱脂棉保湿2 d,置于28 ℃室温下培养,观察发病情况,并计算发病率。
发病率(%)=接种发病点数/接种点数×100
1.2.4 病原菌鉴定
1.2.4.1 病原菌形态学特征观察 将纯化后的病原菌接于PDA培养基上28 ℃下培养3~5 d,观察菌落特征,并采用插片法在显微镜下观察菌丝、孢子以及孢子梗形态特征,参照《真菌鉴定手册》进行初步鉴定[11]。
1.2.4.2 病原菌rDNA-ITS序列分析 病原菌DNA由Ezup柱式真菌基因组DNA抽提试剂盒(上海生工生物工程股份有限公司)提取,采用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)与ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增。PCR产物用1%琼脂糖凝胶电泳检测并委托上海生工生物工程股份有限公司进行测序。测序结果与GenBank核酸数据库进行对比。
1.2.5 拮抗菌分离纯化 采用稀释平板法以及平板划线法在PDA培养基上对各地区土壤样品中菌株进行分离纯化,直至获得单一菌落。
1.2.6 拮抗菌筛选 分离纯化后的菌株与病原菌经平板对峙[12]培养进行拮抗菌初筛,采用含菌平板抑菌圈测定法[13]对初筛有拮抗效果的菌株进行复筛,并采用十字交叉法测量抑菌圈直径[14],每菌株做3次重复。
1.2.7 拮抗菌的鉴定 将细菌JS-8、酵母菌Y-1委托上海生工生物工程股份有限公司分别进行16S rDNA、rDNA-ITS序列测序分析,测序结果与GenBank中核酸数据库进行同源性比对。并结合菌落形态特征、生理生化特性对拮抗菌株进行鉴定[15-16]。
1.2.8 数据处理与分析 实验数据采用SPSS Statistics17.0软件进行统计,并采用ANOVA进行Duncan多重差异分析。
2 结果与分析
2.1 病斑扫描电镜观察
从健康果皮以及病斑处果皮扫描电镜结果看,健康芒果表皮细胞正常,大小、形状不一的皮孔清晰可见,且果皮表面无异物(图1A);发病芒果果皮表面生长大量菌丝,定殖于皮孔以及表皮伤口裂纹处,且发病越严重的果皮表面菌丝越浓密,由此可推断芒果“露水斑病”由真菌引起,并且从(图1B)中可以看出有菌丝延伸入皮孔,推测病原菌菌丝可能由皮孔及伤口侵入芒果表皮;病斑表皮局部可见真菌分生孢子梗(图1C)及分生孢子(图1D)。
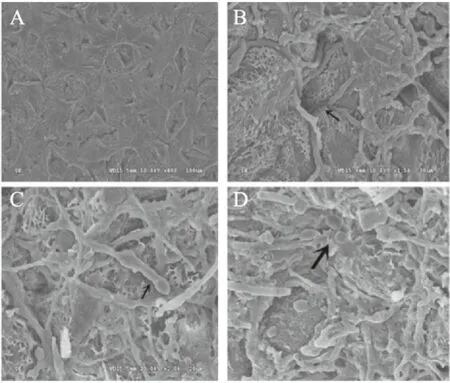
图1 健康与病果果皮的扫描电镜观察Fig.1 Observation of healthy and diseased fruit peel by SEM注:图A为健康芒果表皮;图B箭头处表示病原菌入侵途径; 图C箭头处表示病原菌分生孢子梗; 图D箭头处表示病原菌分生孢子。
2.2 病原菌致病性检测及其鉴定结果
2.2.1 致病性检测 本实验从病果的病健交界处分离纯化出10株不同真菌,采用科赫法则进行致病性验证,发现接种J1号真菌的芒果5 d后果皮表面出现黑斑,与田间“露水斑”病症类似,并且发病率达86.6%,而对照组发病率为0,并且取病斑处果皮组织按照1.2.2所述方法进行组织分离,分离出病原菌与J1号菌菌落形态一致,属于同一种菌株,于是确定J1号菌为芒果“露水斑病”病原菌。
2.2.2 病原菌的形态特征 病原菌J1在PDA培养基上菌落近圆形(图2E、F),生长速度缓慢,菌丝墨绿色,有隔膜,多分枝(图2G);分生孢子梗多侧生,直立或弯曲,顶端分枝或不分枝,具有隔膜,(20.56~83.91)μm×(2.99~5.02)μm。分生孢子链生,呈柠檬形、椭圆形或圆柱形,淡褐色,光滑,且具1~2个脐点,大小为(3.62~10.05)μm×(2.16~4.42)μm(图2H)。根据病原菌形态特征,参考《真菌鉴定手册》将病原菌初步鉴定为芽枝霉属。

图2 病原菌菌落形态以及菌体形态Fig.2 Photographs of colonies and cells of the C. cladosporioides注:图E、F分别为PDA培养基上菌落正反面特征图; 图G为菌丝形态(×40);图H为分生孢子形态(×40)。
2.2.3 病原菌rDNA-ITS序列分析 将病原菌基因组DNA进行PCR扩增,扩增结果如图3所示,扩增片段为500~600 bp,经测序获得534 bp的核苷酸序列,通过在GenBank数据库中进行Blast同源性分析,结果发现菌株与Cladosporiumcladosporioides(KJ596320.1)的ITS序列同源性为100%。综合形态学特征鉴定该病原菌为枝状芽枝霉。

图3 病原菌ITS区PCR扩增电泳图Fig.3 PCR amplification of ITS sequence of the pathogen注:M为DNA Ladder Mix maker;1为J1的ITS扩增产物。
2.3 拮抗菌的分离及筛选结果
共分离纯化出56株菌,通过平板对峙,得到14株对芒果“露水斑病”病原菌具有拮抗效果的菌株,占总分离菌株的25%,经复筛后,从14株拮抗菌中筛选出8株拮抗效果好的菌株,其抑菌圈直径见表1。其中菌株JS-8、Y-1对枝状芽枝霉的拮抗效果明显,抑菌圈直径分别达15.17、14.93 mm。(图4)。
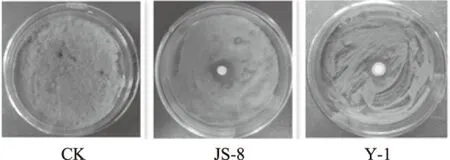
图4 拮抗菌在PDA平板上对枝状芽枝霉的抑制效果Fig.4 Effects of antagonistic bacterium on C.cladosporioides in PDA medium

表1 拮抗菌株对病原菌的抑菌复筛结果
注:不同字母表示差异显著(p<0.05)。
2.4 拮抗菌的鉴定结果
拮抗菌JS-8为革兰氏阴性杆菌、无芽孢,呈灰白色、边缘光滑、湿润、不透明、突起菌落,不产色素。拮抗菌Y-1为酵母菌,菌落白色、不透明、软而平滑且粘稠,具有酵母发酵香气,细胞呈球形或卵圆形,单个或成双,出芽生殖。
分别对菌株JS-8、Y-1进行了部分生理生化实验,主要对拮抗菌JS-8进行了接触酶实验、氧化酶实验、柠檬酸盐实验、硝酸盐还原实验、丙二酸盐利用实验、甲基红实验、V-P实验、吲哚实验以及糖发酵实验;对拮抗菌Y-1进行了糖发酵实验、碳源同化实验以及氮源同化实验,其结果见表2。

表2 拮抗菌JS-8和Y-1的生理生化特征
注:+表示90%以上菌株阳性;-表示90%以上菌株表示阴性。
以JS-8、Y-1菌株的总DNA为模板,分别采用16S rDNA通用引物、rDNA-ITS通用引物进行PCR扩增,扩增结果如图5,PCR扩增片段约为1400、600 bp,经测序得知菌株JS-8的16S rDNA序列长1368 bp,Y-1的ITS序列长613 bp。分别将所得测序结果与GenBank数据库中已有序列进行Blast同源性分析,结果显示菌株JS-8与Burkholderiagladioli菌株16S rDNA同源性为99%,菌株Y-1与Debaryomyceshansenii菌株rDNA-ITS序列同源性为99%。并结合菌落形态学观察以及生理生化特征,分别将JS-8、Y-1鉴定为唐菖蒲伯克霍尔德菌、汉逊德巴利酵母。

图5 拮抗菌JS-8、Y-1电泳图谱Fig.5 PCR amplification of JS-8 and Y-1注:M为DNA Ladder Mix maker;1为Y-1;2为JS-8。
3 讨论与结论
芒果“露水斑病”是海南省芒果产区危害最严重的病害,其发病迅速,多在雨季爆发,并且一旦发病难以控制,该病害主要影响芒果外观、形成污斑,严重降低商品价值,对整个海南芒果发展产业已造成一定影响,目前对该病害的报道还很少,同时对该病害还没有有效的防治措施。本研究从海南省各芒果产区采集了发病样本,利用扫描电镜对比了健康果实与发病果实果皮之间的差异,发现发病果皮表面生长大量真菌菌丝,而健康果实未出现菌丝,从而确定该病害是一种真菌病害。并采用组织分离法对其病原菌进行分离,经过科赫法则验证,通过形态学以及分子生物学鉴定,确定J1号真菌为枝状芽枝霉(Cladosporiumcladosporioides)。
目前芒果病害的防控大多采用化学杀菌剂,但随着病原菌产生抗药性,以及农药残留对环境与人体造成危害,人们逐渐意识到生物防治的重要性[17-18],现有报道的细菌、酵母菌以及小型丝状真菌对真菌病原菌具有拮抗作用[19-20]。目前报道较多的拮抗细菌主要是芽孢杆菌属以及假单胞菌属;具有生防能力的酵母菌已有40余种,主要是假丝酵母属、毕赤酵母属、隐球酵母属、红酵母属以及梅奇酵母属;小型丝状真菌主要是木霉属[21-22]。并且已有生物拮抗制剂得到商业化应用,如杀菌剂Serenade(Agro Quess Inc.,USA)、杀菌剂Rhio-plus(KFZB Biotechnick,Germany)、生物拮抗菌产品Biosave(Eco Science Corporation,USA)以及生物拮抗菌产品Blight Ban A506(Nu Farm,Inc.,USA)[23],由此可见生防菌株有一定的应用前景。目前对芒果病害拮抗菌研究主要集中于炭疽病、蒂腐病,对于芒果其他病害生防菌的报道较少,报道的拮抗菌主要是芽孢杆菌、季也蒙毕赤酵母、假丝酵母[24-26],而针对芒果“露水斑病”病原菌的拮抗菌还未有报道。本研究从芒果果园土壤样品中分离出8株对芒果“露水斑病”病原菌具有拮抗效果的菌株,其中菌株JS-8、Y-1拮抗效果明显,并分别鉴定为唐菖蒲伯克霍尔德菌、汉逊德巴利酵母。之前国内外已有报道利用汉逊德巴利酵母作为生防菌株的研究,如Chalutz等[27]从柠檬果实上分离出汉逊德巴利酵母,并发现其对柑橘青、绿霉病以及酸腐病具有较好的控制效果;Droby等[28]从葡萄果实上分离出的汉逊德巴利酵母对柑橘绿霉病具有抑制作用;何秀娟等[29]报道汉逊德巴利酵母能有效防治芒果炭疽病以及蒂腐病。黄蓉等[30]发现汉逊德巴利酵母产生的挥发性物质对草莓灰霉病的发病有显著地抑制作用。此外汉逊德巴利酵母还可防治苹果青霉病、桃酸腐病[31-32]。对于唐菖蒲伯克霍尔德菌作为生防菌的报道还很少,胡晓峰等[33]报道唐菖蒲伯克霍尔德菌对大丽轮枝菌、辣椒疫霉、立枯丝核菌以及烟草疫霉烟草变种具有一定的拮抗作用。但对于唐菖蒲伯克霍尔德菌、汉逊德巴利酵母两种拮抗菌对芒果“露水斑病”病原菌的抑制作用是首次报道。因此,拮抗菌JS-8以及Y-1可以作为防治“露水斑病”的潜在生防菌株,并为该病的防治提供理论基础。
[1]罗学兵.芒果的营养价值、保健功能及使用方法[J].中国食物与营养,2011,17(7):77-79.
[2]铁万祝,罗关兴,王友富,等.我国芒果产业发展概况与主要问题[J].中国热带农业,2013,5(5):16-19.
[3]杨胜远,陈桂光,肖功年,等.芒果主要病原菌拮抗微生物的分离筛选[J].植物保护,2004,30(3):55-58.
[4]Solaimani B,Ramezani S,Rahemi M,et al. Biological control of postharvest disease caused by Penicillium digitutum and P.italicum on stored citrus fruits by Shiraz Thyme essential oil[J]. Advances in Environmental Biology,2009,3(3):249-254.
[5]张晓宇,张则君,韩巨才.拮抗菌在果蔬采后病害防治中的应用[J].农业技术与装备,2012,242(14):62-64.
[6]鹿秀云,李社增,马平,等.黄瓜白粉病拮抗细菌的筛选与鉴定及其防病机理[J].中国生物防治,2006,22(增刊):54-58.
[7]胡军华,马丽娜,贺磊,等. 47种植物提取物对3种柑桔常见贮藏病害病原菌活性抑菌作用研究[J].中国南方果树,2010,39(3):1-4,8.
[8]潘洵操,谢宝贵.荔枝果皮的扫描电镜观察[J].园艺学报,1996,23(3):227-230.
[9]陆家云.植物病原真菌学[M].北京:中国农业出版社,2001:55-56.
[10]方中达.植病研究方法[M].第三版.北京:中国农业出版社,1998:24-151.
[11]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979:567-569.
[12]幕立义.植物化学保护研究方法[M].北京:中国农业出版社,1991:76-79.
[13]赵健,兰成忠,陈庆河,等.抗番茄青枯病内生拮抗细菌的筛选及室内防效测定[J].武夷科学,2006,22(1):49-54.
[14]刘晓妹,陈秀蓉,蒲金基.两株芽孢杆菌无菌液抗菌谱及稳定性测定[J].中国生物防治,2003,19(3):141-143.
[15]东秀株,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:162-171.
[16]Barnett J A,Penn R W,Yaro D著,胡瑞卿译. 酵母菌的特征与鉴定手册[M]. 青岛:青岛海洋大学出版社,1991:60-117.
[17]Kupper C,Cervantes L,Klein N,et al. Evaluation of Antagonistic MicroorganismsSaccharomycesCerevisiaeand Bacillus Subtilis for Control ofPenicilliumDigitatum[J].Rev Bras Frutic,2013,35(2):425-436.
[18]Sugar D,Basile S R. Orchard Calcium and Fungicide Treatments Mitigate Effects of Delayed Postharvest Fungicide Applications for Control of Postharvest Decay of Pear Fruit[J]. Postharvest Biology and Technology,2011,60(1):52-56.
[19]裘纪莹,王未名,陈建爱,等.拮抗菌在果蔬保鲜中的应用研究进展[J].食品工业科技,2009,30(5):334-336.
[20]华娟,李淋玲,程华,等.拮抗菌生物防治果蔬病害的研究进展[J].江西农业学报,2013,25(10):71-74.
[21]魏巧婕,郑新艳,邓开英,等.黄瓜枯萎病拮抗菌的筛选鉴定及其生物防效[J].南京农业大学学报,2013,36(1):40-46.
[22]黄运凤,刘国凌.拮抗菌制剂在果蔬采后病害防治中的应用研究进展[J].贵州农业科学,2010,38(5):106-109.
[23]王友升. 拮抗酵母菌与果蔬采后病害防治[M].北京:知识产权出版社,2012:4-7.
[24]李春玲,王庆国,胥李娜,等.一株芒果炭疽病拮抗菌抑菌活性的研究及其鉴定[J].食品工业科技,2012,33(11):147-150.
[25]陈敏,高云慨,宋海超,等.氯化钙结合季也蒙毕赤酵母(Meyerozyma guilliermondii)对抑制芒果采后炭疽病效果的影响[J].食品科学,2016,37(2):204-209.
[26]赵超,胡美姣,李敏,等.芒果采后病害拮抗菌的筛选、鉴定及其生防效果研究[J].西南农业学报,29(2):385-389.
[27]Chalutz E,Wilson C L. Postharvest biocontrol of green and blue mold and sour rot of citrus fruit by Debaryomyces hansenii[J]. Plant Disease,1990,74(2):134-137.
[28]Droby S,Lischinski S,Cohen L,et al. Characterization of an epiphytic yeast population of grapefruit capable of suppression of green mould decay caused by Debaryomyces hansenii[J]. Biological Control,1999,16(1):27-34.
[29]何秀娟.筛选芒果采后炭疽病和蒂腐病的生防菌研究[D].武汉:华中农业大学,2006.
[30]黄蓉,黄盼,黄瑞荣.一株酵母菌的鉴定及其挥发性物质防病测定[J].江西农业大学学报,2015,37(5):903-908.
[31]Singh D,Sharma R R,Samuel D V,et al. Enhancing the bioefficacy of Debaryomyces hansenii with sodium salts for reducing the blue mould rot in apples[J].Indian Phytopathology,2011,62(4):478-483.
[32]Diesh S,Goutam M. Improved control of Rhizopus stolonifer-induced storage rot of peach with hot water and antagonistic yeast,Debaryomyces hansenii[J].Indian Phytopathology,2012,59(2):168-173.
[33]胡晓峰,郭晋云,张楠,等.一株溶磷抑病细菌的筛选及其溶磷特性[J].中国农业科学,2010,43(11):2253-2260.
Isolation and identification of pathogen causing mango dew blotch disease and screening of its antagonistic microorganisms
JING Min-min,TIAN Ya-qin,WANG Run-han,SHAO Yuan-zhi*
(College of Food Science and Technology,Hainan University,Haikou 570228,China)
Objective:The project aims to clarify the pathogen of the mango dew blotch disease,screen its antagonistic microorganisms in order to lay theoretical basis for the further prevention of the disease. Methods:Scanning electron microscope was used to observe the condition of the peel of diseased fruit. Conventional tissue separation method was applied to separate disease tissue. And the antagonistic microorganisms were screened by the flat-stand method. The pathogen and antagonistic microorganisms were identified in morphological and molecular biological methods. Results:It was found that mango dew blotch disease was caused by fungus.And the pathogen was identified as Cladosporium cladosporioides. Eight antagonistic strains againstCladosporiumcladosporioideswere isolated and screened from the soil in mango garden. The strain JS-8 and Y-1 showed the highest and most stable antagonistic effect(p<0.05). Results showed that the inhibition zone diameters were 15.17 mm and 14.93 mm. Based on morphological,physiological and biochemical characteristics,and molecular biological methods,JS-8 and Y-1 were identified asBurkholderiagladioli,Debaryomyceshansenii. Conclusions:Mango dew blotch disease was mainly caused byCladosporiumcladosporioides.BurkholderiagladioliandDebaryomyceshanseniican be used for potential biocontrol strains of Mango dew blotch disease.
mango dew blotch disease;pathogen;antagonistic microorganisms;identification;screening
2016-09-28
井敏敏(1990-),女,硕士研究生,研究方向:热带果蔬贮藏加工学,E-mail:jingminmin2016@163.com。
*通讯作者:邵远志(1969-),男,本科,教授,研究方向:果蔬病害防控与果蔬采后保鲜,E-mail:s.yz123789@163.com。
农业部南亚热作项目(14RZNJ-59);海南省重点研发计划项目(ZDYF2016043)。
TS201.3
A
1002-0306(2017)05-0163-05
10.13386/j.issn1002-0306.2017.05.022

