一株高产β-苯乙醇酵母菌的筛选、鉴定及其发酵条件优化
许 岱,范光森,3,富志磊,马 超,孙啸涛,杨 然,孙宝国,3,李秀婷,3,*
(1.北京工商大学食品学院,北京 100048;2.北京市食品风味化学重点实验室,北京 100048;3.食品营养与人类健康北京高精尖创新中心,北京 100048)
一株高产β-苯乙醇酵母菌的筛选、鉴定及其发酵条件优化
许 岱1,2,范光森1,2,3,富志磊1,马 超1,孙啸涛1,2,杨 然1,孙宝国1,2,3,李秀婷1,2,3,*
(1.北京工商大学食品学院,北京 100048;2.北京市食品风味化学重点实验室,北京 100048;3.食品营养与人类健康北京高精尖创新中心,北京 100048)
目的:本文主要是从大曲中筛选一株高产β-苯乙醇酵母菌株,并对其发酵条件进行优化。方法:采用平板涂布法筛选高产β-苯乙醇酵母菌株,通过菌落形态、细胞结构和分子生物学方法对其进行鉴定;利用单因素优化L-苯丙氨酸浓度、酵母浸粉浓度、温度和初始pH等发酵条件,在单因素优化的基础上,采用Box-Behnken法设计三因素三水平试验进行响应面优化,确定其产β-苯乙醇最佳发酵条件。结果:从浓香型大曲中筛选获得一株高产β-苯乙醇的酵母,命名为Y1511,经鉴定为库德里阿兹威毕赤酵母(Pichiakudriavzevii);该菌株在豆芽汁培养基中能产近30种挥发性风味物质;通过单因素和响应面最终获得该酵母发酵产苯乙醇的最佳条件为:葡萄糖 80 g/L、硫酸镁0.5 g/L、磷酸二氢钾5 g/L、L-苯丙氨酸10 g/L、酵母浸粉5.5 g/L,初始pH5,在26 ℃培养,苯乙醇产量达到3.25 g/L。结论:本文首次报道了大曲来源的库德里阿兹威毕赤酵母产苯乙醇研究。
大曲,库德里阿兹威毕赤酵母,苯乙醇,优化
β-苯乙醇是继香兰素之后应用最广泛的香味化合物,具有柔和、愉快而持久的玫瑰香气,作为香料在食品香精、化妆品、洗涤产品中得到广泛应用[1]。同时,β-苯乙醇也是白酒、黄酒、清酒、果酒、葡萄酒、酱油、面包、干酪等传统发酵食品中重要的呈味物质[2-4]。如在米香型白酒中其为主体香,并且其不仅在浓香型白酒、酱香型白酒、豉香型白酒和黄酒等是重要的特征性风味物质,而且对这些发酵食品其它风味物质起到协和及增效的作用[5-7]。由此可见,无论是作为香味调节剂还是对于提升发酵食品品质,β-苯乙醇都具有重要的研究价值。
目前,全球β-苯乙醇的产量近万吨,绝大多数是采用化工原料苯或苯乙烯通过化学合成的方法生产,也有少数部分是从玫瑰或玫瑰精油中提取出来的[8]。虽然化学合成β-苯乙醇价格低廉,市场价格仅为3.5美元/kg,但由于其合成所使用的廉价化工原料苯或苯乙烯多属于致癌物质,不仅对人体健康和环境都有巨大危害,而且还含有一些不良气味的副产物,严重影响β-苯乙醇的品质。植物提取方法在安全性方面得到保障,但由于原料有限而造成天然提取的β-苯乙醇价格高达1000美元/kg以上[9]。随着食品生物技术的发展和人们对食品安全性越来越重视,通过微生物发酵法生产天然苯乙醇香料得到国内外研究者的广泛关注与重视。同时,在以β-苯乙醇为特征风味物质的多种发酵食品酿造过程中,更加强调通过调控自身微生物菌群而达到提高β-苯乙醇含量的目的。目前,已有多种分离获得的酵母具有合成β-苯乙醇的能力报道,如酿酒酵母[1,10-12]、马克斯克鲁维酵母[13-14]、乳酸克鲁维酵母[15]、异常威克汉姆酵母[16]等,这些研究主要集中于筛选获得高产β-苯乙醇的菌株,从而利用生物发酵法获得天然β-苯乙醇产物,很少有针对特殊发酵食品酿造中的微生物进行筛选高产β-苯乙醇菌株的研究。
大曲是浓香型白酒酿造的发酵剂和生香剂,含有大量能起发酵和产香作用的微生物和酶类,为浓香型白酒酿造中重要的微生物菌库[16]。以大曲作为筛选浓香型白酒酿造过程中高产苯乙醇菌株的样品具有突出的代表性和可行性。因此,本文以大曲为高产苯乙醇菌株筛选的出发点,针对浓香型白酒中的特征风味物质——苯乙醇进行功能微生物的筛选,期望获得一株高产β-苯乙醇的功能微生物,对所获的功能微生物进行鉴定,并进行其产苯乙醇条件优化研究,为实现利用该菌株提高浓香型白酒酿造过程中β-苯乙醇含量打下理论基础。
1 材料与方法
1.1 材料与仪器
浓香型大曲:取自安徽古井集团有限责任公司2015年4月制备的大曲,从成熟曲房中不同位置随机取得5块完整大曲后,利用粉碎机粉碎,按照四分法取样后装入物菌袋中,于4 ℃保存待筛选菌株用。
β-苯乙醇标准品购自Sigma公司;甲醇为色谱纯;其余试剂均为国产分析纯试剂。
YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母膏10,琼脂粉20,115 ℃灭菌20 min。
WL培养基(g/L):酵母浸粉5,胰蛋白胨5,葡萄糖50,琼脂20,磷酸二氢钾0.55,氯化钾0.425,氯化钙0.125,氯化铁0.0025,硫酸镁0.125,硫酸锰0.0025,溴甲酚绿0.022,pH为6.5,121 ℃灭菌20 min。
活化培养基(g/L):葡萄糖20,蛋白胨20,酵母膏10,腺嘌呤0.04,尿嘧啶0.02,pH5.5,115 ℃灭菌20 min。
产香培养基(g/L):豆芽汁100,葡萄糖50,蒸馏水调配,115 ℃灭菌20 min。
转化培养基(g/L):葡萄糖80,硫酸镁0.5,磷酸二氢钾5,L-苯丙氨酸10,酵母浸粉5,121 ℃灭菌20 min。
BCN-1360型生物洁净工作台 北京东联哈尔仪器公司;电子天平,pH计 赛多利斯科学仪器有限公司;LHS-100CL恒温恒湿培养箱 上海一恒仪器设备有限公司;TU-19紫外-可见分光光度计 北京普析通用仪器有限责任公司;CKX41-F32FL倒置荧光显微镜 日本OLYMPUS;BL-2200H型电子分析天平 岛津国际贸易(上海)有限公司;7890A-5975C型气相色谱-质谱联用仪(GC-MS) 美国Agilent科技有限公司;Tprofessional PCR仪 Biometra公司;Microfuge 2R离心机 北京田林恒泰科技有限公司;高效液相色谱仪(1260series) Agilent科技有限公司。
1.2 实验方法
1.2.1 酵母菌株的筛选和分离 称取1 g曲粉,加入9 mL无菌水,浸泡15 min后充分振荡,制成菌悬液。在无菌操作条件下,用无菌水逐级稀释至10-3、10-4、10-5和10-6梯度菌悬液。取各梯度菌悬液0.1 mL涂布于YPD平板上,每个稀释梯度做三个平行。将培养基平板倒置于30 ℃恒温培养箱中培养2 d,挑选平板上球形、表面突起、乳白色、不透明的单菌落,划线于YPD平板上,直至在显微镜下观察菌体形态一致。将得到纯菌种保存于YPD斜面培养基上。
1.2.2 酵母菌株初筛 将1.2.1筛选获得的酵母接于活化培养基中,于30 ℃,转速为160 r/min的摇床中培养16 h,再以1%的接种量转接于转化培养基中,于30 ℃,转速为160 r/min,培养54 h。发酵液于10000 r/min离心10 min,取上清液采用高效液相色谱法检测β-苯乙醇含量。
1.2.3 高效液相色谱法测定β-苯乙醇含量 发酵上清液,用0.22 μm滤膜过滤,用纯水稀释适当浓度后进行高效液相色谱检测。具体方法参数为:C-18反相柱(ZORBAX Eclipse Plus C-18)4.6×250 mm,5 μm;流动相为甲醇∶水=1∶1(v/v),流速:0.5 mL/min;检测波长260 nm,柱温30 ℃,进样量10 μL;β-苯乙醇检出时间为16.8 min。
1.2.4 菌株鉴定
1.2.4.1 菌落形态观察 WL培养基形态观察:将1.2.2初筛获得的高产苯乙醇菌种接种至YPD上进行活化,培养24~48 h后接种至WL培养基,30 ℃下培养,5 d后进行观察。
1.2.4.2 显微结构观察 挑取1.2.4.1中YPD平板上单菌落的少量菌体,轻柔、均匀涂布在载玻片中的无菌水液滴中,固定后,采用美蓝染色液进行染色,制作临时装片,于10×100油镜下观察,记录细胞形态特征、细胞大小、出芽情况。置于荧光倒置显微镜下进行观察。
1.2.4.3 分子生物学鉴定 26S rDNA基因的PCR扩增与序列测定:采用氯化苄法提取1.2.2初筛获得的高产苯乙醇酵母基因组DNA,以基因组DNA为模板扩增26S rDNA,以通用PCR引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)扩增D1/D2区序列。PCR扩增条件:95 ℃预变性5 min,95 ℃变性45 s,55 ℃退火45 s,72 ℃延伸45 s,31个循环;72 ℃再延伸10 min。反应体系(25 μL):Taq DNA聚合酶(5 U/L)0.25 μL,10×PCR Buffer 2.5 μL,dNTP(2.5 mol/L)2 μL,模板DNA(基因组DNA)2 ng,引物NL-1(20 μmol/L)0.5 μL,引物NL-4(20 μmol/L)0.5 μL,双蒸水定容至25 μL。PCR扩增产物在0.8%的琼脂糖凝胶电泳检测,在紫外成像系统上拍照分析。将验证后的PCR扩增产物送至北京六合华大基因科技股份有限公司测序。
系统发育树的构建:使用BLAST将26S rDNA测序结果在NCBI(http://www.ncbi. nlm. nih.gov/)上比对,根据同源性搜索结果,使用MEGA 6.0生物学软件对测试菌株和相关菌株的多个序列进行比对分析及Neighbor-Joining方法构建系统发育树。
1.2.5 酵母发酵产香 将1.2.4鉴定的酵母在YPD液体培养基(固体YPD培养基中不添加琼脂)中活化,以1%的接种量接种于产香培养基中,在30 ℃下静置培养72 h。发酵液于4 ℃,10000 r/min离心10 min,取上清液采用顶空固相微萃取-气质联用法(SPME-GC-MS)检测该酵母所产挥发性香气成分。
1.2.6 顶空固相微萃取-气质联用法测定挥发性成分 将离心后的发酵液倒入顶空瓶中,恒温(80 ℃)水浴30 min平衡样品,同时将50/30 μm DVB/CAR/PDMS萃取头插入GC-MS进样口,打开老化柱子程序并老化萃取头30 min。将老化后的萃取头插入顶空瓶中吸附30 min,随后将萃取头移入气相色谱的高温汽化室中解吸5 min,进行GC-MS分析。具体的GC-MS条件参数为:毛细管色谱柱为DB-FFAP,规格为(60 m×250 μm×0.25 μm);手动进样,分流比为10∶1,进样口温度250 ℃;程序升温50 ℃,保留2 min,以8 ℃/min的速率升至120 ℃,保留2 min;再以10 ℃/min升至200 ℃,稳定5 min;最后以5 ℃/min升至250 ℃,稳定20 min;检测器温度250 ℃;载气为He,流速 1 mL/min;EI电离源,电子能量70 eV;扫描范围10-500 u;离子源温度250 ℃;接口温度250 ℃。
1.2.7 单因素实验 将1.2.4鉴定的酵母接种于活化培养基中,在30 ℃下以160 r/min条件下培养16~18 h。然后接入转化培养基中,于200 r/min条件下培养。依次考察L-苯丙氨酸浓度(5、10、15、20、25和30 g/L)、酵母浸粉浓度(0、5、10、15、20、25和30 g/L)、温度(20、25、30、35和40 ℃)和初始pH(1、2、3、4、5、6和7)。检测方法参照1.2.3。
1.2.8 响应面实验 在单因素基础上选择酵母浸粉浓度、pH和温度3个因素为自变量,采用 Box-Behnken中心组合设计,以苯乙醇浓度为响应值,设计了3因素3水平响应面分析实验,实验组合的因素与水平选取如表1。
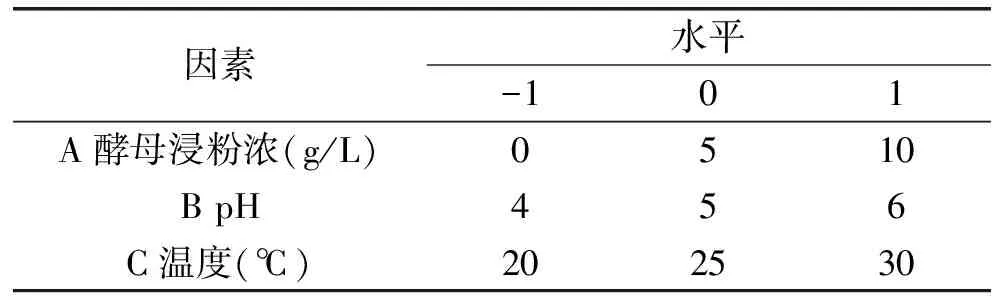
表1 Box-Behnken实验设计因素水平
1.2.9 数据处理 实验结果采用Excel 2013和Design-Expert 8.0.6软件进行分析处理。
2 结果与分析
2.1 苯乙醇产生菌株初筛
通过梯度稀释结合平板涂布方法先后从古井贡酒曲中分离出16株菌株,经菌落形态和细胞显微结构观察,初步确定这些菌株为酵母菌。将上述获得的酵母菌株接种于转化培养基中,于30 ℃,转速为160 r/min,培养54 h,通过高效液相色谱法检测β-苯乙醇含量,实验结果见表2(未检测到β-苯乙醇菌株未列出)。
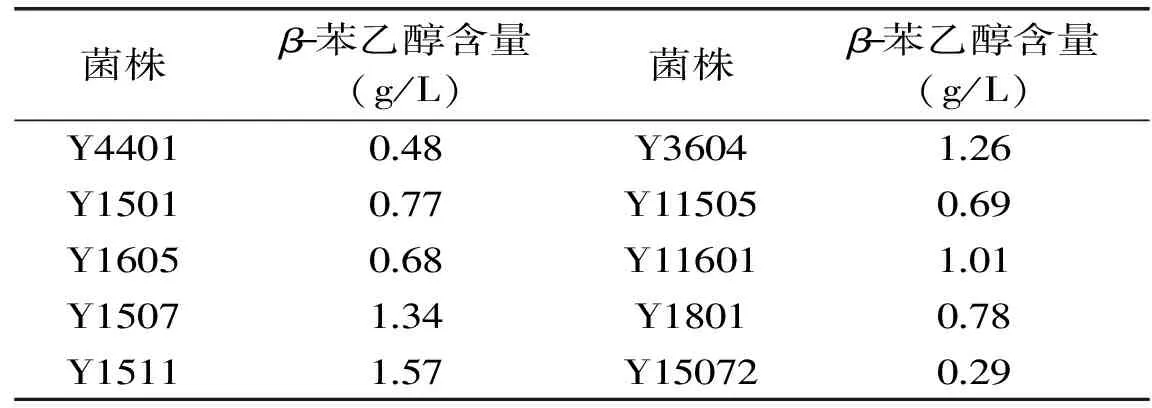
表2 不同酵母发酵液中β-苯乙醇含量比较结果
发酵结束时,通过嗅闻发现有多株酵母能产生明显的香味物质,初步表明多株酵母具有产香能力。由表2可知,不同酵母产β-苯乙醇能力不同,有多株酵母具有较理想的产β-苯乙醇能力,同时与嗅闻时香味强弱结果几乎一致,初步表明香味成分主要就是β-苯乙醇。通过表2可以发现,酵母Y1507、Y1511、Y3604和Y11601所产β-苯乙醇能力相对较高,初步达到1.0 g/L以上,其中酵母Y1511显示出最高的β-苯乙醇合成能力(艾氏途径[17]),其产量初步达到1.57 g/L。图1为菌株Y1511发酵上清液的高效液相色谱图。由图1可以看出,酵母Y1511发酵液在方法1.2.3条件下可以充分洗脱和分离,β-苯乙醇出峰时间在16.8 min左右(与苯乙醇标准品出峰时间一致),峰形对称且无明显干扰峰,同时β-苯乙醇标品在0~3.2 g/L内线性关系良好,线性回归方程为y=1889.0x+3.5567(R2=0.9998)。

图1 酵母Y1511发酵液高效液相色谱图Fig.1 HPLC chromatogram of β-phenylethanol in fermentation of yeast strain Y1511
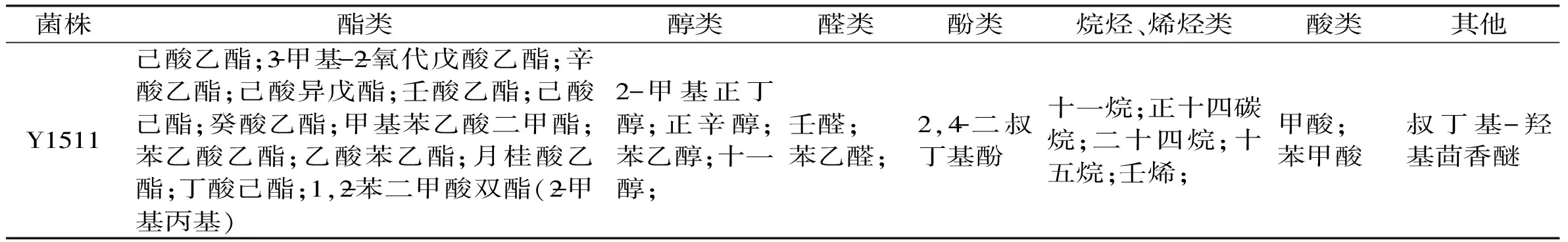
表3 酵母Y1511发酵液中挥发性成分检测
2.2 酵母Y1511发酵产香实验
酵母Y1511接种于产香培养基中,30 ℃下静置培养72 h后,发酵液上清通过SPME-GC-MS方法检测,实验结果如表3所示,由表3可以看出酵母Y1511能合成β-苯乙醇(属于莽草酸从头合成途径[17]),初步表明该菌株能够在白酒酿造过程中产生β-苯乙醇。除此之外,可以看到酵母Y1511还能产生多种挥发性风味物质,酯类有13种,醇类4种(包括β-苯乙醇),醛类2种,酚类1种,烷烃、烯烃类5种、酸类2种等。在这些风味物质中,已酸乙酯是浓香型白酒的主体呈香呈味风味物质,而同样具有玫瑰香的乙酸苯乙酯和苯乙醛则分别是清香型白酒和绵柔型白酒的重要风味物质[18-20]。由此可见,酵母Y1511是白酒酿造过程中重要的产香酵母,研究酵母Y1511产β-苯乙醇能力对于更好的在白酒酿造中利用该菌提供理论基础。
2.3 酵母Y1511的鉴定
2.3.1 酵母Y1511形态特征 酵母Y1511在WL培养基上菌落呈黄绿色,边缘不规则,中间突起(图2a)。其在显微镜下细胞呈长椭圆形,并且有狭长的细胞,生殖方式为顶端出芽,属典型酵母特征(图2b)。
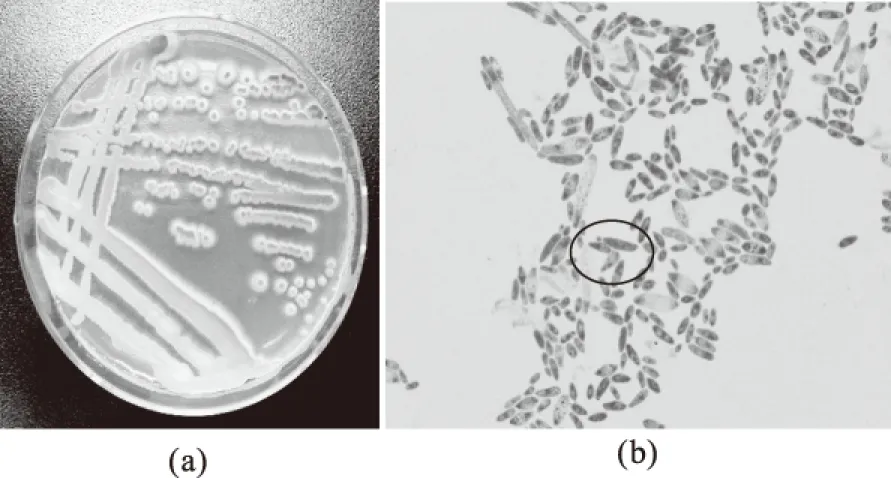
图2 酵母在WL培养基上菌落形态特征(a) 及显微镜下细胞形态特征(×1000)(b)Fig.2 The colony morphology(a)of yeast strain Y1511 on WL culture medium and cell morphology(b)of yeast strain Y1511 captured by microscope(×1000)
2.3.2 26S rDNA序列分析 将酵母Y1511的26S rDNA测序结果在NCBI中进行BLAST比对,结果表明,与东方伊萨酵母(Issatchenkiaorientalis)或库德里阿兹威毕赤酵母(P.Kudriavzevii)的26S rDNA序列同源性最高,相似度达到99%。使用分子软件MEGA 6.0对与酵母Y1511相似度较高的10株菌株进行多序列比对分析,并利用Neighbor-Joining方法构建系统发育树(图3)。由图可以看出酵母Y1511与库德里阿兹威毕赤酵母同源性最高,鉴定为库德里阿兹威毕赤酵母(P.Kudriavzevii)。该菌株已于2016年5月31日保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏号为CGMCC NO.12567。乔晓梅等[21]、兰玉倩等[22]、Zheng等[23]和Li等[24]分别通过高通量测序法和变性梯度凝胶电泳(PCR-DGGE)等方法研究了清香大曲真菌群落结构发现,库德里阿兹威毕赤酵母是其酵母属的重要组成成分;孙剑秋等研究表明库德里阿兹威毕赤酵母可能是北大仓白酒酿造过程中重要的微生物,在酿造过程中发挥重要的作用[25];王晓丹等从酱香白酒中获得一株库德里阿兹威毕赤酵母,发现其产乙酸苯乙酯能力较强[26]。由此可见,库德里阿兹威毕赤酵母是白酒酿造过程中的重要酵母菌株,但同时发现该菌株主要是在清香型白酒和酱香型白酒中报道,本文为首次在浓香型白酒中报道其重要性。更为重要的是,尚未见该菌株产β-苯乙醇的相关报道,为此,本文对该菌株产苯乙醇条件进行优化。

图3 酵母Y1511基于26S rDNA D1/D2序列及Neighbor-Joining法构建的系统发育树Fig.3 Phylogenetic tree of yeast strain Y1511 using neighbor-joining analysis based on the 26S rDNA D1/D2
2.4 单因素实验优化酵母Y1511合成β-苯乙醇条件
2.4.1 L-苯丙氨酸浓度对酵母Y1511合成苯乙醇的影响 在酵母产β-苯乙醇的艾氏途径中,作为转化底物的L-苯丙氨酸浓度至关重要,浓度过低酵母菌不能充分发挥催化能力,浓度过高则会造成转化率低,导致成本增加[12]。为此,考察了底物L-苯丙氨酸浓度对β-苯乙醇合成的影响,结果如图4。可以看出,在L-苯丙氨酸浓度低于15 g/L时,酵母Y1511合成β-苯乙醇的浓度随底物浓度增加而增加,之后出现小幅度下降趋势。当L-苯丙氨酸添加量分别为10 g/L和15 g/L时,酵母Y1511合成β-苯乙醇浓度分别达到1.78 g/L和1.85 g/L,两者相差不大,故选择10 g/L为最优L-苯丙氨酸添加量,这与Etschmann等研究结果相近[27]。大多数研究表明L-苯丙氨酸浓度在5~10 g/L之间为最佳底物浓度范围[13-15],如Eun等通过响应面优化获得最佳的L-苯丙氨酸浓度为6.53 g/L,黄筱萍等实验结果表明L-苯丙氨酸浓度在8 g/L时最佳[28-29];而Fabre等研究发现在L-苯丙氨酸浓度为2 g/L时最佳,苯乙醇产量达到1.4 g/L,同样,Eshkol等研究表明当L-苯丙氨酸浓度为4 g/L时β-苯乙醇产量达到较高水平,继续增加L-苯丙氨酸浓度,苯乙醇产量不再增加[11,30];Grygier等和唐育岐等研究却发现L-苯丙氨酸浓度分别为21 g/L和25 g/L时β-苯乙醇产量最高[31-32]。由此可见,不同的酵母所需要的最佳底物浓度不同。

图4 L-苯丙氨酸浓度对β-苯乙醇合成的影响Fig.4 Effect of L-phenylalanine on β-phenylethanol production from yeast strain Y1511
2.4.2 酵母浸粉浓度对酵母Y1511合成β-苯乙醇的影响 在酵母细胞中,β-苯乙醇合成走哪一条途径取决于培养基中氮源的种类,只有当L-苯丙氨酸作为唯一氮源存在时,能高产β-苯乙醇的艾氏途径才能占优势[33]。所以,很多研究中转化培养基中只有L-苯丙氨酸作为唯一氮源[14-15,28]。然而,有相关研究表明,由于酵母浸粉中含有酵母生长所需要的大量氨基酸、维生素和微量元素等生长因子,所以在促进酵母生长方面具有重要的意义,从而促进酵母合成β-苯乙醇[12,29,32]。本文对酵母浸粉添加量进行了考察,结果如图5所示,可以看出,酵母浸粉添加量为5 g/L时,相比只有L-苯丙氨酸时,酵母合成β-苯乙醇能力增强,然而其它浓度情况下,酵母合成β-苯乙醇能力则都有所下降。这可能是因为在酵母浸粉浓度较低时,主要为酵母生长提供必要的因子,而在较高浓度时,则因为环境中有更多容易利用的氮源存在,L-苯丙氨酸会通过其它途径被代谢,如通过肉桂酸途径降解为3-酮基乙二酸而进入TCA循环[33]。以上结果与梅建凤等、黄筱萍等和唐育岐等研究结果一致[12,29,32]。

图5 酵母浸粉浓度对β-苯乙醇合成的影响Fig.5 Effect of yeast extract on β-phenylethanol production from yeast strain Y1511
2.4.3 温度对酵母Y1511合成β-苯乙醇的影响 温度会影响酵母的生长和活力,考虑到酵母生长温度范围,本实验选择20~40 ℃的范围内进行考察温度对酵母Y1511合成苯乙醇的影响,结果由图6。可以看出,当温度为25 ℃时,酵母Y1511合成β-苯乙醇产量最高为2.79 g/L。较高或较低温度不仅影响菌株的正常生长,而且转化所需要的酶在低温条件下活性较低,在高温则会导致酶失活,从而导致β-苯乙醇产量降低[29]。梅建凤等通过响应面优化得到酿酒酵母最佳的催化温度为30 ℃,黄筱萍等结果表明酵母转化生成β-苯乙醇的最佳温度为28~30 ℃,而Etschmann等和Fang等实验结果则表明马克斯克鲁维酵母催化温度较高,分别在32.5 ℃和35 ℃具有最佳转化能力[12,14,27,29]。
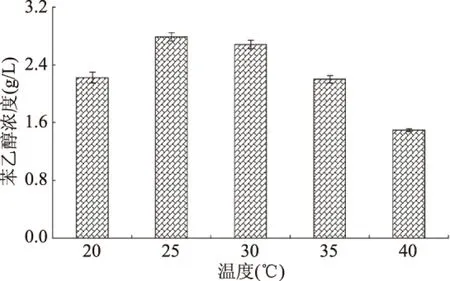
图6 温度对Y1511合成β-苯乙醇的影响Fig.6 Effect of temperature on β-phenylethanol production from yeast strain Y1511
2.4.4 pH对酵母Y1511合成β-苯乙醇的影响 适宜的pH不仅有利于酵母生长,而且会影响代谢途径,对酵母代谢起到重要的调控作用。通过优化初始pH发现(图7),随着初始pH增加,酵母Y1511合成β-苯乙醇的量不断增加,当初始pH达到5.0时,产量达到最大,为3.18 g/L,之后,随着初始pH继续增加,产量逐渐降低。图中所示的自然pH为5.5左右,也符合上述规律。黄筱萍等采用磷酸盐类缓冲液调节培养基初始pH和控制代谢过程中的pH以及加入CaCO3控制转化过程的pH,结果表明pH控制在5.2~5.3有利于转化的顺利进行[29]。崔志峰等对酿酒酵母合成β-苯乙醇条件优化发现最佳的初始pH为5~6;Eun等对异常毕赤酵母优化的结果表明,其最适初始pH为5.03;同样,Grygier等对季也蒙毕赤酵母合成β-苯乙醇初始pH条件进行优化,最佳结果为5.0,以上结果与本文一致[28,31,34]。值得注意的是,该菌株pH适应性比较强,即使在pH为1.0时也能很好的生长,并能合成β-苯乙醇。
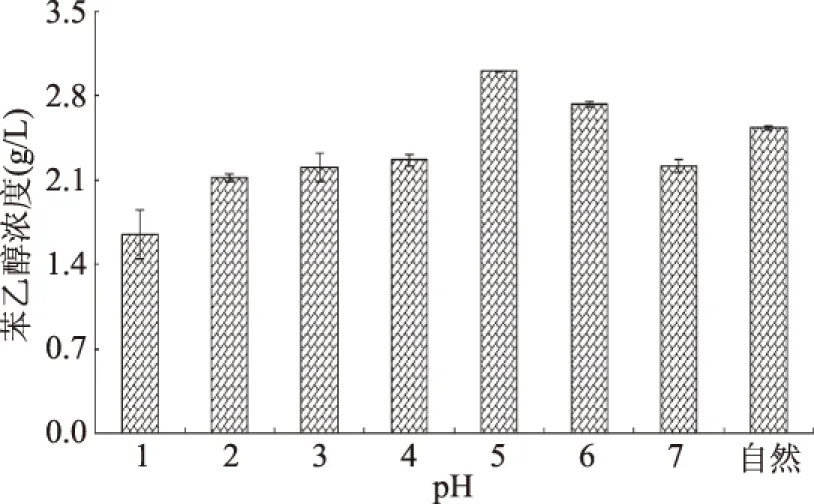
图7 pH对Y1511合成β-苯乙醇的影响Fig.7 Effect of pH on β-phenylethanol production from yeast strain Y1511
2.5 响应面实验优化酵母Y1511合成β-苯乙醇条件
2.5.1 响应面实验设计及结果 根据Box-Behnken中心组合设计原理,选择酵母浸粉浓度、pH和温度为优化参数,以β-苯乙醇的产量为响应值,对酵母Y1511发酵产β-苯乙醇实验进行三因素三水平响应面设计,并对其结果进行分析(表4)。通过Design-Expert8.0.6软件分析,对实验数据进行二次多项回归拟合,得到回归方程:Y=3.20+0.065A-0.025B+0.045C+0.055AB-0.050AC-0.020BC-0.24A2-0.18B2-0.13C2。

表4 Box-Behnken实验设计与结果
对模型进行回归分析后,其结果如表5。

2.5.2 各因素间交互作用分析 通过Design-Expert 8.0.6软件绘制三维响应曲面图,探究两因素间交互作用对酵母Y1511发酵产β-苯乙醇的影响,结果见图8~图10。可见酵母浸粉浓度和pH、温度之间具有较强的交互作用,温度和pH间交互作用弱,但也对酵母Y1511发酵产β-苯乙醇具有一定的影响。
通过回归方程得出,酵母浸粉浓度、pH、温度分别为5.56 g/L、4.94、25.79 ℃时,预测β-苯乙醇含量达到3.21 g/L。为方便后续实验,选择酵母浸粉浓度5.5 g/L、pH5,在26 ℃条件下进行实验,β-苯乙醇含量达到3.25 g/L,与预测值接近,证明拟合模型可以较好的找出酵母Y1511发酵产β-苯乙醇的最优条件。这与荣绍丰等报道的结果近似(3.26 g/L),高于Fabre等研究的马克斯克鲁维酵母发酵水平,而略低于Eshkol等研究的酿酒酵母产β-苯乙醇的能力,处于单相发酵的中等偏上水平[11,30,35]。

表5 回归模型方差分析

图8 酵母浸粉和pH对酵母Y1511发酵产β-苯乙醇影响Fig.8 Effect of yeast extract and pH on β-phenylethanol production from yeast strain Y1511
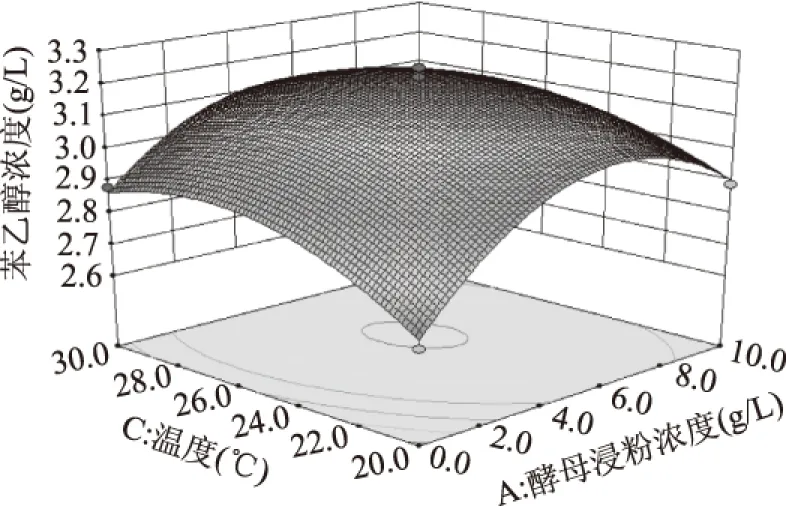
图9 酵母浸粉和温度对酵母Y1511发酵产β-苯乙醇影响Fig.9 Effect of yeast extract and temperature on β-phenylethanol production from yeast strain Y1511

图10 pH和温度对酵母Y1511发酵产β-苯乙醇影响Fig.10 Effect of pH and temperature on β-phenylethanol production from yeast strain Y1511
注:*为显著,**为极显著。
3 结论
本研究从浓香型大曲中筛选获得一株高产β-苯乙醇的库德里阿兹威毕赤酵母,且该酵母发酵产香物质较多,适合应用于白酒酿造过程中,作为功能强化菌调控白酒的风味。通过单因素和响应面法优化,最终确定该酵母最佳条件为:葡萄糖80 g/L,硫酸镁0. 5 g/L,磷酸二氢钾5 g/L,L-苯丙氨酸浓度10 g/L,酵母浸粉浓度5.5 g/L,初始pH5,培养温度26 ℃。在该条件酵母Y1511合成β-苯乙醇高达3.25 g/L,这是首次有关该种属酵母产β-苯乙醇的相关研究,为白酒生产中产香酵母的研究奠定基础。
[1]Shen L,Nishimura Y,Matsuda F,et al. Overexpressing enzymes of the Ehrlich pathway and deleting genes of the competing pathway inSaccharomycescerevisiaefor increasing 2-phenylethanol production from glucose[J]. Journal of Bioscience and Bioengineering,2016,122(1):34-39.
[2]邓斯丽. 米香型白酒中甲醇、乳酸乙酯和β-苯乙醇的气相色谱法测定[J]. 轻工科技,2016(5):3-15.
[3]汪玲玲,范文来,徐岩. 酱香型白酒液液微萃取-毛细管色谱骨架成分与香气重组[J]. 食品工业科技,2012,33(19):304-308.
[4]王培璇,毛健,李晓钟,等. 不同地区黄酒挥发性物质差异性分析[J]. 食品科学,2014,35(6):83-89.
[5]李大和. 试论豉香型白酒独特风格的成因[J]. 酿酒科技,2004(1):24-25.
[6]李诗铁,寻思颖,郝金竹,等. 饮料酒中β-苯乙醇标准物质标准浓度的测量[J]. 中国计量,2013(1):88-90.
[7]周健,郭志,明红梅,等. 优质中高温浓香型大曲主要香味成分的初步研究[J]. 酿酒科技,2014(4):11-14.
[8]Clark G S. Phenethyl alcohol[J]. Perfume Flavor,1990,15:37-44.
[9]赵修报,唐育岐,刘天明.β-苯乙醇的研究进展[J]. 中国酿造,2011(8):1-4.
[10]黄筱萍,刘兰,熊大维,等. 一株高产2-苯乙醇酵母菌的筛选及鉴定[J]. 食品与生物技术学报,2016,35(5):531-536.
[11]Eshkol N,Sendovski M,Bahalul M,et al. Production of 2-phenylethanol from L-phenylalanine by a stress tolerant Saccharomyces cerevisiae strain[J]. Journal of Applied Microbiology,2009,106(2):534-542.
[12]梅建凤,闵航,吕镇梅. 利用酵母细胞生物催化合成2-苯乙醇[J]. 催化学报,2007,28(11):993-998.
[13]Etschmann M M W,Sell D,Schrader J. Production of 2-phenylethanol and 2-phenylethylacetate from L-phenylalanine by coupling whole-cell biocatalysis with organophilic pervaporation[J]. Biotechnology and Bioengineering,2005,92(5):624-634.
[14]Fang G,Daugulis A J. Bioproduction of the aroma compound 2-phenylethanol in a solid-liquid two-phase partitioning bioreactor system by Kluyveromyces marxianus.[J]. Biotechnology and Bioengineering,2009,104(2):332-339.
[15]Etschmann M M W,Sell D,Schrader J. Screening of yeasts for the production of the aroma compound 2-phenylethanol in a molasses-based medium[J]. Biotechnology Letters,2003,25(7):531-536.
[16]明红梅,周健,陈蒙恩,等. 大曲中异常威克汉姆酵母发酵产苯乙醇的条件优化[J]. 湖北农业科学,2015,54(14):3492-3496.
[17]Huang C J,Lee S L,Chou C C. Production of 2-phenylethanol,a flavor ingredient,by Pichiafermentans L-5 under various culture conditions.[J]. Food Research International,2001,34(4):277-282.
[18]王涛,姚韬,李涛,等. 浓香型白酒酿造相关酵母发酵糟醅产己酸乙酯的研究[J]. 食品与发酵工业,2013,39(1):41-45.
[19]王勇,徐岩,范文来,等. 应用GC-O技术分析牛栏山二锅头白酒中的香气化合物[J]. 酿酒科技,2011(2):74-76.
[20]聂庆庆,范文来,徐岩,等. 洋河系列绵柔型白酒香气成分研究[J]. 食品工业科技,2012,33(12):68-74.
[21]乔晓梅,赵景龙,杜小威,等. 高通量测序法对清香大曲真菌群落结构的分析[J]. 酿酒科技,2015(4):28-31.
[22]兰玉倩,樊丹敏,刘志磊,等. 应用PCR-DGGE指纹技术解析清香型大曲生产过程中酵母群落结构[J]. 中国酿造,2012,31(10):156-159.
[23]Zheng X W,Yan Z,Nout M J R,et al. Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu,a Chinese industrial fermentation starter[J]. International Journal of Food Microbiology,2014,182:57-62.
[24]Li X R,Ma E B,Yan L Z,et al. Bacterial and fungal diversity in the starter production process of Fen liquor,a traditional Chinese liquor[J]. Journal of Microbiology,2013,51(4):430-438.
[25]孙剑秋,刘雯雯,臧威,等. 基于26S rDNA D1/D2序列分析酱香型白酒酒醅中酵母菌的群落结构[J]. 微生物学报,2012,52(10):1290-1296.
[26]王晓丹,庞博,陈孟强,等. 酱香白酒酒醅中产香酵母分离与鉴定[J]. 食品安全质量检测学报,2014,5(6):1799-1808.
[27]Etschmann M,Sell D,Schrader J. Medium optimization for the production of the aroma compound 2-phenylethanol using a genetic algorithm[J]. Journal of Molecular Catalysis B-Enzymatic,2004,29(1-6):187-193.
[28]Eun K M,Chang K S. Optimization of culture conditions for phenylethyl alcohol production by Pichia anomala SKM-T using response surface methodology.[J]. Food Science and Biotechnology,2007,16(1):159-162.
[29]黄筱萍,黄国昌,刘兰,等. 酿酒酵母SH003生物转化2-苯乙醇条件的优化[J]. 食品研究与开发,2015,36(22):154-158.
[30]Fabre C E,Blanc P J,Goma G. Production of 2-phenylethyl alcohol by Kluyveromyces marxianus.[J]. Biotechnology progress,1998,14(2):270-274.
[31]Grygier A,Majcher M,Myszka K. Analysis of the ability to form 2-phenylethyl alcohol by Galactomyces geotrichum MK017. [J]. Zywnosc,2015,22(3):74-83.
[32]唐育岐,刘天明,赵修报,等. 高产2-苯乙醇酵母菌株的筛选及培养基优化[J]. 中国食品添加剂,2012(3):137-142.
[33]梅建凤,陈虹. 生物转化法生产β-苯乙醇[J]. 微生物学通报,2005,32(2):114-118.
[34]崔志峰,沈情佳,杨霄,等. 酵母生物转化合成2-苯乙醇的培养条件优化[J]. 食品与发酵工业,2008,34(8):52-55.
[35]荣绍丰,付艳丽,何艳,等. 酿酒酵母AS 2.1182发酵产β-苯乙醇的研究[J]. 食品与发酵工业,2009,35(8):69-73.
欢迎光临我们的网站
www.spgykj.com
Screening of a high-yieldβ-phenylethanol yeast and optimization of its cultural conditions
XU Dai1,2,FAN Guang-sen1,2,3,FU Zhi-lei1,MA Chao1,SUN Xiao-tao1,2,YANG Ran1,SUN Bao-guo1,2,3,LI Xiu-ting1,2,3,*
(1.School of Food and Chemical Engineering,Beijing Technology & Business University,Beijing 100048,China;2.Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,Beijing Key Laboratory of Flavor Chemistry,Beijing 100048,China;3.Beijing Innovation Centre of Food Nutrition and Human Health,Beijing 100048,China)
Objective:A yeast with high-yield forβ-phenylethanol was isolated and purified from Daqu,and the fermentation conditions ofβ-phenylethanol produced from it were optimized. Methods:The high-yieldβ-phenylethanol yeast was isolated and purified by traditional microbial separation;then the yeast was identified by the morphological and physiological characteristics and its 26S rDNA D1/D2 sequence. The factors including L-phenylalanine,yeast extract,temperature and initial pH,that affected the yield ofβ-phenylethanol,were studied in single factor optimization test. On the basis of single factor test,the conditions forβ-phenylethanol production were explored by Box-Behnken design involving the yeast extract,temperature and initial pH at three levels in combination with response surface methodology. Results:A yeast designated as Y1511 with high-yield forβ-phenylethanol was isolated and purified from strong-flavor Daqu,then the yeast was identified as types ofPichiakudriavzevii. It was tested for arom production in bean sprouts medium,and there were nearly thirty kinds of volatile components present in the fermentation of medium. By the experiments of single factor and Box-Behnken design,the optimal conditions forβ-phenylethanol production were as follows:glucose 80 g/L,MgSO40.5 g/L,KH2PO45 g/L,L-phenylalanine 10 g/L,yeast extract 5.5 g/L and initial pH5,incubated at 26 ℃. Under the condition,the yeast Y1511 yieldedβ-phenylethanol of 3.25 g/L. Conclusion:This is the first report aboutβ-phenylethanol production ofP.Kudriavzeviifrom strong-flavor Daqu.
Daqu;Pichiakudriavzevii;phenylethanol;optimization
2016-10-08
许岱(1992-),女,硕士,研究方向:传统食品酿造,E-mail:xdxd0627@163.com。
*通讯作者:李秀婷(1970-),女,博士,研究方向:食品微生物与酶工程,E-mail:lixt@btbu.edu.cn。
“十三五”科技计划国家重点研发计划(2016YFD0400500);中国博士后科学基金面上项目(2016M590026)。
TS201.3
B
1002-0306(2017)05-0151-08
10.13386/j.issn1002-0306.2017.05.020

