密蒙花滴眼液对去势雄兔干眼症泪腺细胞炎症因子TNF-α、IL-1β的影响
彭 俊,欧阳云,2*,谭涵宇,李文娟,吴权龙,彭清华*
(1.湖南中医药大学,湖南 长沙 410208;2.盐城市中医院,江苏 盐城 224001)
密蒙花滴眼液对去势雄兔干眼症泪腺细胞炎症因子TNF-α、IL-1β的影响
彭 俊1,欧阳云1,2*,谭涵宇1,李文娟1,吴权龙1,彭清华1*
(1.湖南中医药大学,湖南 长沙 410208;2.盐城市中医院,江苏 盐城 224001)
目的 观察不同浓度密蒙花滴眼液对去势雄兔角结膜干燥症泪腺细胞炎症因子TNF-α、IL-1β的影响,并探讨其疗效。方法 将 42只雄兔随机分为:空白组(A),模型组(B),密蒙花滴眼液低(C)、中(D)、高(E)浓度组,安慰剂组(F),睾酮组(G),每组6只。除A组外各组切除双侧睾丸及附睾。术后第3天开始C-F组给予滴眼液,3次/d;G组注射丙酸睾酮,每3天1次。各组术前和术后第4周各测量一次SIT和BUT。4周后处死兔子,摘取双眼泪腺,采用免疫组化法检测泪腺中TNF-α和IL-1β,并进行统计学分析。结果 (1)SIT与BUT:B、F组前后比较,B组与其他各组及C组与D、E、G组比较,差异均有统计学意义(P<0.01)。(2)治疗后各组TNF-α、IL-1β比较:B、F组与其他各组比较,差异有统计学意义(P<0.01);C组与D、E、G组比较,差异均有统计学意义(P<0.05)。(3)TNF-α、IL-1β表达结果:A、G组未见表达;B、F组大量表达于细胞膜和细胞浆中,呈棕黄色颗粒;C、D、E组散见表达。结论 密蒙花滴眼液具有与雄激素相似的抑制炎症因子TNF-α和IL-1β表达的作用,但弱于雄激素。密蒙花滴眼液中、高浓度作用无明显差异,但均较低浓度要优。
干眼症;密蒙花滴眼液;去势雄兔;泪腺细胞;炎症因子
干眼 (dry eye)又称角结膜干燥症(keratocon junctivitis sicca),是指任何原因引起的泪液质或量异常,或动力学异常导致的泪膜稳定性下降,并伴有眼部不适和(或)眼表组织病变特征的多种疾病的总称[1]。干眼为常见眼表病,多为双眼发病,流行病学及临床研究发现,其发病率远较人们想象的要高。我们在前期的临床及动物实验中均证实密蒙花对干眼症具有良好的治疗效果[2-8]。本实验通过将密蒙花生药制备成密蒙花滴眼液,用于干预去势雄兔所致雄激素减少性干眼症动物模型,探讨密蒙花滴眼液对雄激素减少所致干眼症泪腺细胞炎症因子TNF-α和IL-1β的影响。
1 材料与方法
1.1 材料
1.1.1 动物 选用42只健康成年新西兰长耳白兔,雄性,体质量1.5~2.0 kg,湖南中医药大学动物实验中心提供,实验动物质量许可证号:SCXK(湘)2009-0012。
1.1.2 实验设备 YZ5H型裂隙灯显微镜、YZ11D型直接检眼镜均为苏州六六视觉科技股份有限公司产品;Leica RM2125RTS型石蜡切片机 (德国Leica公司)、B1 Digital数码显微镜 (德国Motic公司)、Image Pro Plus 6.0计算机图像分析系统 (美国Media Cybernetics公司)等,以上实验所用相关器材均由由湖南中医药大学组织形态学实验室和眼科实验室提供。
1.1.3 药品 丙酸睾酮注射液:天津金耀药业有限公司(规格:1 mL:25 mg);注射用青霉素钠:广州白云山天心制药股份有限公司;氯化钠注射液:江苏亚邦生缘药业有限公司(规格:500 mL:4.5 g);水合氯醛分析纯:天津市科密欧化学试剂有限公司;灭菌注射用水:上海长征富民金山制药有限公司;Schirmer试验滤纸、荧光素钠眼科检测试纸:天津晶明新技术开发有限公司。密蒙花滴眼液及安慰剂滴眼液均由湖南中医药大学药物制剂教研室制备。密蒙花滴眼液规格:低浓度为0.17 g/mL;中浓度为0.33 g/mL;高浓度为0.67 g/mL。安慰剂滴眼液为配制成与密蒙花滴眼液相同颜色及pH值的注射用水。
1.1.4 试剂 Harris苏木素,伊红,3%过氧乙酸,羊抗兔TNF-α抗体(规格:200 μg/mL)均为北京中杉金桥生物技术有限公司产品;兔抗大鼠IL-1β抗体(规格:200 μg/mL);过氧化物酶标记链酶白卵素(strept avidin-biotin complex,SABC)免疫组织化学试剂盒,3,3-二氨基联苯胺 (3,3-diaminobenzi dine,DAB)显色剂均为武汉博士德生物工程有限公司产品。
1.2 实验方法
1.2.1 实验动物分组 按照随机排列表法分成7组,每组6只兔子。分别为:空白组(A)、模型组(B)、低浓度密蒙花滴眼液组(C简称低剂量组)、中浓度密蒙花滴眼液组(D简称中剂量组)、高浓度密蒙花滴眼液组(E简称高剂量组)、安慰剂滴眼液组(F)、睾酮组(G)。
1.2.2 干眼症动物模型的建立 除正常对照组外,其余所有兔子均参照相关文献[9-10]的方法行双侧睾丸及附睾切除术。术后测量模型兔Schirmer I试验(SIT)和泪膜破裂时间(BUT),当 SIT<10 mm,BUT<12 s则造模成功。
1.2.3 术后给药 除A、B组外,C-F组在术后第3天开始予相应滴眼液1滴滴双眼,3次/d;G组丙酸睾酮注射液按2 mg/kg行大腿肌肉注射,每3天注射1次。
1.2.4 SIT和BUT测定 各组兔子均于造模前1天和术后第4周行SIT和BUT测定[11]。SIT试验:按照说明书用法,将滤条按标记线折叠后一端置于下睑内眦1/3处结膜囊内,另一端垂挂在下睑外部,轻闭双眼,5 min后取出滤纸,2 min后观察并记录滤纸湿长。BUT测定:将荧光素钠试纸轻置于下睑结膜囊内3 s后取出,将裂隙灯显微镜调至钴蓝光观察泪膜破裂时间并记录。
1.2.5 标本采集及炎症因子表达观察 所有兔子在术后常规饲养4周后,采用空气栓塞法处死,摘取双眼泪腺,将标本置于4%多聚甲醛中固定24 h后,进行石蜡包埋及切片。
泪腺组织进行免疫组化染色,在200倍光学显微镜下观察各组泪腺细胞炎症因子TNF-α、IL-1β染色后情况,拍照并精确选取视野内所有阳性颗粒,采用Image-pro Plus 6.0分析软件计算出平均光密度值,用于定量表达免疫组化阳性反应程度。
1.3 统计学处理
2 结果
2.1 各组兔子去势手术前与治疗后SIT值及BUT值比较
模型组和安慰剂组自身前后比较及与空白组比较,SIT与BUT值均明显降低(P<0.01);与模型组比较,密蒙花各浓度组和睾酮组SIT与BUT值无明显降低(P<0.01);与密蒙花低浓度组比较,中、高浓度组和睾酮组SIT与BUT值无明显降低(P<0.01);与安慰剂组比较,睾酮组SIT与BUT值无明显降低(P<0.01)。见表1。
表1 各组雄兔去势前与治疗后SIT及BUT比较 (±s,n=12)
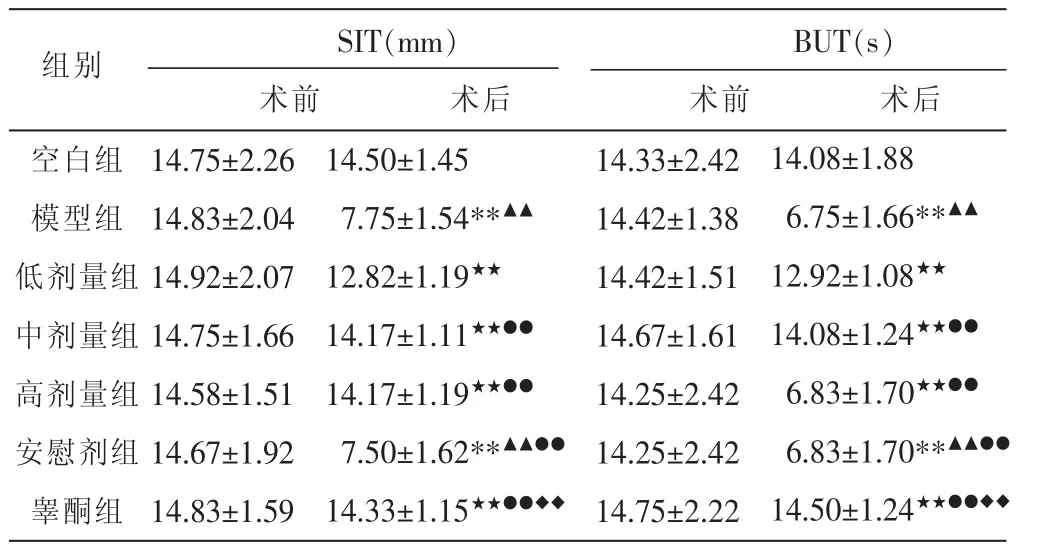
表1 各组雄兔去势前与治疗后SIT及BUT比较 (±s,n=12)
注:各组自身前后比较,**P<0.01;治疗后与空白组比较,▲▲P<0.01;与模型组比较,★★P<0.01;与低剂量组比较,●●P<0.01;与安慰剂组比较,◆◆P<0.01。
组别SIT(mm) BUT(s)术前 术后 术前 术后空白组模型组低剂量组中剂量组高剂量组安慰剂组睾酮组14.75±2.26 14.83±2.04 14.92±2.07 14.75±1.66 14.58±1.51 14.67±1.92 14.83±1.59 14.50±1.45 7.75±1.54**▲▲12.82±1.19★★14.17±1.11★★●●14.17±1.19★★●●7.50±1.62**▲▲●●14.33±1.15★★●●◆◆14.33±2.42 14.42±1.38 14.42±1.51 14.67±1.61 14.25±2.42 14.25±2.42 14.75±2.22 14.08±1.88 6.75±1.66**▲▲12.92±1.08★★14.08±1.24★★●●6.83±1.70★★●●6.83±1.70**▲▲●●14.50±1.24★★●●◆◆
2.2 治疗各组雄兔泪腺细胞中TNF-α、IL-1β的表达比较
与空白组比较,模型组和安慰剂组的表达明显增加(P<0.01);与模型组比较,密蒙花各浓度组和睾酮组的表达无明显增加(P<0.01);与密蒙花低浓度组比较,中、高浓度组和睾酮组的表达无明显增加(P<0.05),但安慰剂组明显增加(P<0.01);与安慰剂组比较,睾酮组的表达无明显增加(P<0.01)。见表2。
表2 术后各组雄兔泪腺细胞中TNF-α、IL-1β平均光密度值 (±s,n=12)
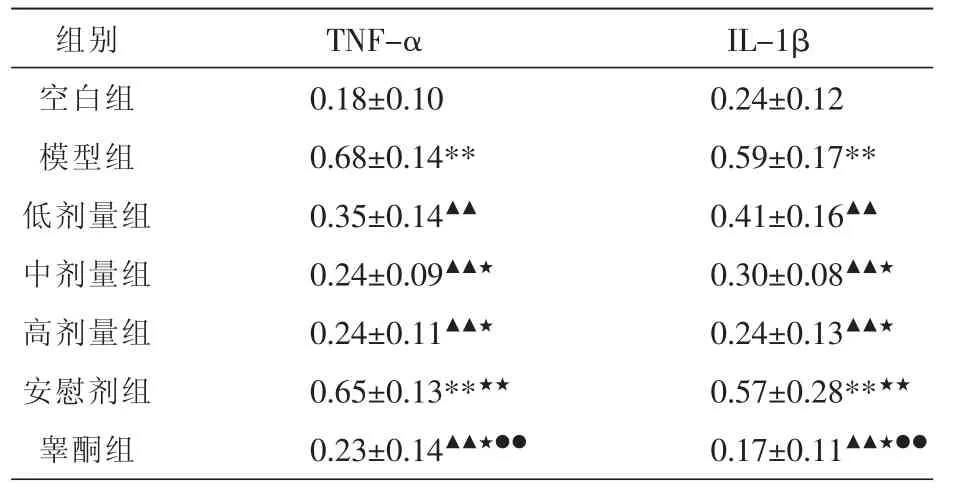
表2 术后各组雄兔泪腺细胞中TNF-α、IL-1β平均光密度值 (±s,n=12)
注:与空白组比较,**P<0.01;与模型组比较,▲▲P<0.01;与低剂量组比较,★P<0.05,★★P<0.01;与安慰剂组比较,●●P<0.01。
组别空白组模型组低剂量组中剂量组高剂量组安慰剂组睾酮组TNF-α 0.18±0.10 0.68±0.14** 0.35±0.14▲▲0.24±0.09▲▲★0.24±0.11▲▲★0.65±0.13**★★0.23±0.14▲▲★●●IL-1β 0.24±0.12 0.59±0.17** 0.41±0.16▲▲0.30±0.08▲▲★0.24±0.13▲▲★0.57±0.28**★★0.17±0.11▲▲★●●
2.3 各组TNF-α、IL-1β的表达观察结果
A、G组:泪腺结构清晰,未见TNF-α、IL-1β表达;B、F组:泪腺结构模糊,TNF-α、IL-1β大量表达于细胞膜和细胞浆中,呈棕黄色颗粒;C、D、E组:泪腺结构清晰,散见TNF-α、IL-1β表达。见图1-2。
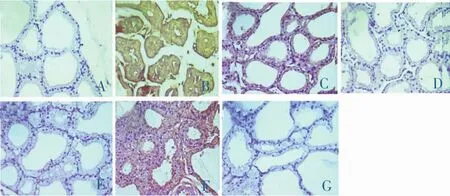
图1 术后各组TNF-α免疫组化染色光镜图(×200倍)
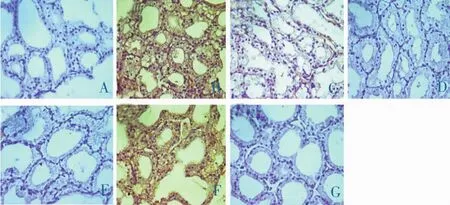
图2 术后各组IL-1β免疫组化染色光镜图(×200倍)
3 讨论
2007年国际干眼病专题研究会赋予干眼病的最新定义是:泪液和眼球表面的多因素疾病,能引起患眼不适、视觉障碍和泪膜不稳定,损害眼球表面。该病伴有泪膜渗透性增加和眼表炎症[12]。与传统的干眼病定义相比,该定义强调了炎症在干眼病发病中的重要作用。尽管引起干眼症的起始病因不同,但一旦进入进展阶段,炎症成为干眼症发病机制中最关键的因素。干眼症患者泪液和结膜上皮中的多种细胞因子包括IL-1α、IL-6、IL-8、TNF-α、TGF-β的水平较正常人有显著改变,且与干眼症的严重程度相关[13]。
近年研究发现,性激素尤其是雄激素对泪液分泌有着重要的作用。雄激素通过刺激TGF-β的合成,降低泪腺中IL-1β、TNF-α的水平来发挥其免疫抑制的作用,有效地保护泪腺免于炎症和变性,加速新陈代谢,调控泪腺和睑板腺的形态及分泌功能。
干眼属中医学“白涩症”范畴,又名“干涩昏花症”及“神水将枯症”“神气枯瘁”。一般认为干眼因肝肾亏损,阴血不足,目失濡养所致。密蒙花味甘,性微寒,归肝经,具有清热泻火养肝、明目退翳之功效,主治目赤翳障、目昏干涩、肝虚目暗、视物昏花等症[14-15]。现代研究认为密蒙花中的活性成分为黄酮类物质[16],并且某些黄酮类化合物具有拟雄激素作用[17],可以用于治疗因性激素水平下降所致的某些疾病,如骨质丢失等[18]。
我们对密蒙花的前期实验研究证实,密蒙花提取物中主要成分为黄酮类,可起到拟雄激素效应,可显著抑制雄激素水平降低后大鼠干眼症的发生,抑制泪腺细胞凋亡,维持泪腺基础分泌量和泪腺的稳定性[2-8]。
目前干眼症的治疗以药物为主,临床常用的药物为人工泪液,该类药物主要是缓解患者眼部的不适,无法从根本上改变干眼症的病理状态。本研究证实密蒙花滴眼液具有类激素效应,能抑制雄激素缺乏所致兔泪腺细胞炎症因子TNF-α、IL-1β表达,维持泪腺基础分泌量和泪腺的稳定性,但其作用弱于雄激素。中、高浓度密蒙花滴眼液对TNF-α和IL-1β的抑制作用要强于低浓度密蒙花滴眼液,但中、高浓度密蒙花滴眼液的抑制作用差别不明显。本研究既为干眼病的治疗提供一种新的天然药物,又可以避免长期使用雄激素所带来的副作用,具有广阔的应用前景。
[1]赵堪兴,杨培增.眼科学[M].第7版.北京:人民卫生出版社,2008:77-80.
[2]彭清华,姚小磊,吴权龙,等.密蒙花提取物滴眼对干眼症去势鼠泪腺组织雄激素受体数量的影响[J].国际眼科杂志,2010,10(2):203-208.
[3]吴权龙,彭清华,姚小磊,等.密蒙花提取物滴眼剂对实验性干眼症大鼠泪腺组织形态学的影响[J].湖南中医药大学学报,2009,29 (5):22-25.
[4]姚小磊,彭清华,吴权龙.密蒙花提取物治疗兔去势所致干眼症[J].眼视光学杂志,2008,l0(1):21-26.
[5]李怀凤,彭清华,姚小磊.密蒙花总黄酮对去势雄鼠干眼症模型角膜和泪腺组织中TNF-α,IL-1β表达的影响[J].国际眼科杂志,2009,9 (7):1248-1251.
[6]彭清华,姚小磊,彭 俊,等.密蒙花提取物对干眼症雄兔泪腺局部炎症反应影响的研究[J].中华中医药学刊,2010,28(7):1351-1356.
[7]陈佳文,彭清华,姚小磊.密蒙花总黄酮对去势雄鼠干眼症泪腺TGF-β1及其基因表达的影响[J].眼科研究,2010,28(4):311-314.
[8]姚小磊,彭清华,吴权龙,等.密蒙花提取物对去势导致干眼症白兔泪腺细胞凋亡的影响[J].中国中医眼科杂志,2007,17(3):139-144.
[9]魏世辉,王志军.眼科实验动物学[M].北京:人民军医出版社,2010:94.
[10]马轶群,王传富,刘美光.去势雄兔干眼病模型角膜上皮细胞凋亡及相关基因表达的研究[J].眼科研究,2004,22(3):286-289.
[11]张 梅,陈家祺,刘祖国.干眼症检查的进展[J].眼科研究,2001,19(2):184-187.
[12]Lemp M,Baudouin C,Baum J,et a1.The definition and classification of dry eye disease:report of the definition and classification subcommittee of the international dry eye workshop[J].Ocul Surf,2007,5(2):75-92.
[13]Pflugfelder SC,Jones D,Ji Z,et a1.Altered cytokine balance in the tear fluid and conjunctiva of patients with sjogrrn’s syndrome keratoconjunctivitis sicca[J].Curr Eye Res,1999,19:201-211.
[14]中华人民共和国卫生部药典委员会.中华人民共和国药典·一部[S].北京:中国医药科技出版社,2015:329.
[15]徐国钧,施大文,沈联德,等.生药学[M].北京:人民卫生出版社,1986:313.
[16]韩 澎,崔亚君,郭洪祝,等.密蒙花化学成分及其活性研究[J].中草药,2004,35(10):1086-1091.
[17]黄秀兰,周亚伟,王 伟.淫羊藿黄酮类化合物药理研究进展[J].中成药,2005,27(6):19-781.
[18]Moyad MA.Complementary therapies for reducing the risk of osteoporosis in patients receiving luteinizing hormone-releasing hormone treatment/orchiectomy for prostate cancer: a review and assessment of the need for more research[J].Urology,2002,59(4):34-40.
(本文编辑 杨 瑛)
Effects of Butterflybush Flower Eye Drops on Inflammatory Factors TNF-α and IL-1β in Lacrimal Gland Cells of Castrated Male Rabbits with Xerophthalmia
PENG Jun1,OUYANG Yun1,2*,TAN Hanyu1,LI Wenjuan1,WU Quanlong1,PENG Qinghua1*
(1.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China;2.Yancheng Traditional Chinese Medicine Hospital,Yancheng,Jiangsu 224001,China)
Objective To observe the effects of butterflybush flower eye drops at different concentrations on inflammatory factors TNF-α and IL-1β in lacrimal gland cells of castrated male rabbits with xerophthalmia.Methods The 42 male rabbits were randomly divided into blank group (A),model group (B),low concentrations butterflybush flower eye drops group (C),medium concentrations butterflybush flower eye drops (D),high concentrations butterflybush flower eye drops(E), placebo group (F)and testosterone group (G),six rabbits in each group.All rabbits of group B to G were cut off bilateral testis and epididymis.The rabbits of group C to F were dropped relevant Eye Drops there times a day.The rabbits of group G were injected testosterone propionate injection every 3 days.The SIT and BUT were determined at 4 weeks before and after operation,respectively.After 4 weeks,the lacrimal gland of all rabbits were killed and clipped.The TNF-α and IL-1β in lacrimalgland cellsweretested byimmunohistochemicalstaining method.Results (1)TheSIT and BUT weresignificantly different between group B and F before and after operation (P<0.01).Compared with other groups,SIT and BUT was significantly different in group B before and after operation (P<0.01).Compared with group D,E,G,there was significant difference in group C before and after operation (P<0.01). (2)Comparison of TNF-α and IL-1β after treatment: there was significant difference between group B and F with other groups (P<0.01).Compared with group D,E,G,the indicators in group C was significantly different(P<0.05).(3)The expression of TNF-α and IL-1β were not found in group A and G.In group B and F:TNF-α and IL-1β wereexpressed in cellmembraneand cytoplasm heavyly,showing brownish granules with yellow.In group C,D and E,TNF-α and IL-1β were poorly expressed.Conclusion Butterflybush flower eye drops show a similar effect with androgen on depressing the expression of inflammatory factors TNF-α and IL-1β, but its effect is slightly weaker than the androgen.The depressing effect of medium and high concentration buddleia eye drops is better than the low concentration,while there was no significant difference between medium and high concentration.
xerophthalmia;butterflybush flower eye drops;castrated male rabbit;lacrimal gland cell;inflammatory factors
R285.5
A
10.3969/j.issn.1674-070X.2017.05.002
2016-03-23
国家自然科学基金面上资助项目(30772824,81574031);湖南省高层次卫生人才“225”工程培养项目资助;湖南省科技厅科研基金资助项目(2015SF2016-6);湖南省发展改革委科研基金资助项目(湘发改投资[2014]658号);长沙市科技计划重大专项(K1501014-31);国家中医药管理局中医眼科学重点学科建设项目。
彭 俊,男,在读硕士研究生,研究方向:眼表疾病、青光眼及眼底病的中医药研究。
*彭清华,男,博士,教授,博士研究生导师,E-mail:pqh410007@126.com;欧阳云,男,博士,主治医师,E-mail:oyy123@126.com。
本文引用:彭 俊,欧阳云,谭涵宇,李文娟,吴权龙,彭清华.密蒙花滴眼液对去势雄兔干眼症泪腺细胞炎症因子TNF-α、IL-1β的影响[J].湖南中医药大学学报,2017,37(5):469-472.

