滋阴活血解毒方对AGEs诱导VEC损伤黏附分子及凝血相关因子表达的影响
廖俞强,邓奕辉,颜佳博,李钰佳,李定祥*
(湖南中医药大学,湖南 长沙 410208)
滋阴活血解毒方对AGEs诱导VEC损伤黏附分子及凝血相关因子表达的影响
廖俞强,邓奕辉,颜佳博,李钰佳,李定祥*
(湖南中医药大学,湖南 长沙 410208)
目的 观察滋阴活血解毒方对糖基化终末产物(advanced glycation end-producs,AGEs)诱导血管内皮细胞(vascular endothelial cell,VEC)损伤的影响及其黏附分子、凝血相关因子表达的变化,进一步探讨该方对AGEs诱导VEC损伤的保护作用。方法 以人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)作为实验对象,以终浓度(100 mg/L)的AGEs诱导HUVEC损伤。各模型组及给药组细胞分别继续培养12、24、48 h。在显微镜下观察各组细胞形态变化,并以Western-blot法检测各组黏附分子VCAM-1、ICAM-1的表达;以RT-PCR方法检测TF、TM mRNA表达。结果 相对于空白组细胞,模型组细胞出现异常增殖,细胞数量明显增多,多数细胞变形皱缩,胞膜轮廓模糊,细胞内出现粗糙样颗粒变化,VCAM-1、ICAM-1、TF表达明显上调,TM表达下调,且在作用24 h后差异有显著性意义(P<0.01);相同时间点,给药组较模型组圆缩形细胞减少,能下调VCAM-1、ICAM-1、TF表达,上调TM表达,且随着作用时间的延长更明显(P<0.01)。结论 滋阴活血解毒方能抑制AGEs对VEC的损伤,降低黏附分子的表达,下调表达组织因子mRNA转录,上调血栓调节素mRNA转录。
滋阴活血解毒方;糖基化终末产物;人脐静脉内皮细胞;VCAM-1;ICAM-1;TF;TM
随着生活水平的提高和生活方式的改变,糖尿病的患病率呈逐年上升趋势,严重威胁身体健康。其中,糖尿病合并脑梗死是糖尿病致死致残的重要原因,早期防治非常重要[1-2]。研究表明,长期高血糖可导致糖基化终末产物(advanced glycation end-producs,AGEs)增加,进而促进糖尿病血管并发症的发生发展[3-4]。既往研究发现,滋阴活血解毒方有抗糖尿病合并缺血性脑损伤的作用[5]。本实验以血管细胞黏附分子-1(vascular cell adhesion molecule 1,VCAM-1)、细胞间黏附分子-1(intercellular cell adhesion molecule 1,ICAM-1)、表达组织因子-1(tissuefactor,TF)、血栓调节素(thrombomodulin,TM)及细胞形态变化为观察目标,研究滋阴活血解毒方对AGEs诱导血管内皮细胞(vascular endothelial cell,VEC)损伤的影响,现报道如下。
1 实验材料
1.1 试剂及仪器
人血清白蛋白(Sigma,批号:A8230-500),D-葡萄糖(Amresco,批号:0188),青霉素(Amresco,批号:A8180-1),庆大霉素(Amresco,批号:G8170-500),吩嗪硫酸二甲酯(Sigma,批号:P8110-1),胰蛋白酶-EDTA消化液(solarbio,批号:T1320),磷酸缓冲液 (phosphate buffer saline,PBS)(Hyclone,批号:SH30256.01),兔抗ICAM-1第一抗体(abcam,批号:Ab53013),兔抗VCAM-1(abcam,批号:Ab134047),TF及TM逆转录试剂盒(北京康为世纪公司,批号:A150311)。FA-N精密天平(上海民桥精密科学仪器有限公司)、Motic BA210T显微镜 (杭州明凯科技有限公司)等。
1.2 实验药剂配制
滋阴活血解毒方(熟地黄20 g,枸杞子12 g,山茱萸12 g,黄芪 30 g,黄连 10 g,川芎 12 g,地龙12 g,丹参20 g,水蛭8 g,石菖蒲 8 g),购于湖南中医药大学第一附属医院中药房。煎煮并浓缩成每1毫升含生药量50 mg,冷却备用。
糖基化终末产物修饰人血清白蛋(advanced gly cosylation end products-modified human serum albnmin,AGEs-HSA),用糖孵育法[6],在总容量1 L磷酸缓冲液中加入终浓度1.75 g/L的人血清白蛋白1.75g,终浓度100 mmol/L的D-葡萄糖18 g,终浓度为 200 mg/L的青霉素 200 mg、终浓度为70 μg/L庆大霉素70 μg和终浓度为1.5 mmol/L吩嗪硫酸二甲酯459 mg,37℃恒温箱中孵育5周。以其他条件相同但不使用浓糖的缓冲液孵育的蛋白作为比对。5周后用无菌PBS(酸碱值为7.4)过滤游离的葡萄糖并消除杂菌,完成后4~5℃储存备用。
2 实验方法
2.1 细胞培养
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)(吉满生物科技上海有限公司货号GM-070036H)复苏后,用0.25%胰蛋白酶联合0.02%EDTA溶解附壁细胞,待圆形细胞逐渐缩小,立即将消化液撤出,把细胞转至含10%胎牛血清的完全培养基中,轻轻吹打内皮细胞,并以PBS洗涤后离心去除EDTA,传代至培养板中,放入37℃、5%二氧化碳无菌培养箱内培养。48 h换液1次,72 h传代1次,连续传4代后,选择80%融合度、生长状态良好的细胞进行实验。
2.2 实验分组及药物干预
参考本课题组前期研究结果及文献资料[7],将实验细胞随机分为7组(A组为空白组,即正常生长状态下的 HUVEC细胞;B、C、D组为模型组;E、F、G组为给药组),每组设置5个孔,B、C、D组加入终浓度(100 mg/L)的AGEs-HSA,于37℃、5%二氧化碳无菌培养箱中分别继续孵育(B组12 h、C组24 h、D组 48 h);E、F、G组加入终浓度 (100 mg/L)的AGEs-HSA于37℃、5%二氧化碳无菌培养箱中孵育,同时用显微镜观察细胞形态变化,当出现细胞收缩变圆,胞体变小,立即加入终浓度为50 mg/mL(此药物浓度参照本课题组前期研究结果)滋阴活血解毒方药液[7],三组分别于37℃、5%二氧化碳无菌培养箱中继续孵育12、24、48 h。
2.3 指标测定
显微镜观察细胞形态变化;分别于相应时间点,提取各组样品,严格按照试剂盒说明书操作步骤,经电泳、转膜、封闭、孵育、显色曝光后,以Western blot法检测HUVEC培养液中VCAM-1、ICAM-1蛋白质的表达,并用quantity one专业灰度分析软件进行分析;分别于相应时间点,提取各组细胞总RNA,按照试剂盒说明书操作步骤,经电泳、RNA反转录、RT-qPCR等程序,以荧光定量RT-PCR法检测HUVEC培养液中TF、TM mRNA的表达。
2.4 统计学方法
3 结果
3.1 细胞形态和结构的观察
镜下观察,空白组细胞梭形单层生长,镶嵌排列,彼此不重叠,胞膜明显,细胞明亮,融合后的细胞为单层鹅卵石状排列;模型组细胞出现异常增殖,细胞数量明显增多,细胞变形皱缩,胞膜轮廓模糊,细胞内出现粗糙样颗粒变化;与模型组比较,给药组都有不同程度的逆转这种损伤的作用,特别是48h后有较明显的形态变化,见梭形正常细胞较多,圆缩形细胞减少。见图1。
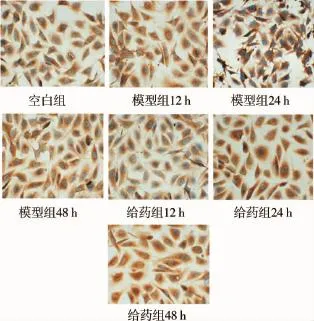
图1 各实验组内皮细胞形态光镜图(×400倍)
3.2 VCAM-1、ICAM-1蛋白表达比较
与空白组比较,模型组 12 h及模型组 48 h VCAM-1、ICAM-1表达上调(P<0.05),且模型组24 h差异有显著性意义(P<0.01);而在相同作用时间点,与模型组比较,给药组12 h差异无统计学意义(P>0.05),给药组24 h ICAM-1、VCAM-1表达下调(P<0.05),且给药组48 h差异有显著性意义(P<0.01)。见表1,图2-3。
3.3 TF、TM mRNA表达比较
与空白组比较,模型组TF表达上调,TM表达下调(P<0.05),且模型组24 h差异有显著性意义(P<0.01);而在相同作用时间点,与模型组比较,给药组12 h差异无统计学意义(P>0.05),给药组24 h TF表达下调,TM表达上调(P<0.05),且给药组48 h差异有显著性意义(P<0.01)。见表2。
表1 各组HUVEC细胞培养液中VCAM-1和ICAM-1灰度值 (±s,n=5)
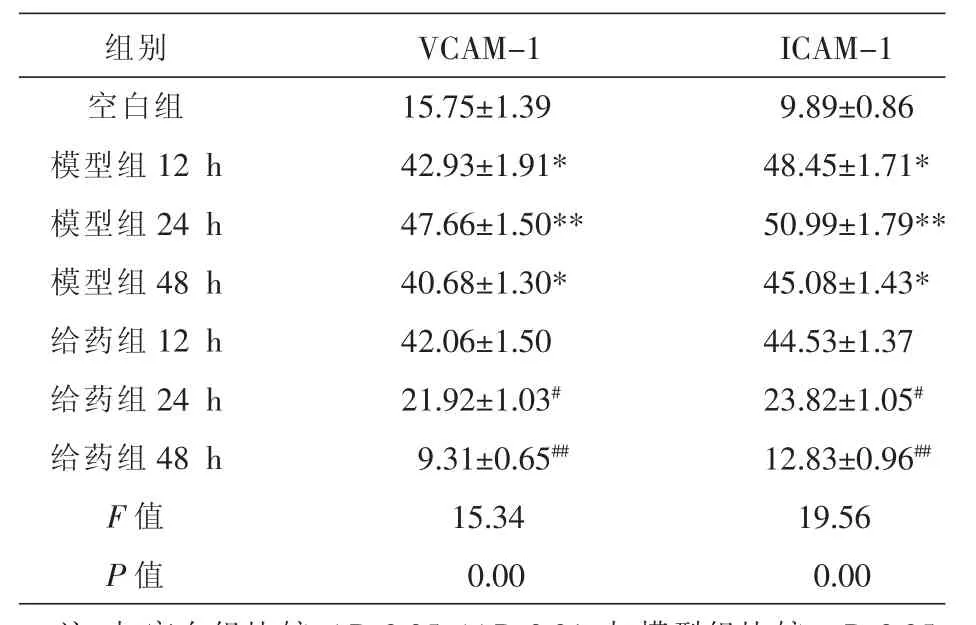
表1 各组HUVEC细胞培养液中VCAM-1和ICAM-1灰度值 (±s,n=5)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别空白组模型组12 h模型组24 h模型组48 h给药组12 h给药组24 h给药组48 h F值P值VCAM-1 15.75±1.39 42.93±1.91* 47.66±1.50** 40.68±1.30* 42.06±1.50 21.92±1.03#9.31±0.65##15.34 0.00 ICAM-1 9.89±0.86 48.45±1.71* 50.99±1.79** 45.08±1.43* 44.53±1.37 23.82±1.05#12.83±0.96##19.56 0.00
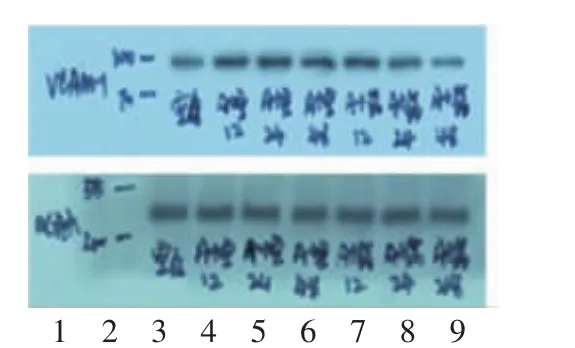
图2 各组细胞培养液VCAM-1的蛋白表达
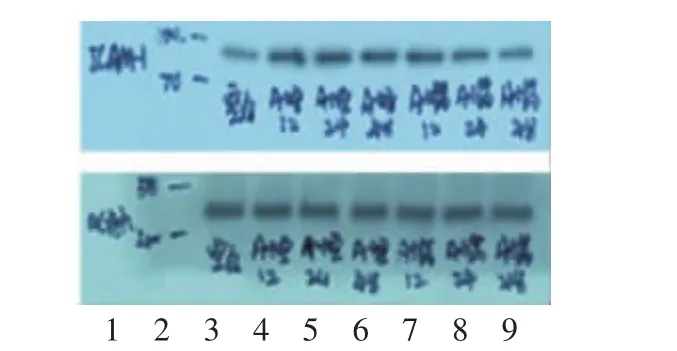
图3 .各组细胞培养液ICAM-1的蛋白表达电泳图
表2 各组HUVEC细胞培养液中TF、TM mRNA相对表达量 (±s,n=5)
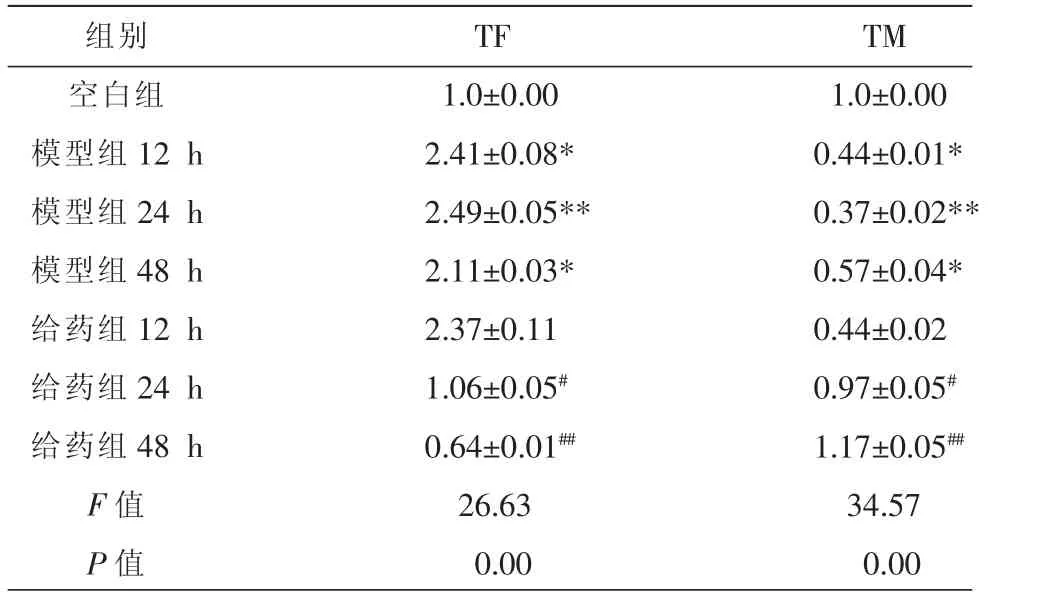
表2 各组HUVEC细胞培养液中TF、TM mRNA相对表达量 (±s,n=5)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别空白组模型组12 h模型组24 h模型组48 h给药组12 h给药组24 h给药组48 h F值P值TF 1.0±0.00 2.41±0.08* 2.49±0.05** 2.11±0.03* 2.37±0.11 1.06±0.05#0.64±0.01##26.63 0.00 TM 1.0±0.00 0.44±0.01* 0.37±0.02** 0.57±0.04* 0.44±0.02 0.97±0.05#1.17±0.05##34.57 0.00
4 讨论
糖尿病合并脑梗死属于中医学“消渴合并中风”,其病机特点为虚(气阴两虚)、瘀(瘀血)、毒(热毒),益气养阴、活血化瘀、清热解毒为其基本治法。滋阴活血解毒方由熟地黄、黄芪、枸杞子、山茱萸、黄连、地龙、丹参、川芎、水蛭、石菖蒲组成,方中熟地黄、山茱萸、枸杞子滋补肾阴,黄芪健脾益气,丹参、川芎、水蛭、地龙活血通络,黄连、石菖蒲解毒化痰,诸药合用,共奏滋阴益气活血解毒之功,是祛邪而不伤正,扶正而不留滞。本课题组基于上述基本病机和治法,既往研究发现,滋阴活血解毒方能显著改善糖尿病并发脑梗死患者的临床症状,改善神经功能缺损程度。
研究认为,高血糖可导致体内糖基化蛋白的大量堆积,形成的AGEs是造成糖尿病血管病变的重要因素。糖尿病血管并发症的共同病理机制是细胞变形,基底膜增厚,细胞异常增殖。本实验发现加入100 mg/L AGEs-HSA后,VEC细胞数量明显增加,变形收缩,细胞内出现粗糙样颗粒变化,细胞异常增殖。细胞增生导致血管壁增厚,血管弹性降低,导致血管损伤。当加入终浓度50 mg/mL滋阴活血解毒方药液后,VEC细胞异常增殖有显著的改善。
AGEs引起VEC结构改变甚至发生自噬或凋亡,使ICAM-1、VCAM-1和TF表达上调,TM下调,导致炎性反应和内皮源性局部血栓形成,在血管损伤中发挥着重要作用[8]。ICAM-1和VCAM-1作为免疫球蛋白基因超家族成员,在介导炎性细胞与血管内皮细胞黏附过程中有着重要的作用[9]。研究发现流动状态下高糖可促进白细胞与内皮细胞的黏附,这也是受内皮细胞表面黏附分子 ICAM-1和VCAM-1调节的[10]。TF是一种跨膜糖蛋白,为凝血因子Ⅶa在细胞表面的受体和辅助因子。在生理条件下血管内皮细胞不表达或极微量表达TF,且大部分血管内皮细胞表面TF是以无活性成簇状态存在的,TF与因子Ⅶ结合并活化之,形成TF-Ⅶa复合物,进而激活因子Ⅹ和因子Ⅸ,同时启动外、内源性两条凝血途径,在体内导致凝血酶及纤维蛋白的产生,最终形成血栓[11]。研究表明,急性期血清TF与糖尿病脑梗死患者的病情严重程度相关[12]。TM的作用与TF相反,它是一种抗凝蛋白,是血管内皮细胞合成并位于细胞表面的凝血酶受体,血浆可溶性TM可作为反映血管内皮损伤的敏感指标[13]。TM能有效与凝血酶结合,使之不能活化纤维蛋白原,从而抑制血栓形成,防止凝血;同时TM结合凝血酶后可使蛋白C活化而发挥抗凝作用,进而有效地防止血栓形成,维持血液的非凝状态[14]。本实验表明,加入100 mg/LAGEs-HSA后模型组VCAM-1、ICAM-1、TF表达明显上调,TM表达下调,且在作用24 h后最显著(P<0.01);而相同时间点,给药组与模型组比较,则有抑制ICAM-1、VCAM-1和TF表达,上调TM表达的作用,且随着作用时间的延长更明显(P<0.01)。
综上所述,滋阴活血解毒方能有效地抑制糖基化终末产物诱导血管内皮细胞损伤,减少回缩变形的细胞,具有保护细胞的作用,这种保护作用可能与降低ICAM-1、VCAM-1表达,以及下调TF mRNA转录,上调TM mRNA转录,从而抑制与炎症反应相关的细胞黏附过程和内皮源性局部血栓形成有关。同时也证明了滋阴活血解毒方具有改善糖尿病并发脑梗死血管损伤的作用。VEC的体外培养,为进一步探讨AGEs诱导VEC损伤提供了一个良好的体外细胞模型,为今后进一步从细胞分子水平研究中医药防治糖尿病血管病变提供了实验依据。
[1]Chinese Diabetes Association.China Type 2 Diabetes Prevention Guide(2013 edition)[J].Chinese Journal of Diabetes,2015,88(3):26-89.
[2]王占志,马 喆.85例2型糖尿病并发脑血管病临床治疗分析[J].吉林医学,2012,33(35):7741-7742.
[3] Rask -Madsen C, King GL. Vascular complications of diabetes:mechanisms of injury and protective factors[J].Cell Metab,2013,17(1):20-33.
[4]那 娜,邹大进.晚期糖基化终末产物及其受体与脑梗死的关系[J].中华神经医学杂志,2010,9(10):1078-1080.
[5]邓奕辉,李定祥,喻 嵘,等.降糖通脉方对葡萄糖、胰岛素和氧化低密度脂蛋白诱导损伤的血管内皮细胞ET-1、NO的影响[J].中国中医药科技,2006,13(5):309-310.
[6]Cooke JP.Does ADMA cause endothelial dysfunction[J].Arterioscler Thromb Vasc Biol.2000,20(9):2032-2037.
[7]邓奕辉,李定祥,喻 嵘,等.滋阴活血解毒中药对血管内皮细胞损伤的保护作用[J].中国中医药信息杂志,2008,15(6):27-29.
[8]Protection of glycyrrhizic acid against AGEs-induced endothelial dysfunction through inhibiting RAGE/NF-kappaB pathway activation in human umbilical vein endothelial cells[J].2013,148 (1):27-36.
[9]Cybulsky MI,Iiyama K,Li H,et al.A major role for VCAM-1, but not ICAM-1,in early atherosclerosis[J].J Clin Invest.2001. 107(10):1255-1262.
[10]Chen G,Chen Y,Chen H,et al.The effect of NF-kappaB pathway on proliferation and apoptosis of human umbilical vein endothelial cells induced by intermittent high glucose[J].Mol Cell Biochem,2011,347(1-2):127-133.
[11]于逢春,翟艳苓,刘 艳,等.急性脑梗死患者血浆组织因子及血栓调节蛋白的研究.北京医学,2006,28(4):196-198.
[12]章 立,洪 庆,金友雨,等.糖尿病脑梗死急性期TF、TFPI水平与其病情严重程度的关系[J].中国免疫学杂志,2015,31(9):1239-1241.
[13]Andreou AP,Crawley JT.Thrombomodulin analogues for the treatment of ischemic stroke[J].J Thromb Haemost,2011,9(6): 1171-1173.
[14]唐小龙,蔡淑玉,江振友,等.脂多糖诱导血管内皮细胞凝血途径相关因子基因表达变化[J].中国病理生理杂志,2006,22(8):1540-1544.
(本文编辑 杨 瑛)
Influence of Ziyin Huoxue Jiedu Decoction on Expression of Adhesion Molecules and Blood Coagulation Related Factors in Vascular Endothelial Cells Induced by Advanced
Glycation End-Products
LIAO Yuqiang,DENG Yihui,YAN Jiabo,LI Yujia,LI Dingxiang*(Hunan University of Chinese Medicine,Changsha,Hunan 410208,China)
Objective To investigate the influence of Ziyin Huoxue Jiedu decoction on the expression of adhesion molecules and blood coagulation related factors in the vascular endothelial cells (VEC)induced by advanced glycation end-products(AGEs).Methods The human umbilical vein endothelial cell as the subjects,the human umbilical vein endothelial cells (HUVEC)damage were induced by AGEs with the final concentration (100 mg/L),and the cells were continually cultured for 12,24,48 h.The cell morphological changes were observed,the dhesion molecule VCAM-1 and ICAM-1 expression were determined by western-blot.The TF and TM mRNA expression were detected by RT-PCR method.Results Compared with the blank group,the model group cell was abnormal proliferation,cell number increased obviously,most of the cell deformation shrinkage,cell membrane hazy outline,a rough sample are observed in the cell.The VCAM 1,ICAM-1,TF expression significantly raised,TM expression reduced.There was significant diffrence after 24 h (P<0.01).Compared with the model group,the VCAM-1,ICAM-1,TF expression in medicine group down-regulated,TM expression up-regulated,the effect was stronger along with time(P<0.01).Conclusion Ziyin Huoxue Jiedu decocotion could inhibit the damage of VEC in-duced by AGEs,reduce the expression of adhesion molecules,down-regulate the expression of tissue factor mRNA transcription,up-regulate thrombomodulin mRNA transcription.
Ziyin Huoxue Jiedu decocotion;advanced glycation end-products;human umbilical vein endothelial cells;VCAM-1;ICAM-1;TF;TM
R285.5;R393
B
10.3969/j.issn.1674-070X.2017.05.006
2016-12-18
湖南省自然科学基金项目资助(14JJ2113);湖南省中医药科研基金资助项目(201606);湖南省教育厅资助项目(16K063)资助;中西医结合基础湖南省重点学科资助。
廖俞强,男,在读硕士研究生,研究方向:中医内科学。
*李定祥,男,副教授,医学博士,硕士研究生导师,E-mail:ldxlzy@hotmail.com。
本文引用:廖俞强,邓奕辉,颜佳博,李钰佳,李定祥.滋阴活血解毒方对AGEs诱导VEC损伤黏附分子及凝血相关因子表达的影响[J].湖南中医药大学学报,2017,37(5):485-488.

