乌药水提液对腹泻型肠易激综合征模型大鼠Ghrelin、MTL、SP、Sec水平的影响
肖小芹,舒圆月,邓桂明,*,葛金文,杨立平,陈 镇,欧阳林旗,向 彪
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007;3.湖南省肿瘤医院,湖南 长沙 410013)
乌药水提液对腹泻型肠易激综合征模型大鼠Ghrelin、MTL、SP、Sec水平的影响
肖小芹1,舒圆月1,邓桂明1,2*,葛金文1,杨立平3,陈 镇2,欧阳林旗2,向 彪2
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410007;3.湖南省肿瘤医院,湖南 长沙 410013)
目的 探讨乌药水提液对腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome,IBS-D)大鼠血清生长激素释放肽(Ghrelin)、胃动素(Motilin,MTL)、P物质(P substance,SP)、促胰液素(Secretin,Sec)水平的影响。方法 将60只大鼠随机分成6组,采用单只孤养1周+番泻叶煎剂灌胃2周+慢性束缚应激1周造模法建立IBS-D大鼠模型,分别给予乌药水提液低、中、高剂量,匹维溴铵灌胃干预。采用酶联免疫吸附法(ELISA)检测各组大鼠血清Ghrelin、MTL、SP、Sec含量。结果 与空白对照组比较,模型对照组SP、Ghrelin、MTL水平显著升高,Sec水平降低(P<0.01),提示造模成功;与模型对照组比较,乌药水提液低、中、高剂量组以及阳性对照组血清SP、MTL水平均明显降低,Sec水平均显著升高(P<0.01),乌药水提液低、中、高剂量组以及阳性对照组对Ghrelin影响无显著差异(P>0.05)。结论 乌药水提液可能通过降低大鼠血清SP、MTL水平来改善IBS-D大鼠腹痛、腹泻症状。
腹泻型肠易激综合征;乌药;生长激素释放肽;胃动素;P物质;促胰液素
乌药为樟科山胡椒植物乌药Lindera aggregata (Sims)Kosterm的膨大块根,为传统常用的温胃理气止痛药,具有温中散寒、理气止痛的功效。其主要化学成分是挥发油、异喹啉生物碱、倍半萜及其内酯类以及黄酮类,最新提取化合物有:乌药双查耳酮、球松素、赤芝酮、肉桂酸、蓟黄素等[1]。近年研究表明,乌药具有胃肠道双向调节作用,既可以促进胃肠蠕动,又能缓解胃肠道平滑肌痉挛,改善功能性胃肠病患者泛酸、嗳气、食欲不振、腹胀、腹痛、腹泻便秘等临床症状[2],临床上广泛应用于功能性胃肠病。腹泻性肠易激综合征 (diarrhea-predominant irritable bowel syndrome,IBS-D)是一种以反复发作的腹痛、腹泻等为主要症状的功能性胃肠疾病。目前已知胃肠动力异常、内脏高敏性、脑肠肽异常以及精神心理压力等都与肠易激综合征(irritable bowel syndrome,IBS)发病有关,其中胃肠动力异常和内脏高敏性被认为是IBS主要的病理生理学基础。脑肠肽是一种存在于中枢神经系统和胃肠道系统的小分子多肽,在内脏感觉和胃肠动力的调节方面起着重要的作用。近年研究发现,脑肠肽的分泌和表达的异常可导致内脏高敏和胃肠动力紊乱,从而产生IBS-D腹痛、腹泻等症状[3]。本文从生长激素释放肽(Ghrelin)、胃动素(Motilin,MTL)、P物质(P substance,SP)、促胰液素(secretin,Sec)四种脑肠肽入手,研究乌药水提液对IBS-D大鼠血浆Ghrelin、MTL、SP、Sec水平变化的影响,从而探讨乌药治疗功能性胃肠疾病的可能疗效机制与物质基础,为乌药的进一步开发和应用提供理论基础。
1 材料
1.1 动物
SD大鼠60只,SPF级,体质量180~220 g,雌性,实验动物合格证号NO.43004700022217。许可证号SCXK(湘)2011-0003,购买自湖南斯莱克景达实验动物有限公司。
1.2 药物及试剂
乌药:批号20150824;番泻叶:批号2015112712,湖南三湘中药饮片有限公司;匹维溴铵片:批号639288,Abbott Products SAS公司,50 mg/片;SP、MTL、SEC、Ghrelin Elisa试剂盒(凯诺生物科技有限公司)等。
1.3 仪器
AUE-210分析天平(长沙湘仪设备有限公司);低温离心机(湘仪实验设备有限公司);CYTATION3多功能酶标仪(美国Biotek公司)。
2 方法
2.1 分组及给药
选用SD雌性大鼠60只按体质量标号后随机分为6组,每组10只,一笼5只,分别为空白组对照,模型对照组,乌药水提液低、中、高剂量组及阳性对照组。造模方法参考番泻叶灌胃+束缚应激进行改良后如下[4-6]:所有动物单只单笼饲养 1周,开始实验,各组动物以番泻叶水煎剂5 g/kg灌胃,每日1次,持续2周。从第2周起,用粗制棉绳束缚大鼠的双前肢,影响其正常行动,但不完全限制自由,被束大鼠可以拖后肢缓慢爬行。束缚持续1周,每天 30 min,空白对照组不予任何处理。造模过程中观察并记录各组大鼠一般情况、大便含水量、腹壁撤退反射(abdominal withdrawal reflex,AWR)评分,以各造模组大鼠粪便含水量高于空白对照组,痛觉阈值低于正常组(P<0.05)为造模成功的标准。
2.2 药物干预
造模成功后,给药剂量按照实验动物研究“等效剂量”的计算方法,即按70 kg/200 g人鼠转换系数r=0.018计算等效剂量。对乌药低、中、高剂量组于每天进行束缚30 min后,分别给予乌药水提液低剂量0.94 g/kg、中剂量1.88 g/kg、高剂量3.76 g/kg灌胃。阳性对照组给予匹维溴铵水溶液灌胃1.5 g/kg。空白对照组和模型组束缚30 min后给予等量生理盐水灌胃,持续灌胃14 d,每天1次。
2.3 模型评价方法
造模完成后,参考Al-Chaer ED等[7]具体评分标准:0分,在进行扩张时大鼠无反应;1分,大鼠头部短暂静止不动;2分,大鼠腹部收缩,但为抬离桌面;3分,大鼠腹部收缩抬离桌面;4分,大鼠身体呈弓形,骨盆抬高。用8F双腔导尿管与装有生理盐水的注射器相连后从肛门插入约5 cm,用棉线将鼠尾根部和导尿管绑在一起,固定导尿管。待其稳定后,缓慢推入生理盐水使导尿管顶端球囊扩张肠道,当引起大鼠腹部抬起(AWR评分3分)时停止推水,记录注射器推进水量,作为痛觉阈值评价大鼠内脏敏感性。大便含水量测定方法:造模后,将各只大鼠放入代谢笼内正常喂养,收集各只大鼠大便,称取湿便质量,然后放入干燥箱内烘干20 min后再称取干便质量,湿便质量与干便质量之差除以湿质量即为大便含水量[8]。
2.4 取材方法与指标测定
实验结束后,各组大鼠禁食不禁水24 h,用10%水合氯醛350 mg/kg腹腔注射麻醉,腹主动脉采血,每只取5 mL;室温放置2 h后,3 000 r/min离心15 min,取上清液,放冰箱-20℃保存待测,采用ELISA检测血清SP、Sec、MTL、Ghrelin含量。
2.5 统计方法
统计分析采用SPSS 16.0统计软件进行统计处理,计量资料采用“±s”表示。符合正态性和方差齐性的资料,采用单因素方差分析;不符合正态性和方差齐性的资料,采用非参数检验。P<0.05差异有统计学意义。
3 结果
实验过程中观察模型组及各给药组模型大鼠体质量增长缓慢、神态倦怠、皮毛散乱、少动、易激惹、大便粒数增多且不成形等症状。与空白对照组比较,其余各组大便含水量均高于空白组,具有显著差异(P<0.01);与空白对照组比较,模型组以及各给药组疼痛阈值降低(P<0.01),提示造模成功。见表1。
表1 造模完成后各组大鼠大便含水量以及痛觉阈值对比 (±s,n=10)
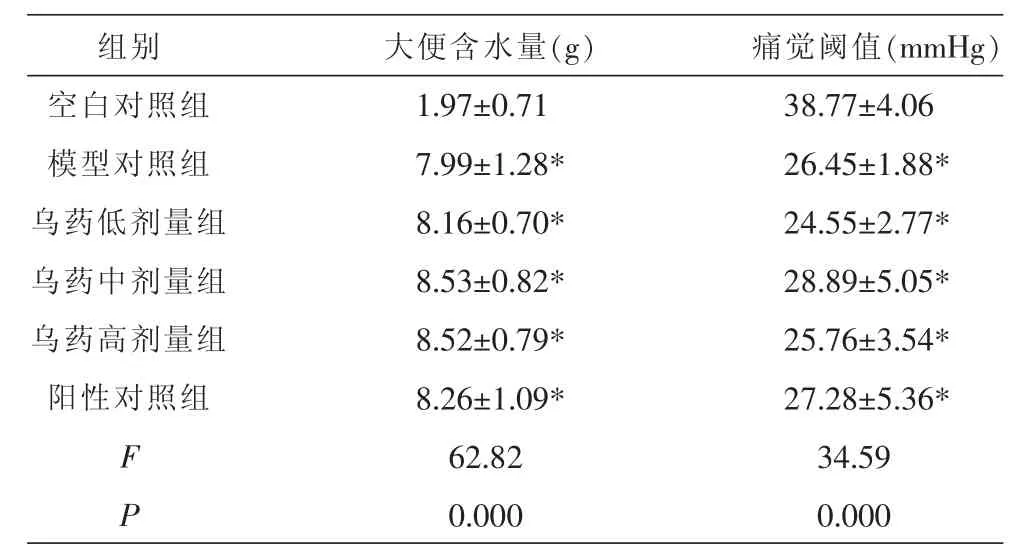
表1 造模完成后各组大鼠大便含水量以及痛觉阈值对比 (±s,n=10)
注:与空白对照组比较,*P<0.01。
组别空白对照组模型对照组乌药低剂量组乌药中剂量组乌药高剂量组阳性对照组F P大便含水量(g)1.97±0.71 7.99±1.28* 8.16±0.70* 8.53±0.82* 8.52±0.79* 8.26±1.09* 62.82 0.000痛觉阈值(mmHg)38.77±4.06 26.45±1.88* 24.55±2.77* 28.89±5.05* 25.76±3.54* 27.28±5.36* 34.59 0.000
各组大鼠血清 SP、Sec、Ghrelin、MTL水平的比较:(1)与空白对照组比较,模型对照组SP高于空白对照组(P<0.05),Sec低于空白对照组(P<0.01),Ghrelin、MTL均高于空白对照组(P<0.01),提示模型成功;(2)与模型对照组比较,乌药水提液低、中、高剂量组及阳性对照组血清SP水平均降低,有显著性差异(P<0.01),Sec水平均显著升高(P<0.01);乌药水提液低剂量组血清MTL降低(P<0.05),中、高剂量组以及阳性对照组MTL水平降低 (P<0.01);(3)乌药水提液低、中、高剂量组以及阳性对照组Ghrelin差异无统计学意义(P>0.05),与中剂量组SP水平无统计学意义(P>0.05);(4)乌药低剂量组与乌药中剂量组、高剂量组、阳性对照组血清Sec、MTL水平比较差异均有统计学意义(P<0.01);乌药中剂量组与与乌药高剂量组血清SP水平比较差异有统计学意义(P<0.05),乌药中剂量组与乌药高剂量组、阳性对照组血清Sec、MTL水平比较差异均有统计学意义(P<0.01);与阳性对照组比较,血清Sec、MTL差异均有统计学意义(P<0.05)。见表2。
表2 各组大鼠血清SP、Sec、Ghrelin、MTL水平的影响 (±s,n=10,pg/mL)
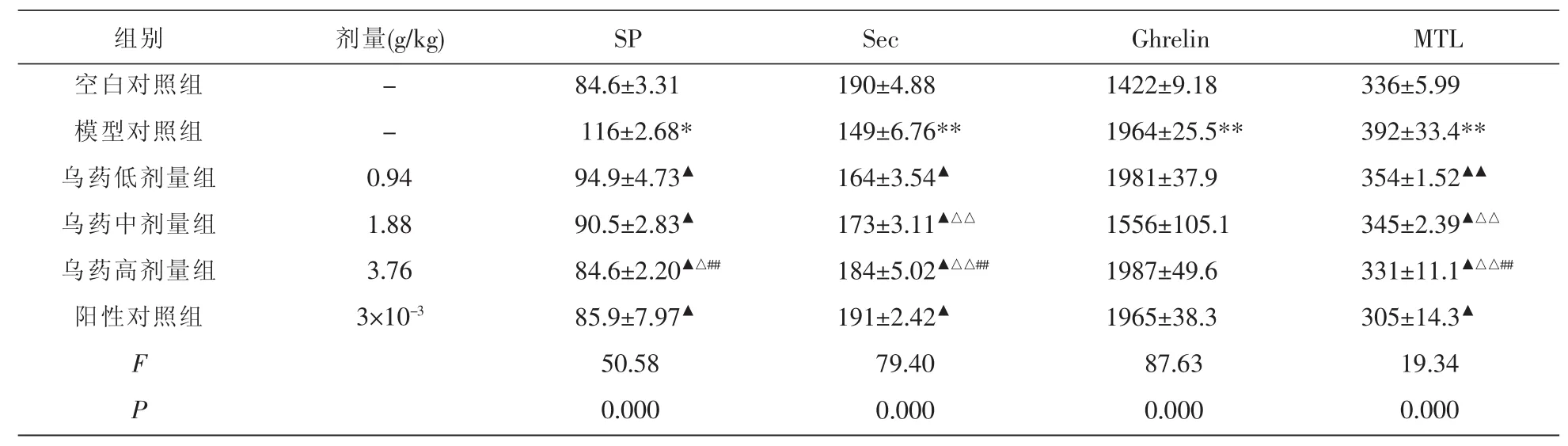
表2 各组大鼠血清SP、Sec、Ghrelin、MTL水平的影响 (±s,n=10,pg/mL)
注:与空白对照组比较*P<0.05,**P<0.01;与模型对照组比较▲P<0.01,▲▲P<0.05;与乌药低剂量组比较,△P<0.05,△△P<0.01;与乌药中剂量组比较,##P<0.01。
组别空白对照组模型对照组乌药低剂量组乌药中剂量组乌药高剂量组阳性对照组F P剂量(g/kg) --0.94 1.88 3.76 3×10-3SP 84.6±3.31 116±2.68* 94.9±4.73▲90.5±2.83▲84.6±2.20▲△##85.9±7.97▲50.58 0.000 Sec 190±4.88 149±6.76** 164±3.54▲173±3.11▲△△184±5.02▲△△##191±2.42▲79.40 0.000 Ghrelin 1422±9.18 1964±25.5** 1981±37.9 1556±105.1 1987±49.6 1965±38.3 87.63 0.000 MTL 336±5.99 392±33.4** 354±1.52▲▲345±2.39▲△△331±11.1▲△△##305±14.3▲19.34 0.000
4 讨论
脑肠肽可作为胃肠道肽能神经释放的调解递质或者神经递质作用于胃肠道,也可以直接作用于胃肠道感觉神经末梢或平滑肌细胞的相应受体而调解胃肠功能。目前已知SP与IBS-D的发病有着密切的联系,李宁宁等[9]研究发现肠神经系统中的P物质对消化道平滑肌有强烈的刺激作用,可增加胃肠蠕动,刺激小肠和结肠分泌水和电解质,增加血管渗透性;脊髓背角释放的SP可激活血小板释放5-HT,诱发IBS,其中SP3能将肠道感觉信息传递给中枢神经系统,参与内脏疼痛敏感的发生[10];Keszthelyi D等[11]研究发现在IBS患者肠黏膜中,SP含量增多,与IBS患者疼痛症状相关。本实验结果提示乌药水提液对于改善IBS-D患者腹泻、腹痛等症状具有明显作用。促胰液素可增强缩胆囊素的作用和胰酶的分泌,抑制胃酸分泌以及胃肠道运动功能,本实验中乌药水提液低、中、高剂量以及阳性对照组均可以升高IBS-D大鼠血清Sec水平,具有统计学意义(P<
0.01 ),提示乌药水提液可以有效抑制IBS-D大鼠胃肠运动。胃动素通过调节消化间期胃肠道移行复合运动并促进小肠分节运动促进胃肠运动及加速胃排空,大量研究发现胃排空与血清MTL水平密切相关,黄鹤飞等[12]研究发现MTL能够作用于消化道平滑肌细胞上的受体,使细胞内Ca2+浓度增高激发消化道的机械运动和电活动,从而调节胃肠、胆囊、食管运动,促进胃肠运动和胃肠道对水、电解质的运输。本实验结果得出,乌药水提液低、中、高剂量组以及阳性对照组均可抑制IBS-D大鼠血清MTL水平,提示乌药水提液对抑制IBS-D大鼠胃肠运动,延缓胃排空,缓解胃肠痉挛具有显著意义。Ghrelin是生长激素促分泌激素受体(GHS-R)的内源性配体,具有保护胃肠黏膜、促进胃肠蠕动及胃酸分泌、改善胃肠动力障碍的作用。王燕等[13]通过实验研究发现,Ghrelin可剂量依赖性地促进大鼠小肠转运,其受体拮抗剂抑制小肠转运;静脉给予Ghrelin促进胃肠消化间期移行性复合肌电活动,此作用可能通过胆碱能通路起作用,与NO通路关系密切;Oka T等[14]研究发现一些传统中草药可以通过促进Ghrelin的分泌,改变胃肠动力异常。本实验中乌药水提液低、中、高剂量组以及阳性对照组对IBS-D大鼠血清Ghrelin水平影响差异无统计学意义(P>0.05)。结论:乌药水提液可以降低IBS-D大鼠模型血清SP、MTL水平,升高血清Sec水平,对血清Ghrelin水平影响差异无显著统计学意义。提示乌药水提液可能通过降低大鼠血清SP、MTL水平,升高血清Sec水平,来抑制IBS-D大鼠胃肠运动,延缓胃排空,从而一定程度上改善IBS-D大鼠腹痛、腹泻症状。
[1]海 萍,高 原,李蓉涛,等.乌药的化学成分研究[J].中草药杂志, 2016,47(6):872-875.
[2]聂子文,郭建生,陈 君,等.乌药不同提取部位对小肠推进、胃排空的影响[J].中药药理与临床,2011,27(2):93-95.
[3]史瑞瑞,王 晶.脑肠肽与肠易激综合征相关性研究进展[J].世界科学技术——中医药现代化专题讨论:临床常见病的动物模型建立及药物干预研究,2013,8(15):12-14.
[4]李延青,郭玉婷.肠易激综合征的动物模型研究[J].胃肠病学和肝病学杂志,2004,13(4):435-439.
[5]刘美荣,肖瑞飞,彭芝配,等.针刺“足三里”“太冲”穴对腹泻型肠易激综合征大鼠胃肠激素的影响[J].针刺研究,2012,37(5):363-368.
[6]邓桂球,张 蓓,张 喆,等.六味顺激胶囊对肝郁脾虚型肠易激综合征大鼠内脏敏感性及五羟色胺水平的影响[J].中国中医药信息杂志,2014,21(8):46-48.
[7]Al-Chaer ED,Kawasaki M,Pasricha PJ.A new model of chronic visceral hyper-sensitivity in adult rats induced by colon irritation during postnatal development[J].Gastroenterology,2000, 119(5):1276-1285.
[8]许惠娟,刘慧慧,滕 超,等.痛泻要方对腹泻型肠易激综合征模型大鼠结肠水通道蛋白8表达影响的机制研究[J].中国实验方剂学杂志,2012,18(6):141-144.
[9]李宁宁,方秀才.脑-肠轴在肠易激综合征发病中的作用[J].胃肠病学和肝病学杂志,2013,22(2):163-166.
[10]王艳杰,关洪全,柴纪严,等,眼针对腹泻型肠易激综合征模型大鼠结肠P物质表达的影响[J].中华中医药杂志,2011,26(10):2268-2271.
[11]KeszthelyiD,TroostFJ,Jonkers DM,etal.Alterations in mucosal neuropeptides in patients with irritable bowel syndrome and ulcerative colitis in remission:A role inpain symptom generation[J].Eur J Pain,2013,17(9):1299-1306.
[12]黄鹤飞,陈 颖,朱晓新,等.中药干预肠易激综合征的脑肠肽调节研究进展[J].中国实验方剂学杂志,2016,22(11):208-217.
[13]王 燕,董 蕾,赵 平,等.Ghrelin对大鼠小肠转运及消化间期移行性复合肌电活动的作用及机制[J].南方医科大学学报,2008,28 (3):328-332.
[14]Oka T,Okumi H,Nishida S,et al.Effects of Kampo on functional gastrointestinaldisorders[J].Biopsychosoc Med,2014,8(1):5.
(本文编辑 杨 瑛)
Effect of Water Extract of Lindera Aggregata on Ghrelin,MTL,SP and Sec Levels in Rats With Diarrhea-Predominant Irritable Bowel Syndrome
XIAO Xiaoqin1,SHU Yuanyue1,DENG Guiming1,2*,GE Jinwen1,YANG Liping3,CHEN Zhen2,OUYANG Linqi2,XIANG Biao2
(1.Hunan University of Chinese Medicine,Changsha,Hunan 410208,China;2.The First Affiliated Hospital of Hunan University of Chinese Medicine,Changsha,Hunan 410007,China;3.Hunan Cancer Hospital,Changsha,Hunan 410013,China)
Objective To investigate the water extracts of Lindera aggregata on Ghrelin,MTL,SP and Sec levels in rats with diarrhea-predominant irritable bowel syndrome.Methods 60 rats were randomly divided into 6 groups.Using a single solitary 1 weeks,gavage of sennoside for 2 weeks and chronic restraint 1 weeks to establish the rat model of IBS-D.The model rats were administrated with low,medium,high dose of water extracts of Lindera aggregata,and pinaverium bromide.The levels of SP,MTL,Sec and Ghrelin in serum of rats were measured by using enzyme linked immunosorbent assay (ELISA).Results Compared with the blank control group,SP,Ghrelin and MTL levels significantly increased in the model control group,Sec was lower than the control group (P<0.01).Compared with the model group,the plasma levels of SP,MTL in the low,medium,high dose water extracts groups and pinaverium bromide group decreased,the Sec levels significantly increased,with statistical significance (P<0.01),while Ghrelin in the above four groups had no statistical significance (P>0.05).Conclusion The water extracts of Lindera aggregata could improve the abdominal pain and diarrhea of IBS-D model rats byreducing the plasma levels of SP and MTL.
diarrhea-predominant irritable bowel syndrome;Lindera aggregata;growth hormone releasing peptide;motilin; substance-p;secretin
R285.5;R574.4
A
10.3969/j.issn.1674-070X.2017.05.004
2016-11-02
湖南省教育厅重点项目(14A107);湖南省中医药科研计划项目(201429、2013135);湖南省教育厅项目(15C1041);中国博士后基金项目(2016T90752、2014M550420)。
肖小芹,男,博士,教授,硕士研究生导师,研究方向:中西医结合基础研究。
*邓桂明,女,博士(后),副主任药师,E-mail:guimingd1004@163.com。
本文引用:肖小芹,舒圆月,邓桂明,葛金文,杨立平,陈 镇,欧阳林旗,向 彪.乌药水提液对腹泻型肠易激综合征模型大鼠Ghrelin、MTL、SP、Sec水平的影响[J].湖南中医药大学学报,2017,37(5):477-480.

