3种植物生长调节剂对坛紫菜自由丝状体生长与光合色素含量的影响
钟晨辉,林 琪,张 鹏,黄瑞芳,林向阳,刘燕飞
(1. 福建省水产研究所,厦门 361013; 2. 福建省海洋生物增养殖与高值化利用重点实验室,厦门 361013; 3. 浙江省海洋水产养殖研究所,温州 325005; 4. 福建省水产技术推广总站,福州 350003)
3种植物生长调节剂对坛紫菜自由丝状体生长与光合色素含量的影响
钟晨辉1,2,林 琪1,2,张 鹏3,黄瑞芳1,2,林向阳1,2,刘燕飞4
(1. 福建省水产研究所,厦门 361013; 2. 福建省海洋生物增养殖与高值化利用重点实验室,厦门 361013; 3. 浙江省海洋水产养殖研究所,温州 325005; 4. 福建省水产技术推广总站,福州 350003)
采用单因素分析法,比较研究了添加3种外源植物生长调节剂(吲哚乙酸IAA、2,4-二氯苯氧乙酸2,4-D、激动素KT)对野生型坛紫菜(Pyropiahaitanensis)自由丝状体生长及光合色素含量的影响。结果表明:与对照组相比,低浓度的IAA(0.5~4.0 mg·L-1)和KT(0.5~2.0 mg·L-1)对藻体的特定生长率有显著影响,以2.0 mg·L-1IAA和1.0 mg·L-1KT对藻体的促生长效应最大,培养25 d时藻体鲜重增加最大,分别是对照组的1.90倍和1.52倍(P<0.05)。高浓度的IAA(6.0~10.0 mg·L-1)和KT(4.0~10.0 mg·L-1)却会抑制藻体生长(P<0.05)。培养25 d时,与对照组相比,2.0 mg·L-1IAA和1.0 mg·L-1KT均有利于叶绿素a(Chla)和类胡萝卜素(Car)的合成,Chla含量分别增加了23.7% 和23.8%;Car含量分别增加了31.0%和28.6%(P<0.05)。然而,高浓度的IAA和KT(6.0、10.0 mg·L-1)不利于Chla的合成,其处理浓度越高,Chla含量下降越多。与对照组相比,较低浓度的IAA(1.0~2.0 mg·L-1)明显促进藻红蛋白(PE)和藻蓝蛋白(PC)合成,其中2.0 mg·L-1IAA处理组PE、PC含量最高,分别增加了59.1%和45.7%(P<0.05)。较低浓度的KT(0.5~2.0 mg·L-1)均有利于PE、PC合成,其中0.5 mg·L-1KT处理组的PE、PC含量增加最多,分别提高了48.4%和50.5%(P<0.05)。高浓度的IAA(6.0、10.0 mg·L-1)和KT(10.0 mg·L-1)则明显降低了PE、PC合成(P<0.05)。2,4-D对藻体的特定生长率和光合色素合成无显著影响(P>0.05)。
坛紫菜; 自由丝状体; 植物生长调节剂; 生长; 光合色素
坛紫菜(Pyropiahaitanensis)是我国特有的一种亚热带大型经济红藻,主要养殖在浙江、福建和广东等沿海地区,其年产量占到我国紫菜年产量的75%左右,其生活史包括微型的丝状孢子体(2n)和大型的叶状配子体(n)两个时期[1]。坛紫菜丝状体主要是由成熟叶状体释放的果孢子或单性叶状体产生的[2]。在低温弱光条件下,丝状体可以长期保存,移入适宜的培养条件后,藻体可实现快速的营养增殖[3],且粉碎后的藻丝可以钻入贝壳基质长成贝壳丝状体,能够在紫菜人工育苗中充当“种子”的角色,该技术称为自由丝状体移植技术[4]。现今,随着我国坛紫菜新种质的不断开发和推广,自由丝状体移植因具有种质纯合、性状稳定和育苗过程简易等优势,已被大部分生产单位采纳和应用[5-6]。另外,坛紫菜富含藻胆蛋白等天然色素,被广泛应用在食品工业、生物医药及高端化妆品等行业[7]。因此,通过优化培养条件,在有限时间内创制出大量优质健康的丝状体将变得非常重要。
植物生长调节剂是一类与植物激素类似的化学物质,对植物具有多种生理效应,可以调控植物的生长发育[8]。外源添加植物生长调节剂可以促进藻类细胞组织分裂,促进藻体单个细胞生长,增加藻体细胞数量及促进藻体假根生长和顶端生长、脱分化和诱导愈伤组织形成等[9]。国内外学者主要研究了植物生长调节剂对海带(Saccharinajaponica)配子体[10]、冈村枝管藻(CladosiphonokamuranusTokida)盘状体[11]、海萝(Gloiopeltisfurcata)盘状体和直立体[12]、细基江蓠(Gracilariatenuistipitata)[13]、斜生栅藻(Scenedesmusobliquus)[14]、枝鞘藻(Oedocladiumsp.)[15]、雨生红球藻(Haematococcuspluvialis)和盐生杜氏藻(Dunaliellasalina)[16]、条斑紫菜(Pyropiayezoensis)[17-18]和坛紫菜叶状体[19]生长与发育的影响,并掌握了有利于藻体快速生长与代谢产物积累的使用浓度范围。然而,植物生长调节剂对紫菜自由丝状体是否存在促生长效应还不清楚,因此,本文以野生型坛紫菜自由丝状体为实验材料,比较研究了外源添加不同质量浓度的吲哚乙酸(IAA)、2,4-二氯苯氧乙酸(2,4-D)和激动素(KT)对坛紫菜自由丝状体生长与光合色素含量的影响,以期筛选出较适宜的处理浓度,为丰富坛紫菜自由丝状体的快速扩大培养模式提供科学参考。
1 材料与方法
1.1 材料
实验材料为野生型坛紫菜丝状体(WT-001),该株系是采集于福建省平潭岛的成熟野生坛紫菜叶状体释放的单个果孢子所萌发而成的杂合丝状体克隆系。
1.2.1 坛紫菜自由丝状体的同步化培养
取一定数量的自由丝状体经打碎机粉碎后,置于单个20 L玻璃充气瓶内充气培养,培养条件设置为:温度24±0.5 ℃,光周期12L∶12D,光照强度10 μmol·m-2·s-1。每周更换一半MES培养液,直至培养到实验所需的生物量。
1.2.2 植物生长调节剂的浓度设计与藻体培养
3种植物生长调节剂IAA,2,4-D和KT的浓度梯度均为0.0、0.5、1.0、2.0、4.0、6.0、10.0 mg·L-1,每个浓度均设3个平行组。将预先同步化培养的坛紫菜自由丝状体按同等质量(0.30±0.05) g转入装有500 mL MES灭菌培养液的单管玻璃瓶内。室内培养条件设置为:温度(24±0.5) ℃,光周期12L∶12D,光照强度20 μmol·m-2·s-1。每周更换一次MES培养液时,并补加相应剂量的植物生长调节剂。培养期间每隔1 d检查一次培养情况,每天定时摇动培养瓶3次(6∶00,14∶00,22∶00),保持藻体悬浮培养状态,实验周期为25 d。
1.2.3 生长指标测定
每次更换培养液时,称量各个培养瓶内坛紫菜自由丝状体的鲜重,测定方法:将自由丝状体经200目筛绢静置过滤10 min后,置于电子分析天平上称重记录。藻体的特定生长率(Specific Growth Rate,SGR)的计算按照公式(1) 。
SGR=100×(LnDt-LnD0)/5
(1)
式中,D0为前一次藻体鲜重,Dt为第t天的藻体鲜重。
虽然鱼儿们如此顽皮,但对我这个“钓鱼高手”来说,也只是雕虫小技。我先将一撮没有连着线的鱼食抛进了鱼群,那些鱼儿们过去嗅了嗅,都走开了。他们好像在嘲笑我:“哼!我们才不中计呢!想把我们钓走,没门儿!”可他们不知道,他们已经中计了!刚刚我把鱼食抛得很近,本来就是给他们设的圈套。他们一下子躲到了后面,却不料我的鱼钩上已经放了鱼食在等他们,其中一个调皮的,上去咬了一口,没有被钓起来,他的胆子就变大了,一口将鱼食吞了下去,我熟练的将鱼竿收回,哈!一条黑色的鱼!我用同样的方法,又钓了九条鱼!
1.2.4 叶绿素a及类胡萝卜素含量测定
培养至25 d时,从每个培养瓶内取出大约0.02 g新鲜藻体,置于加入3 mL甲醇的研磨器中充分研磨,后于4 ℃恒温冰箱过夜处理,次日取出离心(5 000 r·min-1,4 ℃,5 min),将上清液置于紫外分光光度计中,测量480、510、652、665、750 nm波长下各自的吸光值(OD)。叶绿素a(Chla)及类胡萝卜素(Car)含量的计算分别按照公式(2)[20]和公式(3)[21]。
Chla(μg·g-1)=16.29×(OD665-OD750)-8.54×(OD652-OD750)
(2)
Car (μg·g-1)=7.6×[(OD480-OD750)-8.54×(OD510-OD750)]
(3)
1.2.5 藻红蛋白和藻蓝蛋白含量测定
培养至25 d时,从每个培养瓶内取鲜重约0.1 g的藻体,置于放有少许石英砂的研磨器中研磨充分,至匀浆后转入8 mL的磷酸缓冲液(pH 6.8,0.1 mol·L-1)中,然后经离心机离心(10 000 r·min-1,4 ℃,10 min)后取上清液用紫外分光光度仪,检测455、564、592、618、645 nm波长下的吸光值。藻红蛋白(PE)和藻蓝蛋白(PC)含量的计算按照公式(4)和(5)[22]。

(4)

(5)
式中,A表示吸光度,V表示抽提量,DW表示藻类干重(g)。
1.2.6 数据处理
采用Excel 2007计算实验数据并统计作图。SPSS Statistics 17.0软件对各组数据进行单因素方差分析(One-Way ANOVA)及Duncan多重比较分析,差异显著水平设置为P<0.05。
2 结果与分析
2.1 坛紫菜自由丝状体的生长曲线与特定生长率比较
比较不同浓度的3种植物生长调节剂(IAA、2,4-D和KT)对坛紫菜自由丝状体生长的效果。结果显示,不同浓度的IAA和KT对自由丝状体的生长影响较大,在5~15 d阶段不同浓度处理组内的特定生长率(SGR)变化幅度较小,但16~25 d阶段的SGR却明显减小(表1)。与对照组相比,适宜浓度的IAA(0.5~4.0 mg·L-1)和KT(0.5~2.0 mg·L-1)皆可以促进丝状体生长,其藻体鲜重都处于明显的增长趋势,其中2.0 mg·L-1IAA和1.0 mg·L-1KT处理组的SGR最大,至25 d时的藻体鲜重最大,分别是对照组的1.90倍和1.52倍(P<0.05) (图1-A、C,表1)。但高浓度的IAA(6.0~10.0 mg·L-1)和KT(4.0~10.0 mg·L-1)抑制藻体生长,藻体鲜重增加量极少,其SGR明显小于对照组(P<0.05) (图1-A、C,表1)。在整个培养阶段,不同浓度2,4-D处理组的藻体生长曲线基本保持趋同态势,SGR不存在明显差异(P>0.05) (图1-B,表1)。

图1 不同浓度IAA(A)、2,4-D (B)和KT (C)处理下坛紫菜自由丝状体的生长曲线Fig.1 Growth curves of free-living filaments of P.haitanensis treated with different concentrations of IAA(A), 2,4-D (B) and KT (C)

表1 不同浓度的3种植物生长调节剂处理下坛紫菜自由丝状体的特定生长率Tab.1 Specific growth rates of free living filaments of P.haitanensis treated with different concentrations of plant growth regulators
注:同一行数据中,上标字符不同表示同一时段内在不同浓度植物生长调节剂处理下坛紫菜自由丝状体特定生长率之间有显著差异(P<0.05)
Notes:In the same line, data with different superscript letters show the significant differences between the specific growth rates of free-living filaments ofP.haitanensistreated by the same palnt growth regulators of different concentrions in the same time period(P<0.05)
2.2 坛紫菜自由丝状体的叶绿素a与类胡萝卜素含量比较
外源添加不同浓度的3种植物生长调节剂培养坛紫菜自由丝状体25 d后,比较分析了各处理组丝状体的Chla和Car含量。结果表明,不同浓度的IAA和KT对自由丝状体Chla和Car含量存在影响(图2-A、C),而不同浓度的2,4-D对藻体的Chla和Car含量影响极小(图2-B)。与对照组相比,2.0 mg·L-1IAA处理组的Chla和Car含量最高,分别提高了23.7%和31.0%(P<0.05);然而,高浓度IAA(6.0、10.0 mg·L-1)都不利于藻体Chla的合成,其含量分别下降了20.0%和35.3%(P<0.05)。类似地,与对照组相比,1.0 mg·L-1KT处理组的Chla和Car含量最高,分别提高了23.8%和28.6%(P<0.05)。但高浓度KT(6.0、10.0 mg·L-1)处理组的Chla和Car含量均显著性降低,其中Chla含量分别下降了15.4%和53.6%,且Car含量分别下降了23.6%和67.3%(P<0.05)。不同浓度2,4-D处理组的藻体Chla和Car含量不存在显著性差异(P>0.05)。
2.3 坛紫菜自由丝状体的藻胆蛋白含量比较
如图3-A、B所示,不同浓度的IAA和KT处理对坛紫菜自由丝状体的PE和 PC含量影响较大,而不同浓度2,4-D处理下藻体PE和PC含量在各组间的差异不明显。培养25 d后,与对照组相比,1.0 mg·L-1和2.0 mg·L-1IAA处理均显著提高了藻体PE和PC的合成,其中PE含量分别增加了18.1%和59.1%,PC含量分别增加了13.3%和45.7%(P<0.05)。然而与对照组相比,高浓度IAA(6.0、10.0 mg·L-1)处理不利于藻体的PE和PC合成,其中PE含量分别降低了19.5%和33.8%,PC含量分别降低了28.8%和57.6%(P<0.05)。相类似地,与对照组相比,较低浓度KT(0.5、1.0、2.0 mg·L-1)处理组的PE和PC含量增加,其PE含量分别提高了48.4%,32.2%和28.1%;PC含量分别提高了50.5%,33.7%和26.7%(P<0.05)。而高浓度KT(10.0 mg·L-1)处理明显降低了藻体的PE和PC含量,分别降低了23.8%和58.7%(P<0.05)。

图2 不同浓度IAA(A)、2,4-D(B)和KT(C)处理下坛紫菜自由丝状体的叶绿素a和类胡萝素含量 Fig.2 Contents of Chlorophyll α and Carotenoid of free-living filaments of P. haitanensis treated with different concentrations of IAA(A), 2,4-D(B) and KT(C)
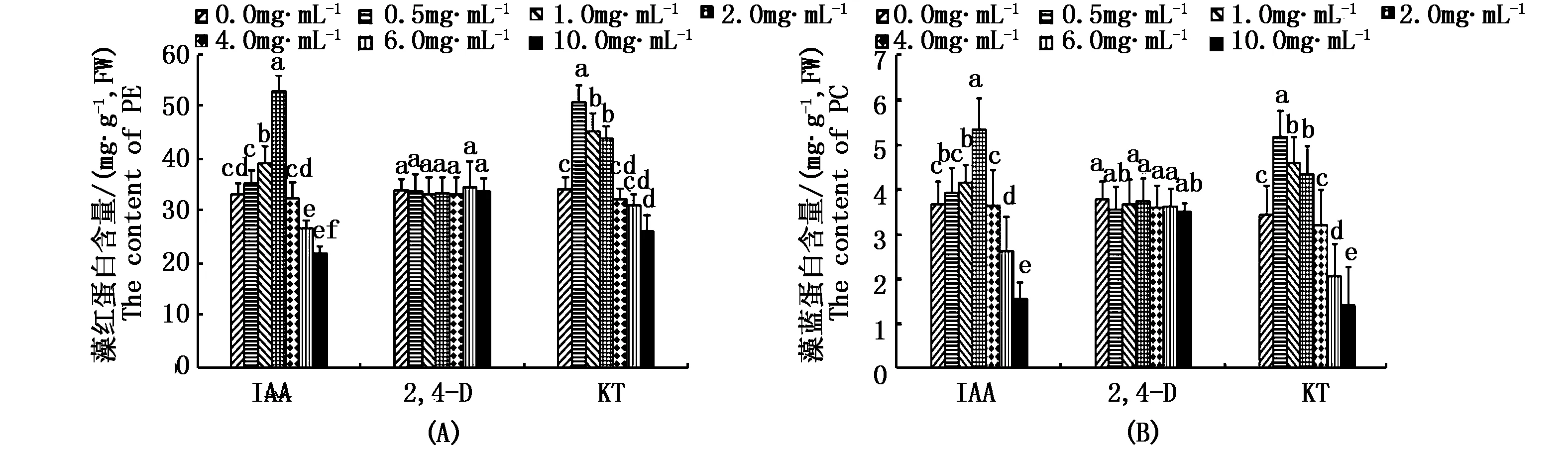
图3 不同浓度的3种植物生长调节剂处理下坛紫菜自由丝状体的藻红蛋白和藻蓝蛋白含量Fig.3 Contents of PE(A) and PC(B) of free-living filameents of P.haitanensis treated with different concentrations of IAA,2,4-D and KT
3 讨论
3.1 3种植物生长调节剂对坛紫菜自由丝状体生长的影响
植物生长素的化学本质是IAA,在藻类中可以促进细胞生长与分裂[23]。特定生长率(SGR)是一个衡量生物体生长状况的常用指标,SGR值越大,代表生物量增长越快。在本研究中,较低浓度的IAA(0.5~4.0 mg·L-1)对坛紫菜自由丝状体的SGR影响显著,以2.0 mg·L-1IAA的促生长作用最明显,藻体鲜重增加量最大(P<0.05)。该结果类似于之前的研究发现1.0×10-5mol·L-1IAA对斜生栅藻[14],1.0 mg·L-1IAA对枝鞘藻[15]及0.05 mg·L-1IAA对海带配子体具有促生长效应[10]。同时,这种生理效应也类似于低浓度的生长素萘乙酸(NAA),可以加快冈村枝管藻盘状体与条斑紫菜原生质体的生长[11,17]。本研究中适宜浓度的IAA可以促进坛紫菜自由丝状体生长,可能是IAA对细胞质膜上的ATP酶有活化作用,从而增强细胞可塑性,增进细胞RNA转录和蛋白质合成,加快了细胞增殖[24],而高浓度IAA却对藻体产生相反的生理作用,导致藻体生长受到抑制。KT和2,4-D属于植物细胞分裂素物质,可以促进细胞的胞质分裂及多种组织的分化和生长[23]。RAPOSO等[16]研究发现低浓度的KT和2,4-D(0.5~2.0 mg·L-1)对雨生红球藻和盐生杜氏藻有生长促进作用。本研究中适宜浓度的KT(0.5~2.0 mg·L-1)均促进坛紫菜自由丝状体的生长,以1.0 mg·L-1KT处理组的SGR最大,藻体鲜重增加量最大(P<0.05)。然而,不同浓度的2,4-D对藻体的SGR不存在影响,这说明坛紫菜自由丝状体对2,4-D不敏感,2,4-D不存在促生长效应。这种KT和2,4-D对藻体生长影响的差异性,类同于YOKOYA等[13]发现1.0~100.0 mol·L-1KT对细基江蓠的中间部位藻体切段有促进作用,而2,4-D不存在促生长效应。这说明坛紫菜丝状体对KT和2,4-D的响应机制不同,也提示植物生长调节剂的存在并不一定直接影响藻体生长,可能还间接地与培养体系中有无媒介物质、藻体自身有无相关信号受体或数量多少及生理调节机制能否发挥作用有关[25-26]。
3.2 3种植物生长调节剂对坛紫菜自由丝状体光合色素含量的影响
光合色素是藻类进行光合作用的物质基础,能够吸收、传递和转换光能。叶绿素a直接参与光合作用过程的光反应,而类胡萝卜素和藻胆蛋白作为辅助色素将吸收的光能传递给叶绿素a,其含量与组成能影响藻体的光合速率[27]。植物生长调节剂可以调节藻体内RNA、DNA和蛋白质合成,并影响光合色素和脂类代谢物等的积累等[28]。本研究中,在同一试验组内2.0 mg·L-1IAA和1.0 mg·L-1KT处理的坛紫菜自由丝状体的SGR最大,其Chla含量最高。适宜浓度的IAA和KT处理组藻体的SGR与Chla含量呈现出关联性,且2,4-D处理后不同组间藻体的SGR和Chla含量都无差异,这提示IAA和KT的促生长效应与藻体的Chla合成密切相关。本研究发现1.0、2.0 mg·L-1IAA处理均显著提高了藻体的PE和PC含量,但0.5 mg·L-1IAA在显著提高藻体的SGR时,并没有明显增加PE和PC含量。此外,0.5、1.0、2.0 mg·L-1KT都可以明显加快藻体生长,其PE和PC含量也增加,却以0.5 mg·L-1KT处理组的PE和PC合成量最高,而不是保持藻体最快生长的1.0 mg·L-1KT处理组。这说明自由丝状体的SGR与藻胆蛋白的合成量并非完全正相关,可能是藻胆蛋白不是藻体光合作用中的主要参与者,而是以一种捕光色素蛋白辅助其光合反应,其光合效率主要由叶绿素所决定[29]。其次,植物生长调节剂的作用主要是促细胞分裂和生长,即主控数量或体积变化,但并不一定直接作用某些营养成分的生成,藻胆蛋白的合成也可能另由其它信号调节[27-28]。目前,红藻和蓝藻是从大型海藻中提取藻胆蛋白的主要原材料,坛紫菜作为目前我国主要的红藻养殖品种之一,其自由丝状体所含有的藻胆蛋白在食品色素、海洋药物及高端化妆品添加剂等领域的应用潜力巨大[7]。因此在室内条件下外源添加适宜质量浓度的IAA(2.0 mg·L-1)和KT(0.5 mg·L-1)可以有效提高坛紫菜自由丝状体的生长速率和生物量,也有利于提高藻体的藻胆蛋白含量及其利用价值。
[1] 曾呈奎,王素娟,刘思俭,等. 海藻栽培学[M].上海:上海科学技术出版社,1985:55-121. ZENG C K,WANG S J,LIU S J,etal. Cultivation of Seaweed[M]. Shanghai: Shanghai Science and Technology Press,1985:55-121.
[2] 严兴洪,李 琳,陈俊华,等. 坛紫菜的单性生殖与遗传纯系分离[J]. 高技术通讯,2007, 17(2): 205-210. YAN X H,LI L,CHEN J H,etal. Parthenogenesis and isolation of genetic pure strains inPorphyrahaitanensis(Bangiales,Rhodophyta)[J]. High Technology Letters,2007,17(2): 205-210.
[3] 汤晓荣,费修绠. 光温与坛紫菜自由丝状体生长发育的关系[J]. 海洋与湖沼, 1997, 28 (5): 475-482. TANG X R,FEI X G. Relationship between light,temperature and growth development of conchocelis ofPorphyrahaitanensis[J]. Oceanologia Et Limnologia Sinica,1997,28(5): 475-482.
[4] 陈国宜. 关于坛紫菜自由丝状体的培养和直接采苗的研究[J].水产学报,1980(1):19-29. CHEN G Y. A study on the culture of free-living filaments and direct spore-collecting ofPorphyrahaitanensis[J]. Journal of Fisheries of China,1980(1):19-29.
[5] 孙霂清,李 琳,刘长军,等. 坛紫菜自由丝状体移植育苗的初步研究[J].上海海洋大学学报,2012,21(5):709-714. SUN M Q,LI L,LIU C J,etal. Study on conchocelis seeding with transplanting free-living conchocelis inPorphyrahaitanensis(Bangiales,Rhodophyta)[J]. Journal of Shanghai Ocean University,2012,21(5):709-714.
[6] 宋武林. 坛紫菜新品系申福1、2号规模化养殖技术研究[J].福建水产,2010,26(4):29-34. SONG W L. Research on cultivation technology for new lines of Porphyra haitanensis[J]. Journal of Fujian Fisheries,2010,26(4):29-34.
[7] NIU J F,WANG G C,ZHOU B C,etal. Purification of R-phycoerythrin fromPorphyrahaitanensis(Bangiales,Rhodophyta) using expanded-bed absorption[J].Journal of Phycology,2007,43(6):1339-1347.
[8] 杨秀荣,刘亦学,刘水芳,等. 植物生长调节剂及其研究与应用[J].天津农业科学,2007 (1):23 -25. YANG X R,LIU Y X,LIU S F,etal. Study and application on plant growth regulators[J]. Tianjin Agricultural Sciences,2007(1):23-25.
[9] 牟晓真,范 晓,韩丽君,等. 藻类中植物生长素的研究[J].海洋科学集刊,2000(42):65-73. MU X Z,FAN X,HAN L J,etal. Reviews of research on auxins in algae[J]. Studia Marina Sinica,2000(42):65-73.
[10] 庄 岩,戴继勋,崔竞进,等. 四种植物生长激素对海带雌配子体克隆生长发育的影响[J].青岛海洋大学学报,1999,29(2):260-264. ZHUANG Y,DAI J X,CUI J J,etal. Effect of four kinds of plant hormones on the growth and development of female gametophytes ofLaminariajaponica[J]. Journal of Ocean University of Qingdao,1999,29(2):260-264.
[11] 时艳侠,张学成,孟 振,等. 植物生长调节剂对冈村枝管藻盘状体生长发育的影响[J].海洋科学,2008,32(4):1-4. SHI Y X,ZHANG X C,MENG Z,etal. The effect of plant growth regulator on the growth of discoid ofCladosiphonokamuranusTokida[J]. Marine Science,2008,32(4):1-4.
[12] 陈素文,吴进锋,陈利雄,等. 三十烷醇对海萝孢子萌发、幼苗及藻体生长的影响[J].华南农业大学学报,2011,32(1):78-82. CHEN S W,WU J F,CHEN L X,etal. The effect of triacontanol on the germination of spore and the growth of germling and frond ofGloiopeltisfurcata[J]. Journal of South China Agricultural University,2011,32(1):78-82.
[13] YOKOYA N S,WEST J A,LUCHI A E. Effects of plant growth regulators on callus formation,growth and regeneration in axenic tissue cultures ofGracilariatenuistipitataandGracilariaperplexa(Gracilariales,Rhodophyta)[J]. Phycological Research,2004(52): 244-254.
[14] SALAMA E,KABRA A N,JI M K,etal. Enhancement of microalgae growth and fatty acid content under the influence of phytohormones[J]. Bioresource Technology,2014(172): 97-103.
[15] 杨 凯,史全良. 不同浓度IAA对微藻TH6(Oedocladiumsp.)生长及脂肪酸含量的影响[J]. 植物资源与环境学报,2009,18(2):80-83,96. YANG K,SHI Q L. Effects of different concentrations of IAA on the growth and fatty acid content of microalgae TH6 (Oedocladiumsp.)[J]. Journal of Plant Resources and Environment, 2009,18(2):80-83,96.
[16] RAPOSO M F J,MORAIS RMSC. Influence of the growth regulators kinetin and 2,4-D on the growth of two chlorophyte microalgae,HaematococcuspluvialisandDunaliellasalina[J]. Journal of Basic & Applied Sciences,2013(9):302-308.
[17] 王 萍,张建伟,刘 蜀,等. 3种植物生长调节剂对培养基中坛紫菜叶状体组织块生长的影响[J]. 应用海洋学学报,2013,32(4):563-567. WANG P,ZHANG J W,LIU S,etal. Effects of three plant growth regulators on the growth of thallus tissue blocks ofPorphyrahaitanensis[J]. Journal of Applied Oceanography,2013, 32(4):563-567.
[18] 张亚萍,于文功,戴继勋,等. 植物激素在条斑紫菜原生质体固体培养中的作用[J]. 海洋湖沼通报,2002(4):56-62. ZHANG Y P,YU W G,DAI J X,etal. Some effects of phytohormone in the solid culture ofPorphyrayezoensisprotoplasts[J]. Transactions of Oceanology and Limnology,2002 (4):56-62.
[19] 张欢欢,李 琳,严兴洪. 三十烷醇对坛紫菜叶状体生长的影响[J].上海海洋大学学报, 2013,22(6):876-881. ZHANG H H,LI L,YAN X H. The effect of triacontanol on the growth of gametophytic blades inPyropiahaitanensis[J]. Journal of Shanghai Ocean University,2013,22(6): 876-881.
[20] ROBERT J PORRA. The chequered history of the development and use of simultaneous equations for the accurate determination of chlorophyllsaandb[J]. Photosynthesis Research,2002,73(1):149-156.
[21] PARSONS T R,STRICKLAND J D H. Discussion of spectrophotometric determination of marine-plant pigments,with revised equation for ascertaining chlorophylls and carotenoids [J]. Journal of Marine Research,1963,21(3):155-163.
[22] BEER S,ESHEL A. Determining phycoerythrin and phycocyanin concentrations in aqueous crude extracts of red algae[J]. Australian Journal of Marine and Freshwater Research,1985, 36(6):785-792.
[23] 汪芳俊,侯赛男,徐年军,等. 藻类植物激素研究进展[J]. 植物生理学报,2015,51(12): 2083-2090. WANG F J,HOU S N,XU N J,etal. Research progress on the phytohormone in algae[J]. Plant Physiology Journal,2015,51 (12):2083-2090.
[24] EVANS L V,TREWAVAS A J. Is algal development controlled by plant growth substances [J]. Journal of Phycology,1991,27(3):322 -326.
[25] 熊国胜,李家洋,王永红. 植物激素调控研究进展[J].科学通报,2009,54(18):2718-2733. XIONG G S,LI J Y,WANG Y H. Advances in the regulation and crosstalks of phytohomones[J]. Chinese Science Bulletin,2009,54(18):2718-2733.
[26] 李敦海,刘永定,宋立荣,等. 藻类与植物生长物质[J].水生生物学报,1999, 23(5):524-532. LI D H,LIU Y D,SONG L R,etal. Algae and plant growth substances[J]. Acta Hydrobiologica Sinica,1999,23(5):524-532.
[27] KATO M,ARUGA Y. Comparative studies on the growth and photosynthesis of the pig mentation mutants ofPorphyrayezoensisin laboratory culture[J]. Japan Journal of Phycology,1984(32):333-347.
[28] HAGEN G. The control of gene expression by auxin// DAVIES,P. J. (Ed) Plant Hormones Physiology,Biochemistry and Molecular Biology[M]. Dordrecht:Kluwer Academic Publishers,1995:228-245.
[29] 李映霞. 三种红藻光合作用色素系统的比较研究[D]. 青岛:中国科学院研究生院(海洋研究所),2007. LI Y X. Comparative study of pigmentary system of photosynthesis on three red algae[D]. Qingdao: Graduate University of Chinese Academy of Sciences (Marine Research Institute), 2007.
Effects of three plant growth regulators on the growth and photosynthetic pigment contents of free-living filaments ofPyropiahaitanensis
ZHONG Chen-hui1,2,LIN Qi1,2,ZHANG Peng3,HUANG Rui-fang1,LIN Xiang-yang1,LIU Yan-fei4
(1.FujianFisheriesResearchInstitute,Xiamen361013,China; 2.FujianKeyLaboratoryofCultivationandHigh-valueUtilizationofMarineOrganisms,Xiamen361013,China;3.ZhejiangMaricultureResearchInstitute,Wenzhou325005,China; 4.FujianFisheriesTechnicalExtensionCenter,Fuzhou350003,China)
The effects of three plant growth regulators, indole-3-acetic acid(IAA), 2,4-dichlorophenoxyacetic acid(2,4-D) and kinetin(KT), with concentrations of 0.0, 0.5,1.0,2.0,4.0, 6.0 and 10.0 mg·L-1acting as the treatments in a single factorial comparative experiment, on the growth and photosynthetic pigment contents of free-living filaments inPyropiahaitanensiswas studied. The results showed that compared to the control group low concentrations of IAA (0.5~4.0 mg·L-1) and KT (0.5~2.0 mg·L-1) had apparent influences on the specific growth rate of filaments, and the most obvious effects were observed in 2.0 mg·L-1IAA and 1.0 mg·L-1KT group,whose algal biomass were 0.90 and 0.52 time higher than those of the control group after 25 d culture,respectively (P<0.05). However, the high concentrations of IAA and KT (6.0~10.0 mg·L-1) significantly inhibited the growth of filaments (P<0.05). After 25 d culture,compared to the control group,both 2.0 mg·L-1IAA and 1.0 mg·L-1KT significantly stimulated synthesis of Chlorophyll α (Chla) and Carotenoids (Car),and the contents of Chlaincreased by 23.7% and 23.8%, respectively. While the contents of Car increased by 31.0% and 28.6%,respectively (P<0.05). Whereas,high concentrations of IAA and KT (6.0~10.0 mg·L-1) significantly reduced the contents of Chla,presenting as the treated concentration higher,the Chlasynthesis less. In additional, low concentrations of IAA (1.0~2.0 mg·L-1) treatmeat significantly increased the contents of Phycoerythrin (PE) and Phycocyanin (PC),which were highest in 2.0 mg·L-1IAA group,and increased by 59.1% and 45.7%,respectively (P<0.05). Meanwhile,low concentrations of KT (0.5~2.0 mg·L-1) resulted in massive synthesis of the PE and PC,which were the highest in 0.5 mg·L-1KT group,and increased by 48.4% and 50.5%,respectively (P<0.05). While high concentrations of IAA and KT (6.0~10.0 mg·L-1) significantly reduced the contents of PE and PC (P<0.05). But 2,4-D treatments had no apparent influence on the growth and synthesis of photosynthetic pigments.
Pyropiahaitanensis; free living conchocelis; plant growth regulators; growth; photosynthetic pigment
1004-2490(2017)02-0216-09
2016-06-27
福建省种业创新与产业化工程项目(2014S1477-10);福建省自然科学基金(2014J01095);福建省海洋高新产业发展专项 (闽海洋高新2014-19);福建省海洋与渔业结构调整专项;福建省海洋经济创新发展区域示范项目(2014FJPT01);厦门南方海洋研究中心资助项目(15GZY021NF04、14PZY017NF17);浙江省科技计划资助项目(2016F50033)
钟晨辉(1984-),男,助理研究员,博士研究生,主要从事藻类生理生态学与遗传育种学研究。 E-mail:zhongchenhui@126.com
S 968.43
A

