SMAD6在Aβ诱导的神经毒性病变中的表达变化
张莹洁 安娜
SMAD6在Aβ诱导的神经毒性病变中的表达变化
张莹洁 安娜
目的 探讨母抗Dpp小同源物6 (small mothers against decapentaplegic homolog 6,SMAD6)在β淀粉样蛋白(amyloid β,Aβ)诱导的神经毒性病变中的表达变化。 方法 取孕15~17 d的SD大鼠的胎鼠,进行海马神经元原代培养,经不同浓度(10、15、20 μ mol/L)Aβ25-35毒性片段处理后,通过定量PCR技术检测SMAD6 mRNA表达水平。取2月龄SD雄性大鼠12只,随机分为Aβ注射组和空白对照组,每组6只。采用双侧基底前脑注射Aβ1-40建立大鼠痴呆模型,通过免疫组化及免疫印迹检测基底前脑及海马区SMAD6蛋白表达水平。结果 不同浓度Aβ25-35处理组海马神经元内SMAD6 mRNA表达均较对照组减少(F=602.1,P<0.01)。免疫组化结果显示,与对照组比较,Aβ1-40注射组大鼠基底前脑区SMAD6蛋白表达减少(68103±1520比96036±1804;t=20.51,P<0.01),而海马区其表达增多(96441±1852比55039±1528;t=29.87,P<0.01);免疫印迹结果显示,与对照组比较,Aβ1-40 注射组大鼠基底前脑区SMAD6蛋白表达减少(0.1042±0.0067比1.000±0.0986;t=15.69,P<0.01),而海马区其表达增多(12.5525±2.6803比1.000±0.0135;t=7.465,P<0.01)。结论 Aβ可直接下调神经元内SMAD6 mRNA转录及表达,不同脑区内SMAD6蛋白表达可能受负反馈调节机制影响。
阿尔茨海默病;母抗Dpp小同源物6;骨形态发生蛋白质;β淀粉蛋白
阿尔茨海默病(Alzheimer disease,AD)是一种进展性神经变性疾病,65岁以上患病率达5%,85岁以上达20%,病残、病死率高[1]。AD的主要病理特征为β淀粉样蛋白(amyloid β protein,Aβ)形成老年斑沉积和异常细胞骨架形成神经原纤维缠结[2]。Aβ具有强神经毒性,在导致大量神经元变性和坏死之前可先引起神经突触损伤,进而引起认知功能障碍[3]。母抗Dpp小同源物(small mothers against decapentaplegic homolog,SMAD)与骨形态发生蛋白(bone morphogenetic protein,BMP)同属转化生长因子β(transforming growth factor β,TGFβ)超家族中的重要成员,参与调节细胞生长、分化、凋亡等过程,由8种不同的蛋白构成整个SMAD家族,通过可逆磷酸化对多种信号传导通路进行调节[4]。SMAD6作为一种抑制性SMAD蛋白,通过减少SMAD2和SMAD5磷酸化,与SMAD4竞争,从而抑制TGFβ/BMP信号通路[5]。作者团队前期研究发现BMP蛋白在Aβ毒性病变中具有神经保护作用[6-7],而作为BMP下游通路中抑制性蛋白SMAD6在Aβ毒性病变中的作用尚不明确。本研究利用原代培养海马神经元和痴呆大鼠模型探讨了SMAD6在Aβ毒性病变中的表达变化以及潜在的作用。
1 材料和方法
1.1 实验动物 采用Sprague-Dawley(SD)雄性大鼠16只,2月龄,体质量200~220 g。购自中国科学院上海实验动物中心,饲养于中国科学院药物研究所实验动物中心(清洁级环境),动物的使用符合上海市动物管理委员会管理条例。将SD大鼠随机分为Aβ注射组和空白对照组,每组8只。
1.2 主要试剂和仪器 Aβ25-35和阿糖胞苷购自美国Sigma公司,Trizol试剂购自于美国Invitrogen 公司。SMAD6抗体(sc-13048)购自于美国Santa Cruz公司。所有化学试剂均为分析级。大鼠立体定向仪、微量推进器、颅骨钻购自美国BAS公司。1 μL微量注射器及手术器械购自上海医疗器械公司。Morris水迷宫图像自动采集和处理系统由中国科学院药物研究所提供。垂直电泳槽、电转移电泳槽购自于美国BioRad公司。
1.3 方法
1.3.1 建立大鼠胆碱能神经元损伤模型:按文献[6]方法向大鼠双侧基底前脑Meynert神经核注射Aβ进行造模。以10%(质量浓度)水合氯醛麻醉大鼠,固定于BAS立体定向仪上,将齿棒定为-2.4 mm。前囟后1.4~1.6 mm,旁开2.5 mm,钻颅缓慢进针深度7 mm。Aβ注射组采用1 μL的微量注射器和微量推进器在双侧基底前脑Meynert核各注射Aβ1-40(10 μg/μL,Sigma公司)1 μL,注射时间10 min,注射完毕后,针停留5 min,缓慢拔出,然后以同样方法注射另一侧[8-9]。对照组采用等剂量的PBS溶液进行注射,方法同上。手术后第11天开始进行水迷宫试验训练,经过5 d水迷宫训练后,采集入水后寻找到平台的时间。造模成功标准以及水迷宫试验结果作者团队前期研究,造模成功率100%[6]。水迷宫试验后取大鼠海马和基底前脑组织冻存备用。
1.3.2 原代海马神经元培养:取孕15~17 d的SD大鼠1只(购自中国科学院上海实验动物中心),无菌条件下取胎鼠海马,以0.125%(质量浓度)胰蛋白酶消化,加入10%(体积分数)胎牛血清培养基终止消化,吸管吹打组织20次,收集细胞悬液,接种于多聚赖氨酸包被的培养板中,放入培养箱,24 h后换不含血清的培养液(1%谷氨酸盐+2% B27+97% Neurobasal,Gibco公司),48 h后加阿糖胞苷,作用24 h后全量换液,此后每3 d半量换液。于培养7~10 d,神经元纯度达到80%~90%后用于下一步实验。
1.3.3 提取与扩增SMAD6 mRNA:将Aβ25-35溶解于0.1%(质量浓度)三氟乙酸溶液中,配成1 mmol/L储存液,临用前置于37 ℃孵箱中孵育3 d进行老化处理,使可溶性Aβ聚集成不溶性Aβ。将培养的原代海马神经元随机分为4组,分别用不同浓度Aβ25-35处理海马神经元,使Aβ25-35终浓度分别为10、15、20 μmol/L;另设立阴性对照,添加等量三氟乙酸溶液。孵育24 h后采用总RNA提取(total RNA isolation,TRIzol)法提取总RNA。实验步骤严格按Realtime PCR试剂盒说明书进行(Takara公司)。用Bio-Rad定量PCR仪(Bio-Rad公司)设置预变性95℃ 10 s,PCR反应95℃ 5 s,依据相应的退火温度持续30 s,循环40次。SMAD6和β-actin cDNA基因全长由Pubmed Genebank查得,委托上海生物工程公司代为设计并合成。PCR扩增引物如下:SMAD6:上游:5′-CGGGAGAACAGGGTATGA-3′,下游:5′-CAGGCTGGAAGGAGAAGAT-3′; β-actin:上游:5′-AACCCTAAGGCCAACCGTGAAAAG-3′,下游:5′-TCATGAGGTAGTCTGTCAGGT-3′。SMAD6片段长度为149 kp,退火温度54℃;β-actin片段长度241 kp,退火温度60℃。PCR产物含量依据2-△△Ct计算(其中Ct值代表每个反应管内的荧光信号到达设定的域值时所经历的循环数)。每个实验独立重复3次,取均数。
1.3.4 免疫印迹分析:取Aβ注射组和空白对照组各3只大鼠冻存大脑组织,研磨制备匀浆。采用Bradford法检测蛋白浓度,细胞蛋白提取物在SDS-PAGE凝胶上进行电泳,采用湿转法转膜,转膜结束后,丽春红及考马斯亮蓝染色。聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜浸入5%(质量浓度)脱脂奶粉的TBST室温封闭。一抗为兔抗大鼠SMAD6(1∶500)或β-actin抗体(1∶2000,Abcam公司),二抗为HRP标记的山羊抗兔抗体(1∶500,碧云天公司),通过电化学发光(electro-chemical luminescence,ECL)试剂盒发光显影。采用Bio-Rad2000型凝胶成像系统将光片在白光下扫描后,应用Quantity One软件(Bio-Rad公司)进行灰度扫描分析。各组SMAD6相对含量以SMAD6条带灰度值与各自β-actin灰度扫描值的比值表示,并设对照组。计算Aβ处理组SMAD6相对蛋白含量与对照组的比值。每个实验独立重复3次,结果取均数。
1.3.5 免疫组化:取Aβ注射组和空白对照组各3只大鼠脑组织进行免疫组化试验,依据SP试剂盒说明书(Santa Cruz公司)步骤操作。石蜡切片(10 μm)常规脱蜡,30%(体积分数)H2O2室温下持续孵育切片10 min,以灭活内源性酶,之后切片上滴加正常山羊血清封闭液,室温下持续孵育30 min。滴加稀释好的兔抗大鼠SMAD6一抗 (1∶500,Abcam公司),4℃过夜。滴加生物素化山羊抗兔二抗(1∶500,碧云天公司),37℃ 20 min后PBS冲洗,DAB显色。细胞核内呈明确棕色染色者即为SMAD6阳性细胞,蓝色染色为SMAD6阴性细胞。选取同一染色条件下的6~7张切片,每张切片随机取100个细胞,将图像摄入计算机,使
用IMS图像分析系统(Nikon公司)设定基础统计面积,分别调定背景、阴性细胞、阳性细胞,通过计算机自动分析,得出阳性表达面积及阳性强度均值,按下列公式计算SMAD6表达阳性指数:阳性指数=阳性表达面积×阳性强度均值。阳性指数越高表示目标蛋白表达越高。每个实验独立重复3次。
1.4 统计学处理 采用GraphPad Phrism 5软件进行分析,对数据进行正态性和方差齐性检验,符合正态分布的计量资料以均数±标准差表示,多组均数间比较采用单因素方差分析,两两比较采用Bonferroni检验,两均数间比较采用独立样本t检验。取α=0.05。
2 结果
2.1 各组大鼠原代海马神经元SMAD6 mRNA转录水平 10、15、20 μmol/L Aβ处理组以及对照组原代海马神经元SMAD6 mRNA表达水平分别为0.1286±0.0050、0.0675±0.0046、0.0189±0.0033、1.0000±0.0654,各组间其表达水平比较差异有统计学意义(F=602.1,P<0.01)。与对照组比较,不同Aβ浓度组海马神经元SMAD6 mRNA表达水平均降低(均P<0.01)。
2.2 各组大鼠不同脑区SMAD6蛋白表达 (1)免疫印迹分析:与对照组相比,Aβ1-40注射组大鼠基底前脑区SMAD6蛋白表达降低(P<0.01),而海马区其表达升高(P<0.01)。(2)免疫组化:与对照组相比,Aβ1-40注射组基底前脑区内SMAD6阳性细胞减少(P<0.01),而海马区则增多(P<0.01)。结果见表1、图1~2。
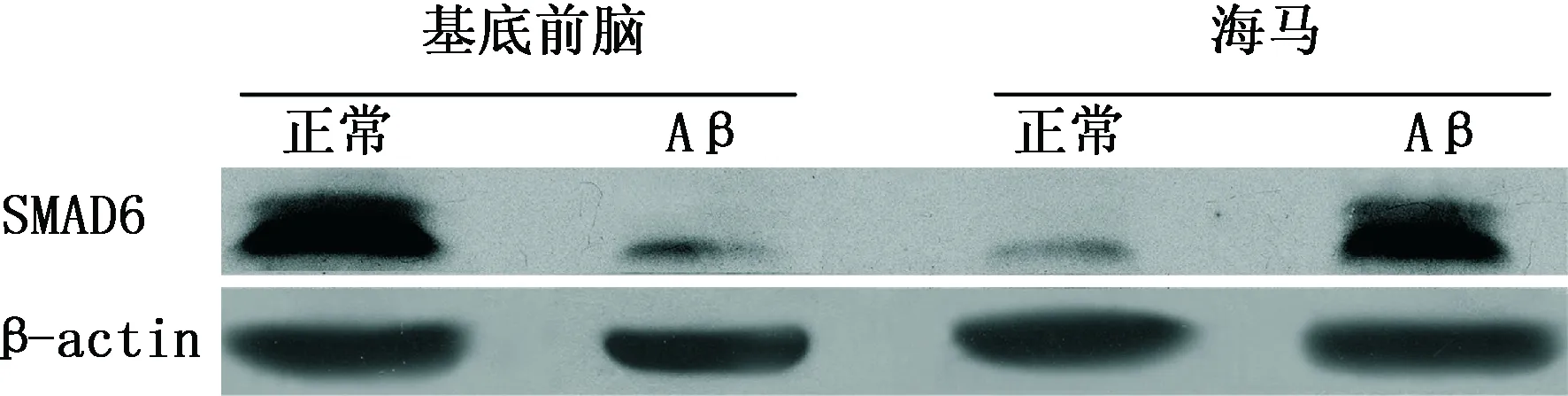
图1 各组SD大鼠不同脑区SMAD6蛋白表达变化(免疫印迹法)
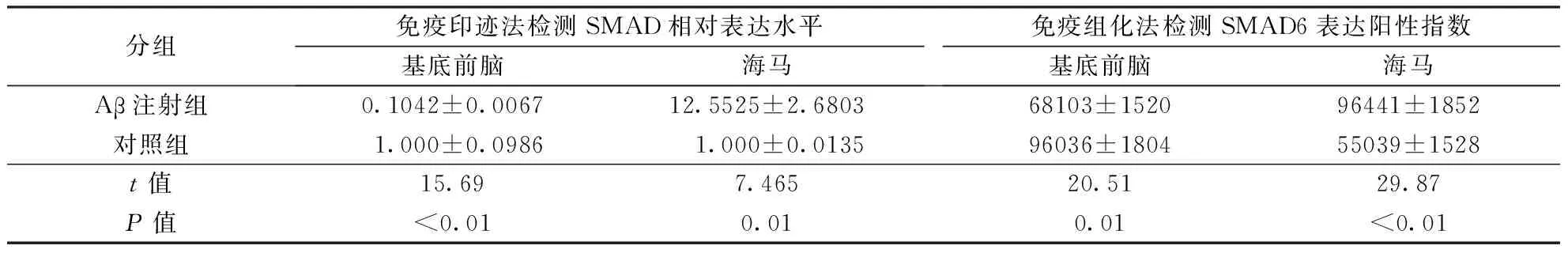
分组免疫印迹法检测SMAD相对表达水平基底前脑海马免疫组化法检测SMAD6表达阳性指数基底前脑海马Aβ注射组0.1042±0.006712.5525±2.680368103±152096441±1852对照组1.000±0.0986 1.000±0.013596036±180455039±1528t值15.697.46520.5129.87P值<0.010.010.01<0.01
注:SMAD6:母抗Dpp小同源物6; Aβ:β淀粉样蛋白。图1、2同

注:A:正常组基底前脑;B:Aβ注射组基底前脑;C:正常组海马;D:Aβ注射组海马 图2 各组SD大鼠不同脑区SMAD6阳性细胞(红色箭头所示)表达比较(蓝色箭头所示为SMAD6阴性细胞;免疫组化,×200)
3 讨论
AD是以渐进性的学习、记忆、行为和人格障碍为主要临床特征的神经精神疾病,Aβ在脑内的沉积是其最典型的病理特征,Aβ具有神经毒性,通过产生氧化应激、代谢压力和兴奋性毒性诱导神经元损害[10]。BMPs最初为软骨内骨形成的诱导剂和骨代谢的调节剂,由胞浆分泌后进入细胞间隙,与细胞膜上的BMPs受体(bone morphogenetic protein receptor,BMPR)相结合,激活BMP下游信号,包括经典的SMAD及非经典的LIM激酶1(LIM kinase 1,LIMKl)等。SMAD6是一种抑制性SMAD蛋白,可竞争性地结合I 型BMPR或SMAD4蛋白,从而抑制SMAD1/5/8磷酸化或者核转移,从而下调BMP信号系统[11]。 本研究选择10、15和20 μ mol/L浓度的Aβ25-35处理培养7 d的海马神经元,结果显示Aβ25-35直接处理海马神经元可导致SMAD6 mRNA转录减少;进一步采用Aβ1-40注射建立胆碱能神经元损伤模型,通过免疫组化和免疫印迹方法检测基底前脑区和海马区SMAD6蛋白的表达情况,结果显示,Aβ1-40对基底前脑区神经元产生直接神经毒性,导致SMAD6蛋白表达降低,这与Aβ25-35直接作用于原代海马神经元导致SMAD6 mRNA表达水平降低的实验结果相一致,提示Aβ可直接引起SMAD6 mRNA转录和蛋白表达降低。作者课题组前期研究应用水迷宫试验证实,Aβ1-40双侧注射大鼠基底前脑区可导致大鼠产生记忆认知功能障碍[6],Aβ可导致SMAD6的上游通路BMP6、BMP7及BMP4蛋白含量下降[6-7],而作为BMPs下游通路中的负性调节蛋白,SMAD6蛋白水平与上诉3种蛋白的变化一致,似乎是一个矛盾的结果。Mouillesseaux 等研究结果显示,BMP2可诱导SMAD6蛋白表达增加,当BMPs信号通路打开时,通过SMAD途径和非SMAD途径影响遗传物质的转录[11]。经典的SMAD途径最终可以作用于细胞核,影响BMPs的负性调节蛋白SMAD6的基因转录,当BMPs信号通路增强时,SMAD6的转录和表达会随之增强。BMPs诱导的SMAD6蛋白增加是BMPs信号通路的负反馈调节机制之一:SMAD6可抑制SMAD1/5/8蛋白与共享SMAD4蛋白形成复合体;同时SMAD6可抑制非SMAD通路中转化生长因子激活激酶1-丝裂原活化蛋白激酶(TGF activated kinase 1-mitogen activated protein kinase, TAK1-MAPK)信号途径;SMAD6还可促进BMPR的降解[11-12]。SMAD6作为BMPs的下游信号,伴随BMPs的变化而变化,从而起到负反馈平衡的作用。BMPs信号途径除SMA6外,还存在多种调节因子,包括BMPs拮抗剂noggin、chordin、follistatin等以及抑制性SMAD7蛋白和SMAD磷酸酶,它们均在不同传导通路上发挥作用[13-14],SMAD6是经典的SMAD信号途径在细胞核内诱导产生的抑制性SMAD蛋白,不仅与BMPs同步变化,而且在维持BMPs信号稳定上有重要作用。上述研究结果提示,在一定强度和时间范围内的Aβ毒性刺激可以激发BMPs/SMAD6信号通路的自我调节功能。中枢神经系统具有双向联系的特征,基底前脑和海马区之间正是具有双向投射纤维[15],这可以解释海马区SMAD6蛋白表达升高的原因。基底前脑胆碱能系统包括腹侧纹状体、杏仁核、Meyner核、隔核及斜方体,隔核海马胆碱能投射纤维终止于海马区神经元。同时,海马区神经纤维元投射到隔阂的外侧区和内侧区,从而反馈海马区的信息[16]。本研究采用Aβ1-40注射基底前脑区建立大鼠模型,其海马区SMAD6蛋白表达升高,推测海马区SMAD6蛋白上调是由于基底前脑区SMAD6下调的负反馈。基底前脑区神经元受到Aβ1-40的毒性攻击,使该区域神经元受损严重,可直接导致细胞内合成SMAD6的功能下降。本实验中Aβ注射区为基底前脑,海马区未直接受到Aβ毒性攻击,与基底前脑区相比,海马区受毒性攻击的程度和时间均会削弱,同时结合脑区间存在双向调节作用,故作者推测海马区SMAD6因负反馈而代偿性增多。本研究结果与既往研究BMP6/BMP7/BMP4在AD病变中作用的结果相似,均表明存在海马区与基底前脑区的双向负反馈调节[6-7,17]。
综上所述,本研究结果显示,Aβ可诱导原代培养神经元内SMAD6 mRNA转录的下降,诱导大鼠注射区-基底前脑内SMAD6蛋白表达下调,提示SMAD6可能参与AD病变;基底前脑和海马区SMAD6蛋白的表达可通过负反馈的方式进行自我调节,这为研究AD发病机制提供了一种潜在的思路。
[1]Jack CR Jr, Knopman DS, Jagust WJ, et al. Hypothetical model of dynamic biomarkers of the Alzheimer’s pathological cascade [J]. Lancet Neurol, 2010, 9 (1): 119-128.
[2]Tamayev R, Matsuda S, Arancio O, et al. β- but not γ-secretase proteolysis of APP causes synaptic and memory deficits in a mouse model of dementia [J]. EMBO Mol Med, 2012, 4 (3): 171-179.
[3]Davis RC, Marsden IT, Maloney MT, et al. Amyloid beta dimers/trimers potently induce cofilin-actin rods that are inhibited by maintaining cofilin-phosphorylation [J]. Mol Neurodegener, 2011, 6 (24): 10.
[4]庞莉,王晶,蒋延文.Smad蛋白研究进展[J].中国医学创新,2013,10(12):155-158.
[5]Hayashi Y, Hsiao EC, Sami S, et al. BMP-SMAD-ID promotes reprogramming to pluripotency by inhibiting p16/INK4A-dependent senescence [J]. Proc Natl Acad Sci U S A,2016, 113(46): 13057-13062.
[6]Sun L, Guo C, Liu D, et al. Protective effects of bone morphogenetic protein 7 against amyloid-beta induced neurotoxicity in PC12 cells [J]. Neuroscience, 2011, 184(1): 151-163.
[7]Sun L, Guo C, Wang T, et al. LIMK1 is involved in the protective effects of bone morphogenetic protein 6 against amyloid-β-induced neurotoxicity in rat hippocampal neurons [J]. J Alzheimers Dis, 2014, 42 (2): 543-554.
[8]Bao XM, Shu SY. The rat brain in stereotaxic coordinates [B]. Beijing: People’s Medical Publishing House, 1991.
[9]Bishop KM. Therapeutic potential of CERE-110(AAV2- NGF): targeted, stable, and sustained NGF delivery and trophic activity on rodent basal forebrain cholinergic neurons [J]. Exp Neurol, 2008, 211 (2): 574-584.
[10]Annunziata I, Patterson A, Helton D, et al. Lysosomal NEU1 deficiency affects amyloid precursor protein levels and amyloid-β secretion via deregulated lysosomal exocytosis [J]. Nat Commun, 2013, 4 (1): 2734.
[11]Mouillesseaux KP, Wiley DS, Saunders LM, et al. Notch regulates BMP responsiveness and lateral branching in vessel networks via SMAD6 [J]. Nat Commun, 2016, 11(7):13247.
[12]Lee YS, Park JS, Jung SM, et al. Inhibition of lethal inflammatory responses through the targeting of membrane-associated Toll-like receptor 4 signaling complexes with a Smad6-derived peptide [J]. EMBO Mol Med, 2015, 7(5):577-592.
[13]Brazil DP, Church RH, Surae S, et al. BMP signalling: agony and antagony in the family [J]. Trends Cell Biol. 2015, 25(5):249-264.
[14]Fortini BK, Tring S, Plummer SJ, et al. Multiple functional risk variants in a SMAD7 enhancer implicate a colorectal cancer risk haplotype [J]. PLoS One,2014, 9(11):e111914.
[16]Gyengesi E, Andrews ZB, Paxinos G, et al. Distribution of secretagogin-containing neurons in the basal forebrain of mice, with special reference to the cholinergic corticopetal system [J]. Brain Res Bull, 2013, 94 (5):1-8.
[17]安娜、孙琳.股形态发生蛋白4在Aβ诱导的神经毒性病变中的表达变化[J].中国神经免疫学和神经病学杂志,2015,22(4):233-236.
(本文编辑:时秋宽)
The change of SMAD6 expression in Aβ-induced neurotoxicity
ZHANGYingjie,ANNa*.
*ShanghaiMentalHealthCenter,ShanghaiJiaotongUniversity,SchoolofMedicine,Shanghai200030,China
Corresponding author: AN Na, Email: nanaan1978@126.com
Objective To investigate the change of small mothers against decapentaplegic homolog 6(SMAD6) expression in amyloid β(Aβ)- induced neurotoxicity. Methods 15-17 days of pregnant SD mice were used for the experiment. Hippocampal neurons from the brain of fetal rats were treated with different concentrations of Aβ25-35 (10,15,20 μmol/L) for 24 h. The mRNA level of SMAD6 in rat hippocampal neurons after Aβ25-35 treatment was assayed through Realtime PCR. Twelve SD rats with the age of 2 months old and the weight of 200~220 g, were divided into an Aβ injection group and a control group.Invivo, Aβ 1-40 was bilaterally injected into the basal forebrain to simulate neuropathological processes of Alzheimer’s disease (AD), and the levels of SMAD6 protein were explored in the regions of basal forebrain and hippocampus. Results Result of Realtime PCR showed that the levels of SMAD6 mRNA in the Aβ group significantly decreased compared with the control group(F=602.1,P<0.01). Immunohistochemisty results showed that SMAD6 protein was significantly decreased in the Aβ group relative to the control group in the basal forebrain(68103±1520vs. 96036±1804;t=20.51,P<0.01), while there was an opposite change in the hippocampus(96441±1852vs. 55039±1528;t=29.87,P<0.01). Western blot results showed that SMAD6 protein was significantly decreased in the Aβ group relative to the control group in the basal forebrain(0.1042±0.0067vs. 1.000±0.0986;t=15.69,P<0.01), while there was an opposite change in hippocampus(12.5525±2.6803vs. 1.000±0.0135;t=7.465,P<0.01). Conclusions Aβ directly down-regulates SMAD6 expression, and there may be negative feedback regulation of SMAD6 among different brain regions.
Alzheimer’s disease; small mothers against decapentaplegic homolog 6; bone morphogenetic proteins; amyloid beta protein
10.3969/j.issn.1006-2963.2017.03.008
100088首都医科大学附属北京安定医院13病区(张莹洁);200030上海交通大学医学附属精神卫生中心老年科(安娜)
安娜,Email:nanaan1978@126.com
R749.1
A
1006-2963(2017)03-0183-05
2016-09-04)

