重症肌无力患者外周血AIRE、Tfh细胞和Tfr细胞与病情严重性相关分析
王圣元 张慜 李柱一 赵思佳 杨永祥
重症肌无力患者外周血AIRE、Tfh细胞和Tfr细胞与病情严重性相关分析
王圣元*张慜*李柱一 赵思佳 杨永祥
目的 探讨自身免疫性调节因子(AIRE)、滤泡辅助性T(Tfh)细胞和滤泡调节性T(Tfr)细胞与重症肌无力(MG)患者病情严重程度的相关性。方法 收集2015-12—2016-4第四军医大学唐都医院收治的MG患者22例,根据临床表现分为全身型MG(GMG)和眼肌型MG(OMG);同期选取健康体检中心查体者10名作为健康对照。收集MG患者详细临床资料,包括美国MG协会(MGFA)分型及定量MG(QMG)评分。通过流式细胞术分析AIRE阳性细胞比例及Tfh/Tfr比值。结果 (1)AIRE表达在各组间比较差异具有统计学意义(P<0.01)。GMG组和OMG组AIRE表达均较对照组降低(P<0.01,P<0.05),而GMG组与OMG组间比较差异无统计学意义(P>0.05)。(2)Tfh/Tfr比值在各组间比较差异具有统计学意义(P<0.01)。GMG组和OMG组Tfh /Tfr比值均高于对照组(P<0.01,P<0.05),且GMG组高于OMG组(P<0.05)。(3)MG患者AIRE表达与MGFA分型及QMG评分呈负相关(r=-0.517,P<0.05;r=-0.616,P<0.01),Tfh/Tfr比值与MGFA分型和QMG评分呈正相关(r=0.761,r=0.581,均P<0.01)。结论 AIRE、Tfh/Tfr比值与MG的病情严重程度有一定的相关性,并可能参与了MG的发病。
重症肌无力;自身免疫性调节因子;滤泡辅助性T细胞;滤泡调节性T细胞;Tfh/Tfr比值
重症肌无力(myasthenia gravis,MG)是常见的自身免疫疾病,其发病机制与异常的免疫应答相关,且体液免疫在MG发病过程中发挥重要作用,但抗体激活B细胞的调控机制尚不清楚[1-2]。自身免疫性调节因子(autoimmune regulator,AIRE)是一种转录因子,外周表达AIRE的细胞可与CD4+T细胞相互作用,间接诱导免疫耐受[3]。滤泡辅助性T(T follicular helper,Tfh)细胞可促使B细胞形成浆细胞,产生大量高亲和性抗体[4]。滤泡调节性T(T follicular regulatory,Tfr)细胞通过抑制Tfh细胞功能而发挥作用,具有Tfh和调节性T(Treg)细胞的双重特点[5]。近期研究表明,Tfh/Tfr细胞平衡紊乱可能与MG病情相关。这种相关性是否与AIRE的异常有关尚未见报道。本研究通过检测MG患者外周血AIRE、Tfh/Tfr细胞的表达变化,旨在探讨其与MG疾病严重程度的相关性,为进一步研究MG发病机制奠定理论基础。
1 对象和方法
1.1 对象 收集2015-12—2016-04第四军医大学唐都医院收治的新发MG患者22例,其中男14例,女8例,年龄20~66岁,平均(45.4±14.8)岁。入组标准包括:(1)符合MG诊断标准:骨骼肌易疲劳(包括咽喉肌和/或延髓肌);(2)症状有波动性,伴明显晨轻暮重特点;(3)重复神经电刺激(RNES)检查显示低频(3~5 Hz)刺激时衰减达到或超过10%,单纤维肌电图检查结果显示间隔时间延长;(4)乙酰胆碱酯酶抑制剂(AChEI)治疗有效;(5)首次发病或病情稳定后复发的患者;(6)收集血标本前半年内未予以激素治疗、血浆置换或基础免疫治疗。排除标准:(1)曾使用免疫抑制(如糖皮质激素或硫唑嘌呤)、血浆置换或静脉用免疫球蛋白治疗;(2)怀孕或哺乳期;(3)合并其他自身免疫性疾病或炎性疾病。根据患者不同临床表现分为全身型MG(GMG)组和眼肌型MG(OMG)组:(1)GMG组:共12例,男女各6例,年龄28~66岁,平均(47.8±12.0)岁;美国重症肌无力协会(MGFA)分型:Ⅱb型4例、Ⅲa型2例、Ⅲb型3例、Ⅳ型3例;定量MG(QMG)评分为5~27分,平均(15.33±6.34)分。(2)OMG组:共10例,男8例,女2例,年龄20~61岁,平均(42.5±17.9)岁;MGFA分型:Ⅰ型8例、Ⅱa型1例、Ⅱb型1例;QMG评分为3~12分,平均(6.90±3.41)分。选取作者医院健康体检中心同期查体者10名作为健康对照,其中男6名,女4名,年龄22~64岁,平均(40.7±15.44)岁,对照者各项体检结果均正常,无任何免疫疾病病史,6个月内未使用过激素或免疫制剂。
1.2 方法
1.2.1 资料收集:使用统一设计的调查表收集MG患者及健康对照者的临床资料。MG患者的临床资料主要包括姓名、性别、年龄、MGFA分型及QMG评分等。MGFA分型可以客观评价MG患者所受累的肌群,而QMG评分可量化MG患者在复视、眼睑下垂、唇肌、咽喉肌及四肢肌肉受累的严重程度,得分越高病情越重。评估由唐都医院神经内科一名富有临床经验的主治医师进行。
1.2.2 AIRE和Tfh/Tfr细胞比值测定:MG患者于入院时(未接受治疗)、对照组于体检时采集空腹肘静脉血6 mL分装两管,充分摇匀,放置4℃环境中保存。采用常规技术Ficoll-Paque密度离心法分离人外周血单个核细胞(PBMCs),将外周血与等量的RPMI-1640混匀,然后缓慢滴入15 mL离心管,4℃下以300g离心20 min,提取PBMCs。随后使用RMPI-1640洗涤细胞两次。重悬细胞后加入FITC抗人CD4抗体(美国Biolegend)和PE抗人CD185(CXCR5)抗体(美国Biolegend)进行表面染色。表面染色后洗涤细胞,在核内染色前加入固定/破膜液(德国MACS)破膜。破膜后洗涤破膜液并进行细胞重悬。分别加入APC抗人AIRE抗体(德国MACS)和AlexaFlour647 抗鼠/人Foxp3抗体(美国Biolegend)充分混匀进行核内染色。染色后再次洗涤细胞并加入2%(质量浓度)多聚甲醛固定,随后在流式细胞仪(BD FACSCalibur系统)上进行流式细胞分析。计算Tfh/Tfr细胞比值和AIRE表达情况。AIRE以阳性细胞数比例表示。
1.3 统计学处理 采用SPSS 19.0统计软件进行统计学分析,符合正态分布的计量资料采用均数±标准差表示,多组均数比较(经检验方差不齐)采用Kruskal-Wallis检验,两两均数比较采用Dunn-Bonferroni检验。MGFA分型和QMG评分与AIRE表达及Tfh/Tfr比值间的相关性采用Spearman相关检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组AIRE及Tfh/Tfr比值比较 各组间AIRE阳性细胞比例比较差异有统计学意义(P<0.01),两两比较,GMG组和OMG患者AIRE表达均较对照组降低(P<0.01,P<0.05),而GMG组与OMG组间比较差异无统计学意义(P>0.05,图1)。各组间Tfh /Tfr比值比较差异具有统计学意义(P<0.01),两两比较,GMG组和OMG组Tfh /Tfr比值均高于对照组(P<0.05,P<0.01),且GMG组Tfh/Tfr比值高于OMG组(P<0.05,图2)。

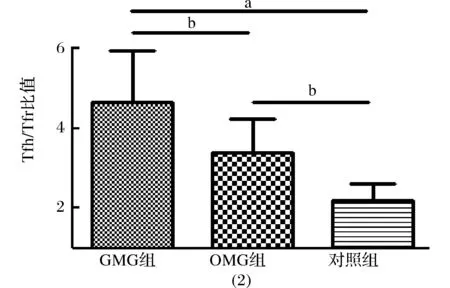
注:GMG:全身型重症肌无力,OMG:眼肌型重症肌无力,AIRE:自身免疫性调节因子,Tfh/Tfr:滤泡辅助性T细胞/滤泡调节性T细胞,PBMCs:外周血单个核细胞;图2、表1同。a P<0.01,bP<0.05 图1 各组PBMCs AIRE表达比较 图2 各组PBMCs Tfh/Tfr比值比较
2.2 AIRE和Tfh/Tfr比值与病情严重程度相关性 22例MG患者AIRE表达与MGFA分型及QMG评分均呈明显负相关,而Tfh/Tfr比值与MGFA分型和QMG评分呈明显正相关(表1)。为排除干扰因素,进行AIRE与年龄、Tfh/Tfr比值与年龄、MGFA分型及QMG评分与年龄进行相关性分析,均未发现具有明显相关性(r=0.197,P=0.379;r=-0.154,P=0.495;r=0.048,P=0.832;r=-0.079,P=0.728)。

表1 MG患者AIRE阳性细胞及Tfh/Tfr比值与病情严重程度的相关性分析
3 讨论
MG曾被认为是细胞免疫依赖、补体参与的神经系统自身免疫性疾病。但乙酰胆碱受体抗体的检出,使体液免疫在MG发病中的作用得到关注[6]。此时,抗体的产生途径成为进一步研究的热点。胸腺生发中心(GC)的发现对MG的研究意义重大,源于GC的Tfh细胞是辅助B细胞迁移、增殖、分化为浆细胞并产生高亲和力抗体的主要效应T细胞,在免疫调节过程中发挥“核心”作用[7-8]。而Tfr细胞作为Treg细胞的特殊亚群,同时拥有Tfh细胞和Treg细胞的表型特征,并且Tfr细胞可以迁移到GC并抑制Tfh细胞介导的细胞活化和抗体的产生[9-10]。本研究结果显示,MG病情与AIRE表达、Tfh/Tfr比值有一定的相关性,一定程度上提示AIRE、Tfh、Tfr细胞的异常与MG抗体的产生有一定的联系。
在中枢免疫系统,AIRE主要存在于胸腺并参与对自反应T细胞的清除过程;而在外周免疫系统,AIRE主要参与抗原的识别或通过对抗原的修饰及抗原递呈,维持免疫系统的稳定[11-12]。研究结果表明,AIRE表达在GMG组及OMG组均明显低于对照组,且AIRE的表达与MG症状严重程度呈负相关,可推测AIRE的低表达有可能与MG临床症状严重程度相关。
研究发现,Tfh/Tfr比值在GMG组最高,其次是OMG组,最低的是对照组。此外,MG患者的Tfh/Tfr比值均与MGFA分型和QMG评分呈正相关。MG患者GC的形成,致使Tfh细胞有了生存的场所;而Tfr细胞有与Tfh细胞相同的部分,如均产生于GC,高表达CD4+、CXCR5+,但其具有自身的特殊性:表达Foxp3,与传统Treg细胞一样产生抑制能力的细胞因子,且其转录信号特点较接近于Treg细胞,功能是限制Tfh细胞提供的“帮助”,从而保持一种细胞免疫内部的相对平衡[13]。任何破坏这种平衡而产生的异常或无序Tfh /Tfr比值,都会导致免疫内部的紊乱,其结果是抗体过度生成,从而导致MG的发展。本研究结果提示,Tfh细胞自身可能存在生成增多,同时其调节细胞——Tfr细胞减少,致使Tfh/Tfr比值过度增加,免疫紊乱呈现一种恶性循环状态,间接导致MG的发展。同时,AIRE的实验结果与病情严重程度呈明显负相关,考虑到AIRE在外周血的作用可能在抗原的识别或通过对抗原的修饰及抗原递呈,即免疫启动阶段;而Tfh或Tfr细胞与抗体产生的机制有关,即主要免疫过程;因而AIRE与Tfh及Tfr细胞失衡可能存在一定的因果联系。
虽然AIRE、Tfh和Tfr细胞很多特性仍不清楚,但本研究结果发现,其可能参与外周血MG的发病,并可能对自身抗体的调控起到关键作用。AIRE与MG病情严重程度呈负相关,而Tfh/Tfr比值与之呈正相关,提示可能在外周的免疫系统中存在AIRE和Tfh、Tfr细胞之间相互作用的机制,而这些机制可能与Tfh及Tfr细胞成熟过程的细胞因子的调控相关,所有这些,尚需进一步的实验研究来证实。
[1]Guptill JT,Yi JS,Sanders DB,et al. Characterization of B cells in muscle-specific kinase antibody myasthenia gravis[J]. Neurol Neuroimmunol Neuroinflamm,2015,26;2(2):e77.
[2]郝茂林, 张桂茹, 冯建利, 等. 重症肌无力的分型及治疗新进展[J]. 医学综述,2016,22 (18):3591-3595.
[3]Laurie AD,Zoltan F,Ioana V. Peripheral aire[J]. Science,2013,342(6157):447-453.
[4]Park HJ,Kim DH,Lim SH,et al. Insights into the role of follicular helper T cells in autoimmunity[J]. Immune Netw,2014,14:21-29.
[5]Wang CM,Luo Y,Wang YC,et al. Roles of follicular helper T cells and follicular regulatory T cells in pathogenesis of Henoch-Schönleinpurpura in children[J]. Chin J Contemp Pediatr,2015,17(10):1084-1087.
[6]李媛,楚兰,张艺凡. 重症肌无力免疫学机制研究进展[J]. 中国神经免疫学和神经病学杂志,2015,22(3):209-214.
[7]Cannons JL,Qi H,Lu KT,et al. Optimal germinal center responses require a multistage T cell: B cell adhesion process involving integrins, SLAM-associated protein, and CD84[J]. Immunity,2010,32(2):253-65.
[8]Zotos D,Coquet JM,Zhang Y,et al. IL-21 regulates germinal center B cell differentiation and proliferation through a B cell-intrinsic mechanism[J]. J Exp Med,2010,207(2):365-78.
[9]Sage PTT, Sharpe AH. T follicular regulatory cells[J]. Immunol Rev,2016,271(1):246-259.
[10]Chung Y,Tanaka S,Chu F,et al. Follicular regulatory T cells expressing Foxp3 and Bcl-6 suppress germinal center reactions[J]. Nat Med,2011,17:983.
[11]Perniola R, Musco G. The biophysical and biochemical properties of the autoimmune regulator (AIRE) protein[J]. Biochimica et Biophysica Acta (BBA),2014,1842(2):326-337.
[12]杜伟伟,李劲频,陈泽志,等. 自身免疫调节因子对EAMG模型小鼠发病的影响[J]. 中国神经免疫学和神经病学杂志,2014,21(3):157-160,165.
[13]Zhu Y,Zou L,Liu YC. T follicular helper cells, T follicular regulatory cells and autoimmunity[J]. Intern Immunol,2016,28(4):173-179.
(本文编辑:时秋宽)
The correlation between the expression of AIRE, Tfh and Tfr cells and clinical severity in myasthenia gravis patients
WANGShengyuan*,ZHANGMin*,LIZhuyi#,ZHAOSijia,YANGYongxiang.
#DepartmentofNeurology,TangduHospital,FourthMilitaryMedicalUniversity,Xi’anShaanxi710038,China*These authors contribute equally to this work
Corresponding author:LI Zhuyi,Email:lizhuyi@fmmu.edu.cn
Objective To explore the correlation between the expression of autoimmune regulator (AIRE), T follicular helper (Tfh), T follicular regulatory (Tfr) cells and clinical severity in myasthenia gravis (MG) patients. Methods Clinical data of 22 MG patients were collected at the Department of Neurology, Tangdu Hospital of Fourth Military Medical University from December 2015 to April 2016. The patients were divided into a generalised MG (GMG) group and an ocular MG (OMG) group; at the same time 10 volunteers were chosen as healthy controls from physical examination center. Detailed clinical information of MG patients was collected by questionnaires, including Myasthenia Gravis Foundation of America (MGFA) clinical classification and quantitative Myasthenia Gravis (QMG) score. The ratios of AIRE, Tfh and Tfr cells were measured by flow cytometry. Results (1)The difference of AIRE expression among all the three groups was significant (P<0.01). The expression of AIRE was lower in the GMG group and the OMG group, compared with the control group (P<0.01,P<0.05); but between the GMG group and the OMG group, there was no significant difference (P>0.05). (2)The difference among all the three groups in ratios of Tfh/Tfr was significant (P<0.01). The ratios of Tfh/Tfr were higher in the GMG group and the OMG groups than the control group (P<0.01,P<0.05),and higher in the GMG group than the OMG group (P<0.05). (3)The expression of AIRE showed a significantly negative correlation with MGFA classification and QMG score in all the 22 MG patients (P<0.05,P<0.01). Meanwhile, the ratio of Tfh/Tfr had a positive correlation with MGFA classification and QMG score in all the MG patients (bothP<0.01). Conclusions AIRE and Tfh/Tfr might have a relationship with the severity of MG and might participate in the pathogenesis of MG.
myasthenia gravis;AIRE;follicular helper T cell;follicular regulatory T cell;Tfh/Tfr
10.3969/j.issn.1006-2963.2017.03.005
国家自然科学基金资助项目 (81301069)
710038 第四军医大学唐都医院神经内科
*这些作者对本文具有同等贡献
李柱一,Email:lizhuyi@fmmu.edu.cn
R746.1
A
1006-2963(2017)03-0170-04
2017-2-27)

