海南龙血树茎干石蜡切片技术的研究
陈林 王清隆 王祝年

摘要根据龙血树的形态结构和植物生理的特点,以海南龙血树茎干为试验材料,探讨龙血树茎干的石蜡切片制作条件。该研究结果可为进一步观察龙血树茎干的微观形态结构提供参考。
关键词 海南龙血树;茎干;石蜡切片
中图分类号S718.3文献标识码
A文章编号0517-6611(2017)10-0005-03
Study on the Paraffin Section Technology of Dracaena cambodiana Stems
CHEN Lin1,WANG Qinglong2,WANG Zhunian2*(1.College of Applied Science and Technology,Hainan University,Danzhou,Hainan 571737; 2.Tropical Crops Genetic Resources Institute,CATAS,Danzhou,Hainan 571737)
AbstractTaking the stems of Dracaena cambodiana as test materials,according to the morphological structure and physiological characteristics of D.cambodiana,the production conditions of their paraffin sections were discussed.The research results can provide basis for observing the microscopic morphological structure of D.cambodiana stems further.
Key wordsDracaena cambodiana;Stem;Paraffin sections
海南龍血树(Dracaena cambodiana)又名小花龙血树、柬埔寨龙血树,其植物形态、生理特性和剑叶龙血树极为相似,剑叶龙血树树脂也可作为血竭的代用品。海南龙血树被列为国家二级保护野生植物,在海南儋州、东方、乐东、昌江、三亚、文昌等市(县)均有分布,生于热带季雨林或石灰岩山季雨林中背风区的干燥砂土上,同属多种和变种植物用于园林观赏。石蜡切片技术是组织学常规制片技术中应用最广泛的制片方法,石蜡切片技术是观察研究动植物形态发育和内部构造的重要技术,但是对于不同植物、不同器官及不同组织制片时需要的具体条件各不相同,切片的质量不仅与材料自身及试验操作相关,还与固定、脱水、透明、浸蜡、包埋、切片、染色等步骤的操作和时间相关[1-9],因此应根据植物的组织结构特点选择合适的制片方法。笔者在传统植物石蜡切片技术的基础上,结合海南龙血树茎干的结构特点[10],对脱水、透明、切片、染色等环节的操作技术进行了改善,以期为进一步观察龙血树茎干的微观形态结构提供参考。
1材料与方法
1.1材料
1.1.1试验材料。试验材料采自海南省儋州市热带植物园,经王祝年研究员鉴定为海南龙血树(Dracaena cambodiana),选取新鲜龙血树的茎干进行石蜡制片。
1.1.2主要试剂。无水乙醇(φ乙醇=99.7%)、冰醋酸、二甲苯、甲醛,均为分析纯,由广州化学试剂厂生产;藏红T(即番红)、固绿、切片石蜡(60~62 ℃)、中性树胶,均为分析纯,由国药集团化学试剂有限公司生产。
1.1.3主要仪器。光学显微镜、轮转式切片机、塑料载玻片染色缸、鼓风干燥箱、烤片机、酒精灯、切片盒等。
1.2试验方法
依据传统的石蜡切片流程中的固定、脱水、透明、浸蜡、包埋与修蜡、切片、粘片、脱蜡与染色、封片环节,根据龙血树茎干的结构特点,着重对脱水、透明、切片、染色等流程进行了改善。选取染色效果优良、完整的切片在显微系统下进行显微观察并拍照。
1.2.1试剂的配制。FAA固定液:V70%乙醇∶V冰醋酸∶V37%甲醛=90∶5∶5。番红染液:将1.0 g番红溶于100 mL 70%乙醇中。固绿染液:将0.5 g固绿溶于100 mL 95%乙醇中。其他试剂均按照常规方法进行配制。
1.2.2取材与固定。
从龙血树植株上取下茎干后立即进行分割,并迅速固定。分割茎干要快、准,分割长度为5~8 mm,放入有FAA固定液的广口瓶中,并贴上标签。固定用50 mL玻璃广口瓶,每个小瓶中放置4~5段茎干,固定24 h。
1.2.3脱水与透明。对于脱水与透明环节,时间是关键,而脱水与透明二者密切相关。脱水越充分,透明效果也就越好。按照以下流程进行透明与脱水:50%乙醇20 min → 70%乙醇20 min → 80%乙醇20 min → 95%乙醇20 min →无水乙醇 Ⅰ 30 min →无水乙醇 Ⅱ 30 min → 1/2 100%二甲苯+1/2无水乙醇30 min → 100%二甲苯 Ⅰ 30 min → 100%二甲苯 Ⅱ 30 min。
1.2.4浸蜡与包埋。按照以下流程进行浸蜡(在60 ℃恒温箱中操作):
2/3 100%二甲苯+1/3 纯石蜡→1/3 100%二甲苯+2/3 纯石蜡→纯石蜡 Ⅰ→纯石蜡 Ⅱ。 2/3 100%二甲苯+1/3 纯石蜡中可放置4~8 h或过夜,1/3 100%二甲苯+2/3 纯石蜡中放置2 h,再转入融化的纯石蜡中2次,每次放置2 h。然后,将浸蜡后的试验材料倒入固定槽中静置、冷却至凝固状。
1.2.5切片、贴片与烤片。
将蜡块修成上、下两边平行的正方形或长方形,粘在小木块支座上。用切片机夹好小木块支座,将蜡块切成9~12 μm的薄片。切下的薄片自然形成蜡带,把切好的蜡带用毛笔轻放在干净的纸上,光面朝下。用胶头滴管在玻片中央滴少许蒸馏水,蒸馏水的用量视蜡带长短而定。若蜡带比较窄,可在载片上放置1~2排蜡带。用镊子和解剖针将蜡带转移到蒸馏水上,蜡带慢慢平展。待完全平展后,用解剖针将切片位置拨正,倾去载玻片上多余的水或用吸水纸放在载玻片边缘吸去多余水后,按照从上到下的顺序从烤片机左上角依次排列载玻片,在45 ℃烤片机上干燥24 h以上[2]。
1.2.6脱蜡、透明、染色与封片。切片先按照以下流程进行脱蜡与透明:100%二甲苯 Ⅰ 20 min → 100%二甲苯 Ⅱ 20 min → 1/2 100%二甲苯+1/2无水乙醇20 min →无水乙醇 Ⅰ 5 min →无水乙醇 Ⅱ 5 min → 95%乙醇5 min → 80%乙醇5 min → 番红染色22 h → 70%乙醇3~5 s→ 50%乙醇3~5 s → 70%乙醇5 min → 80%乙醇5 min → 95%乙醇5 min → 固绿染色3~5 s → 95%乙醇5 min →无水乙醇5 min →无水乙醇5 min → 1/2 100%二甲苯+1/2无水乙醇5 min → 100%二甲苯Ⅰ 5 min → 100%二甲苯 Ⅱ 5 min。采用番红和固绿对切片进行染色,先在染色缸中用番红溶液染色22 h,然后在固绿溶液中染色3~5 s。完成以上过程后就可用树胶封固,制成永久装片。
1.2.7显微结构观察。利用显微镜对海南龙血树的茎干结构进行观察,并通过显微成像系统软件对制作的石蜡切片进行拍照。
2结果与分析
海南龙血树的茎干结构(图1)与剑叶龙血树十分相似,茎干的初生结构由外至内依次为:表皮、皮层及基本组织、散生的初生维管束。在老茎中栓化层是皮层外部细胞通过壁加厚栓化后形成的能代替表皮起保护作用的层次。皮层及基本组织由一条环带的形成层来划分。基本组织由大量排列紧密的、径向排列的、近圆形或长方形或方形的薄壁细胞组成,有的细胞中还可见草酸钙针晶束。初生外韧有限维管束大而稀疏,分布位置靠近老茎的中央即散生于内基本组织中。次生周木有限维管束小而密,轮廓呈椭圆形或近圆形,数目众多,径向排列于外基本组织中[10]。
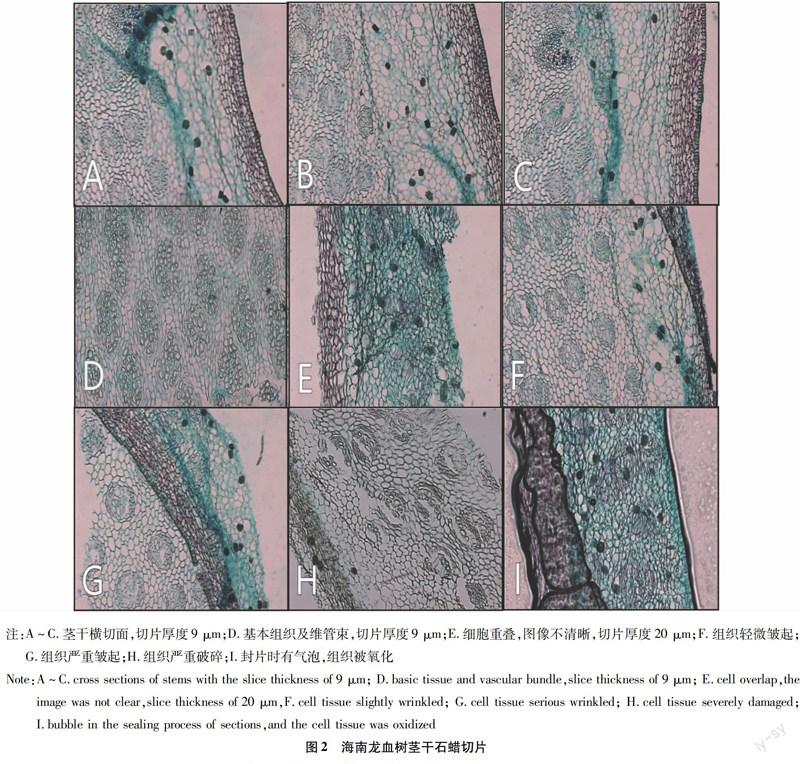
针对海南龙血树的结构特点以及在石蜡制片中出现的问题,经过大量摸索得到其合适的石蜡切片制作方案,与普通的石蜡切片方法[11-14]相比,对脱水、透明、切片、染色等环节进行了改进,提高了制片成功率,制片效率得以提高,切片质量(图2 A~D)也有所提高。
2.1取材与固定环节
取材时应立即对材料进行分割,并放入有FAA固定液的广口瓶中。FAA固定液具有渗透快、不使组织膨胀或收缩能够保持原形、硬化组织的程度适中、能增加染色能力、具有保存剂的作用等特点。每个广口瓶中固定的材料不能过多,若材料过多会相互碰撞造成组织受损,或固定不充分,以4~5个材料为宜。材料固定的时间至少24 h。
2.2脱水与透明环节
脱水先用低浓度乙醇,然后递增乙醇浓度,直至无水乙醇。脱水必须在有盖的玻璃器皿中进行,防止吸收空气中的水分。在低浓度乙醇中每级停留时间不能太长,否则易使组织变软,助长材料的解体;在高浓度乙醇中每级也不能停留太长时间,否则可使组织收缩变硬,影响切片[8]。在透明这个环节,脱水越充分,透明效果就越好。在进行透明时,随着时间的推移,能够观察到组织逐渐变得透明,最终整个组织都呈透明状。二甲苯是有毒试剂,且易挥发,因此在进行透明时要带上口罩、手套,使用二甲苯后要随时盖紧盖子,更换试剂时动作要快。
根據海南龙血树茎干的结构特点,为使试验材料在试验过程中不收缩,设计了5个乙醇浓度梯度,同时也使龙血树能够保证彻底脱水,与传统的石蜡切片方法相比,缩短了脱水环节所需要的时间(每个梯度20 min),但又不影响后期切片的质量。在透明环节,设置2个浓度梯度,对透明时间也进行了调整。通常制片时建议采用以下流程:1/3二甲苯+ 2/3无水乙醇、1/2二甲苯+ 1/2无水乙醇、2/3二甲苯+ 1/3无水乙醇[12]。为了使材料能够充分透明,将透明过程改为:1/2 100%二甲苯+1/2无水乙醇→ 100%二甲苯 Ⅰ→ 100%二甲苯 Ⅱ,试验结果表明在每个浓度梯度处理30 min能达到试验预期的目标。
2.3浸蜡与包埋环节若浸蜡时温度过高,会引起材料变硬变脆而收缩,造成切片质量不高甚至失败;若温度过低,石蜡就不能完全熔化,难以均匀地渗透到组织内部,造成组织与石蜡脱离,蜡块中出现气泡﹑裂隙。浸蜡期间要保持恒温箱的温度恒定,切忌忽高忽低。移材料的镊子最好一起放在恒温箱中,否则镊子插入或移出后,尖端的石蜡容易凝固,造成操作困难[15]。为了节省时间,可以提前将蜡块溶解,而浸蜡前一定要将石蜡溶解并过滤后再使用,减少其他因素的影响。包埋过程最好在恒温箱中操作,避免温差过大,影响石蜡浸入组织的均匀度,在切片时会出现植物组织从腊带上脱落的情况,时间上也要尽量缩短,否则也会出现同样的情况。包埋后的石蜡块应呈均匀的半透明状态,但有时会出现白色混浊结晶、气泡等,影响切片。
2.4切片环节
切片前要将蜡块修成上、下两边平行的面,这样切成的蜡带呈直线。如果上、下两边不平行,蜡带容易弯曲。要将蜡块修得尽可能小,在材料的周围不要留太多的蜡,否则一张玻片只能贴几个切片。通常修整蜡块时留蜡边3 mm左右较合适。为了保证石蜡块牢固地黏在木块上,可用解剖刀粘取少许石蜡碎屑放在固着蜡块的木块四周,解剖刀加温后迅速将石蜡碎屑熔化烫平。石蜡块固着后要放置几分钟,使其完全凝固,否则切片时蜡块易脱落[15]。
在对组织进行切片时,选择9、12、16、20 μm等厚度进行切片试验,发现在16、20 μm切片容易出现重叠现象(图2 E),9 μm厚度的切片效果最好。在切片时片刀必须锋利,没有缺口,最好使用新刀片。若刀片太钝,会使蜡带自行卷起或皱起(图2 F和G),或使组织出现伤痕,甚至使切片破碎(图2H)、不完整,从而导致试验失败。
2.5染色环节
染色是利用石蜡切片观察和诊断的关键步骤,该过程中容易出现的问题是切片染色对比不清晰和容易脱片。染色对比不清晰有以下原因:①固绿染色太深;②番红染色不够或过深。因此,染色液的浓度要准确配制,酸碱度要适中,且不能有沉淀。染色时脱片是由于组织切片在染色的系列溶液中浸泡时间较长或贴片不好造成的[5]。染色时最好选用染色缸进行染色,可以一次对多个切片进行染色,还可以减少对切片的移动而造成的脱片。
在试验过程中也对染色时间进行了摸索,通过番红的染色时间10和22 h等时长进行染色条件摸索,结果表明在番红染色10 h的效果不如22 h的染色效果。固绿能够迅速染色,所以3~5 s即可得到具有较好染色效果的切片。
2.6封片环节
在进行封片时,要尽量缩短操作时间,
避免组织长时间暴露在空气中被氧化,滴加中性树胶和用盖玻片进行封片时也要避免气泡的产生(图2 I)。封片时要根据材料与盖玻片的大小来评估所需树胶的滴数。若树胶过多,盖玻片容易滑动,对封片造成影响;若树胶过少,不能将组织完全覆盖,部分组织会被氧化。封片时动作要轻而快,尽量避免口﹑鼻呼吸对切片的影响;在树胶未干前,不能用手去动盖玻片,避免盖玻片移动对切片质量的影响。
3结论
经过“取材、固定、脱水、透明、浸蜡、包埋、切片、贴片、烤片、脱蜡、透明、染色、封片”一系列环节制得永久制片,其切片染色清楚,细胞界限清晰,植物组织完整,石蜡切片干净,表皮细胞被染成红色,基本组织被染成绿色。通过对切片进行显微观察,可以清楚看到表皮、皮层及基本组织、维管束等组织结构。
石蜡切片技术是组织学常规制片技术中应用最广泛的制片方法,也是观察研究动植物形态发育和内部构造的重要技术,但是对于不同植物、不同器官、不同组织制片时需要的条件各不相同。切片的质量不仅与材料自身结构特点相关,而且与固定、脱水、透明、浸蜡、包埋、切片、染色等环节的操作和时间相关。
参考文献
[1]
王健,林清鹏.樟子松松针石蜡切片制备[J].科技经济市场,2014(12):5-6.
[2] 帅焕丽,杨途熙,魏安智,等.杏花芽石蜡切片方法的改良[J].果树学报,2011,28(3):536-539.
[3] 李晓梅.大豆茎顶端分生组织石蜡切片的制备[J].大豆科学,2008,27(4):708-710.
[4] 蔡海滨,涂敏,胡彦师,等.一种优化的橡胶树木质部石蜡切片制作方法[J].热带农业科学,2015,35(6):25-28.
[5] 李素坤,张秋芝,郝玉兰,等.玉米成熟期茎秆石蜡切片方法的研究[J].安徽农业科学,2010,38(8):3935-3937.
[6] 陈土娟,黄子娟,潘海玉,等.茴香成熟叶柄石蜡切片技术的研究[J].韶关学院学报,2014,35(12):41-45.
[7] 康海岐,常红叶,许育彬,等.水稻籽粒胚乳的石蜡切片方法改良及其结构发育观察[J].西北植物学报,2008,28(5):1069-1074.
[8] 王金平,张俊梅.白头翁花的石蜡切片制作[J].信阳师范学院学报(自然科学版),2008,21(4):573-576.
[9] 赵云,李涛,陈增洁.含羞草石蜡切片的制作[J].宁夏农林科技,2011,52(4):45-46,封3.
[10] 周琼,黎桦,谢义林,等.靖西珍稀药用植物剑叶龙血树(Dracaena cochinchinensis)生态解剖研究[J].中国农业大学学报,2014,19(2):137-142.
[11] 刘桂芝.石蜡切片标本的制作过程[J].通化师范学院学报,2004,25(11):90-91.
[12] 李正理.植物制片技术[M].北京:科学出版社,1987:129-137.
[13] 李景原,谷艳芳.生物制片原理与技术[M].开封:河南大学出版社,1998:88-102.
[14] 林加涵,魏文玲,彭宣宪.现代生物学实验(上册)[M].北京:高等教育出版社,2000:70-99.
[15] 楊捷频.常规石蜡切片方法的改良[J].生物学杂志,2006,23(1):45-46.

