木薯细菌性萎蔫病菌抗铜性评价及抗铜相关基因簇分子分析
时涛 蔡吉苗 李超萍 黄洁 黄贵修


摘 要 细菌性萎蔫病是世界范围内木薯种植中的重要病害,也是中国木薯种植中为害最严重的病害。前期研究发现铜基杀菌剂对国内木薯细菌性萎蔫病防效欠佳,随即开展了病菌抗铜性评价及抗铜相关基因簇的分子分析工作。评价了42个不同来源病原菌菌株对硫酸铜的抗性,发现其抑菌最低有效浓度均在1.35~1.75 mmol/L之间。通过和已报道黄单胞菌类抗铜相关基因的比对分析,发现来自广西的菌株GX11携带有copTAB和XmeRSA 2个抗铜基因簇。对来自南美州、非洲和亚洲67个菌株的基因组序列分析发现绝大多数菌株均带有这2个基因簇,聚类分析发现相关基因在菌株之间具高度的同源性。
关键词 木薯;细菌性萎蔫病菌;copTAB基因簇;XmeRSA基因簇
中图分类号 S435.651 文献标识码 A
Abstract Cassava bacterial blight caused by Xanthomonas axonopodis pv. manihotis is one kind of worldly important diseases, and it is the most serious disease in the cassava plantations of China too. Further research results showed the copper-based fungicides had a little effective on cassava bacterial blight, so the resistance evaluation to copper and molecule analysis about copper resistance related gene clusters for X. axonopodis pv. manihotis was launched in our lab. The evaluation results showed the lowest effective concentration of 42 strains came from different areas were from 1.35 mmol/L to 1.75 mmol/L. Compared with reported copper resistance genes from other Xanthomonas spp strains, the two homologous gene clusters of copTAB and XmeRSA were anchored in the genome of X. axonopodis pv. manihotis strain GX11 from Guangxi province. These two gene clusters were also located in almost all of 67 strains from South America, Africa and Asia, and phylogenetic analysis showed this two gene clusters were highly consistent between strains. The results in this paper would facilitate for further research related with response mechanism of X. axonopodis pv. manihotis strain to copper and formulate the control program for this disease.
Key words cassava; Xanthomonas axonopodis pv. manihotis; copTAB gene clusters; XmeRSA gene clusters
doi 10.3969/j.issn.1000-2561.2017.03.023
木薯(Manihot esculenta Crantz)為大戟科木薯属灌木状多年生作物,是世界上六大粮食作物之一。木薯起源于热带美洲地区,栽培史悠久,目前广泛栽种于热带和亚热带地区的100多个国家[1]。1820年前后,木薯首次传入中国广东地区,因其具有耐旱、耐贫瘠、高产高淀粉等特点,目前已遍及华南地区。木薯在中国主要用作工业原料,相关产业在当地农业经济中占有重要地位[2],但木薯生产尚不能自给,是世界上最大的进口国[3]。
由地毯草黄单胞木薯萎蔫致病变种(Xanthomonas axonopodis pv. manihotis,简称Xam)侵染引起的细菌性萎蔫病,也称细菌性枯萎病,是世界范围内木薯种植中的毁灭性病害,广泛发生于亚洲、非洲和拉丁美洲的木薯产区。病原菌主要为害叶片和茎干,能够产生叶片角斑、萎蔫、枯萎、提前脱落以及幼苗萎蔫、枝条回枯、茎干溃疡、维管束坏死等症状,削弱长势并造成严重的产量损失[4]。项目组前期研究发现该病已在中国木薯主产区普遍发生,是当前木薯种植中为害最严重的病害[5]。铜基杀菌剂是作物细菌性病害防控中的常用药剂,也是中国木薯细菌性萎蔫病防控中常见的推荐药剂[6-8]。前期研究发现,国内菌株GX01对氢氧化铜(有效成分为77%氢氧化铜WP)、噻菌铜(有效成分为20%噻菌铜SC)等铜基杀菌剂表现出一定程度的抗性[9],而氢氧化铜对该病的田间校正防效也仅在30%左右(未发表资料)。本研究开展了该病病原菌抗铜性评价及已测序Xam病菌抗铜相关基因的分子分析工作,为进一步开展抗铜分子机理研究及该病防控策略的制订提供依据。
1 材料与方法
1.1 材料
Xam菌株的培养采用YGP 培养基(参照《植病研究方法》[10]的配方制备)。42个分别来自中国、柬埔寨、哥伦比亚和乌干达的供试Xam菌株由中国热带农业科学院环境与植物保护研究所、哥伦比亚波哥大大学、乌干达国家农业研究组织等机构提供(表1)。相关试剂均为国产分析纯。菌株XamGX11的全基因组序列由中国热带农业科学院环境与植物保护研究所提供。
1.2 方法
1.2.1 不同来源Xam病菌抗铜性评价 参照卢昕等[11]的方法进行。
1.2.2 国内XamGX11菌株抗铜相关基因簇分子分析
从网站(http://www.ncbi.nlm.nih.gov/)基因组数据库中下载代表性黄单胞类病原菌抗铜相关基因序列,获得氨基酸序列后,比对各基因之间的同源性,采用tBlastn程序分析XamGX11菌株中的同源基因。获得包括候选基因在内的大片段序列后,在NCBI 数据库中进行ORF(Open Reading Frame)预测,得候选基因氨基酸序列,通过NCBI数据库中的Blastp对其功能进行预测。
1.2.3 Xam病菌抗铜相关基因簇分析 从网站(http://www.ncbi.nlm.nih.gov/)基因组数据库中下载已登录的木薯细菌性萎蔫病菌菌株的基因组序列,分析各菌株中抗铜相关基因簇的分布情况。应用MEGA version 4.0中的NJ(Neighbor-Joining)方法比较各菌株中的同源基因簇同源性并生成系统树,用Bootstrap进行检验,1 000次重复[12]。
2 结果与分析
2.1 Xam病菌抗铜性评价
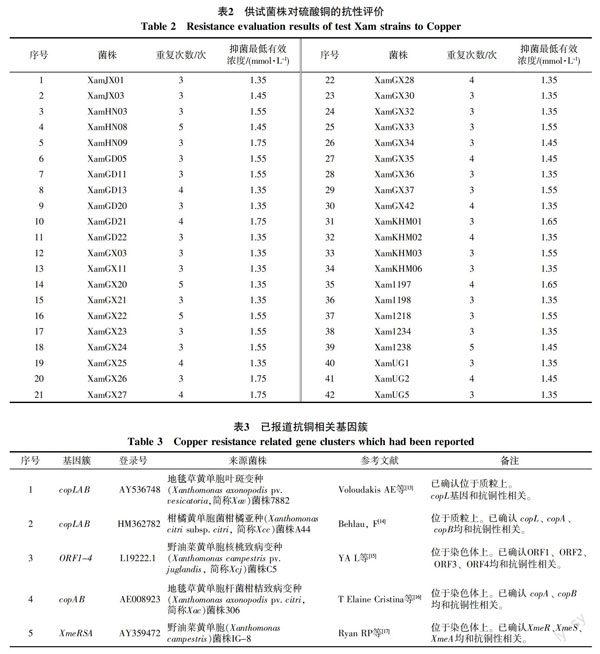
供试菌株对硫酸铜的抗性评价结果见表2,各菌株抑菌最低有效浓度在1.35~1.75 mmol/L之间。国外菌株中,来自柬埔寨的4个菌株及哥伦比亚的5个菌株均在1.35~1.65 mmol/L之间,来自乌干达的3个菌株为1.35或1.45 mmol/L。国内菌株中,来自江西的1个菌株、广东的3个菌株、广西的10个菌株均为1.35 mmol/L,而来自海南的1个菌株、广东的1个菌株和广西的2个菌株在42个菌株中抗铜能力最强,抑菌最低有效浓度为1.75 mmol/L。
2.2 国内XamGX11菌株抗铜相关基因簇分子分析
2.2.1 已报道黄单胞类病原菌抗铜相关基因簇分子分析 检索文献并下载5株已报道的黄单胞菌株的抗铜基因簇后,发现黄单胞病菌抗铜基因簇的典型结构为copLAB,也有菌株缺少copL基因,而来自中国河北的1株野油菜黄单胞菌带有XmeRSA抗铜相关基因簇。在5个已登录的抗铜基因簇中,3个位于染色体上,2个由质粒携带,各基因簇来源菌株、登录号等见表3。同源性比对结果表明,多数抗铜相关copLAB基因簇的氨基酸序列之间具有较高的同源性(图1),但XmeRSA基因簇和其它基因之间无同源性,和嗜麦芽窄食单胞菌(Stenotrotromonas maltophilia)RND家族多重抗药性系统smeRSABC有较高的同源性。
2.2.2 XamGX11菌株抗铜相关基因簇分析 分析發现国内菌株XamGX11基因组上同样带有两个抗铜相关基因簇,根据同源性比对结果,分别命名为copTAB和XmeRSA,其染色体位置、预测基因大小、预测功能等见表4。该菌株copA基因上游的1个预测基因和黄单胞类copL基因之间无同源性,但和已报道Xac菌株306的copAB上游1个预测蛋白之间同源性为86%,预测其编码铜转运蛋白,因此暂命名为copT。copTAB位于Scaffold6,全长3 420 nt,编码3个读码方向一致的预测基因,其中copT和copA、copA和copB编码区之间间隔分别为90 nt和85 nt。XmeRSA位于Scaffold1,全长3 444 nt,编码3个预测基因,XmeA和另外2个基因读码方向相反,XmeR和XmeS有4 nt的重叠,而XmeS和XmeA编码区之间间隔162 nt。除copT的起始密码子为“GTG”外,其余5个预测基因均为“ATG”。
比对结果表明,copA、copB和已报道Xac菌株306的同源基因相似性均为96%,copA和Xcj菌株C5的ORF1同源性仅为63%,而copB和Xav菌株7882的copB基因同源性仅为38%。该菌株copTAB基因簇和已报道代表性抗铜基因的同源性见图2。XmeRSA和黄单胞菌株IG-8的XmeRSA同源性分别为67%、57%和34%(图3)。
2.3 已完成基因组序列测定Xam病菌的抗铜相关基因簇分析
下载已登录的67个Xam菌株的基因组数据,用菌株XamGX11两个基因簇的序列进行比对分析,筛选同源基因簇,各菌株编号、来源、分离时间、登录号等见表5。来自马拉维的菌株CFBP4642没有找到XmeRSA基因簇,copTAB序列和XamGX11序列同源性为83.7%,3个预测基因氨基酸序列同源性分别为59%、88%和64%。其余菌株中,来自乌干达的10个(UG21,UG23,UG24,UG27,UG28,UG39,UG43,UG44,UG45和UG51)、巴西的5个(IBSBF278,IBSBF2538,IBSBF2539,IBSBF2818和LMG784)、哥伦比亚的7个(UA303,UA306,UA323,UA536,UA556,UA560和UA686)以及其它地区的9个(AT6B,ORST17,ORSTX27,Xam672,Xam678,AFNC1360,ThaiXam,Xam668和Xam1134),共31个菌株的copTAB、XmeRSA的序列和XamGX11一致,另外UA324的copTAB、NG1的XmeRSA的序列也和XamGX11一致。来自尼日利亚的IBSBF285的XmeRSA基因簇仅在非编码区存在1 nt的差异,而编码区和XamGX11序列完全一致。另外7个菌株的copTAB和2个菌株的XmeRSA不完整,分析可能是测序时遇到gap区。各菌株和XamGX11相比,两个基因簇仅存在少于4 nt和4 aa的差异。
68个菌株的copTAB基因簇中,除32个菌株和XamGX11完全一致外,IBSBF289、IBSBF356、IBSBF2345、IBSBF2346、IBSBF2665和IBSBF2667等6个来自巴西的菌株,CFBP1851、CI01、CIO151、IBSBF320、IBSBF725、IBSBF726、NCPPB1159、UA226和Xam669等9个菌株,以及IBSBF436、IBSBF1411、IBSBF2666、IBSBF2670、IBSBF2672、IBSBF2816、IBSBF2819、IBSBF2820、IBSBF2821、IBSBF2822等10个菌株之间的copTAB基因簇序列同样完全一致。各菌株的XmeRSA基因簇中,除32个菌株和XamGX11完全一致外,CFBP1851、IBSBF289、IBSBF320、IBSBF356、IBSBF436、IBSBF614、IBSBF725、IBSBF1182、IBSBF1411、IBSBF1994、IBSBF2345、IBSBF2346、IBSBF2665、IBSBF2666、IBSBF2667、IBSBF2670、IBSBF2672、IBSBF2673、IBSBF2816、IBSBF2819、IBSBF2820、IBSBF2821、IBSBF2822、NCPPB1159和xam669等25个菌株之间完全一致。构建了61个Xam菌株和两个代表性菌株copLAB基因簇的系统发育树,结果表明60个菌株聚类成一个分枝,自展率为100%,和菌株CFBP4642聚成一大分支,自展率为83.7%,而Xav菌株7882和Xcc菌株A44组成另一个大分枝(图4)。65个Xam菌株和Xc菌株IG-8的XmeRSA的系统发育分析表明各菌株聚类为一个分枝,自展率为100%(图5)。
copTAB基因簇中,在不考虑预测基因不完整及菌株CFBP4642的情况下,6个菌株的copT基因和菌株XamGX11相比存在1 nt/1 aa的差异,1个菌株(IBSBF285)copB基因存在1 nt/1 aa的差异,24个菌株的copA基因存在1 nt/1 aa或2 nt/2 aa的差异。XmeRSA 2个基因簇中,仅有1个菌株(ORST4)XmeS存在3 nt/2 aa的差异,30个菌株的XmeR和XmeA存在差异,其中XmeR为2 nt、1 nt或2 nt/1 aa,而XmeA为1 nt 、1 nt/1 aa或2 nt/2 aa,另外菌株UA324的XmeA存在1 nt/1 aa的差异。
3 讨论
国内外研究表明,黄单胞等病原细菌中广泛存在着抗铜性菌株,分析铜基杀菌剂的选择压是抗铜菌株增多及抗铜能力提高的重要原因。Bouzar等[21]评价了从4个加勒比海和中美洲国家的32个种植园中获得的95个黄单胞病菌的抗铜性,发现90%以上菌株对硫酸铜的抗铜性高于0.8 mmol/L。Guiping等[22]收集了8个种的41个黄单胞菌株,发现33个菌株对1.2 mmol/L的硫酸铜具有抗性。来自加拿大安大略湖地区的98个致病力不同的黃单胞菌株中,87个对1.0 mmol/L的硫酸铜具有抗性[23]。来自非洲坦桑尼亚的30个野油菜黄单胞叶斑变种(X. campestris pv. vesicatoria)菌株中,有28个对0.8 mmol/L硫酸铜具有抗性[24]。调查发现,美国弗洛里达、墨西哥、俄克拉荷马等地区,野油菜黄单胞叶斑变种(X. campestris pv. vesicatoria)抗铜菌株的数量随着铜基杀菌剂的大量使用而不断增加[25]。王君[26]用4株硫酸铜半致死浓度为100 μg/mL的地毯草黄单胞杆菌柑桔致病变种(X. axonopodis pv. citri)为初始菌株,用硫酸铜将其半致死浓度诱导提高到270 μg/mL以上。本研究发现来自哥伦比亚、柬埔寨、乌干达和国内木薯主栽区的42个Xam菌株均表现出不同程度的抗铜性,其中4个菌株的抗铜能力高于其它菌株,这一点是否和铜基杀菌剂的施用有关,还需要进行进一步的研究分析。
铜是各类生物不可获缺的微量元素,但高浓度的铜离子对细胞具有毒性[27-28]。细菌的抗铜作用包括耐药结节细胞分化(Resistance-nodulation-cell-division,简称RND)等基因家族的外排作用,阳离子扩散(CDF)基因家族的过滤作用,P型ATP酶的调控作用等不同层次的机制,包括铜离子的吸附沉积、隔离、修饰及向外转运等[29-30]。在病原细菌中,部分抗铜相关基因还具有其它功能。西瓜细菌性果斑病菌(Acidovorax. citrulli)的RND家族外排转运体膜融合蛋白亚基cusB和抗铜性、胞外多糖分泌和生物膜形成等相关[31],而多铜氧化酶(CueO)和抗铜性、胞外多糖形成以及对苦瓜的致病力相关[32]。野油菜黄单胞菌野油菜致病变种(X. campestris pv. campestris)菌株Xc17的copA基因缺失后不但降低了抗铜能力,同时也降低了对卷心菜的毒力[33]。疮痂病菌(X. gardneri)菌株Xv10的copB基因不但和抗铜性相关,而且影响着侵染番茄的能力[34]。本文研究结果表明,在完成基因组序列测定的68个Xam菌株中,除CFBP4642外,其余菌株均带有高度同源的CopTAB和XmeRSA预测基因簇,分析其可能为内源性。6个预测基因中,有哪些和抗铜性相关,是否还参与包括致病性在内的其它代谢作用,还需要进行进一步的研究。
参考文献
[1] 贾晶霞, 李雷霞. 世界及中国木薯生产概况[J]. 农业工程, 2015, 5(5): 124-126.
[2] 陈丽珍, 叶剑秋. 我国木薯加工业的发展现状与展望[J]. 园艺与种苗, 2011(3): 87-90.
[3] 盘 欢. 亚洲11国木薯生产概况[J]. 广西热带农业, 2009, 5: 29-31.
[4] 黃贵修, 李开绵. 中国木薯主要病虫草害识别与防治[M]. 北京: 中国农业科学技术出版社, 2012.
[5] 李超萍, 时 涛, 刘先宝, 等. 国内木薯病害普查及细菌性枯萎病安全性评估[J]. 热带作物学报, 2011, 32(1): 116-121.
[6] 黄子乾, 赖廷锋, 花会功, 等. 合浦县木薯良种良法综合高产配套栽培技术[J]. 中国热带农业, 2011, 6: 85-86.
[7] 王明花. 木薯品种 “GR891” 在大田种植表现及高产栽培技术[J]. 福建稻麦科技, 2015, 33(2): 91-93.
[8] 曾小荣, 郑刚辉. 木薯主要病虫害的发生及防治[J]. 现代农业科技, 2011, 18: 200, 205.
[9] 卢 昕, 李超萍, 时 涛, 等. 木薯细菌性枯萎病菌防控药剂的筛选[J]. 热带农业科学, 2013, 33(2): 53-56.
[10] 方中达. 植病研究方法[M].第3版. 北京: 中国农业出版社, 1998.
[11] 卢 昕, 李超萍, 时 涛, 等. 木薯细菌性枯萎病菌防控药剂的筛选[J]. 热带农业科学, 2013, 33(2): 53-56.
[12] Guindon S, Gascuel O. A simple, fast, and accurate algorithm to estimate large phylogenies by maximum likelihood[J]. Syst Biol, 2003, 52: 696-704.
[13] Voloudakis A E, Reignier T M, Cooksey D A. Regulation of resistance to copper in Xanthomonas axonopodis pv. vesicatoria[J]. Applied and Environmental Microbiology, 2005, 71(2): 782-789.
[14] Behlau F, Canteros B I, Minsavage G V, et al. Characterization of copper resistance genes from Xanthomonas citri subsp. citri and Xanthomonas alfalfae subsp. citrumelonis[J]. Applied and Environmental Microbiology, 2011, 77(12): 4 089-4 096.
[15] YA Lee, Hendson M, Panopoulos N J, et al. Molecular cloning, chromosomal mapping, and sequence analysis of copper resistance genes from Xanthomonas campestris pv. juglandis: homology with small blue copper proteins and Multicopper Oxidase[J]. Journal of Bacteriology, 1994, 176(1): 173-188.
[16] T Elaine Cristina, FDO Julio Cezar, MN Maria Teresa, et al. The copper resistance operon copAB from Xanthomonas axonopodis pathovar citri: gene inactivation results in copper sensitivity[J]. Microbiology, 2008, 154: 402-412.
[17] Ryan R P, Ryan D J, Sun Y C, et al. An acquired efflux system is responsible for copper resistance in Xanthomonas strain IG-8 isolated from China[J]. Fems Microbiology Letters, 2007, 268: 40-46.
[18] Bart R, Cohn M, Kassen A, et al. High-throughput genomic sequencing of cassava bacterial blight strains identifies conserved effectors to target for durable resistance[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(28): E1 972-1 979.
[19] Arrieta-Ortiz M L, Rodríguez-R L M, Pérez-Quintero A, et al. Genomic survey of pathogenicity determinants and VNTR markers in the cassava bacterial pathogen Xanthomonas axonopodis pv. manihotis strain CIO151[J]. Plos One, 2013, 8(11): e79 704.
[20] Bolot S, Munoz Bodnar A, Cunnac S, et al. Draft genome sequence of the Xanthomonas cassavae type strain CFBP 4642[J]. Genome, 2013, 1(4): pii: e00679-e00713.
[21] Bouzar H, Jones JB, Stall RE, et al. Multiphasic analysis of Xanthomonads causing bacterial spot disease on tomato and pepper in the Caribbean and Central America: evidence for common lineages within and between countries[J]. Phytopathology, 1999, 89(4): 328-335.
[22] D Guiping, G Zijian, Y Xiaojing, et al. Evidence for acquisition of copper resistance genes from different sources in citrus-associated Xanthomonads[J]. Phytopathology, 2013, 130(5): 409-418.
[23] Abbasi P A, Khabbaz S E, Weselowski B, et al. Occurrence of copper-resistant strains and a shift in Xanthomonas spp. causing tomato bacterial spot in Ontario[J]. Canadian Journal of Microbiology, 2015, 61: 753-761.
[24] Shenge K C, Mabagala R B, Mortensen C N, et al. Resistance of Xanthomonas campestris pv. vesicatoria isolates from Tanzania to copper and implications for bacterial spot management[J]. African Journal of Microbiology Research, 2014, 8(30): 2 881-2 885.
[25] Garde S, Bender CL. DNA probes for detection of copper resistance genes in Xanthomonas campestris pv. vesicatoriat[J]. Applied and Environmental Microbiology, 1991, 57(8): 2 435-2 439.
[26] 王 君. 硫酸铜诱导对柑橘溃疡病菌抗铜性及抗铜相关基因表达的影响[D]. 武汉: 华中农业大学, 2010.
[27] Gaetke L M, Chow C K. Copper toxicity, oxidative stress, and antioxidant nutrients[J]. Toxicology, 2003, 189(1-2): 147-163.
[28] Gaggelli E, Kozlowski H, Valensin D, et al. Copper homeostasis and neurodegenerative disorders (Alzheimer's, prion, and parkinson's diseases and amyotrophic lateral sclerosis)[J]. Chemical Reviews, 2006, 106(6): 1 995-2 044.
[29] K Balamurugan, W Schaffner. Copper homeostasis in eukaryotes: teetering on a tightrope[J]. Biochimica et Biophysica Acta-biomembranes, 2006, 1763(7): 737-746.
[30] Rensing C, Grass G. Escherichia coli mechanisms of copper homeostasis in a changing environment[J]. Fems Microbiology Reviews, 2003, 27(2-3): 197-213.
[31] 刘 星, 王希东, 刘 君. 西瓜食酸菌RND蛋白家族外排转运体cusB基因抗铜功能研究[J]. 微生物学通报, 2016, 43(1): 97-106.
[32] 李 强. 瓜类果斑病菌多铜氧化酶基因CueO的功能研究[D]. 呼和浩特: 内蒙古农业大學, 2014.
[33] Hsiao Y M, Liu Y F, Lee P Y, et al. Functional characterization of copA gene encoding Multicopper Oxidase in Xanthomonas campestris pv. campestris[J]. Journal of Agricultural & Food Chemistry, 2011, 59: 9 290-9 302.
[34] 吴亚男. Xanthomonas gardneri抗铜基因copB的克隆及功能鉴定[D]. 长沙: 湖南农业大学, 2012.

