葡萄糖酸钙联合硫酸镁预防奥沙利铂在结直肠癌患者神经毒性治疗中的应用
张利东 梁蔓逸
【摘要】 目的 探究葡萄糖酸钙与硫酸镁联合用于预防奥沙利铂在结直肠癌患者治疗中神经毒性的作用。方法 100例结直肠癌患者作为研究对象, 根据治疗方案的不同将患者分为观察组和对照组, 各50例。对照组患者单一采用奥沙利铂方案化疗, 观察组患者在对照组的化疗方案治疗基础上加用葡萄糖酸钙和硫酸镁治疗, 对比分析两组患者的神经毒性反应。结果 观察组患者的神经毒性发生率10%明显低于对照组的28%, 差异有统计学意义(P<0.05);观察组患者在神经毒性反应分级程度优于对照组, 差异有统计学意义(P<0.05)。结论 对结直肠癌采用奥沙利铂治疗患者预防性采用葡萄糖酸钙和硫酸镁能起到较好的预防神经毒性作用, 提高患者的生存质量, 值得临床对其加强相关研究。
【关键词】 葡萄糖酸钙;硫酸镁;奥沙利铂;结直肠癌;神经毒性
DOI:10.14163/j.cnki.11-5547/r.2016.34.007
Application of calcium gluconate combined wtih magnesium sulfate in the treatment of neurotoxicity in colorectal cancer patients ZHANG Li-dong, LIANG Man-yi. Department of Medical Oncology, Guangdong Puning City Peoples Hospital, Puning 515300, China
【Abstract】 Objective To investigate effect by calcium gluconate combined wtih magnesium sulfate in the treatment of neurotoxicity in colorectal cancer patients. Methods A total of 100 patients with colorectal cancer as study subjects were divided by different treatment regimens into observation group and control group, with 50 cases in each group. The control group received single oxaliplatin regimen for chemotherapy, and the observation group received additional calcium gluconate and magnesium to chemotherapy regimen in the control group. Neurotoxic reactions were compared and analyzed between the two groups. Results The observation group had obviously lower incidence of neurotoxicity as 10% than 28% in the control group, and the difference had statistical significance (P<0.05). The observation group had better neurotoxic reactions classification degree than the control group, and the difference had statistical significance (P<0.05). Conclusion Preventive implement of calcium gluconate and magnesium sulfate for colorectal cancer patients in oxaliplatin treatment can provide excellent prevention effect of neurotoxicity and improvement in quality of life. This method is worth further clinical study.
【Key words】 Calcium gluconate; Magnesium sulfate; Oxaliplatin; Colorectal cancer; Neurotoxicity
奧沙利铂是第三代铂类抗癌药物, 其对多种肿瘤细胞均有较为显著的抑制作用, 不少对顺铂、卡铂耐药的肿瘤细胞[1], 奥沙利铂也能起到抑制作用。目前, 奥沙利铂已在肺癌、卵巢癌、胃癌、结直肠癌等恶性肿瘤治疗中得到广泛应用, 但是与其他化疗药物一样, 奥沙利铂也存在一定的毒副反应[2, 3], 大大限制了其在临床上的广泛、持续性应用, 奥沙利铂的毒副反应主要表现为外周神经病变, 目前临床上尚无特效的预防神经毒性方法, 多数学者认为神经毒性的发生与铂蓄积毒性和代谢产物毒性有关[4], 在预防上, 钙离子通道阻滞剂、中药制剂等能取得一定效果。本院对50例采用奥沙利铂化疗的结直肠癌患者预防性使用葡萄糖酸钙和硫酸镁, 有效预防了神经毒性的发生, 现报告如下。
1 资料与方法
1. 1 一般资料 选取2013年9月~2016年6月收治的100例结直肠癌患者, 全部患者均经组织病理学检查诊断为结直肠癌, 预计生存期≥3个月, Karnofsky功能状态评分标准(KPS)评分≥80分, 有可测量的病灶, 排除合并神经系统疾病、糖尿病、脑转移患者, 排除有酗酒史患者。根据治疗方法的不同将患者分为观察组和对照组, 各50例。观察组中男32例, 女18例, 年龄53~67岁, 平均年龄(59.3±3.2)岁, 结肠癌21例, 直肠癌29例。对照组中男35例, 女15例, 年龄55~65岁, 平均年龄(60.1±3.5)岁, 结肠癌18例, 直肠癌32例。两组患者年龄、性别、病情等一般资料比较差异无统计学意义(P>0.05), 具有可比性。
1. 2 方法 两组患者均采用奥沙利铂化疗方案治疗, 具体为:第1天将135 mg/m2奥沙利铂溶于250 ml 5%葡萄糖注射液中给予患者静脉滴注, 在2~3 h滴注完;在第1~14天口服卡培他滨1000 mg/m2, 2次/d。21 d为1个治疗周期, 连续治疗8个周期。
观察组患者在奥沙利铂化疗方案的基础上采用葡萄糖酸钙和硫酸镁治疗, 在每个周期奥沙利铂化疗当天将250 g/L
硫酸镁注射液10 ml和100 g/L葡萄糖酸钙注射液10 ml溶入到50 g/L葡萄糖注射液100 ml中给予患者静脉滴注。
1. 3 观察指标及评价标准 观察两组患者的神经毒性发生率、神经毒性的分级情况。神经毒性的分级:1级:在遇冷时感觉异常或是感觉迟钝, 在1周内完全消退。2级:患者感觉异常或者迟钝, 在21 d内完全消退。3级:患者感觉异常或者迟钝, 在21 d内无法完全消退。4级:患者感觉异常或迟钝, 并且伴有部分神经功能障碍。
1. 4 统计学方法 采用SPSS19.0统计学软件处理数据。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2 检验;等级资料采用秩和检验。P<0.05表示差异有统计学意义。
2 结果
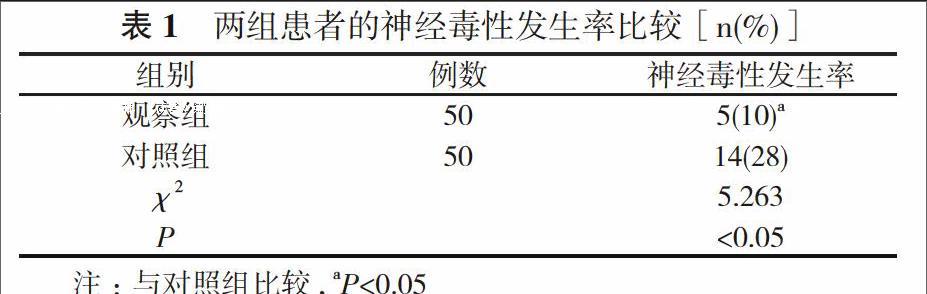
2. 1 两组患者的神经毒性发生率比较 观察组患者的神经毒性发生率为10%, 对照组患者的神经毒性发生率为28%, 两组比较差异有统计学意义(P<0.05)。见表1。
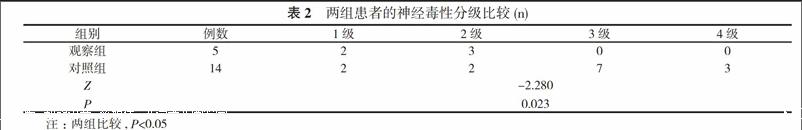
见表2。
3 讨论
奥沙利铂与其他铂类药物引起的毒副反应存在一定的差异, 其主要可能诱发轻中度的恶心呕吐反应, 在血液毒性反应上主要表现为轻度的白细胞减少和血小板减少, 一般不会对肝肾功能造成严重影响, 其主要毒副反应表现为外周神经病变, 其中感觉神经的病变是最为常见的[5]。奥沙利铂引起的神经毒性反应可以分成两种, 一种是急性的短暂性神经毒性, 另一种是慢性的延迟性、累积性神经毒性[6]。其中前者的主要诱因是冷刺激, 一般在用药后数小时内疚出现症状, 持续的时间较短;后者则是在多周期用药后出现的毒性蓄积反应, 表现出剂量依赖性, 与用药剂量、输注持续时间、累积剂量等密切相关, 一般在停药后可得到缓解和控制。奥沙利铂引起神经毒性反应的主要损伤部位为脊髓背根神经元, 由于奥沙利铂的清除速度低于蓄积速度, 因而更容易出现神经毒性反应[7, 8]。由于奥沙利铂的神经毒性反应存在剂量依赖性, 因而限制奥沙利铂暴露能降低神经毒性反应。在早期的临床研究中, 不少学者认为患者出现神经毒性反应后, 停止使用奥沙利铂, 随着病情的进展再次使用奥沙利铂治疗, 并不一定总是伴随着神经毒性反应, 因此有学者提出在确定剂量诱导治疗后, 有计划性的停用奥沙利铂能在一定程度上减低神经毒性风险[9-11]。
对结直肠癌患者采用奥沙利铂化疗治疗中, 为预防神经毒性反应的发生, 本院对患者预防性使用葡萄糖酸钙和硫酸镁治疗[12, 13]。由于奥沙利铂诱发神经毒性反应的机制主要为:奥沙利铂的代谢物草酸盐会与钙形成螯合物, 从而选择性的作用于钙依赖性Na+通道, 使得Na+内流幅度和动作电位减弱, 奥沙利铂的反复使用可能会阻碍神经递质释放、基因表达等的Na+通道, 最终导致神经毒性反应的发生[14-16]。针对这一机制, 作者认为在采用奥沙利铂治疗过程中, 只要能直接控制草酸盐就很可能预防神经毒性的发生。钙和镁离子可以与奥沙利铂代谢物草酸盐螯合形成螯合物, 对结直肠癌采用奥沙利铂治疗的患者, 预防性的使用钙、镁离子注射液能在一定程度上预防神经毒性反应发生。硫酸镁在临床上被广泛用于妊高症的治疗中, 其能预防子痫的发生, 能控制中枢神经系统的突触传递, 抑制神经纤维的应激性[17-19], 故而将其与葡萄糖酸钙联合用于治疗预防奥沙利铂的神经毒性上, 能有效降低神经毒性发生率。本研究结果显示:观察组患者的神经毒性发生率明显低于对照组, 差异有统计学意义(P<0.05), 表明葡萄糖酸钙和硫酸镁的应用效果确切, 能有效降低神经毒性反应的发生率。另外, 观察组出现神经毒性的患者在严重程度上明显低于对照组, 差异有统计学意义(P<0.05), 表明预防性使用葡萄糖酸钙和硫酸镁后, 即使出现神经毒性反应, 一般较为轻微, 经过对症处理后即可得到缓解。关于慢性神经毒性反应上, 有学者认为其可能是急性神经毒性反应长期作用的结果, 而葡萄糖酸钙和硫酸镁联合应用不仅能预防急性神经毒性反应, 也能预防慢性神经毒性反应。邓伟婧等[20]的研究指出:在奥沙利铂化疗胃肠癌的神经毒性预防方案上, 葡萄糖酸钙+硫酸镁、神经节苷脂均能起到一定的预防作用, 而防治作用则与奥沙利铂的用药持续时间、给药时间等有关。
综上所述, 奥沙利铂治疗结直肠癌患者中, 采用葡萄糖酸钙联合硫酸镁能起到一定的预防神经毒性反应效果, 减轻患者化疗过程中的神经毒性反应, 促使患者能耐受化疗, 提高患者的生存质量。为更好发挥奥沙利铂的作用, 临床上还应加强对其神经毒性发生机制等的研究, 以研究出更多有效的预防性方案, 提高患者的生存质量。
参考文献
[1] 蒋一玲, 陆帅. 葡萄糖酸钙和硫酸镁预防奥沙利铂对晚期结直肠癌患者的神经毒性. 肿瘤学杂志, 2012, 18(12):960-963.
[2] 郑林静. 奥沙利铂与顺铂联合5-氟尿嘧啶治疗结直肠癌疗效及安全性比较. 实用药物与临床, 2012, 15(9):607-608.
[3] 潘海燕, 关晓东, 张百萌, 等. 转移性结直肠癌XELOX与FLOFOX6治疗方案的临床疗效与毒副反应观察. 胃肠病学和肝病学杂志, 2016, 25(2):144-147.
[4] 茅慧, 石燕, 戴廣海, 等. 西妥昔单抗联合FOLFOX 4方案一线治疗转移性结直肠癌的临床观察. 临床肿瘤学杂志, 2012, 17(4):356-359.
[5] 刘慧龙, 王莉, 贾佳, 等. 奥沙利铂治疗结直肠癌相关神经毒性的临床观察及随访. 中国肿瘤临床, 2013, 40(12):725-729.
[6] 徐烨, 陈诚豪, 包向东, 等. 自拟三仙汤防治结直肠癌术后CapeOX化疗副作用的临床研究. 中国现代医生, 2016, 54(20):
125-128, 132.
[7] 申思, 吕春梅, 冯海燕, 等. 奥沙利铂神经毒性反应的防治及护理进展. 实用临床医药杂志, 2016, 20(10):197-200.
[8] 李风君. 奥沙利铂致外周神经毒性反应防治研究进展. 护理研究, 2012, 26(6):481-483.
[9] 李明颖, 徐建明, 宋三泰. 奥沙利铂的神经毒性机理与防治方法研究进展. 中华医学杂志, 2006, 86(19):1365-1367.
[10] 陈清华. 中西医结合治疗奥沙利铂致神经毒性24例. 河南中医, 2011, 31(9):1034.
[11] 李敬瑜, 孙珏. 奥沙利铂神经毒性防治思路与方法. 亚太传统医药, 2016, 12(15):94-97.
[12] 李双凤, 舒亚花. 奥沙利铂化疗所致神经毒性反应的预防护理. 安徽医药, 2008, 12(7):665.
[13] 刘素, 张侠. 奥沙利铂神经毒性机制及基因多态性研究进展. 中华临床医师杂志(电子版), 2015(9):163-167.
[14] 刘杨正, 石年. 奥沙利铂神经毒作用模式及防治研究进展. 毒理学杂志, 2015(2):144-147.
[15] 陈小兵, 吕慧芳, 陈贝贝, 等. 奥沙利铂神经毒性机制及防治研究进展. 中国医药科学, 2012, 2(3):38-40.
[16] 董雪, 李平. 奥沙利铂神经毒性机制和预防研究进展. 中国临床保健杂志, 2007, 10(2):215-218.
[17] 张玉锋. 硫辛酸联合葡萄糖酸钙及硫酸镁对恶性肿瘤化疗所致的周围神经病变的疗效观察. 实用癌症杂志, 2015, 30(8):1253-1256.
[18] 缪继东, 蔡典琨. 钙镁合剂联合谷胱甘肽减少奥沙利铂相关神经毒性的随机对照研究. 实用医院临床杂志, 2011, 8(6):113-115.
[19] 王强. 黄芪桂枝五物汤手足浴联合钙镁合剂防治奥沙利铂神经毒性的临床观察. 现代中西医结合杂志, 2015, 24(3):318-320.
[20] 邓伟婧, 刘丽阳. 不同方案对奥沙利铂化疗胃肠癌神经毒性的预防效果. 西南国防醫药, 2016, 26(8):887-889.
[收稿日期:2016-12-19]

