具有核/壳结构的明胶/海藻酸钠缓释微球的制备及释药性能
赵蕊,肖涛,王亚丽,刘力宏,雷霆
具有核/壳结构的明胶/海藻酸钠缓释微球的制备及释药性能
赵蕊1,肖涛2,王亚丽1,刘力宏2,雷霆1
(1. 中南大学粉末冶金国家重点实验室,长沙 410083;2. 中南大学湘雅二医院,长沙 410011)
以液体石蜡作为油相,Span-80为乳化剂,戊二醛为交联剂,采用乳化交联法制备载硫酸庆大霉素的明胶缓释微球,将载药明胶缓释微球和海藻酸钠以一定的质量比加入异辛烷中,用CaCl2交联海藻酸钠,制备具有核/壳结构的载硫酸庆大霉素的明胶/海藻酸钠缓释微球,分别考察微球的形态和粒径,测定其包封率、载药量和体外释放曲线。结果表明:明胶/海藻酸钠缓释微球呈圆球形,表面光滑无皱、形态规整,粒径约为109mm,硫酸庆大霉素的载药量为29.32 µg/mg,包封率为58.64%,在磷酸盐缓冲液(PBS)中14 d的累积释放量为60.69%,表明核/壳结构的明胶/海藻酸钠缓释微球有显著的缓释性能,具有良好的潜在应用前景。
核/壳结构;明胶/海藻酸钠微球;乳化交联法;硫酸庆大霉素;缓释
微球作为药物缓释载体能够满足临床的不同需求而成为当前国内外学者关注的热点[1−2]。具有生物相容性和降解性,又有一定机械强度和稳定性的高分子材料在微球的应用中起到了非常重要的作用[3]。明胶是一种来源丰富的天然高分子材料,有着与胶原极为相似的氨基酸结构,因此,明胶继承了胶原优异的生物功能, 具有良好的生物相容性和生物降解性,是制备药物载体的主要原料,明胶微球具有良好的缓控释放药物的功能而被广泛研究[4−5]。海藻酸钠是从褐藻类的海带或马尾藻中提取的天然高分子多糖碳水化合物[6]。海藻酸钠有良好的生物降解性、生物相容性以及生物粘附性,来源丰富且成本低廉,广泛应用于医学领域、食品工业和日用化工业[7]。在生物医学方面,将海藻酸钠微球作为包埋药物、蛋白与细胞的载体,能够起到防止包覆物突释,控制包覆物释放速度的作用[8]。目前研究最广泛的是单一成分的载药微球,如聚乳酸微球[9]、壳聚糖微球[10−11]和明胶微球[12]等,其结构相对疏松,释放过程中,小分子药物容易出现突释现象,难以实现良好的缓释效果。为此,采用共混改性法制备的复合微球如壳聚糖/明胶微球[13]、壳聚糖/海藻酸钠微球[14]、海藻酸钠/羟基磷灰石复合微球[15−16]以及三元纳米羟基磷灰石/壳聚糖/明胶微球[17]等则表现出更有利的小分子药物的包埋和缓释效果。本文以硫酸庆大霉素作为模型药物,将药物负载于明胶微球作为核,再包覆一层海藻酸钠作为壳层,制备一种具有核/壳结构的载硫酸庆大霉素的明胶/海藻酸钠微球,以期进一步减缓药物释放速率,减小累积释放量。这种具有核/壳结构的载药微球的研究还鲜见文献报道,希望本研究工作能为药物缓释提供一种更为可行和有效的新途径。
1 实验
1.1 实验材料
明胶(化学纯,国药集团化学试剂有限公司),海藻酸钠(化学纯,国药集团化学试剂有限公司),庆大霉素(USP,Cassion Laboratories,USA),戊二醛(50%)(分析纯,成都市科龙化工试剂厂),Span-80(分析纯,天津市大茂化学试剂厂),吐温80(分析纯,天津市科密欧化学试剂有限公司),液体石蜡(分析纯,天津市致远化学试剂有限公司),异辛烷(分析纯,国药集团化学试剂有限公司),氯化钙(分析纯,天津市科密欧化学试剂有限公司)。
1.2 制备方法
1.2.1 明胶微球的制备
采用乳化交联法制备明胶微球。配置质量浓度为20%的明胶溶液作为水相,置于60℃的水浴锅中预热,配置含有0.05 g/mL Span-80的液体石蜡溶液作为油相,置于三口烧瓶中,水油相的体积比为1:6。将预热的明胶溶液逐滴加到油相中,边滴加边搅拌,滴加完后乳化10 min,迅速将三口烧瓶转移到0 ℃的冰水浴中,20 min后,滴加0.4 mL戊二醛(50%)交联1 h。取出溶液,加入体积比为5:1的丙酮/水溶液,静置,过滤出下层淡黄色明胶微球,将过滤出的明胶微球置于丙酮溶液中,在5 ℃以下的环境中固化24 h,先用丙酮/水溶液洗涤,再分别用丙酮和蒸馏水充分洗涤,室温干燥,过筛并分装。
1.2.2 载药明胶微球的制备
用PBS(pH=7.4)缓冲溶液配置50 µg/mL的硫酸庆大霉素溶液,然后准确称量3 mg明胶微球,浸泡于30 mL上述硫酸庆大霉素PBS溶液中,室温下摇床振荡48 h。10000 r/min离心10 min,用PBS溶液清洗明胶微球3遍,收集硫酸庆大霉素明胶微球,干燥后备用。
1.2.3 核壳结构载药明胶/海藻酸钠微球的制备
配置2%的海藻酸钠溶液,离心后过滤,作为水相待用。配置含有5% Span-80和0.5%吐温80的异辛烷溶液作为油相,在油相中加入载药明胶微球(明胶微球与海藻酸钠的质量比为1:15),搅拌均匀,置于三口烧瓶中在40 ℃水浴锅中预热10 min后,高速乳化10 min。取水油相的体积比为1:1,将海藻酸钠溶液逐滴加入油相中,边滴加边搅拌,搅拌30 min后,逐滴加入8%的CaCl2溶液并继续搅拌乳匀30 min,用无水乙醇和蒸馏水充分洗涤,室温干燥后过筛,备用。
1.3 明胶/海藻酸钠微球表征方法
用Nova Nano SEM230场发射扫描电镜(SEM)观察微球的表面形貌,用Micro−Plus型激光粒度分析仪测定微球的粒径以及粒径分布,采用美国Nicolet− 6700型傅里叶变换红外光谱进行FTIR 分析(KBr压片法),用U5100型紫外分光光度计测定硫酸庆大霉素的吸光特性。
1.4 硫酸庆大霉素明胶/海藻酸钠微球的载药量与包封率
1.4.1 标准曲线的绘制
准确称量硫酸庆大霉素0.02,0.03,0.04,0.05和0.06 g,分别置于100 mL容量瓶中,加入少量0.02 mol/L的PBS(pH=7.4)缓冲溶液使其充分溶解后,再继续缓慢加入缓冲液定容至刻度,分别配置浓度为200,300,400,500和600 µg/mL的硫酸庆大霉素溶液。精密吸取上述5种溶液各1 mL于10 mL的容量瓶中,加入3 mL浓硫酸在100 ℃水浴30 min,冷却,然后加入约3 mL的PBS缓冲液,充分振荡摇匀,冷却后继续加入PBS缓冲液定容至刻度。测定各标准溶液在232 nm下的紫外吸收值,绘制硫酸庆大霉素溶液浓度与吸光度的标准曲线。
1.4.2 载药量和包封率的测定
制备载药明胶微球时,收集离心液和PBS清洗液,取收集液1 mL,加入浓硫酸,水浴30 min,测定溶液在232 nm下的紫外吸收值,从标准曲线中获得对应的硫酸庆大霉素浓度,记为1,投入的硫酸庆大霉素的总量记为0,明胶微球的质量记为g,载药量()和包封率()的计算公式如下:
=(0−1)/g(1)
=(0−1)/0×100% (2)
1.5 硫酸庆大霉素明胶/海藻酸钠微球的体外释放 性能
准确称取30 mg硫酸庆大霉素明胶/海藻酸钠微球,置于30 mL PBS缓冲液中,进行磁力搅拌。在1 h,2 h,4 h,8 h,12 h,24 h,3 d,7 d和14 d时间点停止磁力搅拌,稍作静置后,取1 mL上清液,同时向样品中补充同体积的缓释液。将取出的上清液在2000 r/min离心10 min后,取出离心液,经硫酸处理后,用紫外分光光度计测定溶液在232 nm下的紫外吸收值,由标准曲线得到对应取样时间点样品溶液中硫酸庆大霉素的含量。计算出硫酸庆大霉素的缓释累计百分比,并绘制体外缓释曲线。
2 结果与讨论
2.1 明胶微球以及核/壳结构明胶/海藻酸钠微球的 形态和粒径
在种子乳液聚合法中,当种子聚合与后续聚合采用不同的单体时,可以得到核/壳结构颗粒。本研究采用类似于种子乳液聚合法的方法,将明胶微球加入含有乳化剂的油相中,明胶微球被乳化剂包裹形成“种子”,后续加入的海藻酸钠以明胶微球为核,形成核/壳结构的明胶/海藻酸钠微球。采用扫描电镜观察所制备的明胶微球和明胶/海藻酸钠微球的表面形貌,结果如图1所示。从图1(a)可见,明胶微球呈圆球形,大小分布较为均匀,分散性较好,球体表面光滑无皱褶,微球之间无团聚粘连的现象。图1(b)和(c)分别为明胶微球与海藻酸钠的质量比分别为1:10和1:15时所制备的核/壳结构微球的电镜照片。从图1(b)可以看出,当质量比为1:10时,存在部分海藻酸钠未完全包覆的明胶微球,部分微球形状不规则,扭曲;当质量比为1:15时,海藻酸钠将明胶微球完全包覆,得到完整的具有核/壳结构的明胶/海藻酸钠微球,微球表面光滑,球形度好,海藻酸钠包覆明胶微球后的球径略有变大。
明胶微球和核/壳结构明胶/海藻酸钠微球的激光粒度分布如图2所示。从图中可知,明胶微球粒径呈正态分布,大部分微球分布在52.43~132.73 µm范围内,平均粒径约为91 µm,核/壳结构明胶/海藻酸钠微球的粒径主要分布在72.61~151.37 µm范围内,平均粒径约为109 µm,较明胶微球的粒径略有增大,这一粒度分布结果与图1的电镜照片结果一致。

图1 明胶和明胶/海藻酸钠微球的SEM照片

图2 明胶和明胶/海藻酸钠微球的激光粒度分布

图3 明胶微球的能谱分析
2.2 明胶/海藻酸钠微球的能谱分析和红外光谱分析
图3所示为对明胶微球指定区域扫描的能谱分析,结果显示明胶微球主要含有C,N和O元素,这与明胶的多肽结构组成元素是一致的。由前面形貌表征结果可知,当明胶微球与海藻酸钠的质量比为1:10时,海藻酸钠并不能完全包覆明胶微球,对包覆不完全的微球的壳层和核部位分别进行能谱分析,结果如图4所示。图4(b)和(c)分别是未包覆完全的微球的内层和外层能谱分析结果。从图4(b)可见,未包覆完全的明胶/海藻酸钠微球的内层含有7.71%(质量分数,下同)的N元素,说明微球内层作为核的部分是明胶微球。相比于单纯明胶微球中19.22%的N含量,较低的N含量是由于在其表面存在海藻酸钠包覆层的缘故,虽然海藻酸钠还没有形成完整的壳层。进一步从图4(c)发现,未包覆完全的明胶/海藻酸钠微球的外层也含有N元素,含量为1.75%,说明外层主要是海藻酸钠壳层,而海藻酸钠的组成中不含有N元素,因此,壳层中检测出的N元素只能来自于作为核的明胶微球,之所以能谱中检测出N元素,是由于X射线有较深的穿透距离,穿透壳层到达了明胶核层部分。
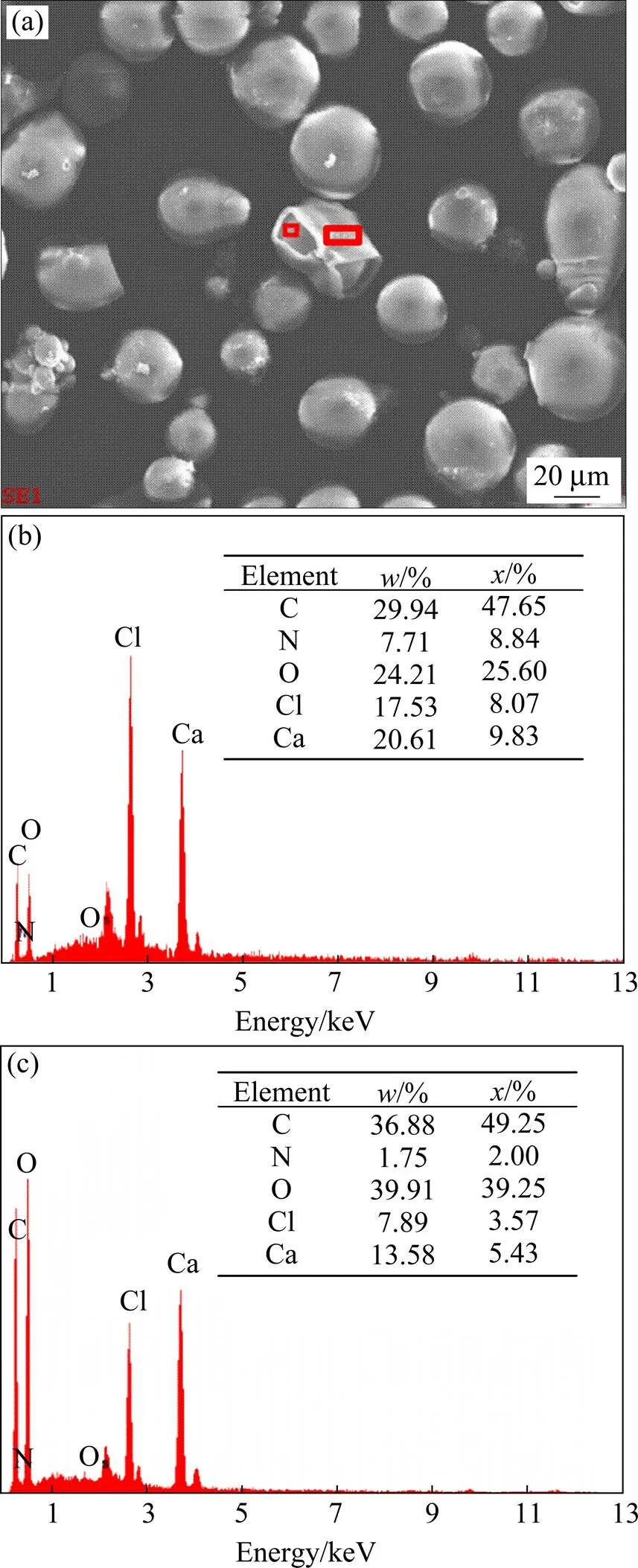
图4 明胶/海藻酸钠微球不同部位的能谱分析
将明胶微球、海藻酸钠微球以及明胶/海藻酸钠微球进行红外光谱分析,结果如图5所示。从图中可见,海藻酸钠上存在大量的羧羟基(COO—H),由于分子间氢键的形成,COO—H伸缩振动在波数 3426 cm−1处出现一个宽而强的吸收峰[18],1628 cm−1处为海藻酸钠羰基的红外特征吸收峰,在1084 cm−1处的吸收峰为吡喃环化合物C—O—C的伸缩振动。明胶的N—H伸缩振动在3426 cm−1处出现宽的红外吸收带,此外,在波数为1628 cm−1和1506cm−1处还观察到明胶结构中酰胺Ⅰ带(C=O基团的伸缩振动)和酰胺Ⅱ带(NH弯曲振动)的吸收峰,酰胺Ⅲ带的吸收峰(N—H伸缩振动)出现在波数1223 cm−1处。核壳结构的明胶/海藻酸钠微球保留了明胶和海藻酸钠的特征吸收峰,如在 1627 cm−1和1530 cm−1处出现酰胺Ⅰ带和酰胺Ⅱ带的吸收峰,海藻酸钠的C—O—C伸缩振动从波数1084 cm−1移动到1094 cm−1,表明海藻酸钠的醚键和明胶的氨基之间有氢键形成[19],这些特征峰的存在证明核壳结构微球中含有明胶和海藻酸钠成分。
由微球经海藻酸钠包覆后的粒径增大和微球的能谱分析与红外光谱分析结果可知,该方法制备的微球含有明胶以及海藻酸钠,并结合对包覆不完整的微球不同部位的能谱分析结果,说明制备的明胶/海藻酸钠微球具有核/壳结构。
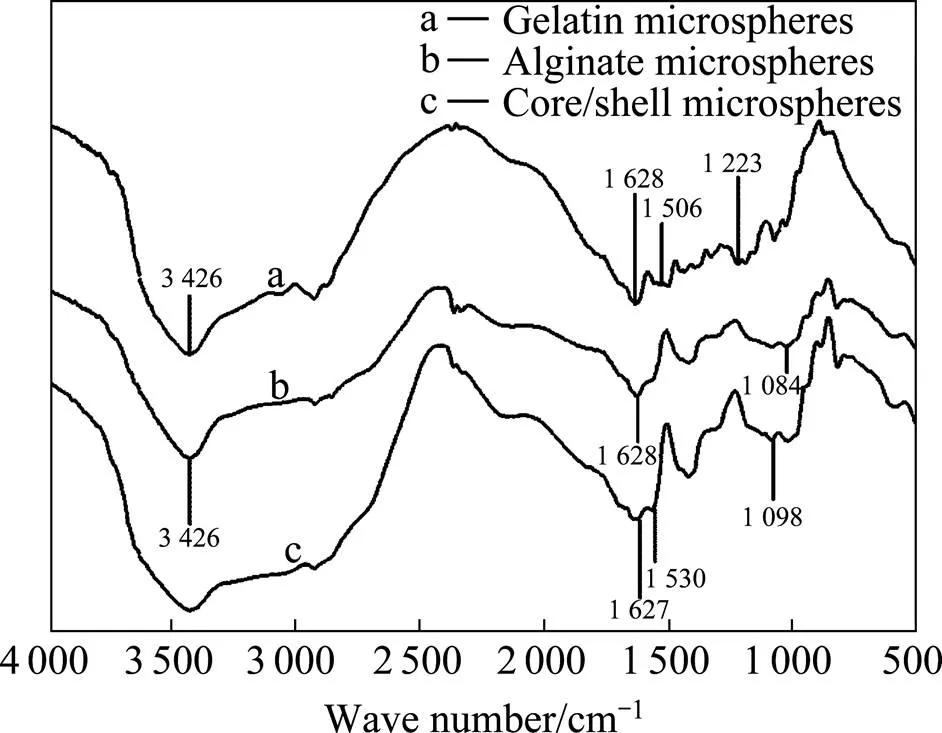
图5 三种微球的红外光谱图
2.3 明胶/海藻酸钠微球的载药性能及体外缓释
采用紫外分光光度计,分别测出浓度为20,30,40,50和60 µg/mL的硫酸庆大霉素的吸光度,绘制出标准曲线,并得出回归方程,结果如图6所示。
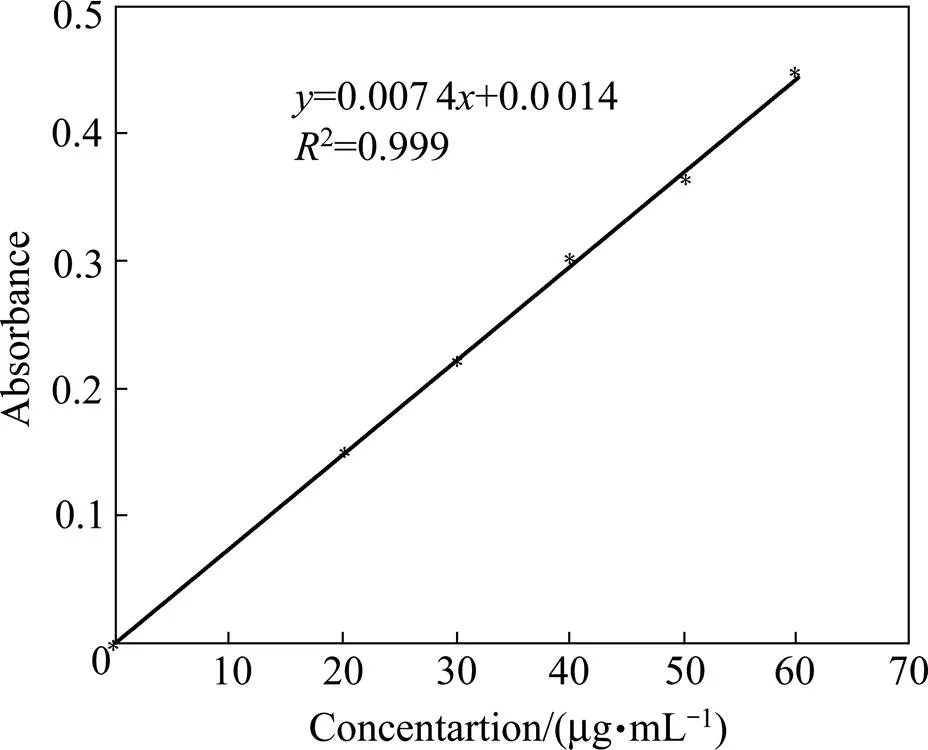
图6 硫酸庆大霉素的标准曲线
收集明胶微球在硫酸庆大霉素PBS溶液中摇床振荡48 h后的上清液,检测其吸光度从而计算出上清液中硫酸庆大霉素的含量,得到明胶微球的载药量为29.32 µg/mg,包封率为58.64%。将体外释放过程中载药明胶微球和载药明胶/海藻酸钠微球各个时间点样品的紫外吸光度带入回归方程,计算出清液中硫酸庆大霉素的含量并获得累计释放百分比。表1和表2所列分别为明胶微球和核/壳结构的明胶/海藻酸钠微球各对应时间点取样清液的吸光度以及累计释放百分比,并绘制硫酸庆大霉素的释放曲线,结果如图7所示。由图中可看出,载药明胶/海藻酸钠微球在前24 h的累计释放量为27.6%,当释放时间达到14 d时,累计释放量仅为60.69%,而单纯的载药明胶微球在前24 h的累积释放量达到38.86%,出现初期突释现象,同样释放14 d的累计释放量达到80.74%。因此与单纯的载药明胶微球相比,载药明胶/海藻酸钠微球对硫酸庆大霉素的释放速率较为缓慢平稳,说明核壳结构的明胶/海藻酸钠微球拥有更好的缓控释放药物的效果。类似的结果在复合微球的载药释放研究中也有文献报道,如卞丽红等[20]将紫杉醇/海藻酸钠微球用壳聚糖再次包覆,制备出紫杉醇/海藻酸/壳聚糖微囊,体外释放结果显示紫杉醇从单纯海藻酸钠微球中释放的速率高于微囊。杨星军等[21]采用层层自组装技术在海藻酸钠核心球的表面依次包覆壳聚糖、海藻酸和壳聚糖,制备了多层海藻酸盐−壳聚糖缓释微球,体外释药平稳持续,无明显突释。一般认为,微球释放药物是透过微囊化的载体材料发生的物理扩散过程,药物释放初期的突释现象是由粘附于载体材料表面药物的快速释放引起,以后的释放是药物按照浓度梯度从微球内部迁移到微球表面释放的结果,遵守扩散控制机制。本工作制备的明胶/海藻酸钠微球具有核壳结构,一方面作为核层的载药明胶微球表面的部分细小孔道一定程度上由于海藻酸钠壳层的包覆而封闭,导致硫酸庆大霉素的扩散通道减少;另一方面由于海藻酸钠壳层作为阻滞层的存在[22],延长了药物扩散释放的路径,使药物通过明胶和海藻酸钠膜层的渗透性下降, 表面粘附药物的快速释放受到抑制,从而可减缓药物分子的释放速率,有效延长释放时间。

表1 明胶微球各时间点样品的吸光度以及释放累计百分比
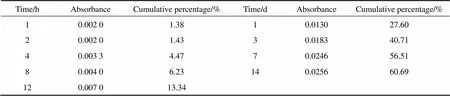
表2 核壳结构微球各时间点样品的吸光度以及释放累计百分比
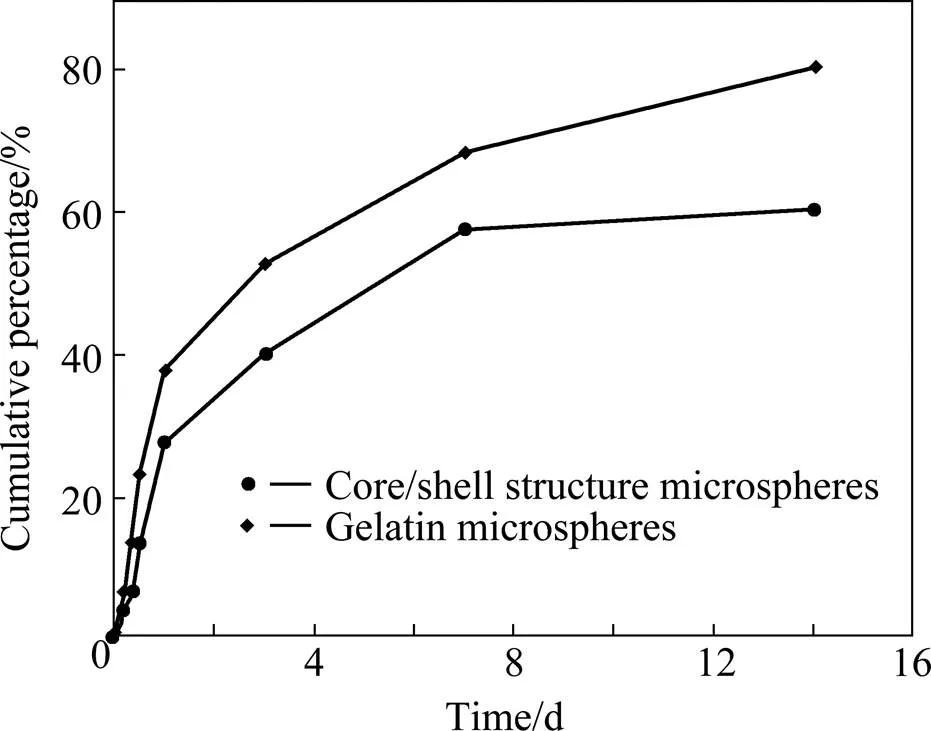
图7 硫酸庆大霉素的体外释放曲线
3 结论
1) 采用乳化交联法制备的明胶微球有较好的球形度,表面光滑,粒度分布均匀。选取明胶微球与海藻酸钠的质量比为1:15,制得具有核/壳结构的明胶/海藻酸钠微球,微球表面光滑圆整,分散性好,平均粒径为109 µm,对硫酸庆大霉素的载药量为29.32 µg/ mg,包封率为58.64%。
2) 载药明胶/海藻酸钠微球释放14 d的累计释放量仅为60.69%,没有出现初期突释现象。
3) 核/壳结构的载药明胶/海藻酸钠微球比单纯载药明胶微球表现出更小的释放速率。
[1] SINHA V R, TREHAN A. Biodegradable microspheres for protein delivery[J]. J Control Release, 2003, 90(3): 261−280.
[2] FREIBERG S, ZHU X X. Polymer microspheres for controlled drug release[J]. Int J Pharm, 2004, 282(1/2): 1−18.
[3] 刘伟, 王莹, 王士斌, 等. 乳化−凝胶化法制备药用载体海藻酸钙微球的研究[J]. 生物医学工程研究, 2007, 26(3): 155− 158. LIU Wei, WANG Ying, WANG Shibin, et al. Preparation of calcium alginate microspheres used for drug carrier by emulsification-gelation method[J]. Journal of Biomedical Engineering Research, 2007, 26(3): 155−158.
[4] ZHANG Shuxia, WANG Yijuan, HUANG Sha, et al. Preparation of gelatin microspheres with different surface structures and the effect of surface morphology on cell proliferation[J]. Journal of Shanxi Normal University, 2009, 37(1): 42−46.
[5] JIANG Dan, TANG Zhaojun, JIANG Yunlei, et al. Preparation and in-vitro degradation of biodegradable gelatin microspheres [J]. Journal of Jilin University, 2008, 46(1): 143−147.
[6] 魏靖明, 张志斌, 冯华, 等. 海藻酸钠作为药物载体材料的研究进展[J]. 化工新型材料, 2007, 8(8): 20−22. WEI Jingming ,ZHANG Zhibin, FENG Hua, et al. Study on alginate as drug carrier material[J]. New Chemical Materials, 2007, 8(8): 20−22.
[7] 吴秋惠, 吴皓, 王令冲, 等. 海藻酸钠微球的制备及其在药物载体中的应用进展[J]. 中华中医药杂志, 2011, 8(8): 1791− 1794. WU Qiuhui, WU Hao, WANG Lingchong, et al. Review on preparation and application of Alginate microspheres as drug carrier[J]. Journal of Chinese medicine, 2011, 8(8): 1791−1794.
[8] CHAN L W, JIN Y, HENG P W S. Cross-linking mechanisms of calcium and zinc in production of alginate microspheres[J]. International Journal of Pharmaceutics, 2002, 242(1/2): 255− 258.
[9] CARBALLIDO A, VANRELL R, MARTINEZ I T, et al. Biodegradable ibuprofen-loaded PLGA microspheres for intraarticular admin-istration: Effect of labrafil addition on release in vitro[J]. International Journal of Pharmaceutics, 2004, 279(1/2): 33−41.
[10] CHIOU M S, LI H Y. Adsorption behavior of reactive dye in aqueous solution on chemical cross-lingked chitosan beads[J]. Chemosphere, 2003, 50(8): 1095−1105.
[11] CHIOU M S, HO P Y, LI H Y. Adsorption of anionic dyes in acid solutions using chemically cross-linked chitosan beads[J]. Dyes and Pigments, 2004, 60(1): 69−84.
[12] PENG Z Y, SHEN Y Q, LI Z P. Control of size and morphology of gelatin microspheres[J]. Journal of Macromolecular Science, 2012, 51: 12−21.
[13] 周佳男, 周智华, 孔令臣, 等. 壳聚糖/明胶复合微球的制备[J]. 粉末冶金材料科学与工程, 2011, 16(5): 787−793. ZHOU Jia’nan, ZHOU Zhihua, KONG Lingchen, et al. Preparation of chitosan/gelatin composite microsphere[J]. Materials Science and Engineering of Powder Metallurgy, 2011, 16(5): 787−793.
[14] ZHANG Y, WEI W, LÜ P, et al. Preparation and evaluation of alginate-chitosan microspheres for oral delivery of insulin[J]. Eur J Pharm Biopharm, 2011, 77(1): 9−11.
[15] KIMURA I, HONMA T, RIMAN R E. Preparation of hydroxyapatite microspheres by interfacial reaction in a multiple emulsion[J]. J Ceram Soc Jpn, 2007, 115(1348): 888−893.
[16] CHEN B H, CHEN Kang I, HO Meiling, et al. Synthesis of calcium phosphates and porous hydroxyapatite beads prepared by emulsion method[J]. Materials Chemistry and Physics, 2009, 113(1): 365−371.
[17] 黄大建, 张文熊, 刘晶冰, 等. 纳米羟基磷灰石/壳聚糖−明胶微球的制备及性能[J]. 中国组织工程研究与临床康复, 2009, 13(16): 3097−3100. HUANG Dajian,ZHANG Wenxiong, LIU Jingbing, et al. Preparation and performance of nanohydroxyapatite/chitosan- gelatin composite microspheres[J]. Journal of Clinical Rehabilitative Tissue Engineering Research, 2009, 13(16): 3097−3100.
[18] 崔园园, 陈红, 周丰, 等. 海藻酸钠−胰蛋白酶微球的制备及药物释放性能[J]. 复合材料学报, 2011, 28(2): 117−122. CUI Yuanyuan, CHEN Hong, ZHOU Feng, et al. Preparation and drug release of sodium alginate-trypsin microsphere[J]. Acta Materiae Compositae Sinica, 2011, 28(2): 117−122.
[19] 骆东辉, 刘安妮, 李明芳, 等.131Ⅰ标记海藻酸钠包裹明胶微球的制备及性能评价[J]. 高等学校化学学报, 2011, 31(6): 1412−1417. LUO Donghui, LIU Anni, LI Mingfang, et al. Preparation and performance evaluation of sodium alginate package gelatin microspheres marked by131Ⅰ[J]. Chemical Journal of Chinese Universities, 2011, 31(6): 1412−1417.
[20] 卞丽红, 王洪权, 窦园园, 等. 紫杉醇/海藻酸钠微囊/微球的缓释及抑瘤作用研究[J].军事医学科学院院刊, 2005, 29(2): 152−155. BIAN Lihong, WANG Hongquan, DOU Yuanyuan, et al. Controlled releasing characteristics and cytotoxic activity of alginate-paclitaxel microcapsules/microspheres[J]. Bulletin of the Academy of M ilitary Medical Sciences, 2005, 29(2): 152− 155.
[21] 杨星军, 王琦, 刘志辉, 等. 双重载药多层海藻酸盐−壳聚糖缓释微球的制备及体外释放[J]. 高等学校化学学报, 2015, 36(5): 1025−1032. YANG Xingjun, WANG Qi, LIU Zhihui, et al. Preparation and in vitro release of double drug-loading multilayer-sodium alginate- chitosan microspheres[J]. Chemical Journal of Chinese Universities, 2015, 36(5): 1025−1032.
[22] 南艳微, 郑晓玲. 多层海藻酸−壳聚糖聚电解质膜微球的制备与体外释放特性研究[J]. 中国药房, 2013, 24(17): 1581−1583. NAN Yanwei, ZHENG Xiaoling. Preparation and in vitrorelease study of multilayer-sodium alginate-chitosan microspheres with polyelectrolytes film[J]. China Pharmacy, 2013, 24(17): 1581− 1583.
(编辑 高海燕)
Preparation and drug release characteristics of gelatin/alginate microspheres with core/shell structure
ZHAO Rui1, XIAO Tao2, WANG Yali1, LIU Lihong2, LEI Ting1
(1. State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China; 2. The Secondary Xiangya Hospital, Central South University, Changsha 410011, China)
The gentamycin sulfate-loaded gelatin microspheres were prepared by emulsion-crosslinking method choosing paraffin as oil phase, Span-80 as emulsifier and glutaraldehyde as crosslinking agent. The gentamycin sulfate-loaded gelatin/alginate microspheres with core/shell structure were prepared by adding the drug loaded gelatin microspheres and alginate with different mass ratio in isooctane and subsequently crosslinking through CaCl2. The characterization of surface morphology, particle size, entrapment efficiency, drug loading andin vitro release behavior were studied. The results show that the as-prepared gelatin/alginate microspheres are spherical and intact with smooth surface and possess a mean diameter of 109 μm. The drug loading and encapsulation efficiency of the gentamicin sulfate are up to 29.32 µg/mg and 58.64%, respectively. The cumulative rate of drug-release in PBS solution over 14 days is 60.69%, which indicates satisfactory sustained-release behavior of the gelatin/alginate microspheres with core/shell structure and promises application prospect.
core/shell structure; gelatin/alginate microspheres; emulsion-crosslinking method; gentamycin sulfate; sustained-release
O636
A
1673-0224(2017)02-221-07
国家高技术研究发展计划(863计划) (2015AA033503);中南大学粉末冶金国家重点实验室开放基金资助项目
2016−06−23;
2016−09−28
雷霆,教授,博士。电话:15974242599;E-mail: tlei@mail.csu.edu.cn

