DKI在脑星形细胞瘤分级中的应用及与Ki67的相关性研究
李波良,张 辉,王效春,谭 艳,秦江波,雷 颖,吴晓峰,王 乐,张 磊
DKI在脑星形细胞瘤分级中的应用及与Ki67的相关性研究
李波良1,张 辉2,王效春2,谭 艳2,秦江波2,雷 颖2,吴晓峰2,王 乐2,张 磊2
目的 评价磁共振(MRI)扩散峰度成像(DKI)在脑星形细胞瘤分级中的应用价值,及其与Ki67标记指数的相关性研究。方法 收集经手术病理证实的脑星形细胞瘤病人60例,分为低级别组(WHOⅠ级、Ⅱ级)26例和高级别组(WHOⅢ级、Ⅳ级)34例。病人术前行头颅MRI平扫、增强及DKI扫描,测定肿瘤实质区平均弥散峰度(MK)值、各向异性分数(FA)值及平均扩散系数(MD)值,术后标本行Ki67免疫组化染色,采用独立样本t检验比较,组间DKI各参数值、Ki67表达水平差异;Spearman相关分析DKI各参数值与Ki67相关性。结果 肿瘤实质区,高级别组MK值显著高于低级别组,差异有统计学意义(P=0.001);高级别组MD值显著低于低级别组,差异有统计学意义(P=0.002);FA值在高低级别组间比较,差异无统计学意义(P>0.05)。高级别组瘤体Ki67 29.4%±7.5%表达明显高于低级别组7.4%±2.3%,差异有统计学意义(P<0.001)。MK值(r=0.842;P=0.000)与Ki67具有正相关性;MD值(r=-0.613;P=0.000)与Ki67具有负相关性;而FA值(r=0.058;P=0.601)与Ki67无相关性。结论 DKI参数MK值及MD值在高低级别组脑星形细胞瘤中存在差异,可鉴别高低级别脑星形细胞瘤,与脑星形细胞瘤Ki67表达存在相关性,间接反映肿瘤增殖活性。
脑星形细胞瘤;核抗原Ki67;扩散峰度成像
脑星形细胞瘤是成人常见的颅内原发性肿瘤。肿瘤病理级别不同,病人预后与临床治疗不同,因此对脑星形细胞瘤术前精确分级至关重要。常规磁共振成像(MRI)主要通过对肿瘤的形态及信号特征进行诊断分级,无法反映其复杂的微观病理变化。扩散峰度成像(diffusion kurtosis imaging,DKI)可提供靶组织的病理生理学信息,是常规MRI的补充[1]。脑星形细胞瘤的恶性度主要取决于肿瘤的增殖活性。Ki67是一种与细胞增殖密切相关的核蛋白,是检测细胞增殖活性及评估肿瘤治疗和预后的可靠指标[2]。本研究利用DKI参数鉴别高低级别脑星形细胞瘤的应用价值,初步探讨各参数值与ki67的相关性。
1 资料与方法
1.1 临床资料 选择山西医科大学第一医院2014年3月—2016年12月接受MRI常规检查及DKI扫描,且术后病理证实为脑星形细胞瘤病人60例,男26例,女34例,年龄34岁~76岁,平均56岁。按WHO2007年脑肿瘤分级标准,低级别脑星形细胞瘤(Ⅰ级、Ⅱ级)26例和高级别组(Ⅲ级、Ⅳ级)34例。
1.2 检查方法 MR扫描方法:使用GE3.0T超导型MRI仪,采用八通道头颈联合拓扑相控阵线圈进行MRI扫描。行常规MRI扫描(T1WI、T2WI、T2 FLAIR及T1WI增强扫描)及DKI扫描。常规MRI序列参数:T1WI及T1WI增强扫描序列参数(TR:1 676 ms,TE:24 ms,FOV:4.8 cm,层厚6.0 mm);T2WI序列参数(TR:6 800 ms,TE:107 ms,FOV=24 cm,层厚:6.0 mm);T2FLAIR序列参数(TR:8 002 ms,TE:127.8 ms,FOV=24 cm,层厚:6.0 mm)。马根维显(0.1 mmol/kg)用于T1WI增强扫描。DKI扫描序列采用平面回波序列,扫描参数,TR:6 500 ms,TE:115 ms,FOV=24 cm ,层厚:6.0 mm,30个扩散敏感梯度场,b值分别为0 s/mm2、1 000 s/mm2、2 000 s/mm2。
1.3 数据处理 在GE Advantage Workstation4.4工作站后处理,得到DKI[均弥散峰度(MK)值、各向异性分数(FA)值及平均扩散系数(MD)值]参数图,分别对肿瘤实质画确定感兴趣区(region of interest,ROI),兴趣区选择尽可能避开出血、坏死、囊变区,并测定ROI的DKI(MK、FA、MD)参数值,每个ROI重复测量3次,取平均值。
1.4 病理资料收集方法 所有标本均经HE和Ki67免疫组化染色,采用WHO 2007脑肿瘤分级标准对术后脑星形细胞瘤病理分级,在200倍视野显微镜下,随机选择100个细胞,计算Ki67阳性表达率,重复5次,计算平均表达率。
2 结 果
2.1 两组DKI定量参数及Ki67标记指数比较 高级别组肿瘤实质区MK值显著高于低级别组,差异有统计学意义(P=0.001);高级别组MD值显著低于低级别组,差异有统计学意义(P=0.002)。而FA值在高低级别组间比较,差异无统计学意义(P>0.05);Ki67标记指数在高低级别组间比较,差异有统计学意义(P<0.001)。详见表1。
表1 两组DKI定量参数及Ki67标记指数比较(±s)
2.2 Spearman相关性分析 MK值(r=0.842;P=0.000)与Ki67具有正相关性;MD值(r=-0.613;P=0.000)与Ki67具有负相关性;而FA值(r=0.058;P=0.601)与Ki67无相关性。详见表2。
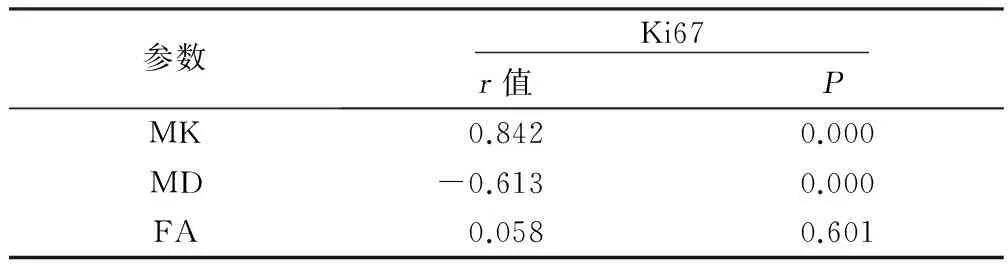
表2 Spearman相关性分析
3 讨 论
脑星形细胞瘤是成人常见的颅内原发性肿瘤,随着病理级别的增高,肿瘤内部含有复杂的细胞结构,更多的新生血管及坏死结构[3],其内部结构的改变导致水分子明显受限,并偏离高斯分布,扩散峰度成像(diffusion kurtosis imaging,DKI)是DTI技术的延伸,为描绘组织内非高斯分布水分子扩散的一种新的磁共振成像方法,较传统的DTI技术相比,DKI更适合把握组织微观结构的变化[4]。DKI不仅能获得常规DTI参数FA、MD外,还可以获DKI峰度参数MK。FA值是扩散各向异性成分占整个扩散张量总值比例,反映扩散方向;MD反映水分子整体的弥散水平,MD越大,组织内所含自由水分子越多;MK值主要反映生物组织水分子扩散运动的复杂程度和受限程度,MK值越高说明组织结构越复杂。
关于MD、FA值在鉴别高低级别脑星形细胞瘤的研究一直饱受争议,van Cauter等[5]应用DKI技术对22例高级别胶质瘤和14例低级别胶质瘤研究发现,高级别胶质瘤MD值显著降低;Kinoshita等[6]对15例Ⅱ级~Ⅳ级星形细胞瘤研究发现,FA值与肿瘤细胞密度呈正相关,因此高级别脑星形细胞瘤FA值更高。van Cauter等[7]对17例高级别胶质瘤和11例低级别胶质瘤研究中发现,FA值和MD值在高低级别组间差异无统计学意义。
本研究应用MD值鉴别高低级别脑星形细胞瘤的研究结果与van Cauter等[5]一致,可能是由于高级别脑星形细胞瘤细胞增殖迅速,细胞外间隙相对较小,水扩散因此降低,从而导致高级别脑星形细胞瘤MD值低于低级别组。FA值在鉴别高低级别脑星形细胞瘤研究发现无意义,可能是由于高级别脑星形细胞瘤肿瘤实质区组织水分子弥散方向性与低级别脑星形细胞瘤肿瘤实质区差异不明显。
MK值在高、低级别脑星形细胞瘤的研究结果与国内外比较一致,表现为高级别脑星形细胞瘤MK值
高于低级别者。谭艳等[8]利用DKI技术对60例脑星形细胞瘤研究发现,高级别组脑星形细胞瘤MK值显著高于低级别组。 Raab等[9]利用DKI技术对34例脑星形细胞瘤研究发现,高低级脑星形细胞瘤MK值显著高于低级别,且WHO2级与WHO3级星形细胞瘤之间及WHO4级星形细胞瘤与胶质母细胞瘤之间,其MK值差异也有统计学意义。本研究虽然没利用MK值对不同级别脑星形细胞瘤鉴别进行研究,但同样得到MK值在高低级别脑星形细胞瘤间差异有统计学意义。
Ki67由Gerdes于1983年首先发现并报道,是一种存在于增殖细胞核与细胞增殖密切相关的核蛋白,已广泛应用于肿瘤研究和探讨。Johannessen等[10]通过分析Ki67在脑星形细胞瘤分级中应用,发现Ki67随着脑星形细胞瘤级别增高表达强度增加,Ki67是反映肿瘤增殖及预后的重要指标。本研究发现高级别脑星形细胞瘤Ki67标记指数显著高于低级别组。作为评价细胞增殖的标记物,Ki67是常规检测指标应用于脑星形细胞瘤中,然而Ki67检测须获得肿瘤标本,因此术前对Ki67预测临床意义较大。Rizea等[11]通过对多例不同级别脑胶质瘤病人进行研究发现,肿瘤实质区FA值与肿瘤Ki67值数呈正相关;而MD值与肿瘤Ki67值呈负相关。Beppu等[12]对19例胶质母细胞瘤研究发现FA值与细胞密度、Ki67标记指数(r=0.80,P<0.05)呈负相关。本研究发现,MD值与Ki67呈负相关,FA与Ki67不存在相关性,与他们研究结果部分一致,可能由于本研究纳入病理少,及ROI选取区域不当,或ROI内包含有坏死成分或表达其他胶质瘤组织特性成分。关于MK值与Ki67研究国内外报道较少,Jiang等[13]利用DKI技术对74例胶质瘤病人研究发现,MK值与Ki67呈明显相关性,本研究亦发现MK值与Ki67具有显著正相关性,可能由于肿瘤细胞Ki67表达量越高,肿瘤细胞增殖速度越快,因而细胞外间隙相对较小,水分子弥散受到限制,从而导致MK值升高。
本研究结果表明,DKI参数在鉴别高低级别脑星形细胞瘤中具有一定的价值;DKI参数MD和MK可无创性预测高低级别脑星形细胞瘤细胞增殖水平的差异。
[1] 曾丁巳.扩散峰度成像(DKI)在中枢神经系统的应用[J].临床放射学杂志,2011,30(9):1400-1402.
[2] Alexiou GA,Tsiouris S,Kyritsis AP,et al.Assessment of glioma prolif eration using imaging modalities[J].J Clin Neurosci,2010,17(10):1233-1238.
[3] Basser PJ,Pierpaoli C.Microstructural and physiological features of tissues elucidated by quantitative-diffusion-tensor MRI[J].J Magn Reson,2011,213(2):560-570.
[4] Hui ES,Cheung MM,Qi L,et al.Towards better MR characterization of neural tissues using directional diffusion kurtosis analysis[J].Neuroimage,2008,42(1):122-134.
[5] van Cauter S,De Keyzer F,Sima DM,et al.Integrating diffusion kurtosis imaging,dynamic susceptibility-weighted contrast-enhanced MRI,and short echo time chemical shift imaging for grading gliomas[J].Neuro Oncol,2014,16(7):1010-1021.
[6] Kinoshita M,Hashimoto N,Goto T,et al.Fractional anisotropy and tumor cell density of the tumor core show positive correlation in diffusion tensor magnetic resonance imaging of malignant brain tumors[J].Neuroimage,2008,43(1):29-35.
[7] van Cauter S,Veraart J,Sijbers J,et al.Gliomas:diffusion kurtosis MR imaging in grading[J].Radiology,2012,263(2):492-501.
[8] 谭艳,张辉,王效春,等.磁共振扩散峰度成像在脑星形细胞瘤分级的初步研究[J].中西医结合心脑血管病杂志,2014,12(11):1351-1352.
[9] Raab P,Hattingen E,Franz K,et al.Cerebral gliomas:diffusional kurtosis imaging analysis of microstructural differences[J].Radiology,2010,254(3):876-881.
[10] Johannessen AL,Torp SH.The clinical value of Ki-67/MIB-1 labeling index in human astrocytomas[J].Pathol Oncol Res,2006,12(3):143-147.
[11] Rizea RE, Ciurea AV,Onose G,et al.New application of diffusion tensor imaging in neurosurgery[J].J Med Life,2011,4(4):372-376.
[12] Beppu T,Lnoue T,Shibata Y,et al.Fractional anisotropy value by diffusion tensor magnetic resonance imaging as a predictor of cell density and proliferation activity of glioblastomas[J].Surg Neurol,2005,63(1):56-61.
[13] Jiang R,Jiang J,Zhao L,et al.Diffusion kurtosis imaging can efficiently assess the glioma grade and cellular proliferation[J].Oncotarget,2015,6(39):42380-42393.
(本文编辑薛妮)
1.山西医科大学(太原 030006);2.山西医科大学第一医院
张辉,E-mail:zhanghui_mr@163.com
R739.4 R445.2
B
10.3969/j.issn.1672-1349.2017.08.035
1672-1349(2017)08-1008-03
2016-04-19)
引用信息:李波良,张辉,王效春,等.DKI在脑星形细胞瘤分级中的应用及与Ki67的相关性研究[J].中西医结合心脑血管病杂志,2017,15(8):1008-1010.

