Lp-PLA2与动脉粥样硬化性脑梗死的相关性分析
靳志峰,郭施勉
Lp-PLA2与动脉粥样硬化性脑梗死的相关性分析
靳志峰,郭施勉
目的 探讨血浆脂蛋白磷脂酶A2(Lp-PLA2)与动脉粥样硬化性脑梗死的相关性。方法 选取2014年5月—2016年5月在我院治疗的急性脑梗死病人120例,同时选取健康人100名作为对照组,检测血浆Lp-PLA2水平、血脂及颈动脉内膜中层厚度。结果 观察组血浆Lp-PLA2、总胆固醇(TC)、三酰甘油(TG)和低密度脂蛋白胆固醇(LDL-C)分别为64.20 mg/L±9.35 mg/L、5.10 mmol/L±1.17 mmol/L、2.12 mmol/L±0.95 mmol/L和3.01 mmol/L±0.81 mmol/L,均明显高于对照组(P<0.05);不稳定斑块病人Lp-PLA2为79.81 mg/L±2.81 mg/L,明显高于其他病人(P<0.05);混合斑块病人Lp-PLA2为62.03 mg/L±3.10 mg/L,明显高于稳定斑块和无斑块病人(P<0.05);稳定斑块病人Lp-PLA2为51.81 mg/L±2.83 mg/L,明显高于无斑块病人(P<0.05)。血浆Lp-PLA2与颈动脉内膜中层厚度和中国脑卒中临床神经功能缺损评分(CSS)评分呈正相关(r值分别为0.322和0.401,P<0.05)。结论 Lp-PLA2可能参与脑血管动脉粥样硬化导致脑梗死,其与病人斑块的稳定性和神经功能缺损程度有一定关系。
急性脑梗死;动脉硬化;脂蛋白磷脂酶A2;神经功能缺损;血脂
脑梗死是临床常见的脑血管疾病,相关研究显示脑梗死发病率达0.005%以上,且近年来呈现明显上升趋势[1]。脑梗死发生发展可导致病人病死率上升,临床预后不佳[2]。生物学分子通过影响脂蛋白代谢,促进血管内皮细胞功能损伤,进而促进病人病情进展。
通过脑梗死发病过程相关生物学信号分子研究,揭示脑梗死的发病机制、为脑梗死综合性治疗措施提供理论依据。血浆脂蛋白磷脂酶A2(lipoprotein phospholipase A2,Lp-PLA2)可水解溶血卵磷脂和游离卵磷脂,进而促进脑血管内皮粥样硬化性病变发生[3-5]。本研究选取2014年5月—2016年5月在我院治疗的急性脑梗死病人120例。探讨Lp-PLA2在脑梗死病人的异常表达,现报道如下。
1 资料与方法
1.1 一般资料 选取2014年5月—2016年5月在我院治疗的急性脑梗死病人120例。纳入标准:符合中华医学会制定的脑梗死标准[6];均为发病72 h内入院;病人及家属知情同意并签署同意书。排除标准:脑梗死后继发出血、脑出血、糖尿病性及动脉炎性脑梗死;凝血机制异常及高黏血症、结缔组织所致脑梗死;合并恶性肿瘤者。同时选取健康人100名作为对照组,两组研究对象性别、年龄等比较,差异无统计学意义(P>0.05)。详见表1。
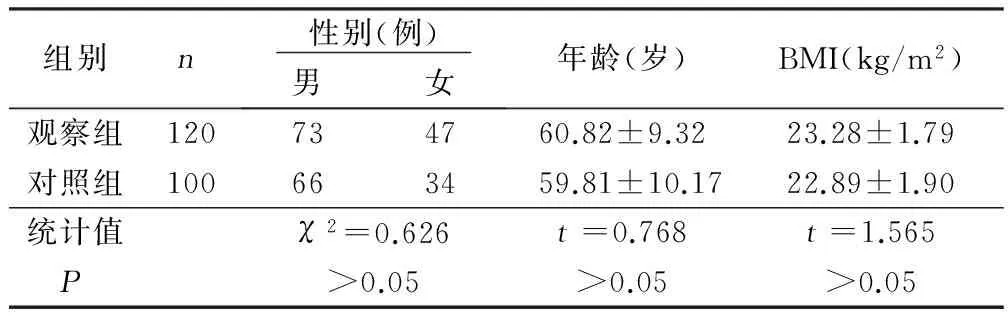
表1 两组一般资料比较
1.2 生化指标检测 抽取清晨空腹静脉血,以3 000 r/min离心速度分离血清,-20 ℃保存待测,采集标本后1周内检测Lp-PLA2、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)。采用瑞士罗氏全自动生化分析仪E170模块检测,试剂盒购自上海泰康生物科技有限公司。具体检测方法参照试剂盒说明书,试剂盒内配有质控血清或质控标准品,所有操作严格按照操作说明完成。
1.3 颈动脉彩色多普勒超声检查 采用美国GE公司生产IU-900系列超声诊断仪器进行诊断,检查者取仰卧位,充分暴露颈部,超声探头频率为4.5 MHz~5.5 MHz。检查者头仰向另一侧,探头从颈部根部检测颈动脉主干,并向上移行观察颈动脉膨大及分支处,典型动脉外膜、肌层、内膜呈现出明显的两亮一暗,在颈动脉膨大处1 cm内检测内膜内层至中膜外层的厚度,重复检测两次,取平均值。
1.4 神经功能缺损评分 中国脑卒中临床神经功能缺损评分(CSS)量表对病人精神功能进行评分,包括意识水平、水平凝视、面瘫、肩手下肢活动能力及语言、步行能力,评分范围0分~45分,分数越高则病情越重。
2 结 果
2.1 两组血浆Lp-PLA2及生化指标比较 观察组血浆Lp-PLA2、TC、TG和LDL-C均明显高于对照组,差异有统计学意义(P<0.05)。详见表2。
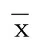
表2 两组血浆Lp-PLA2及生化指标比较(±s)
2.2 Lp-PLA2水平与颈动脉斑块关系比较 经颈动脉超声检查,颈动脉不稳定斑块34例,稳定斑块31例,混合斑块22例,无斑块33例。不稳定斑块Lp-PLA2明显高于其他病人(P<0.05);混合斑块病人Lp-PLA2明显高于稳定斑块和无斑块病人(P<0.05);稳定斑块病人Lp-PLA2明显高于无斑块病人(P<0.05)。详见表3。
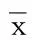
表3 Lp-PLA2水平与颈动脉 斑块关系比较(±s) mg/L
2.3 相关性分析 本研究中病人颈动脉内膜中层厚度平均1.46 mm±0.47 mm,CSS评分为13.21分±3.41分,将病人血浆Lp-PLA2与颈动脉内膜中层厚度、CSS评分和生化指标进行相关性分析,结果显示:血浆Lp-PLA2与颈动脉内膜中层厚度和CSS评分呈正相关(r值分别为0.322和0.401,P<0.05),而与TC、TG和LDL-C无相关性(P>0.05)。
3 讨 论
高血脂症、遗传易感因素及年龄等均为脑梗死发生的独立风险因素,特别是年龄大于55岁的吸烟人群,脑梗死发生率较普通人群上升3倍~4倍[7]。脑梗死发病人群较广,病情进展较为迅速,短期内即可造成病人死亡,病死率较高,远期中枢神经系统并发症较高,临床预后较差[8]。颈部血管粥样硬化病变等,可导致缺血性脑血管疾病发生,通过继发性血栓形成、血栓脱落及血流动力学紊乱等,促进脑梗死发生发展[9-10]。但脑血管动脉粥样硬化导致脑梗死的发病机制研究不足。
脑血管动脉粥样硬化过程中,Lp-PLA2分解代谢的相关产物对脑血管的内皮层具有明显氧化应激损伤。Lp-PLA2可分解代谢产物溶血卵磷脂,并通过上调下游LDL、TC、TG等,导致泡沫细胞沉积,促进粥样硬化病情进展[11-13]。基础研究显示,Lp-PLA2末端含有羧基结构对血管内膜层斑块具有显著侵蚀作用,可显著促进脑梗死的发生发展。虽然已有研究探讨Lp-PLA2在脑梗死病人中的异常表达,但缺乏Lp-PLA2在不同性质斑块表达的分析研究。
本研究发现,脑血管粥样硬化病人血清Lp-PLA2表达明显上升,高于对照组,差异有统计学意义,提示Lp-PLA2可能参与动脉血管粥样硬化的发生发展。Lp-PLA2可通过促进血管内皮细胞功能损伤,加剧血管内皮下脂质沉积,进而促进斑块形成。Zhang等[14-15]通过回顾性分析72例病人临床资料,发现Lp-PLA2在脑梗死等脑血管粥样硬化病理改变的病人表达浓度可平均上升25%以上,且病人病情越重,Lp-PLA2表达越高,这与本研究结论较一致。TC、TG和LDL-C异常上升,提示血脂代谢紊乱对脑血管粥样硬化的促进作用,血脂水平代谢紊乱对脑血管损伤的具体机制仍需进一步探讨。
不同斑块类型病人血清Lp-PLA2表达分析发现,混合型斑块明显高于正常组,而不稳定型斑块组Lp-PLA2表达明显高于混合斑块组,提示脑血管斑块性质稳定性越差,Lp-PLA2表达浓度越高,趋势较为明显。Lp-PLA2可通过影响单核细胞、巨噬细胞等对斑块的浸润和损伤,促进斑块脱落,导致斑块不稳定性增加。Zhang等[15]研究并未发现Lp-PLA2表达与斑块不稳定性关系,这与本研究结论存在一定差异,考虑检测方法的不一致、随访时间的差别及基础治疗方式的差异等,均可能导致最终结论差异。相关关系分析发现,血浆Lp-PLA2与颈动脉内膜中层厚度和CSS评分呈正相关,进一步提示Lp-PLA2表达与脑血管动脉粥样硬化关系。
综上所述,脑血管粥样硬化病人血清Lp-PLA2的表达呈现明显上升趋势,且斑块性质稳定性越差,Lp-PLA2表达强度越高。本研究对Lp-PLA2与脑血管粥样硬化病人远期病死率等指标分析不足,存在一定的局限性。
[1] Lv M,Zhang D,Dai D,et al.Sphingosine kinase 1/sphingosine-1-phosphate regulates the expression of interleukin-17A in activated microglia in cerebral ischemia/reperfusion[J].Inflammation Research,2016,65(7):551-562.
[2] Askarova S,Yang X,Sheng W,et al.Role of Aβ-receptor for advanced glycation endproducts interaction in oxidative stress and cytosolic phospholipase A2 activation in astrocytes and cerebral endothelial cells[J].Neuroscience,2011,199(6):375-385.
[3] 黄耀忠,曾祥富,林武壮,等.血浆脂蛋白磷脂酶A2在防治急性动脉硬化性脑梗死的临床价值[J].医学检验与临床,2014,32(3):53-54.
[4] 顾汉沛,王光胜,葛剑青.血浆脂蛋白相关磷脂酶A2与脑梗死复发的相关性分析[J].临床神经病学杂志,2016,26(4):290-292.
[5] 陈仁玉,王惠娟,陈哲,等.人血浆脂蛋白相关磷脂酶A2与脑梗死患者颈动脉斑块稳定性关系[J].中国免疫学杂志,2013,32(12):1293-1296.
[6] 雷建明,杨职,钟雪华,等.血浆脂蛋白磷脂酶A2和高敏C反应蛋白与急性脑梗死相关性研究[J].中国实用神经疾病杂志,2016,25(3):47-49.
[7] Pappa V,Seydel K,Gupta S,et al.Lipid metabolites of the phospholipase A2 pathway and inflammatory cytokines are associated with brain volume in paediatric cerebral malaria[J].Malaria Journal,2015,14(1):90-92.
[8] 贾文辉,胡风云,陈文军,等.血清脂蛋白相关磷脂酶A2类胰蛋白酶血清淀粉样蛋白A和超敏C反应蛋白与大动脉粥样硬化性脑梗死的相关性研究[J].中国药物与临床,2016,25(8):1169-1171.
[9] Romero JR,Preis SR,Beiser AS,et al.Lipoprotein phospholipase A2 and cerebral microbleeds in the Framingham Heart study[J].Stroke,2012,43(11):3091-3094.
[10] 李凤,朱余友,杨孙凤,等.血清五聚素3、超敏C反应蛋白、脂蛋白相关磷脂酶A2水平以及微栓子信号与大动脉粥样硬化型急性脑梗死患者颈动脉粥样硬化斑块稳定性的相关研究[J].临床神经病学杂志,2016,32(2):95-100.
[11] 许光.急性脑梗死患者血清脂蛋白相关性磷脂酶A2水平的变化及意义[J].中国实用神经疾病杂志,2013,16(21):20-21.
[12] 王少纲.脂蛋白相关磷脂酶A2与急性脑梗死的关系[J].中国老年学杂志,2013,25(15):3586-3588.
[13] 任丽,王玉凯,黄铭娜,等.糖耐量异常脑梗死患者血浆脂蛋白相关磷脂酶A2水平的改变及其与颈动脉硬化的关系[J].临床神经病学杂志,2013,32(5):335-337.
[14] 钟萍,吴丹红,吴计划,等.血清脂蛋白相关磷脂酶A2和超敏C-反应蛋白水平与大动脉粥样硬化性脑梗死关系的临床研究[J].中华临床医师杂志(电子版),2012,26(4):924-927.
[15] Zhang Y,Wang T,Yang K,et al.Cerebral microvascular endothelial cell apoptosis after ischemia:role of enolase-phosphatase 1 activation and aci-reductone dioxygenase 1 translocation[J].Frontiers in Molecular Neuroscience,2016,9(5):90-92.
(本文编辑薛妮)
河南省南阳市第一人民医院(河南南阳 471000),E-mail:jinzhifengbb@163.com
引用信息:靳志峰,郭施勉.Lp-PLA2与动脉粥样硬化性脑梗死的相关性分析[J].中西医结合心脑血管病杂志,2017,15(8):997-999.
R743 R255.2
B
10.3969/j.issn.1672-1349.2017.08.031
1672-1349(2017)08-0997-03
2016-12-24)

