肾上腺淋巴管瘤1例并文献复习
刘政江,黄明亮,刘家辉,孙金涛
肾上腺淋巴管瘤 (adrenal lymphangioma,AL)临床十分少见,属罕见病,目前发病机制尚不了解,腹部彩超可做初步判断,CT增强扫描作用越来越明显,确诊需要病理诊断,免疫组化D2-40有确定性意义。笔者所在医院泌尿外科2016年11月收治的1例肾上腺淋巴管瘤,现将其发病及诊治过程报告如下,结合相关文献进行复习讨论,目的在于提高对该病的全面认识。
1 临床资料
患者,男,39岁。因“血压高6年,查体发现左侧肾上腺肿瘤3 d”于2016-11-15入院。最高血压170/120 mmHg(1 mmHg=0.133 kPa),偶有头晕、头痛,无发作性大汗、心慌等不适。口服硝苯地平控制片,30 mg,1 次/d,血压控制在 140~150/90~95 mmHg。否认其他疾病。体格检查未见明显异常(无满月脸、水牛背等体征)。实验室检查:血尿粪常规、血生化、凝血4项均未见异常。相关激素检查:肾素、醛固酮、血浆皮质醇、血浆儿茶酚胺、17-羟皮质类固醇、17-酮类固醇均在正常值范围。CT检查结果:左侧肾上腺内侧支见类圆形软组织密度影,大小约11 cm×10 mm,CT值119 HU,与正常肾实质分界不清,考虑左侧肾上腺占位。术前诊断:左侧肾上腺肿瘤。按肾上腺嗜铬细胞瘤做术前准备 (盐酸酚苄明片10 mg,口服,2 次/d,连续 10 d)。 于 2016-11-24 在插管全麻下行腹腔镜下左肾上腺肿瘤切除术,术中血压无明显波动。切除肿瘤标本大小约1.5 cm×1.0 cm×1.0 cm,包膜完整,内可见灰白色黏液。术后病理诊断:肾上腺淋巴管瘤。
2 结果
患者手术顺利,出血约10 ml,手术时间1 h。术后恢复良好,血压下降,但仍高于正常,未服降压药可维持在 140~145/90~95 mmHg,于 12月 1日康复出院,随访中。
3 讨论
3.1 发病机制 淋巴管瘤由Fink于1885年首先报道,可发生于人体任何包含有淋巴管道的部位,起源于肾上腺区域的淋巴管瘤则极为罕见,可见于任何年龄段,女性多于男性[1]。对于AL的机制,目前文献报道[2]主要有 4种学说。(1)淋巴管发生形态变化。肾上腺淋巴管在胚胎发育时,未能与其他淋巴系统相通,导致其自身发生囊性改变。(2)淋巴管阻塞。特别是各种原因导致的淋巴管炎症纤维化,致使淋巴回流障碍,从而引起淋巴管扩张,产生囊性改变。(3)淋巴管损伤。肾上腺的各种损伤(主要为外伤和邻近区域手术),引起其淋巴液引流不通畅,亦可引起该疾病。(4)各种理化因素导致的淋巴管闭锁。部分淋巴管闭锁,淋巴液引流不通畅,引起扩张形成。
3.2 诊断 因肾上腺肿瘤位于腹膜后腔隙,解剖位置较深,当肿瘤<4 cm时多无明显临床症状。有功能腺瘤则可引起高血压(嗜铬细胞瘤可引起恶性高血压),或者引起激素水平紊乱,继而出现满月脸、水牛背、多毛等临床症状,以及高血压、低血钾等醛固酮增多症表现。当肿瘤体积逐渐增大时,会压迫毗邻脏器,如肝、脾、肾上极,引起局部胀痛不适。肿瘤过大时查体可触及局部包块。当肿瘤破裂或合并囊内出血、感染时可表现为急腹症。肾上腺淋巴管瘤是肾上腺内皮囊肿中最常见一种类型,发生率低,常无临床表现,多在行超声、CT或MR检查,或进行与其无关的外科手术时偶然发现[3]。该例患者为青年男性,有高血压病6年,无其他症状,否认家族高血压病史,为查找高血压原因来笔者所在医院就诊。查体和实验室检查均未见明显异常。肾上腺淋巴管瘤多发生于一侧肾上腺,偶尔见双侧发病[4]。CT检查对肾上腺肿瘤有独特优势,平扫或增强CT扫描表现为肾上腺区大小不等囊状低密度影,囊壁较薄且光滑,CT 值约 20~25 HU,高于单纯性囊肿[5]。肾上腺淋巴管瘤以呈圆形、类圆形多见,随着体积增大也可以表现为葫芦状、哑铃状、葡萄状甚至不规则形[6]。以往认为淋巴管瘤CT值约20~25 HU,而本例患者肾上腺肿瘤CT值119HU,呈椭圆形,与正常肾上腺组织分界不清,故术前倾向诊断“肾上腺腺瘤”。该病确诊仍需病理检查,镜下病理表现为:多发大小不等的圆形或不规则的扩张淋巴管,管腔内衬以扁平内皮细胞,外有正常肾上腺组织包绕,局灶可见淋巴细胞聚集于部分囊壁。免疫组化染色 CD31(+)[7]。 患者免疫组化结果:D2-40(+),S-100(-),CD31(-),CD34(-),CD68(-),Ki-67(+),平均值约为1%。D2-40是新近发现的一种淋巴管内皮细胞特异性标记物,其能特异性标记淋巴管,而不标记血管,因此在鉴别脉管性肿瘤的起源及判断肿瘤转移途径等方面具重要作用[8]。查阅既往文献多参考 CD31,而该例患者 CD31(-),恰恰是靠D2-40(+)明确诊断。 见图 1、2。

图1 D2-40免疫组化检查
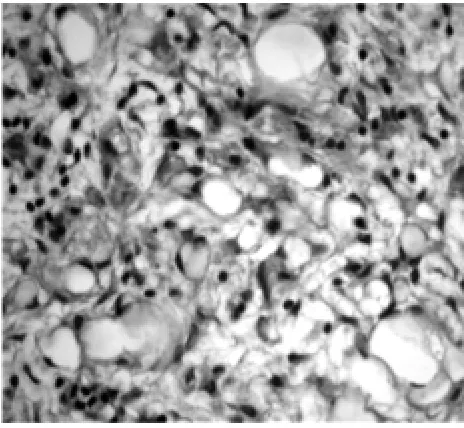
图2 病理检查(HE染色)
3.3 鉴别诊断 肾上腺淋巴管瘤需与肾上腺腺瘤、单纯性肾上腺囊肿、肾上腺肿瘤囊性变(嗜铬细胞瘤)、假性囊肿等相鉴别。无功能肾上腺腺瘤多为实质性病变,直径2~3 cm,内分泌激素检查多在正常范围,彩超检查提示肿瘤与正常肾上腺组织回声相近,CT检查表现为等密度或略低密度影。单纯肾上腺囊肿或假性囊肿容易鉴别,彩超多提示无回声占位,囊内回声均匀一致,呈液性暗区。嗜铬细胞瘤作为肾上腺肿瘤囊性的代表,典型症状是持续性或阵发性高血压,伴大汗、心慌等不适,最高血压可超过200/120 mmHg。彩超和CT可提示伴有中央坏死及出血,极少呈完全囊性病变。实验室检查可见肾素、醛固酮、血浆皮质醇、血浆儿茶酚胺等异常,而肾上腺淋巴管瘤内分泌检查大多正常。值得一提的是,当囊性淋巴管瘤体积较大时,应注意与肝囊肿、肾囊肿相区分,此时CT或MRI的矢状位、冠状位扫描有助于定位[9]。
3.4 治疗 AL的治疗主要有保守观察和外科手术,目前动态观察和手术时机选择尚无标准化治疗规范和专家共识,大多参照肾上腺腺瘤处理方法,而且要综合考虑肿瘤大小、性质、临床表现、内分泌检查等等,针对不同患者做个体化治疗方案。当肿瘤体积≥5 cm时,要高度怀疑有恶性可能,手术治疗为首选。当肿瘤介于2~5 cm,CT平扫呈略高密度影(CT值>10 HU),有功能及临床症状,或引起瘤体破裂、出血、感染时要积极手术治疗。当肿瘤<2 cm,无任何临床症状,彩超和CT提示囊性病变时,可随访观察。但是,在观察过程中,若发现肿瘤生长迅速,或出现血压高、内分泌功能异常,则应考虑外科手术。该例患者肿瘤虽<2 cm,但考虑青年男性,术前判断高血压与肿瘤相关,且CT值119 HU,明显高于普通囊性病变。患者积极要求手术,明确性质,故予以手术治疗。采用后腹腔镜下肾上腺肿瘤切除术,手术创伤小,时间短,出血少、恢复快,微创优势明显,是首选手术方式。
综上所述,肾上腺淋巴管瘤是一种罕见的肾上腺良性肿瘤,发病机制尚不十分明确,无特异性临床表现,典型囊肿样改变,经CT、MRI可做初步判断,但出现钙化或其他原因导致CT值升高时容易误诊为“肾上腺腺瘤”。最终仍需病理检查,免疫组化D2-40是确定诊断的标准项目。腹腔镜下肾上腺肿瘤切除术仍是首选治疗方式。因为该病极少见,绝大多数为术后病理证实,临床病例有限,近期术后效果较好,但远期预后仍有待于长期随访观察。
参考文献
[1] Cakir E,Aydin NE,Samdanci E,et al.Cystic adrenal lymphangioma-report of two cases and review of the literature[J].J Pak Med Assoc,2012,62(9):962-964.
[2] Giguere CM,Bauman NM,Smith RJ.New treatment options for lymphangioma in infants and children [J].Ann Otol Rhinol Laryngol,2002,111(12):1066-1075.
[3] Akand M,Kucur M,Karabagli P,et al.Adrenal lymphangioma mimicking renal cyst:a case report and review of the literature[J].Case Repurol,2013,11(3):459.
[4]冯娟娟,袁德全,沈雪峰,等.腹部囊性淋巴管瘤的CT及MRI诊断[J]. 中国临床医学影像杂志,2013,24(10):745-747.
[5]李 震,王秋霞,肖 明,等.肾上腺囊性占位的多排螺旋CT诊断与鉴别[J]. 现代泌尿生殖肿瘤杂,2010,2(4):201-204.
[6] Liu B,LI Y,Wang S.Adrenal lymphangioma removed by aretroperitoneoscpic procedure[J].Oncol Lett,2013,5(2):539-540.
[7] Garcia M,Louis LB,Vernon S,et al.Cystic adrenal lymphangioma[J].Arch Pathol Lab Med,2004,128(6):713-714.
[8]张梅娟,张丽华.免疫标记物D2-40在病理诊断中的应用和意义[J]. 诊断学理论与实践,2007,6(3):277-280.
[9]陈志刚,纪志刚,李汉忠,等.右肾上腺囊性淋巴管瘤1例并文献复习[J]. 现代泌尿生殖肿瘤杂志,2014,6(6):366-367.

