表观弥散系数评价壁虎活性单体治疗兔肝脏VX2移植瘤疗效的价值*
范鹏琳,林明明,刘 峰,王苗苗,刘玉玺,贺 皓,孙业全
介入治疗是肝细胞肝癌的主要非外科治疗手段,具有创伤小、栓塞肿瘤供血动脉效果明显、局部药物浓度高等优点[1]。由于常规的化疗药物介入治疗后可引起肝功能损害、免疫功能降低等不良反应,使得经皮肝动脉化疗栓塞(transcatheter hepatic arterial chemoembolization,TACE)技术受到一定的限制。因此,研制低毒、靶向的介入制剂成为提高肝癌化疗栓塞疗效的发展方向。20世纪80年代,冯敢生等[2]在国内首次应用中药白芨经肝动脉介入治疗肝癌,取得了良好的效果,从此,中药联合TACE成为中晚期肝癌及肝转移瘤颇为有效的姑息治疗方法[3]。壁虎活性单体是从新鲜的无蹼壁虎中提取而来,对肿瘤特别是肝癌等实体瘤具有独特的疗效[4]。该研究通过局部灌注壁虎活性单体治疗兔肝脏VX2移植瘤,并应用磁共振弥散加权成像技术监测评估其近期介入治疗疗效。
1 材料与方法
1.1 动物模型建立 随机取普通级纯种健康成年新西兰大白兔 (购于山东省农科院,许可证号SCXK20090013)25 只,雌雄不限,体重 2.5~3.0 kg,将传代荷瘤兔肿瘤制成1 mm3大小的瘤块备用,将麻醉(2%戊巴比妥钠,5±1 ml/只)好的实验兔固定于兔台,碘附消毒,铺无菌洞巾后行腹部正中切口,自剑突下切开长约1.5 cm的切口,钝性分离后暴露出肝脏,轻柔地将肝左叶拉出体外,用眼科镊在肝左叶膈面插入约0.5 mm深的窦道,将准备好的瘤粒植入,然后用明胶海绵填塞窦口,用蘸有生理盐水的纱布按压数分钟,确认无出血后回纳肝脏,逐层缝合。缝合后碘附消毒,术后连续四天后肢外侧肌肉注射头孢氨苄青霉素(60万U/只·d)。
1.2 实验分组和药物干预 2 w后,超声 (美国Siemens Medical公司的乳腺容积成像系统,型号ACUSON S2000,探头为 9L4,频率范围为 5~8 MHz)筛选20只建模成功的大白兔,随机平均分为2组。实验组:选择右侧腹般沟区备皮、消毒,暴露出约2 cm的股动脉。用眼科剪剪一“V”字形小口,引入3F微导管及微导丝,透视下间断注入造影剂寻找腹腔干开口,当导管顶端在胸12和腰1椎体间出现“嵌入”现象时造影,直至找到腹腔动脉开口,进入腹腔动脉并超选至肝左动脉,造影可见肿瘤组织轻度染色(图1A),然后灌注混有壁虎活性单体的碘化油栓塞目标血管(图1B),完成后近端股动脉结扎。对照组操作同实验组,栓塞剂仅有碘化油。
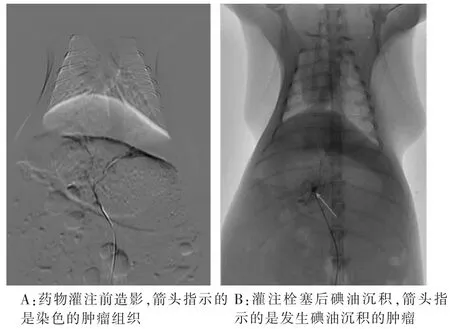
图1 药物灌注前后肿瘤组织图像
1.3 MRI检查 术前1 d及术后3周采用GE Signa3.0TMR扫描仪行MR扫描,扫描参数:T1WI TR 2240 ms,TE22.0 ms,NEX 为 2 次;T2WI TR5620 ms,TE119.6 ms,NEX为1次,所有轴位成像采用快速自旋回波 (Fast Spinecho,SE),FOV24.0 cm, 矩阵256×256,层厚 5.0 mm,层间距 5.5 mm。DWI参数:TR5000 ms,TE75.9 ms,NEX 为 2 次,FOV24.0 cm,矩阵 160×160,层厚 5.0 mm,层间距 5.5 mm,b值分别取0、1000 s/mm2。观察肿瘤的形态、境界、信号以及有无局部浸润等情况。在肿瘤的最大层面上测量感兴趣区(ROI)的 DWI信号值(b=1000),ADC 参数图上自动显示ADC值,连续层面测定并计算平均值(去除头尾两层避免部分容积效应)。ROI应选择相应层面同一位置进行测量。比较两组肿瘤DWI信号强度及ADC值治疗前后变化[5]。
1.4 病理学检查 实验结束后,将肿瘤组织完整切除,观察瘤组织大小、色泽质地、表面结节等。4%甲醛固定、石蜡包埋、切片,常规HE染色。
1.5 统计学处理 采用统计学软件SPSS 17.0进行相关统计学检验,连续正态分布变量资料数据以x±s表示,组间比较采用 t检验;P<0.05为差异具有统计学意义。
2 结果
2.1 MRI表现 肝左叶可见圆形或类圆形的实性瘤灶,T1WI呈低信号,T2WI示肿瘤呈高信号,境界清楚,肿瘤信号均匀;术前肿瘤DWI信号呈高信号,信号均匀(图 2A、3A),强度(1626.20±370.10),ADC 值为(0.9±0.1)×10-3mm2/s;术后实验组及对照组T2WI及DWI信号较术前减低,以实验组较明显(图2B、3B),术后实验组、对照组肿瘤DWI信号强度分别为 653.69±67.82,785.34±98.13,ADC 值分别为(1.67±0.54)×10-3mm2/s 和(1.47±0.36)×10-3mm2/s,治疗前、后实验组DWI信号强度及ADC值差异均具有统计学意义 (P<0.01);治疗前、后对照组DWI信号强度及ADC值差异均具有统计学意义(P<0.05);术后两组DWI信号强度及ADC值差异均具有统计学意义(P<0.05)。

图2 对照组术前和术后DWI扫描像
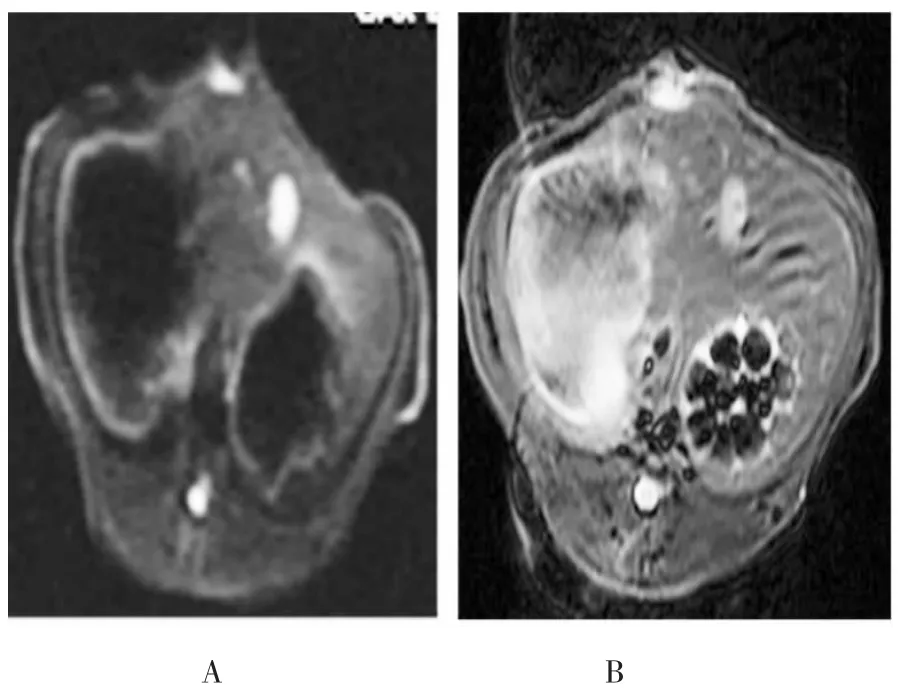
图3 实验组术前和术后DWI扫描像
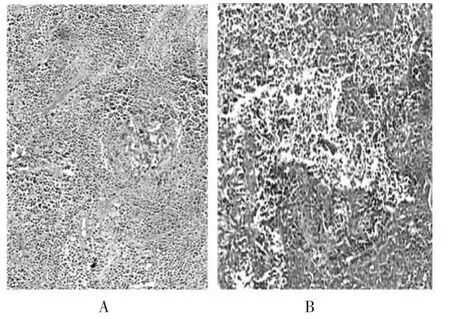
图4 对照组和实验组的病理切片图像(10×)
2.2 病理学结果 肿瘤表面欠光滑,质地较韧,切面呈灰白色、鱼肉状,部分肿瘤组织内部凝固性坏死;对照组镜下观可见散在的细胞核固缩、碎裂,坏死程度相对较轻;实验组切片可见小片状无结构的红染区,坏死程度较重。
3 讨论
肝癌严重影响着人类健康,在传统抗肿瘤药物存在一定不良反应的情况下,从天然动植物中提取低毒、高效、多靶点的抗肿瘤药物成了药物研发的热点[6]。国医药典中记载,壁虎对肿瘤特别是肝细胞癌等实体瘤具有独特的疗效[4],其主要作用机制为:(1)免疫调节作用;(2)抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡;(3)抑制血管生成;(4)调节肿瘤微环境。虽然壁虎活性单体的药效学研究很多,但其治疗剂量的研究却少有报道,该实验采用的浓度(20 mg/kg)是在赵荣荣等[5]研究的基础上确定,其认为壁虎活性单体对兔VX2移植瘤具有双重作用,低浓度时促进肿瘤的生长,高浓度(20 mg/kg)时抑制肿瘤的生长。
MR弥散加权成像(DWI)因其评价抗肿瘤药物的疗效具有早期、可重复、无创伤等优点[7],而成为近年来研究的热点[8-10]。 DWI能够反映在体组织内水分子的微观扩散情况,ADC值的变化反映组织结构的变化。ADC值的大小主要由细胞外间隙的弥散阻力决定,其次为细胞的含水量等[11]。DWI评价介入短期疗效的原理:TACE能直接或间接闭塞肿瘤的供血动脉,使得肿瘤细胞因缺少营养物质而出现凋亡、坏死,从而增加细胞外间隙游离水的含量,DWI图像上表现为低信号,ADC值升高。而正常肝组织中70%左右的血供由门静脉供血,且组织内枯否细胞能代谢碘油,因此介入治疗前后对正常肝脏组织的 ADC值变化无明显影响[12]。研究发现:实验组和对照组的ADC值均升高,而且实验组升高的较为明显,说明实验组的肿瘤组织坏死较多,病理结果也证实实验组瘤组织出现坏死较对照组范围广且彻底,与理论相符合。该实验说明了壁虎活性单体联合碘油栓塞较单纯栓塞对癌细胞的杀伤能力更强,其效果优于单纯碘油栓塞,说明壁虎活性单体对肿瘤细胞具有显著的抑制作用。
综上所述,适量壁虎活性单体联合介入能够有效抑制肿瘤的生长;MR弥散加权成像可以准确、客观、无创的评价壁虎活性单体联合对兔肝VX2移植瘤的作用。
参考文献
[1] Lencioni R.Loco-regional treatment of hepatocellular carcinoma[J].Hepatology,2010,52(2):762-773.
[2]冯敢生,颜小琼,王丽雅.一种新的栓塞材料:中药白芨的实验性研究[J]. 肿瘤防治研究,1985(1):33-35.
[3]凌昌全,李 琦.中药经肝动脉介入治疗原发性肝癌的现状、存在问题及前景[J]. 中医杂志,2002(1):69-71.
[4]刘 菲,王建刚,席守民,等.中药壁虎抗肿瘤作用的实验研究[J]. 时珍国医国药,2008,19(9):957-959.
[5]赵荣荣,张仕状,王 滨,等.MR分子成像评价壁虎活性单体对兔VX2移植瘤疗效的实验研究[J].医学影像学杂志,2013(3):341-344,349.
[6]刘妍婕,吴小东,徐寒梅.壁虎药用价值的研究进展[J].药学进展,2015,12(9):915-919.
[7]江新青,陈 亮,魏新华,等.兔肝VX2种植瘤三维适形放疗前后 MR 的灌注加权成像比较[J].中国医学影像技术,2009,25(5):543-546.
[8]杜 鲲,杨 奎,尹 君,等.表观扩散系数评价肝细胞癌肝动脉化疗栓塞近期疗效的价值[J].中国医学影像学杂志,2014(5):365-368.
[9]刘连杰.表观扩散系数(ADC)评价肝细胞癌(HCC)肝动脉化疗栓塞(TACE)近期疗效的价值[J]. 医学理论与实践,2015(3):293-295.
[10]马霄虹.3.0T磁共振功能成像对原发肝细胞肝癌介入治疗的应用研究[D].北京:北京协和医学院,2015.
[11] Kim JH,Park BW.Apparent diffusion coefficient:prostate cancer versus noncancerous tissue according to anatomical region[J].J Magn Reson Imaging,2008,28(10):1173-1179.
[12] Marin HL,Furth EE,Olthoff K,et al.Histopathologic outcome of neoadjuvant image-guided therapy of hepatocellularcarcinoma[J].Gastrointestin Liver Dis,2009,18(2):169-176.

