铜基二维配位聚合物的合成及晶体结构表征
屈德朋,姜子龙,朱伟伟,郭大营
(温州大学化学与材料工程学院,浙江省碳材技术研究重点实验室,浙江 温州 325027)
铜基二维配位聚合物的合成及晶体结构表征
屈德朋,姜子龙,朱伟伟,郭大营
(温州大学化学与材料工程学院,浙江省碳材技术研究重点实验室,浙江 温州 325027)
合成配位聚合物的一个行之有效的途径就是采用自发自组装的方法,藉助配位键和氢键的作用实现。本文以过渡金属离子铜(Ⅱ)为骨架离子,2,5-二羧基苯磺酸钠为主要配体,具有配位点的含氮有机化合物作为桥联配体,在有机溶剂体系中合成了具有二维网络结构的配位聚合物。合成的配合物为三斜晶体,空间群为P-1,晶胞参数:a=0.9961(14)nm,b=1.0116(15)nm,c=l.6960(2)nm;α=98.991(2)°,β=103.676(2)°, γ=103.302(2)°;V=1.5753(4)nm3,Z=1,Dc=1.357mg·m-3,F(000)=610,R=0.0542,wR=0.1457,GOF=0.979。
铜离子;有机配体;晶体结构;自组装
金属配合物在日常生活和工业上都有广泛的应用,尤其是过渡金属配合物,对探索和研究药物分子的作用机制具有重要意义[1]。有新型功能的金属配合物在催化、光学材料以及电学材料等行业已有广泛应用[2]。配位聚合物晶体材料的设计、合成、结构及性能研究已经成为配位化学研究中的热点之一,设计和合成具有特定结构和物理功能的配位聚合物越来越受到研究者们的关注。
金属配位聚合物是通过过渡金属和有机配体的自组装而形成的,它结合了复合高分子和配位聚合物两者的特点,是一类结构新颖、性能奇特的高分子材料[3]。普鲁士科学家Diesbach 1704年就发现了第一个配位化合物——普鲁士兰。但是,真正对配位化合物的了解和研究一般认为是1798年Tassaert发现的第一个氨的化合物CoCl3-6NH3,这一重大发现揭开了研究配位化合物的序幕。经过一个多世纪的研究与发展,1989年,Hoskins和Robson等人[4]首次将无机矿物网络结构的观点拓展到配合物的设计与合成中。目前常用的合成配合物的方法有水热(溶剂热)合成法、常规溶液法、液层扩散法、凝胶扩散法、微波法等,而且不同合成方法所制备的晶体产物,其性质也有很大差异[5]。合成的方法不同往往得到的产物不同,此外,反应时间、反应温度、加料顺序、反应物的溶解度、反应物的配比、反应物的浓度、体系的酸碱度等条件对配合物的形成也有重要影响。
铜基配合物在整个过渡金属配合物大家庭中扮演着越来越重要的角色[6],与其他过渡金属特别是贵金属相比,铜具有在自然界中储量大、价格低廉、配位性能稳定等优点。因此,以铜为骨架离子的二维配位聚合物的开发、利用以及性能研究都具有其独特的优势[7]。基于此,本文使用过渡金属离子铜(Ⅱ)为中心体, 2,5-二羧基苯磺酸钠为主要配体,咪唑和吡啶等含氮有机化合物为辅助配体,采用溶剂挥发法合成了铜金属配合物,并对该配合物进行了详尽的晶体表征与分析。
1 实验部分
1.1 主要试剂与仪器
实验试剂:二水合硝酸铜、3,5-二羧基苯磺酸钠、吡啶、咪唑、甲醇等(均为分析纯)。
实验仪器:FA2004电子天平、DHT型搅拌控温电热套、回流装置、X射线单晶衍射仪(Bruker Smart-1000 CCD),晶体的X射线衍射数据采用Bruker SMART APEXⅡ CCD衍射仪测定。采用经石墨单色器单色化的Mo-kα射线(λ=0.7103A )作为衍射光源,在2.19°≤θ≤27.02°范围内,以w-20扫描方式收集衍射点,在 296(2)K下收集衍射数据。
1.2 实验步骤
1.2.1 铜基配合物的合成
准确称取二水合硝酸铜固体48.3mg,3,5-二羧基苯磺酸钠53.4mg,置于50mL的圆底烧瓶中,加入10mL甲醇作为溶剂,放入磁力搅拌子并用搅拌型电热套加热回流,加热回流时间为30min。然后加入1mL吡啶和少量咪唑,震荡溶解。反应体系冷却后进行过滤,所得滤液注入试管中封口保存。常温下静置使溶剂挥发,随着溶剂的挥发即可长出蓝色的配合物晶体。
1.2.2 配合物晶体结构的测定与表征
晶体的X射线衍射数据采用Bruker SMART APEXⅡ CCD衍射仪测定。晶体结构采用直接法解出并扩展,以各向异性进行修正,最后采用全矩阵最小二乘法,依据可观察的衍射数据和可变参数进行校正,所有数据经Lp因子校正。用直接法解出全部非氢原子坐标,结构参数由全矩阵最小二乘法优化,除氢原子采用各项同性热参数外,其它原子均采用各向异性热参数法,所有的计算均使用SHELX-97程序。
2 结果与讨论
2.1 配合物的晶体学参数
通过对合成晶体的X射线衍射分析可以得出,该配合物为三斜晶体,空间群为P-1,晶胞参数:a=0.9961(14)nm,b=1.0116(15)nm,c=l.6960(2)nm;α=98.991 (2)°,β=103.676(2)°,γ=103.302(2)°;V=1.5753(4)nm3,Z=1,Dc=1.357mg·m-3,F(000)= 610,R=0.0542,wR=0.1457,GOF=0.979。主要的键长键角如表1所示。

表1 配合物的主要键长和键角
2.2 铜基配合物的配位环境分析
合成的二维铜基配位化合物中,中心金属离子铜(Ⅱ)采取了两种不同的配位方式,我们将这两种配位环境不同的金属中心分别标记为Cu1和Cu2。如图1所示,从Cu1的配位环境图可以看出,Cu1为八面体构型的六配位方式[8],以Cu1为中心,N3A、N4A、N3B、N4B在一个平面上呈平行四边形,即八面体的赤道位置是由2个吡啶基上的N和2个咪唑基上的N占据。Cu1原子与4个氮原子的键长为:Cu1-N3A=0.2027(4)nm,Cu1-N3B=0.2027(4)nm,Cu1-N4A=0.2025(5)nm,Cu1-N4B =0.2025(5)nm,键角大小见表1。O1A和O1B在同一条直线上并垂直于平行四边形,构成八面体构型。八面体中心平面上的两对角线顶点分别为相互对称的吡啶基和咪唑基,分别通过N3、N4与Cu1配位。八面体中两个端点上与Cu1配位的O1则是来自配体2,5-二羧基苯磺酸钠中磺酸基上的氧,Cu1与O1的键长为0.2466nm。

图1 Cu1的配位环境图
铜原子的另一种配位方式如Cu2的配位环境图(图2)所示,其中2个Cu2与2个羧基上的氧配位形成一个八元环。每个Cu2都是采取同样的配位方式,以五配位的形式呈三角双锥构型。在三角双锥构型中,分别来自3个羧基的氧O4、O5、O6在同一平面上构成一个平面三角形;N1、Cu2、N2在同一条直线上与平面三角形垂直,N1和N2分别来自于2个相对的吡啶基上的氮原子。Cu2与各个配体间的键长为:Cu2-O5=0.1937(4)nm,Cu2-O6=0.1990(4) nm,Cu2-N1=0.2025(6)nm,Cu2-N2=0.2025(6)nm,Cu2-O4=0.2202(4)nm;Cu2原子与各个配位原子间的键角大小见表1。2个五配位的Cu2以羧基上的氧为联结配体形成中心对称的八元环结构。

图2 Cu2的配位环境图
2.3 配合物的结构分析
两种不同配位环境的铜(Ⅱ)分别以六配位的八面体和五配位的三角双锥构型,和2,5-二羧基苯磺酸钠中的磺酸基、吡啶和咪唑上的O、N形成配位键。从配合物的分子面状图(图3)分析可知,以Cu1为中心体的六配位结构和以Cu2为中心体构成的八元环结构,通过磺酸基上的S与吡啶环上的C成键,以及和与Cu1相配位的吡啶相连而构成面状大分子。

图3 面状分子结构图
配合物的中心金属离子通过自组装的过程形成了Cu1和Cu2两种配位方式,其中Cu1和Cu2分别以不同的配位构型与含氧配体或含氮配体相结合,形成平面状大分子。如图4所示,具有两种配位环境的铜(Ⅱ)配合物平面大分子又进一步地层层堆积,通过这种层间的有序排列构成晶体层状堆积。
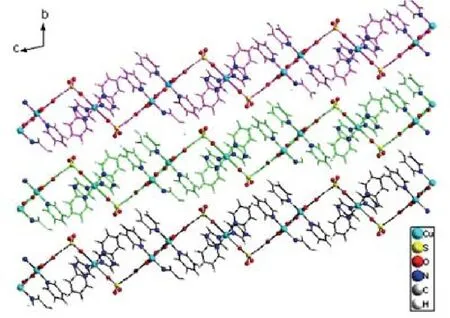
图4 晶体层状堆积图
3 结论
本论文合成的配合物,在选择中心金属离子时,考虑到第一过渡系列金属离子有较多的未成对电子,可以得到较大的自旋值,因此使用过渡金属离子铜(Ⅱ)作为中心体,选取了2,5-二羧基苯磺酸钠作为主要配体,用咪唑和吡啶等含氮有机物作为辅助配体。实验过程中通过一系列的回流、过滤以及溶剂静置挥发法来合成晶体,并且对生成晶体的温度、酸碱度、溶剂选择等条件进行了优选探究,最终采用有机溶剂挥发的办法合成了配合物晶体。用X射线单晶衍射仪测其结构并作参数表征:a=0.9961(14) nm,b=1.0116(15)nm,c=l.6960(2)nm;α=98.991(2)°,β=103.676(2)°, γ=103.302(2)°;V=1.5753(4)nm3,Z=1,Dc=1.357mg·m-3,F(000)=610,R=0.0542,wR=0.1457,GOF=0.979。合成的配合物晶体中铜采取两种不同的配位方式,并借助配位键和氢键的作用与配体及辅助配体构成了二维的平面状分子。
[1] Li Y L, Qin Q P, Liu Y C, et al. A platinum(Ⅱ) complex of liriodenine from traditional Chinese medicine (TCM): Cell cycle arrest, cell apoptosis induction and telomerase inhibition activity via G-quadruplex DNA stabilization.[J]. Journal of Inorganic Biochemistry, 2014, 137(4): 12-21.
[2] Saljooghi A S, Rudbari H A, Nicolò F, et al. Copper(Ⅱ) and lead(II) complexes based on 2,3,5,6- tetrakis (2-pyridyl) pyrazine as a polydentate ligand[J]. Russian Journal of Coordination Chemistry, 2014, 40(6): 424-431.
[3] Clouston L J, Siedschlag R B, Rudd P A, et al. Systematic Variation of Metal–Metal Bond Order in Metal-ChromiumComplexes[J]. Journal of the American Chemical Society, 2013, 135(35): 13142-13148.
[4] Bell M, Edwards A J, Hoskins B F, et al. Synthesis and x-ray crystal structures of tetranickel and tetrazinc complexes of a macrocyclic tetranucleating ligand[J]. Journal of the American Chemical Society, 1989, 111(10): 3603-3610.
[5] Wang X L, Hou L L, Zhang J W, et al. Bis(benzimidazole)-based ligands-directed the various dimensionality of metal–organic complexes based on carboxylates co-ligands: Syntheses, structures and properties[J]. Inorganica Chimica Acta, 2013, 405(16): 58-64.
[6] Fang T, Zhou L L, Fu L Z, et al. Synthesis and studies of a molecular copper(Ⅰ)-triazenido electrocatalyst for catalyzing hydrogen evolution from acetic acid and water[J]. Polyhedron, 2015, 85: 355-360.
[7] 赵俊伟,马杏,李兴华,等. CuⅠ-GdⅢ异金属二维配位聚合物[GdⅢCu2Ⅰ(Hbpdc)4]·Cl·8H2O的制备及晶体结构[J].化学研究,2015(4):373-377.
[8] 宋天佑,徐家宁,王杏乔,等.无机化学(第2版)[M].北京:高等教育出版社,2009.
Synthesis and Crystal Structure Characterization of Copper-based Two-Dimensional Coordination Polymers
QU Depeng, JIANG Zilong, ZHU Weiwei, GUO Daying
(Institute of Chemical and Materials Engineering, Key Laboratory of Carbon Materials in Zhejiang Province, Wenzhou University, Wenzhou 325027, China)
One of the effective ways to synthesize the coordination polymer was to use self-assembly methods, with the aid of coordination and hydrogen bonding. The transition metal ions of copper (Ⅱ) were the central ions, 2,5-dicarboxybenzenesulfonate as the main ligand, and the nitrogen-containing organic compounds with the coordination point as the bridging ligand. The coordination polymers with two-dimensional network structure were synthesized in the organic solvent system. The synthesized complex was triclinic, the space group was P-1, the unit cell parameter: a=0.9961(14)nm, b=1.01 16(15)nm, c=l.6960(2)nm; α=98.991(2)°, β=103.676(2)°, γ=103.302(2)°; V=1.5753(4)nm3, Z=1, Dc=1.357mg/m3,F(000)=610, R=0.0542, wR=0.1457, GOF=0.979。
copper ion; organic ligand; crystal structure; self-assembly
O 614.4
A
1671-9905(2017)05-0015-03
2017-03-06

