鸡传染性支气管炎病毒M基因真核表达载体的构建及免疫效力研究
孙晓云,刘成倩,易建中,李 红
(1上海海洋大学水产与生命学院,上海 201306;2上海市农业科学院畜牧兽医研究所,上海 201106)
鸡传染性支气管炎病毒M基因真核表达载体的构建及免疫效力研究
孙晓云1,2,刘成倩2,易建中2,李 红2
(1上海海洋大学水产与生命学院,上海 201306;2上海市农业科学院畜牧兽医研究所,上海 201106)
从GenBank上下载鸡传染性支气管炎病毒(IBV)H120型标准株M基因的标准序列,以此标准序列为模板设计合成一对引物。从IBV尿囊液中提取总RNA,采用PCR技术扩增出M基因,将扩增出的目的片段克隆至pMD18-T载体上获得pMD18-IBV-M质粒,通过亚克隆将目的基因连接到经过改造的pEGFP-C1-SCP-SEC载体上,成功构建真核表达质粒pC1-IBV-M。通过间接免疫荧光试验验证了构建的真核载体能在真核细胞内表达,通过动物免疫试验来检测该真核表达载体对动物的免疫保护情况。
鸡传染性支气管炎病毒;M基因;动物试验
鸡传染性支气管炎(Chicken infectious bronchitis,IB)是一种急性呼吸道传染病,通过接触传播,该病由鸡传染性支气管炎病毒(Chicken infectious bronchitis virus,IBV)引起,属于冠状病毒科冠状病毒属。病鸡感染后主要表现为咳嗽、打喷嚏和气管啰音,雏鸡感染后出现伸颈,张口呼吸,流鼻涕,产蛋鸡则表现产蛋减少、产粗壳蛋或软壳蛋。肾型没有呼吸道症状,主要表现肾炎综合征、花斑肾和组织器官表面白色尿酸盐沉积[1-2]。该病对各日龄鸡均具有感染性,其中以1—4周龄的雏鸡最易感,死亡率高达40%—90%[2-4]。该病在世界范围内广泛流行,对养禽业的危害非常大,是重大传染病之一[2]。
IBV为单股正链RNA,有囊膜、不分节段,是目前所知的最大的RNA病毒,病毒粒子略呈球形,有时呈多形性[2],主要由囊膜和核衣壳两部分组成,囊膜内主要包含膜蛋白(M蛋白)和纤突蛋白(S蛋白)这两种结构蛋白;核衣壳较长呈螺旋状,主要包含核衣壳蛋白(N蛋白)[4-7]。在IBV病毒编码的三种结构蛋白中,M蛋白约占病毒结构蛋白总量的40%,其基因在进化中很少发生变异,具有较高的保守性,各毒株彼此间的核苷酸同源率在85.7%—100%,并且M蛋白与病毒的复制有关,是重要的免疫原基因[9]。
本研究根据鸡传染性支气管炎病毒H120型基因序列设计引物,扩增出M基因,并克隆至真核表达载体pEGFP-C1-SCP-SEC上,以PEI 25000包裹质粒,完成核酸疫苗的制备,通过间接免疫荧光试验验证了其能在真核细胞内表达,通过动物免疫及攻毒试验分析其免疫保护效果,对研制IBV核酸疫苗打下良好的基础。
1 材料与方法
1.1 材料
感受态细胞DH5α、改造好的真核表达载体pEGFP-C1-SCP-SEC均为上海市农业科学院畜牧兽医研究所禽病防控研究室保存,改造好的质粒切去了EGFP基因,加入了SCP启动子和SEC序列;鸡传染性支气管炎H120株活疫苗购自哈药集团生物疫苗有限公司;限制性内切酶Eco RI、Sal I、T4 DNA连接酶均购自Thermo Fisher Scientific公司;pMD18-T载体、rTaq酶、KOD酶购自宝生物工程有限公司;Trizol试剂购自上海生工生物公司;PEI 25000购自阿拉丁试剂有限公司。
1.2 病毒培养
将H120株弱毒活疫苗经PBS溶解,经尿囊腔接种8枚10—11日龄非免疫鸡胚,每枚鸡胚接种200μL,取2枚正常鸡胚作对照,注入等量PBS,用石蜡封孔。弃去接毒后24 h内死亡的鸡胚;孵育72 h后将鸡胚放入4℃冰箱过夜,无菌收集尿囊液,尿囊液应为澄清颜色,黄色或红色则不可用。
1.3 引物设计及IBV总RNA的提取
通过分析GenBank上已登录的IBV-H120株M基因序列,利用软件Primer Premier 5.0设计1对引物,在引物的上下游分别加入Eco RI、Sal I两个酶切位点,引物由上海捷瑞生物公司合成。
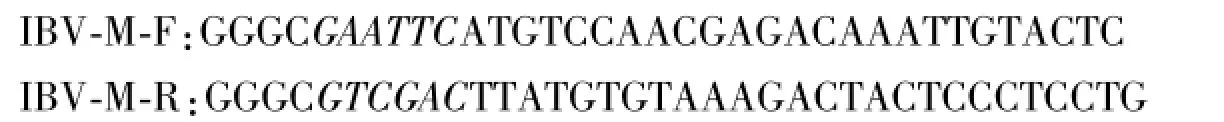
斜体为引入的Eco RI和Sal I酶切位点,扩增片段为678 bp。参考Trizol试剂说明书用Trizol裂解法提取IBV尿囊液总RNA。
1.4 RT-PCR反应
反转录体系:取1.3提取的病毒RNA 4μL,加入dNTP 0.5μL,下游引物0.5μL(10μmol/L),在冰上混合后65℃水浴5min,取出立即放冰上2min;依次加入5×PrimeScriptReverse transcriptase Buffer2μL,RNase抑制剂0.5μL,PrimeScript Reverse Transcriptase(5 U/μL)1μL,DEPC水1.5μL,在冰上混合,42℃水浴1 h,然后70℃灭活15 min。
PCR反应体系:取cDNA 4μL,依次加入10×KOD Buffer 5μL,dNTP(2 mmol/L)5μL,MgSO44μL,上/下游引物(10μmol/L)各1.5μL,KOD-Plus酶2μL,ddH2O 27μL以补足50μL体系;PCR反应条件:94℃4 min;(94℃45 s;56℃45 s;68℃1 min)设35个循环;68℃10 min。
取5μL PCR产物在1.0%的琼脂糖凝胶中电泳检验是否扩增出目的片段。
1.5 PCR产物的克隆与序列测定
将检验正确的PCR产物用胶回收试剂盒进行回收,连接pMD18-T载体,转化感受态细胞DH5α,在LBAmp+板上涂布,37℃培养16 h后PCR筛选,筛选出阳性克隆后进行质粒双酶切鉴定。鉴定阳性克隆命名为pMD18-IBV-M,送上海铂尚生物公司测序。
1.6 pC1-IBV-M基因真核表达载体的构建与鉴定
用内切酶EcoR I、Sal I对pMD18-IBV-M质粒和pEGFP-C1-SCP-SEC载体双酶切,回收目的片段,取回收产物16℃连接过夜。产物转化感受态细胞DH5α,涂布LB Kan+平板,37℃16 h后进行PCR筛选,筛选结果正确的进行大量培养后提取质粒并进行Eco RI、Sal I双酶切,鉴定正确的质粒命名为pC1-IBV-M,送上海铂尚生物公司测序。
1.7 pC1-IBV-M重组质粒的间接免疫荧光试验
按照脂质体2000转染说明书分别用不含血清的DMEM稀释转染试剂脂质体2000和C1-IBV-M,质粒用量为0.8μg/孔,转染试剂的量约为质粒的2—2.5倍,稀释后迅速混匀,室温放置20 min,转入Vero细胞中,同时设立不转染的正常Vero细胞为阴性对照,6 h后换液,放入37℃5%CO2培养箱中培养48 h,将细胞培养液弃掉,加入预冷的75%乙醇,4℃冰箱预冷1 h,弃掉乙醇溶液,用PBS洗3次并风干,使有机溶剂挥发完全,每孔加入1∶50倍稀释的IBV阳性血清200μL,37℃孵育1 h,用PBS洗涤3次,每孔加入1∶200倍稀释的FITC标记兔抗鸡IgG 400μL,37℃避光孵育1 h,用PBS洗3遍并风干,然后在荧光显微镜下观察结果,并拍照。
1.8 H120株M基因真核表达载体的免疫保护性试验
将大量提取的质粒与PEI 25000(1 mg/mL)按N/P=8混合,轻微震荡后离心混匀,室温放置20 min直接腿部多点肌肉注射。
将7日龄雏鸡随机分为2组,每组5只,试验组注射制备的真核表达载体100μg/只,另一组设为对照,注射PBS 500μL/只。一免1周后同剂量加强免疫1次,二免14 d后攻毒(200μL/只),连续观察14 d后全部扑杀,取肾脏组织提取RNA进行病毒的检测,以评判该核酸疫苗是否具有免疫保护性。
2 结果与分析
2.1 IBV-M基因的RT-PCR扩增
以提取的IBV尿囊液总RNA为模板,进行PCR扩增,扩增片段全长约678 bp(图1)。
2.2 pMD18-IBV-M基因克隆筛选与酶切鉴定
以pMD18-IBV-M进行菌落PCR筛选,可检测到约678 bp的基因片段(图2)。
将pMD18-IBV-M质粒进行双酶切,得到约2 692 bp和678 bp长度的2个片段,分别与pMD18-T载体和IBV-M基因片段一致(图3)。比对测序结果,IBV-M基因大小正确。
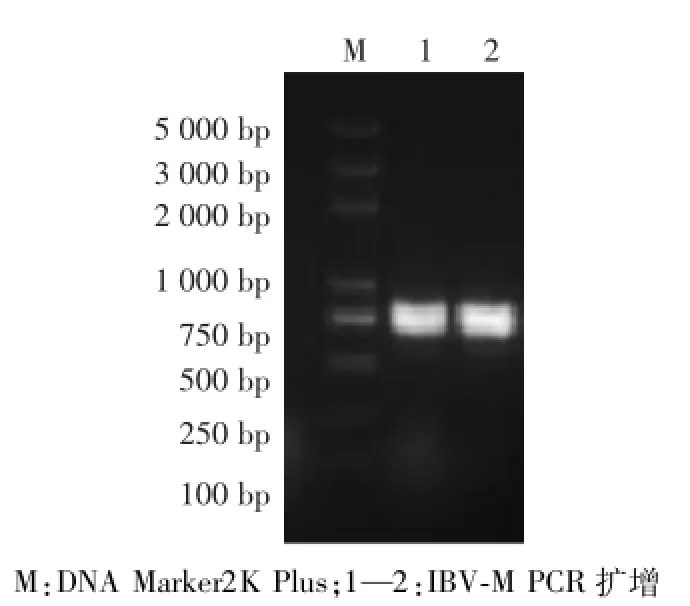
图1 IBV-M基因的PCR扩增Fig.1 PCR product of IBV-M

图2 pMD18-IBV-M筛选阳性克隆Fig.2 PCR of bacterium drop of pMD18-IBV-M
2.3 真核表达载体构建和筛选
将C1-IBV-M重组质粒进行双酶切,得到约4 731 bp和678 bp的2个片段,分别与C1-SCP-SEC载体和IBV-M基因片段一致(图4)。比对测序结果,IBV-M基因大小正确,说明真核表达质粒pC1-IBV-M构建成功。

图3 pMD18-IBV-M酶切鉴定Fig.3 Identification of the p lasm id pMD18-IBV-M
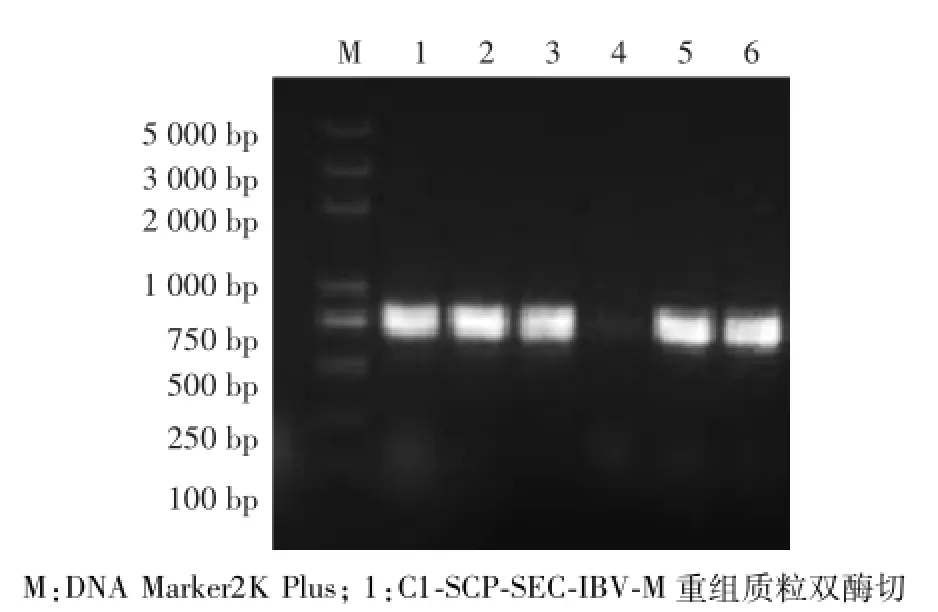
图4 C1-SCP-SEC-IBV-M酶切鉴定Fig.4 Dentification of the recom binant p lasm id C1-SCP-SEC-IBV-M
2.4 重组质粒的间接免疫荧光试验
重组质粒转染Vero细胞后,经过48 h的培养进行免疫荧光试验,通过荧光显微镜观察试验结果,根据是否有荧光来判断免疫荧光的效果,在重组质粒的细胞孔内可以观察到特定的绿色荧光,而阴性对照细胞内无绿色荧光(图5),由观察可知,构建的重组质粒pC1-IBV-M在Vero细胞中能够表达,表达的蛋白能与IBV血清发生特异性结合。

图5 重组质粒的免疫荧光试验(40×)Fig.5 Immunofluorescence assay of recombinant p lasm id(40×)
2.5 C1-IBV-M重组质粒的免疫保护性
两组动物攻毒后连续观察14 d后全部扑杀,取肾脏组织提取RNA,进行病毒PCR鉴定。图中泳道1—5为对照组均能检测到病毒条带,泳道6—10为疫苗组均未检测到病毒。说明本研究制备的真核表达载体具备一定的免疫保护效果(图6)。

图6 动物试验肾脏组织RT-PCR鉴定Fig.6 Identification of kidney RT-PCR
3 讨论
IBV在世界范围内广泛流行,是高度接触性呼吸道传染病,主要侵害鸡的呼吸系统,泌尿生殖系统和消化系统[6]。自从IBV被发现以来,人们就一直致力于IBV的防控,接种疫苗是预防控制IBV传播的最有效手段[13],普通疫苗的制备成本高,运输和贮存条件要求较高,加上该病原不断出现新的血清型,常导致免疫不成功,这使得普通疫苗在实践应用中从根本上控制不了IB的流行,因此研制高效安全的IB疫苗,对防控和治疗IB具有重大意义[14-18]。随着分子生物学的飞速发展,人们对病毒基因组的结构及其主要免疫功能有了越来越深入的了解,开发研制IB基因工程疫苗,克服传统疫苗的不足之处,已成为未来IB疫苗研制越来越热门的方向[20-21]。
DNA疫苗是指将具有保护性免疫应答的目的基因克隆至真核质粒载体,然后将重组质粒导入机体,它会通过宿主体内的转录系统表达目的抗原,从而刺激机体产生保护性免疫应答的一种生物制剂[21]。其中目的基因的选择至关重要,通常选择该病原主要的保护性抗原基因,一般选择对大多数毒株都有保护作用的抗原基因,其表达产物能诱导机体产生保护性的免疫反应。
有研究表明,M基因保守性高于S1基因而低于N基因[9],将国内外参考毒株相比较发现彼此之间核苷酸同源率很高,为85%—100%。本研究将扩增的IBV-M基因与GenBank上登录的参考株相比,发现同源率在94%—100%,说明M基因变异性小,这与文献报道一致[23-25]。另有研究表明,M基因能刺激机体产生抗体,在M基因的N端能形成抗原决定簇,能诱导细胞介导的免疫反应[24]。
本试验选择IBV H120株的M基因作为真核表达载体的免疫原基因,将M基因插入改造好的真核表达载体pEFGP-C1-SCP-SEC载体上,通过酶切鉴定和比对测序结果,成功构建IBV-M的真核表达载体,通过动物试验验证了其具有一定的免疫保护性:图6中泳道1—5为对照组均能检测到病毒条带,但是存在非特异性条带,分析原因认为,此非特异性扩增条带为引物自聚体,不影响试验结果。此结果表明了M基因能刺激机体产生特异性抗体,可以保护机体免受病毒的攻击,这与其他研究结果基本一致,为进一步研究IBV的DNA疫苗奠定了基础。
[1]蔡宝祥.家畜传染病学[M].北京:中国农业出版社,2001.
[2]王红宁.禽呼吸系统疾病[M].北京:中国农业出版社,2002.
[3]MOLENKAMP R,SPAANW J.Identification of a specific interaction between the coronavirusmouse hepatitis virus A59 nucleocapsid protein and packaging signal[J].Virology,1997,239:78-86.
[4]江国托,刘思国,康丽娟,等.鸡传染性支气管炎病毒的遗传与变异(一)[J].养禽与禽病防治,1999(4):6-9.
[5]JIAW,KARACA K,PARRISH CR,etal.A novel variantofavian infectiousbronchitis virus resulting from recombination among three different strains.[J].Archives of Virology,1995,140:259-271.
[6]SAIF YM.禽病学[M].苏敬良,高福,索勋主,译.11版.北京:中国农业出版社,2005.
[7]殷震,刘景华.动物病毒学[M].北京:科学出版社,1985.
[8]MOCKETT A P A.Envelope proteins of avian infectious bronchitis virus:Purification and biological properties[J].Journal of Virological Methods,1985,12:271-278.
[9]罗艳.陕西省鸡IBV的分离鉴定及其M蛋白基因的遗传变异研究[D].杨凌:西北农林科技大学,2007.
[10]IGNJATOVIC J,GOULD G,SAPATS S.Isolation of a variant infectious bronchitis virus in Australia that further illustrates diversity among emerging strains[J].Archives of Virology,2006,151:1567-1585.
[11]WANG H N,WU Q Z,HUANG Y,et al.Isolation and identification of infectious bronchitis virus from chickens in Sichuan,China.[J].Avian Diseases,1997,41:279-282.
[12]MOCKETT A P,CAVANAGH D,BROWN T D.Monoclonal antibodies to the S1 spike and membrane proteins of avian infectious bronchitis coronavirus strain MassachusettsM41[J].JOURNAL OF GENERAL Virology,1984,65:2281-2286.
[13]许瑞,刘璐.鸡传染性支气管炎的免疫机制及疫苗防控[J].兽医导刊,2013(2):49-50.
[14]汪洋,李俊平,杨承槐,等.鸡传染性支气管炎病毒基因型与血清型相关性初步研究[J].中国预防兽医学报,2011(11):845-848.
[15]YU L,JIANG Y,LOW S,et al.Characterization of three infectious bronchitis virus isolates from China associated with proventriculus in vaccinated chickens.[J].Avian Dis,2001,45:416-424.
[16]于秀俊,杨静利,张莉.鸡传染性支气管炎疫苗研究进展[J].沧州师范专科学校学报,2007(2):42-44.
[17]吴悌霖.鸡传染性支气管炎疫苗的研究进展[J].中国动物检疫,2011(1):84-86.
[18]李国峰,韩鹤,翟宇.鸡传染性支气管炎病毒疫苗研究概述[J].畜牧兽医科技信息,2013(8):4-5.
[19]ZHOU JY,ZHANG D Y,YE JX,et al.Characterization of an avian infectious bronchitis virus isolated in China from chickens with nephritis[J].Journal of Veterinary Medicine(Series B),2004,51:147-152.
[20]廖娟,王红宁,黄勇,等.鸡传染性支气管炎病毒基因工程疫苗研究进展[J].中国家禽,2006(11):45-46.
[21]江国托.鸡IBV中国流行毒株的分子变异及其DNA疫苗的研究[J].畜牧兽医科技信息,1997(23):6.
[22]BAYRY J,GOUDAR M S,NIGHOT PK,et al.Emergence of a nephropathogenic avian infectious bronchitis viruswith a novelgenotype in India[J].Journal of Clinical Microbiology,2005,43:916-918.
(责任编辑:张睿)
Construction of DNA vaccine bearing M gene of chicken infectious bronchitis virus and evolution of its immune efficacy
SUN Xiao-yun1,2,LIU Cheng-qian2,YIJian-zhong2,LIHong2
(1College of Fisheries and Life Science,Shanghai Ocean University,Shanghai201306,China;2Animal Husbandry and Veterinary Research Institute,Shanghai Academy of Agricultural Sciences,Shanghai201106,China)
According to the M gene sequence of chicken infectious bronchitis H120,the primers were designed and synthesized.The total RNA was acquired from allantois fluid,M gene was amplified by using PCR technology.The plasmid of pMD18-IBV-M was cloned and then the M gene was inserted into pEGFP-C1-SCP-SEC vector which has been modified to construct the eukaryotic expression vector pC1-IBV-M.The animal’s immune protection was detected by indirect immunofluorscence(IFA)and animal experiment.
Chicken Infectious Bronchitis virus;M gene;Animal experiment
S831.7;S851.3
:A
1000-3924(2017)02-104-05
10.15955j.issn1000-3924.2017.02.19
2016-05-25
上海市科技人才计划(14YF1414600);上海市农业科学院中青年科技人员“助跑”计划
孙晓云(1989—),女,硕士,主要从事动物疾病的分子生物学及免疫学研究。E-mail:sunyun0529@163.com
,E-mail:lihong20061029@163.com

