鼠源炎症因子流式蛋白定量试剂盒的优化及初步应用
胡茂志,赵维芯,康喜龙,顾 杰,潘志明,崔桂友,焦新安
(1.扬州大学江苏省高校动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009; 2.扬州大学江苏省人兽共患病学重点实验室,江苏扬州 225009;3.扬州大学旅游烹饪学院 食品科学与工程学院,江苏扬州 225009)
鼠源炎症因子流式蛋白定量试剂盒的优化及初步应用
胡茂志1,2,赵维芯3,康喜龙1,2,顾 杰1,2,潘志明1,2,崔桂友3,焦新安1,2
(1.扬州大学江苏省高校动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009; 2.扬州大学江苏省人兽共患病学重点实验室,江苏扬州 225009;3.扬州大学旅游烹饪学院 食品科学与工程学院,江苏扬州 225009)
以小鼠炎症因子流式蛋白定量(cytometric bead array,CBA)检测试剂盒为参考,分别从降低试剂用量和缩短孵育时间两个方面进行优化,然后以沙门菌感染小鼠为模型,动态分析小鼠血清中炎症因子的分泌情况。结果表明,试剂用量由50 μL降至20 μL、孵育时间由2 h缩短至30 min仍然可以得到较好的检测效果。沙门菌感染小鼠后,利用该方法动态分析了小鼠血清中炎症因子的变化情况,并且发现炎症因子的早期分泌与沙门菌在小鼠体内的定殖呈正相关。通过CBA技术的优化和初步应用,为其推广应用提供了重要数据。
流式蛋白定量技术;剂量;孵育时间;沙门菌;小鼠
细胞因子(cytokine)是构成免疫系统的重要介质之一,主要是活化的免疫细胞和某些基质细胞(如骨髓基质细胞)分泌的具有高活性、多功能的多肽类小分子。细胞因子作为细胞信号分子,在激活免疫细胞中具有重要的作用[1]。参与免疫反应的细胞因子主要有干扰素(interferon,IFN)、白细胞介素(interleukin,IL)、集落刺激因子(colony stimulating factor,CSF)、肿瘤坏死因子(tumor necrosis factor,TNF)和转化生长因子(transforming growth factor,TGF)及一些趋化因子如单核细胞趋化因子(monocyte chemotactic protein 1,MCP-1)等。目前,细胞因子的检测技术大致有细胞生物活性检测、免疫学检测和分子生物学检测等方法。但由于生物活性检测法和分子生物学检测法需要实验条件较高,且操作较为繁杂,目前使用较多的就是免疫学检测法,而要在短时间内,用较少的样本量同时检测多个细胞因子的含量变化,传统的酶联免疫吸附试验和免疫印迹法是无法做到的。而应用流式蛋白定量技术(Cytometric bead array,CBA)则可以解决此问题。
CBA技术是将不同的捕获抗体包被在带有不同荧光强度的微球上,形成捕获微球,然后与待测标本溶液混合,微球上的特异性抗体就与样本中的抗原或蛋白结合,此后加入荧光标记的检测抗体,就形成了“三明治”夹心复合物,最后,通过流式细胞仪检测荧光强度的变化[2-4],就可以得到样品中细胞因子的变化情况。虽然此方法操作便捷、简单,但CBA试剂盒的成本比较昂贵,本试验通过优化该技术过程,以期降低试剂成本、缩短孵育时间,从而提高检测效率,并以沙门菌感染小鼠为模型,对该方法进行初步应用。
1 材料与方法
1.1 材料
鼠伤寒沙门菌分离株D6为江苏省人兽共患病学重点实验室分离并保存;6周龄C57BL/6雌性小鼠购自扬州大学比较医学中心;可以同时检测IL-6、IL-10、MCP-1、IFN-γ、TNF和IL-12p70等6种细胞因子的Mouse Inflammation CBA Kit和FACSAria Ⅱ流式细胞仪(FACSDiva分析软件)购自美国BD公司。
1.2 方法
1.2.1 CBA方法的优化 使用CBA试剂盒中的Cytometer setup beads设定仪器参数。
样品标记方法按照Mouse inflammation CBA Kit试剂盒操作说明书进行:①用2 mL稀释液复溶标准品,然后用稀释液进行倍比稀释,共9个稀释梯度;②分别取相同体积的六种不同的捕获微球进行混匀,分装10个管。③分别加入9个系列稀释的标准品和1个稀释液对照,混匀。④加入PE标记的检测试剂,轻吹混匀。⑤室温避光孵育2 h。⑥加入洗液,1 500 r/min离心10 min,最后用100 μL洗液重悬,上机检测。分别改变试剂用量(标准品、捕获微球和检测试剂的比例不变)和作用时间两个参数,比较对检测结果的影响。
1.2.2 沙门菌感染小鼠分析 将鼠伤寒沙门菌D6分离株腹腔注射6周龄C57BL/6雌性小鼠,1×105CFU/只,每组3只。分别在感染后不同时间,摘除眼球采血,收集血清,利用以上优化的CBA方法进行炎性因子分析;然后脱颈椎致死小鼠,采集脾脏,称取重量;将脾脏用5 mL灭菌PBS研磨,取100 μL涂布LB平板,培养16 h后,记录菌落数。
2 结果
2.1 CBA方法的优化分析结果
2.1.1 试剂用量对结果的影响 按照说明书的操作步骤,调节仪器状态。然后,在作用时间等其他因素均不变的情况下,改变标准品、捕获微球和检测试剂的用量(保持三者的比例关系不变),分析结果表明,将以上三者的用量均减为20 μL后,流式细胞仪分析结果仍然呈现较好的分析效果,随着炎症因子浓度的升高,平均荧光强度逐渐升高(图1)。每种细胞因子的平均荧光强度与原来50 μL时的结果基本一致,差异不显著(图2)。当三者的用量继续降低后,由于微球的量过低,在流式检测时,由于微球数量较少,可能会影响统计结果。因此,为了降低成本,又能保证结果的统计,将试剂用量减为20 μL进行分析比较合适。本试验重复3次,均有较好的重复性。
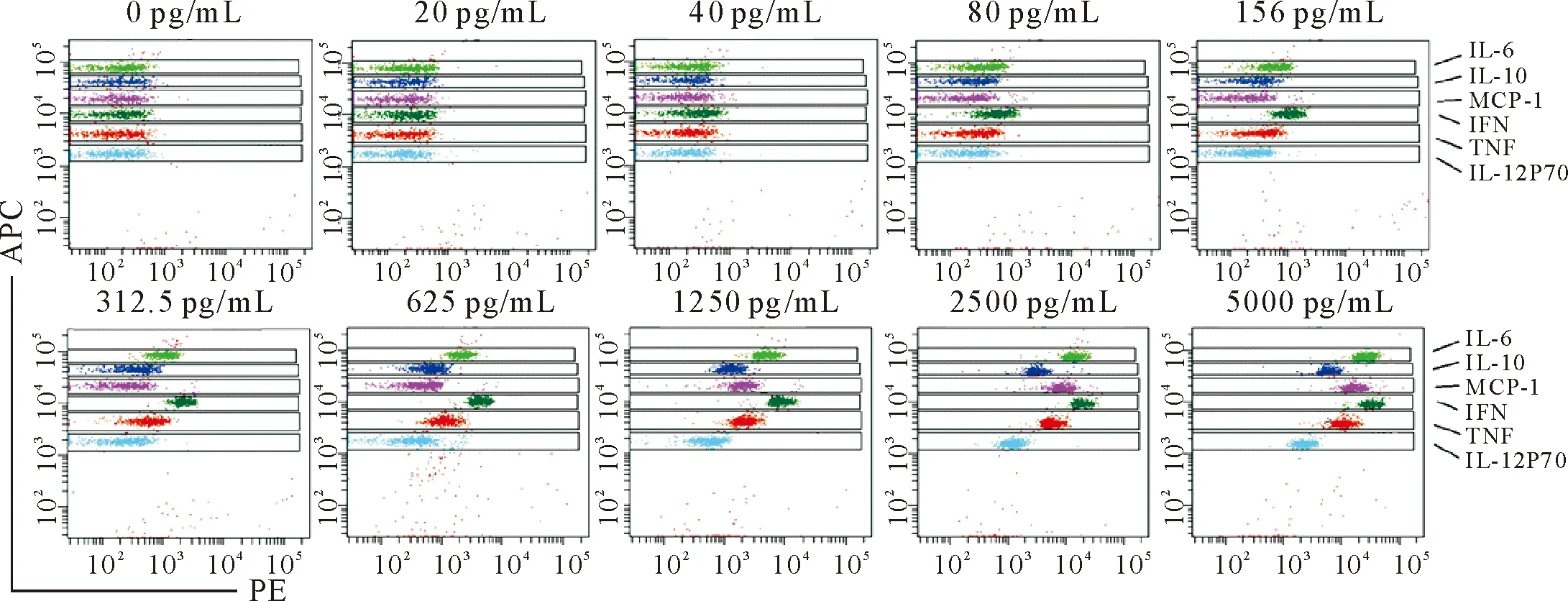
图1 炎症因子的流式分析结果

图2 试剂用量对炎症因子平均荧光强度的影响
2.1.2 孵育时间对结果的影响 在试剂用量等其他因素均不变的情况下,将试剂混合后,比较不同孵育时间对结果的影响。分析结果表明,分别避光孵育0.5 h、1 h 和2 h后发现,随着炎症因子标准品浓度的增加,各细胞因子的平均荧光强度均逐渐增强。在样品浓度1 250 pg/mL以下时,3个作用时间的检测结果呈现一致的变化趋势。在2 500 pg/mL ~5 000 pg/mL时,随着时间的延长,荧光强度略有升高。因此,为了节省检测时间,孵育时间可以减为0.5 h。本试验重复3次,重复性较好。
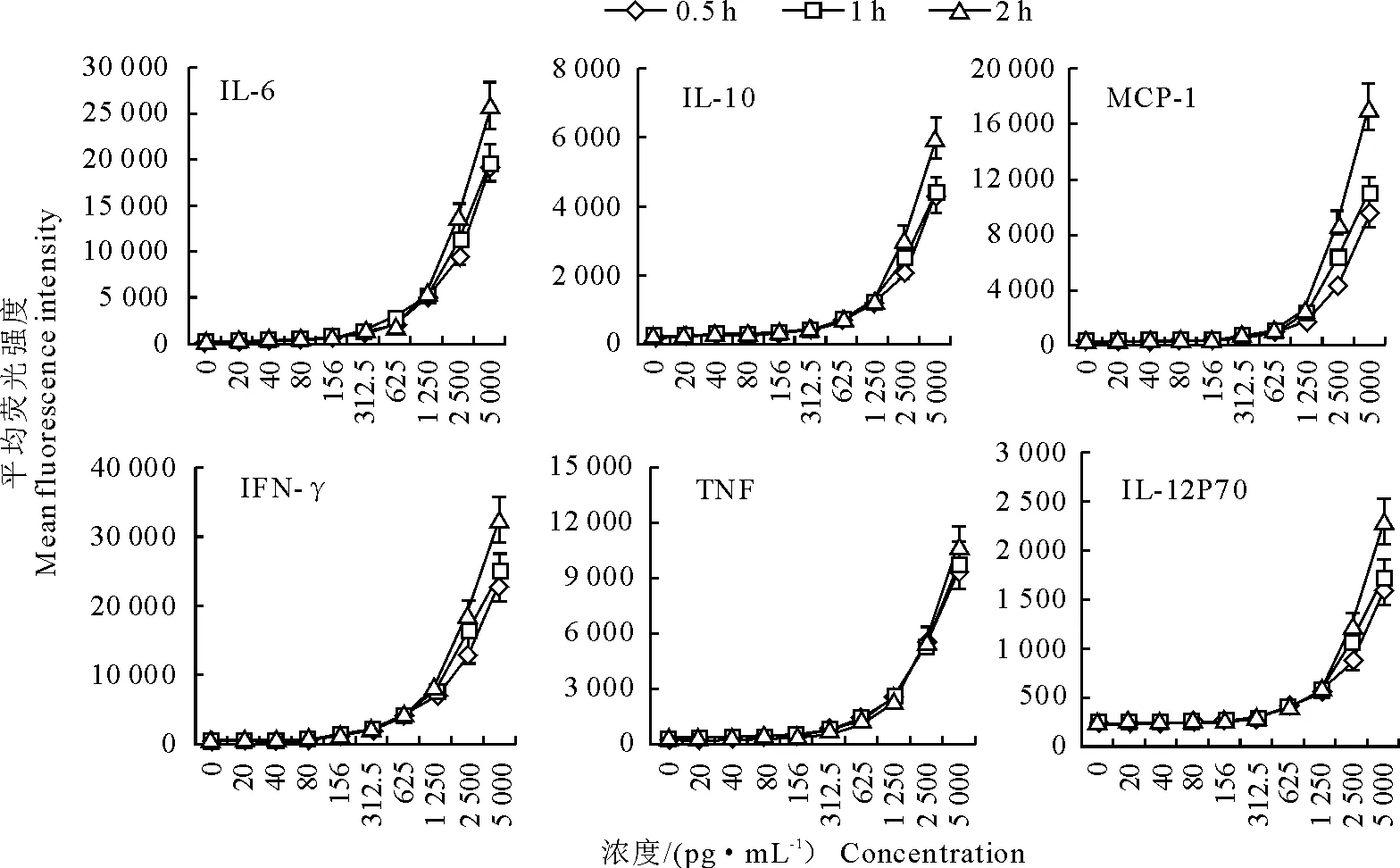
图3 孵育时间对炎症因子平均荧光强度的影响
2.2 沙门菌感染小鼠分析结果
腹腔注射感染小鼠分析结果表明,感染24 h后,随着感染时间的延长,小鼠脾脏重量逐渐增加(图4)。沙门菌在小鼠体内的定殖情况显示,在10 h内,基本分离不到,而24 h后,脾脏和肝脏中细菌数量均逐渐升高(图5)。小鼠血清中炎症因子分析结果表明,10 h内各炎症因子的变化不明显;1天后,IL-6、IL-10和MCP-1达到高峰,随后逐渐下降; IFN-γ在3 d后达到高峰,随后有所下降;TNF和IL-12P70从感染1 d后逐渐上升(图6)。

图4 小鼠脾脏重量分析结果

图5 沙门菌在小鼠脾脏和肝脏中的定殖分析结果

图6 小鼠血清中炎症因子分析结果
3 讨论
近年来,随着流式细胞技术的普及应用和免疫学研究的发展,CBA技术作为细胞因子检测的分析技术也逐步被实验室所认可和接受。该方法所需样品量少,而且可以自由组合,同时检测多种细胞因子的含量。相对于使用较普遍的ELISA方法而言,CBA技术可以用较少的样本量同时检测多种细胞因子的含量,并能够避免酶联反应信号放大带来的假阳性,灵敏度较高[5]。它的检测灵敏度一般为20 pg/mL ~5000 pg/mL[6]。CBA试剂盒中含有多种不同的捕获微球,其自身荧光强度不同,可使用流式细胞仪区分[4],每个微球都结合有特异性的检测抗体,将不同捕获微球等量混合,即将荧光试剂与免疫测定试样绑定,可以检测出相应细胞因子的含量。Carson[7]等将多种捕获微球混合同时检测15种不同细胞因子含量。另外,捕获微球还可以作为抗原或抗体的载体用于免疫学研究。在临床医学领域,CBA技术已逐步用于肿瘤疾病的辅助诊断、疗效和预后监测、干细胞研究和干细胞的治疗监测、免疫疾病的辅助诊断和监控等[8]。但由于该方法试剂成本较高,对其普及应用带来了限制。本研究在前期利用流式细胞仪进行单细胞水平分析的基础上,从CBA技术的应用出发,通过优化实验条件,以期达到降低成本,缩短检测时间的目的。
在试验过程中,捕获抗体微球、样品和检测抗体可以依次按比例混合后,孵育一段时间,最后洗涤后,即可进行流式细胞仪分析。根据这一过程,本试验分别从试剂的用量(按比例)和孵育时间两个方面分别进行比较分析,从而优化实验步骤。在流式细胞仪检测分析过程中,需要记录一定数量微球的平均荧光强度,以便进行统计分析,因此,保证不同微球的数量非常重要。在试剂保存过程中,微球会沉淀,所以在吸取之前,必须要将微球混匀,以保证微球的数量。通过比较分析,将试剂用量同时降低一半,仍然可以达到一致的效果。
孵育时间的选择需要保证抗原抗体的充分结合,从而达到最佳的检测效果。一般情况下,抗原抗体的结合时间从20 min~2 h不等[9-12]。在保证检测效果的前提下,缩短孵育时间可以提高检测效率。另外,许多试样和荧光检测试剂不宜在室温存放,需要低温避光保存[13]。所以,应该在不影响试验结果的情况下尽量缩短孵育时间。有试验表明,在测定MCP-1、MIP-1α、IL-8、IL-6、IL-10、IL-12、TNF-α等细胞因子时,将捕获微球、血清及PE-检测抗体混合孵育缩短至1 h即可进行分析[14]。本试验分别比较了不同孵育时间的检测效果发现,孵育30 min的检测效果与孵育2 h的效果基本一致,因此,可以将孵育时间缩短至30 min以提高检测效率。
沙门菌是一种重要的食源性微生物,在细菌源性食品中毒中常列榜首。目前,关于沙门菌感染机制和感染早期的宿主应答情况的研究已经比较详尽[15]。在沙门菌感染早期,宿主细胞通过分泌IL-12、IFN-γ和TNF-α等细胞因子来增强吞噬能力,但沙门菌在长期的进化过程中,逐渐建立了一套适合自身的逃逸机制,通过调节细胞因子的分泌来逃避宿主细胞的杀伤[16]。本试验以沙门菌腹腔注射感染小鼠为模型,利用以上优化的CBA方法动态分析了感染早期小鼠血清中炎症因子的变化情况,与报道结果一致。同时分析发现,在感染早期,炎症因子的释放与沙门菌在小鼠体内的定殖情况呈正相关。
本试验通过对流式蛋白定量检测技术的优化及在沙门菌感染模型中的初步应用,为该技术的推广应用提供了重要数据。
[1] Alnek K,Kisand K,Heilman,et al.Increased blood levels of growth factors,proinflammatory cytokines,and Th17 cytokines in patients with newly diagnosed type 1 diabetes [J].PLoS One,2015,10(12):e0142976.
[2] Dabitao D,Margolick J B,Lopez J,et al.Multiplex measurement of proinflammatory cytokines in human serum:comparison of the Meso Scale Discovery electrochemiluminescence assay and the Cytometric Bead Array [J].J Immunol Meth,2011,372(1-2):71-77.
[3] Meimaridou A,Haasnoot W,Shelver W L,et al.Multiplex immunoassay for persistent organic pollutants in tilapia:comparison of imaging-and flow cytometry-based platforms using spectrally encoded paramagnetic microspheres [J].Food Addit Contam A,2013,30(5):843-852.
[4] Fu Q,Zhu J,Van Eyk J E.Comparison of multiplex immunoassay platforms [J].Clin Chem,2010,56(2):314-318.
[5] Wyns H,Croubels S,Vandekerckhove M,et al.Multiplex analysis of pro-inflammatory cytokines in serum of Actinobacillus pleuropneumoniae-infected pigs [J].Res Vet Sci,2015,102:45-48.
[6] Madureira D F,da Silva J M,Teixeira A L,et al.Cytokine measurements in gingival crevicular fluid and periodontal ligament:Are they correlated [J].Am J Orthod Dentofac,2015,148(2):293-301.
[7] Carson R T,Vignali D A.Simultaneous quantitation of 15 cytokines using a multiplexed flow cytometric assay [J].J Immunol Meth,1999,227(1-2):41-52.
[8] 杨玉娇,刘正霞,吴玉呈,等.冠心病患者血清细胞因子水平及临床意义[J].南京医科大学学报,2014,6(34):755-760.
[9] Zhang F,Pang N,Zhu Y,et al.CCR7(lo)PD-1(hi) CXCR5(+) CD4(+) T cells are positively correlated with levels of IL-21 in active and transitional cystic echinococcosis patients [J].BMC Infect Dis,2015,15:457.
[10] Wang H,Li J,Pu H,et al.Echinococcus granulosus infection reduces airway inflammation of mice likely through enhancing IL-10 and down-regulation of IL-5 and IL-17A [J].Parasite Vector,2014,7:522.
[11] Cai X,Pacheco-Rodriguez G,Haughey M,et al.Sirolimus decreases circulating lymphangioleiomyomatosis cells in patients with lymphangioleiomyomatosis [J].Chest,2014,145(1):108-112.
[12] Bossowski A,Harasymczuk J,Moniuszko A,et al.Cytometric evaluation of intracellular IFN-γ and IL-4 levels in thyroid follicular cells from patients with autoimmune thyroid diseases [J].Thyroid Res,2011,4:13.
[13] Sada-Ovalle I,Ocaa-Guzman R,Pérez-Patrigeón S,et al.Tim-3 blocking rescue macrophage and T cell function againstMycobacteriumtuberculosisinfection in HIV+ patients [J].J Int AIDS Soc,2015,18:20078.
[14] Loh Y S,Dean M M,Johnson L,et al.Treatment of platelets with riboflavin and ultraviolet light mediates complement activation and suppresses monocyte interleukin-12 production in whole blood [J].Vox Sang,2015,109(4):327-335.
[15] Portaliou A G,Tsolis K C,Loos M S,et al.Type III secretion:building and operating a remarkable nanomachine [J].Trends Biochem Sci,2016,41(2):175-189.
[16] Franchi L,Kamada N,Nakamura Y,et al.NLRC4-driven production of IL-1β discriminates between pathogenic and commensal bacteria and promotes host intestinal defense [J].Nat Immunol,2012,13(5):449- 456.
Optimization of Mouse Inflammation Cytometric Bead Array Kit by Flow Cytometry and Its Application
HU Mao-zhi1,2,ZHAO Wei-xin3,KANG Xi-long1,2,GU Jie1,2,PAN Zhi-ming1,2, CUI Gui-you3,JIAO Xin-an1,2
(1.JiangsuCo-innovationCenterforPreventionandControlofImportantAnimalInfectiousDiseasesandZoonoses,YangzhouUniversity,Yangzhou,Jiangsu,225009,China;2.JiangsuKeyLaboratoryofZoonosis,YangzhouUniversity,Yangzhou,Jiangsu,225009,China; 3.CollegeofTourism&Cuisine(CollegeofFoodScienceandEngineering),YangzhouUniversity,Yangzhou,Jiangsu,225009,China)
The mouse inflammation cytometric bead array (CBA) kit was used as reference,the mean fluorescence intensity by flow cytometry was compared through changing reagent dose and incubation time,respectively.Then the serum cytokines of mice were measured after infection withSalmonella.The results indicated that similar tendency can be detected when decreasing reagent dose from 50 μL to 20 μL and shortening incubation time from 2 hours to 30 minutes,respectively.The optimized CBA technique was then used to analyze the serum cytokines inSalmonella-infected mice.We simultaneously found that the secretion of inflammatory cytokines in the early-stage of infection is associated with the colonization ofSalmonellain mice.This data will be helpful for the application of CBA technique.
cytometric bead array; reagent dose; incubation time;Salmonella; mouse
2016-09-24
国家自然科学基金项目(31372414);江苏省高校优势学科建设工程项目
胡茂志(1976-), 男,山东临沂人,副研究员,博士,主要从事微生物学和免疫学研究。
S852.6
A
1007-5038(2017)05-0017-05

