反射式共聚焦显微镜在炎症性皮肤病诊疗中的应用
江文才 袁 超
反射式共聚焦显微镜在炎症性皮肤病诊疗中的应用
江文才 袁 超
反射式共聚焦激光扫描显微镜(RCM)作为一种在体无创性皮肤检查设备,能够实时动态反应细胞形态及皮肤结构的变化,在某些皮肤病中其图像特征与组织病理学检查结果具有高度的一致性,本文就RCM在炎症性皮肤病的诊断、疗效评价和疾病进展中的应用作一综述。
共聚焦激光扫描显微镜; 炎症性皮肤病; 组织病理学
反射式共聚焦显微镜(Reflectance confocal microscopy, RCM)是一种实时、动态、无创性皮肤检测设备。利用不同层面不同组织细胞结构对光的反射和折射系数不同,获得皮肤组织的灰度图像,其分辨率可与组织病理学相媲美,且与组织病理表现有很好的对应关系。目前,RCM已广泛用于皮肤肿瘤[1-3]和色素性皮肤疾病[4,5]诊疗,显示出较高的临床应用价值。近年来国内外大量研究也表明,诸如银屑病、扁平苔藓、急性接触性皮炎和脂溢性皮炎等炎症性皮肤病均具有一些独特的RCM图像特征,RCM可在一定程度上替代组织病理学检查,用于这类疾病的鉴别诊断及疗效观察。因此,本文将就RCM在炎症性皮肤病诊断、疗效评价及病程演变研究中的应用现状做一综述。
1 炎症性皮肤病RCM常见特征及描述
常见炎症性皮肤病组织病理学改变主要发生在表皮层、真皮乳突层和浅表血管丛,包括炎性细胞浸润、脓泡、水疱和大疱等[6]。RCM最大穿透深度250~300 μm,基本上覆盖炎症性皮肤组织病变的解剖深度。目前,文献已报道的炎症性皮肤病的RCM图像特征多达18个[7-10],其中角化不全、海绵水肿、炎性细胞浸润及基底层色素环完整性和血管扩张等9个参数是应用最多的评价指标(表1 )。

表1 常见炎症性皮肤病RCM特征
2 RCM在炎症性皮肤病诊断中的应用
2.1 寻常型银屑病 寻常型银屑病是慢性复发性炎症性皮肤病,主要的组织学特征包括角化不全伴中性粒细胞浸润,银屑病样增生,颗粒层减少和真皮乳头内血管扩张、迂曲及真皮浅层血管周围淋巴细胞浸润等。Ardigo等[7]系统地比较了寻常型银屑病(Plaque Psoriasis,PP)患者的RCM图像特征和组织病理变化的对应关系(图1)。分析的8个参数中,角化不全、乳头瘤样增生、乳突血管扩张和棘层增厚等5个RCM参数与组织病理切片的一致性>90%,棘层增厚的一致性最高为100%,总体Kappa系数为0.66(P<0.001)。因此,作者认为RCM能够全面、准确地发现PP组织病理学改变,是一种非常有前景的PP诊断工具。2011年,国内学者刘华绪等[11]应用RCM对多例临床表现不典型的疑似银屑病患者或曾误诊患者进行检查,结果显示患者的RCM图像均有角化不全、Munro微脓肿、棘层增厚、真皮乳头血管扭曲扩张充血,部分患者还伴有真皮乳头上延和表皮突下延等特征,符合银屑病的组织改变。随后的组织病理学检查和疗效也进一步证实了RCM诊断的正确性。相对于上述研究中的定性分析,Wolberink等[8]对已确诊的8例PP患者,采用半定量法分析RCM图像特征与组织病理学结果间的相关性,共选取了6个参数,其中角化不全、炎性细胞浸润、表皮厚度和真皮乳突增生4个参数2种检查方法的相关系数分别为0.93、0.77、0.89和0.89。可见RCM在诊断PP中具有与组织病理学检查类同的效果。
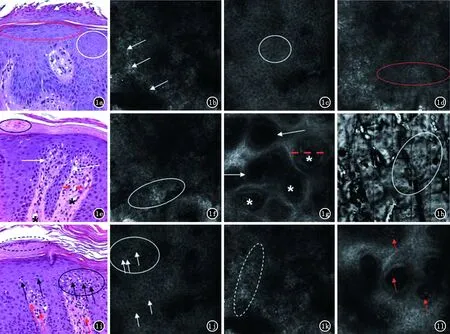
a白色箭头:角化不全,白色圆圈:棘层增厚,红色圆圈:颗粒层减少(HE,×200);b白色箭头:角化不全;c白色圆圈:正常的棘层“蜂窝状”结构;d红色圆圈:颗粒层减少,可见部分棘层;e黑色圆圈:角化不全,白色箭头:乳头瘤样增生(HE,×200);f白色圆圈:炎性细胞浸润;g红色虚线:乳突直径增大,白色星号:乳突内毛细血管扩张;h白色圆圈:乳突上延至棘层;i虚线圈:角化不全,黑色箭头:炎性细胞迁延,黑色圆圈:海绵水肿,红色箭头:乳突内血管周围炎性细胞浸润(HE,×200);j角化不全;k海绵水肿;l血管扩张伴有血管周围炎性细胞浸润
图1 寻常型银屑病患者的组织病理切片和RCM图像(图片来自文献9)
RCM也可以用于PP的鉴别诊断。同为红斑鳞屑性皮肤病的PP、湿疹、脂溢性皮炎和毛发红糠疹,仅凭临床表现,有时容易误诊。应用RCM可快速、准确发现角质层中的Munro微脓肿,仅利用该指征结合临床表现诊断PP的敏感性和特异性分别高达90.0%和96.4%[12]。Moscarella等[9]采用单盲法,选用角化不全、角质层厚度、表皮厚度、海绵水肿和毛囊螨虫等9个指标,鉴别诊断脂溢性皮炎和PP,结果显示2种疾病的角化不全、海绵水肿、炎性细胞浸润3个参数间差异显著;另外,扩张的血管水平方向性以及是否有毛囊蠕形螨也是鉴别诊断两者的有效指标。同时,作者根据上述参数绘制ROC曲线,当截留值为5时,RCM诊断PP的敏感性和特异性分别为78.9%和75%。然而,该研究并未进一步分析综合上述9个参数诊断PP的敏感性和特异性。由此可见,RCM是鉴别诊断PP的有效手段之一。
2.2 扁平苔藓 扁平苔藓是一种原因不明的慢性或亚急性炎性皮肤病。典型的扁平苔藓通过临床症状即可作出判断,但很多不典型的扁平苔藓,常与玫瑰糠疹、银屑病、慢性单纯性苔藓等皮肤病难以鉴别。国内一些学者对组织病理学确诊的扁平苔藓应用RCM观察皮损处的图像特征,研究结果均显示,患者角质层增厚、颗粒层局灶性增厚,真皮乳头环模糊或消失,真表皮界限模糊,真皮浅层可见致密的中等折光炎性细胞,部分研究还发现真皮浅层可见椭圆形或星形、边缘不整齐、高折光的噬黑素细胞[13-15]。基于基底层液化变性,以及RCM图像中有无水疱和Munro微脓肿等特征,可有效进行上述皮肤病的鉴别诊断。2011年Moscarella等[10]全面比较了扁平苔藓组织病理学改变与RCM图像间的关系,同国内学者研究结果基本一致。同时,该研究还发现棘层细胞排列中度紊乱和海绵水肿;以及在表皮内可见到折光度均匀、较正常角质细胞体积更大、无核的不规则形的坏死角质细胞(见图2)。由此可见,扁平苔藓的RCM图像特征与组织病理学特征间具有良好对应关系,有望成为一种诊断和鉴别诊断非典型性扁平苔藓的有效工具。
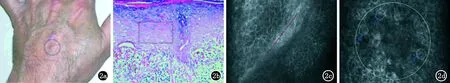
a临床图像;b颗粒层增厚、表皮炎性细胞浸润、表皮底层坏死的角质细胞、基底层液化和散在噬黑素细胞(HE,×200);c红色线条为颗粒层和棘层分界线,清晰可见,提示颗粒层增厚(HE,×200);d大的白色圆圈:基底层液化变性,蓝色箭头:形状不规则的坏死角质细胞(白线为细胞轮廓)(HE,×200)
图2 扁平苔藓组织病理切片和RCM图像-手背(图片来自文献12)
2.3 其他炎症性皮肤病 RCM也正逐渐用于其他炎症性皮肤病的辅助诊断。Meinke等[16]通过比较特应性皮炎(Atopic dermatitis, AD)患者正常部位和皮损部位皮肤RCM图像差异,发现皮损部位皮肤具有明显的多边形网格状纹理、海绵水肿、蜂窝状结构缺失、棘层增厚,以及明亮的乳突环缺失等炎症性皮肤病常见的特征,但未见有角化过度和真皮炎性细胞浸润。上述特征与AD的病理学改变基本一致,因此,作者认为RCM在AD的临床诊断中具有较高的应用价值。2011年国内学者刘华绪等[17]首次报道,光泽苔藓具有扩大的真皮乳突内充满高折光的噬色素细胞和炎性细胞,同时伴有乳突上方基底层消失等RCM特征,该检测结果为确诊光泽苔藓提供了有价值的参考依据。另外,RCM在过敏性接触性皮炎[18]和盘状红斑性狼疮[19]等炎性皮肤病诊断中的应用也有文献报道。
3 RCM在炎症性皮肤病疗效评价中的应用
炎症性皮肤病治疗方案的确定主要取决于皮损面积、严重程度、并发症及治疗的效果和不良反应等[20]。其中疗效评价对于治疗方案的确定及调整至关重要。然而,目前炎症性皮肤病的疗效评价主要依赖于临床医生的经验,主观性比较大。RCM通过动态观察,能够提供皮肤结构变化的客观指标,已广泛用于银屑病的疗效评估。Baaran等[21]应用RCM观察25例PP患者治疗前后,棘层厚度、单位面积海绵水肿的数量、Munro微脓肿数量、表皮炎性细胞个数、色素环缺失的真皮乳突的数量和真皮乳突血管数量等18个参数变化,以及银屑病皮损面积及严重程度指数(Psoriasis Area Severity Index, PASI)的改变。与治疗前相比,棘层厚度显著降低(168.85±7.73μmvs 123.44±24.32μm);真表皮伴有炎性细胞浸润的患者的比例分别从84%和84%,降至72%和60%;同时,发生Munro微脓肿的患者比例也从治疗前的80%降至治疗后的32%。同时,研究还发现PASI与棘层厚度、海绵水肿数量和表皮厚度等8个RCM特征具有显著相关性(P<0.05)。该研究结果与Wolberink等[22,23]应用RCM观察中波紫外线对银屑病的治疗效果一致,可见RCM是一种有效的细胞水平的疗效评价工具。RCM除了具有客观评价指标的优势外,还能早期发现炎症症状有无改善。Ardigò等[24]应用抗TNF-α单克隆抗体阿达木治疗银屑病,4周后患者的红斑症状尚未明显消退,但RCM检查显示,真、表皮炎性细胞均已消失,表明阿达木单抗抗炎疗效快。此外,RCM也已用于玫瑰痤疮的疗效评价。一项针对25例玫瑰痤疮患者的研究显示[25],治疗前患者的单个毛囊和8×8 mm2蠕形螨数量分别是0.63和155,治疗后分别为0.41和96.2,较治疗前明显降低,临床症状也明显好转。作者认为应用RCM观察蠕形螨密度的变化是评价玫瑰痤疮治疗效果最为直观有效的方法。由此可见,RCM是一种辅助临床医生对炎症性皮炎病疗效进行早期、客观评价的有效手段。
4 其它
随着对RCM研究的深入,该项技术也被逐渐应用炎症性皮肤病进程的动态研究。已有文献报道,炎症细胞的RCM图像特征为高折光率、同质性的小颗粒[26]。组织病理学研究进一步证实,该特征颗粒为分叶核中性粒细胞[27]。基于这些发现,Peppelman等[28]通过局部应用白三烯B4构建炎症性皮肤病模型,RCM观察到应用白三烯B4 24 h后,6个受试者(共7个受试者)棘层发现高折光颗粒,与组织病理学中弹性蛋白酶染色阳性细胞分布一致。因此,作者认为该特征性颗粒即为分叶核中性粒细胞。随着时间的推移,分叶核中性粒细胞的体积、边界清晰度、密度、折光度和折光率等不断发生变化。同时,随着疾病的发展,迁移至棘层不同深度的分叶核中性粒细胞形态也有所不同,并且上述RCM观察到的特征性改变与相应时间点的组织病理学结果完全一致。因而,可根据分叶核中性粒细胞的形态特征的变化,判断疾病的进程。Wolberink等[29]进一步证实RCM在研究炎症性皮肤病动态变化的可行性。作者利用RCM清晰地观察到中性粒细胞随着病程的发展由基底层向角质层迁移。同时,伴随有Munro微脓肿逐渐降解的变化。因而,作者认为根据RCM图像中分叶核中性粒细胞Munro微脓肿形态的变化,可用于判定银屑病皮损是活动性或者静止期。
除此之外,RCM还可用比较药物的疗效。Ardigò等[30]分别应用乙酰氯芬酸(非甾体消炎药)和倍他米松(糖皮质激素类药)治疗银屑病,治疗3周和6周后,利用RCM观察皮肤细微结构的改变。乙酰氯芬酸组和倍他米松组不同时间点临床症状改善的比例分别是32%、45%和76%、81%。虽然倍他米松组的临床症状改善优于乙酰氯芬酸组,但皮下细微结构的恢复情况正好相反。RCM检查结果显示,治疗6周后,乙酰氯芬酸组和倍他米松组的角化不全消退的比例分别为20%和13.3%;同时,相对于乙酰氯芬酸组,倍他米松组很多皮损处的颗粒层-棘层角质细胞界限仍不清,基层海绵水肿消退的更少,真皮乳突环结构恢复情况也更差。由此可见,乙酰氯芬酸具有更好的治疗效果。
综上所述,RCM作为一种无创的、快速在体研究皮肤及皮肤结构的新技术,在炎症性皮肤病的诊断、疗效评估以及发病机制方面具有较高的应用价值。然而,目前已开展研究的炎症性疾病种类仍较少,样本量也有待进一步扩大,且绝大多数研究在与组织病理学进行比较时,未采用盲法;此外,已应用的RCM评价参数仍为形成统一共识,研究结果间无法进行直接比较;同时,RCM也无法区分炎性细胞的类型。这些方法上的不足和技术上的局限性一定程度上影响着RCM在临床上的进一步应用。相信随着这一技术的不断完善和发展,以及更多相关研究的开展和评价标准的制定,RCM必将能够更好应用于皮肤学科疾病研究,促进皮肤科学的发展。
[1] Pellacani G, Scope A, Farnetani F, et al. Towards an in vivomorphologic classification of melanocytic nevi[J]. J Eur Acad Dermatol Venereol,2013,10:422-424.
[2] Prodinger C, Tatarski R, Laimer M, et al. Large congenital nevusspilus -improved follow-up through the use of in vivo reflectanceconfocal microscopy[J]. Dermatol Pract Concept,2013,3:55-58.
[3] Longo C, Lallas A, Kyrgidis A, et al. Classifying distinct basal cell carcinoma subtype by means of dermatoscopy and reflectance confocal microscopy[J]. J Am Acad Dermatol,2014,71(4):716-724.
[4] 刘华绪,林燕,陈学超,等.白癜风及其他色素减退性皮肤病的RCM图像特点[J].中国麻风皮肤病杂志,2012,28(3):192-196.
[5] Liu H, Lin Y, Nie X, et al. Histological classification of melasmawith reflectance confocal microscopy:a pilot study in Chinesepatients[J]. Skin Research Technology,2011,17(4):398-403.
[6] Alsaad KO, Ghazarian D. My approach to superficial inflammatory dermatoses[J]. J Clin Pathol,2005,58(12):1233-1241.
[7] Ardigo M, Cota C, Berardesca E, et al. Concordance between in vivo reflectance confocal microscopy and histology in the evaluation of plaque psoriasis[J]. J Eur Acad Dermatol Venereol,2009,23(6):660-667.
[8] Wolberink EA, van Erp PE, Teussink MM, et al. Cellular features of psoriatic skin: imaging and quantification using in vivo reflectance confocal microscopy[J]. Cytometry B ClinCytom,2011,80(3):141-149.
[9] Moscarella E, Gonzlez S, Agozzino M, et al. Pilot study on reflectance confocal microscopy imaging of lichen planus: a real-time, non-invasive aid for clinical diagnosis[J]. J Eur Acad Dermatol Venereol,2012,26(10):1258-1265.
[10] Zhong LS, Wei ZP, Liu YQ. Sensitivity and specificity of Munro microabscess detected by reflectance confocal microscopy in the diagnosis of psoriasis vulgaris[J]. J Dermatol,2012,39(3):282-283.
[11] 刘华绪,林燕,单晓峰,等.反射式共聚焦激光扫描显微镜在银屑病诊断中的应用[J].中国麻风皮肤病杂志,2011,27(7):488-491.
[12] Zhong LS, Wei ZP, Liu YQ. Sensitivity and specificity of Munro microabscess detected by reflectance confocal microscopy in the diagnosis of psoriasis vulgaris[J]. J Dermatol,2012,39(3):282-283.
[13] 梁淑静,徐丽敏,孙兆伟.扁平苔藓的共聚焦激光扫描显微镜特征表现[J].临床皮肤科杂志,2011,40(3):139-141.
[14] 权晟,魏志平,刘彦群,等.扁平苔藓的共聚焦激光扫描显微镜影像特征[J].临床皮肤科杂志,2012,41(8):461-462.
[15] 胡亚莉,马秋茹,王砚宁.扁平苔藓皮损组织共聚焦激光扫描显微镜特征分析[J].实用皮肤病学杂志,2013,6(1):19-21.
[16] Meinke MC, Richter H, Kleemann A, et al. Characterization of atopic skin and the effect of a hyperforin-rich cream by laser scanning microscopy[J]. J Biomed Opt,2015,20(5):051013.
[17] Liu H, Chen S, Shi Z , et al. In vivo imaging of lichen nitidus withconfocal laser scanning microscopy[J]. Arch Dermatol,2011,147:142.
[18] Slodownik D, Levi A, Lapidoth M, et al. Noninvasive in vivo confocal laser scanning microscopy is effective in differentiating allergic from nonallergic equivocal patch test reactions[J]. Lasers Med Sci,2015,30(3):1081-1087.
[19] Wassef C, Mateus R, Rao BK. In vivo reflectance confocal microscopy features of discoid lupus erythematosus[J]. J Drugs Dermatol,2012,11(9):1111-1113.
[20] Murphy G, Reich K. In touch with psoriasis: topical treatments andcurrent guidelines. J Eur Acad Dermatol Venereol,2011,25(4):3-8.
[22] Wolberink EA, van Erp PE, de Boer-van Huizen RT, et al. Reflectance confocal microscopy: an effective tool for monitoring ultraviolet B phototherapy in psoriasis[J]. Br J Dermatol,2012,167(2):396-403.
[23] 张静,徐丽敏,梁淑静,等.寻常型银屑病局部治疗前后共聚焦激光扫描显微镜观察[J].临床皮肤科杂志,2011,40(3):147-149.
[24] Ardigò M, Agozzino M, Longo C, et al. Reflectance confocal microscopy for plaque psoriasis therapeutic follow-up during an anti-TNF-α monoclonal antibody: an observational multicenter study[J]. J Eur Acad Dermatol Venereol,2015,29(12):2363-2368.
[25] Sattler EC, Hoffmann VS, Ruzicka T, et al. Reflectance confocal microscopy for monitoring the density of Demodex mites in patients with rosacea before and after treatment[J]. Br J Dermatol,2015,173(1):69-75.
[26] Guitera P, Li LX, Scolyer RA, et al. Morphologic features ofmelanophages under in vivoreflectance confocal microscopy[J]. Arch Dermatol,2010,146(5):492-498.
[27] Gonzalez S, Rajadhyaksha M,Gonzalez-Serva A, et al. Confocal reflectance imaging of folliculitis in vivo:correlation with routine histology[J]. J Cutan Pathol,1999,26(4):201-205.
[28] Peppelman M, Wolberink EA, Gerritsen MJ, et al. Application of leukotriene B4 and reflectance confocal microscopy as a noninvasive in vivo model to study the dynamics of skin inflammation[J]. Skin Res Technol,2015,21(2):232-340.
[29] Wolberink EA, Peppelman M, van de Kerkhof PC, et al. Establishing the dynamics of neutrophil accumulation in vivo by reflectance confocal microscopy[J]. Exp Dermatol,2014,23(3):184-188.
[30] Ardigò M, Agozzino M, Longo C, et al. Psoriasis plaque test with confocal microscopy: evaluation of different microscopic response pathways in NSAID and steroid treated lesions[J]. Skin Res Technol,2013,19(4):417-423.
(收稿:2016-04-27 修回:2016-06-18)
Application of reflectance confocal microscopy in inflammatory skin diseases
JIANGWencai,YUANChao.
DepartmentofSkinandCosmeticresearch,ShanghaiskinDermatologyHospital,Shanghai200443,China
YUANChao,E-mail:dermayuan@163.com
In vivo reflectance confocal microscopy (RCM) is a technique characterized by real time, noninvasive visualization and dynamic monitoring of the changes of cell morphology and the skin structure. The RCM image features are in accordance with the pathology image in some skin diseases. In this paper the role of RCM in the diagnosis, evaluation of the efficacy and improvement of the inflammatory skin diseases are reviewed.
reflectance confocal microscopy; inflammatory skin diseases; histopathology
上海市皮肤病医院,200443
袁超,E-mail: dermayuan@163.com

