不同氮源及氮浓度对真眼点藻纲微藻生长及油脂积累的影响
苏 怡 高保燕 黄罗冬 吴曼曼 李爱芬 张成武
(暨南大学水生生物研究中心生态学系, 广州 510632)
不同氮源及氮浓度对真眼点藻纲微藻生长及油脂积累的影响
苏 怡 高保燕 黄罗冬 吴曼曼 李爱芬 张成武
(暨南大学水生生物研究中心生态学系, 广州 510632)
以真眼点藻纲8株微藻(类波氏真眼点藻(Eustigmatos cf. polyphem)、大真眼点藻(Eustigmatos magnus)、波氏真眼点藻(Eustigmatos polyphem)、魏氏真眼点藻(Eustigmatos vischeri)、斧形魏氏藻(Vischeria helvetica)、点状魏氏藻(Vischeria punctata)、星形魏氏藻(Vischeria stellata)和眼点拟微绿球藻(Nannochloropsis oculata))为研究材料, 用3种氮源(硝酸钠、碳酸氢铵或尿素)和4种氮浓度(18、9、6和3 mmol) 在改良的BG-11培养基中对藻细胞进行培养。比较分析这8株微藻在不同培养条件下的藻液pH、生物量、油脂含量、脂肪酸组成的差异, 从而筛选出适合该类微藻生长和油脂积累的最适氮源与最佳氮浓度。结果表明,这8株微藻均能在3种氮源中生长, 但是随着培养时间延长, 以碳酸氢铵和尿素为氮源时藻液pH逐渐降低, 其变化范围为5.0—6.0, 而以硝酸钠为氮源时藻液pH保持在7.0—8.0, 变化不大。当以尿素为氮源培养时, 能获得较高的生物量, 但是不同藻株在不同尿素浓度时达到最高生物量。最高生物量是波氏真眼点藻(E. polyphem)在9 mmol时达到, 为10.96 g/L。总脂含量分析发现, 在低氮浓度下均能促进8株微藻油脂的积累, 真眼点藻属中的魏氏真眼点藻(E. vischeri)在8株藻中获得最高油脂含量, 达到59.24%。进一步对脂肪酸分析发现, 8株微藻总脂肪酸含量为细胞干重的50%—58%, 主要脂肪酸组成为豆蔻酸(C14:0)、棕榈酸(C16:0)、棕榈油酸(C16:1)、油酸(C18:1)和二十碳五烯酸(C20:5), 其中拟微绿球藻(N. oculata)细胞中棕榈酸的含量最高占总脂肪酸50%左右; 其他7株微藻细胞中棕榈油酸的含量较高, 其占总脂肪酸含量范围在40%—60%。8株微藻均表现出较高的生物量与油脂积累能力, 以尿素为氮源, 氮浓度为6 mmol时更有利于该类微藻生物量和油脂的积累。总体来说, 真眼点藻纲的微藻是一类极具潜力适合于微藻生物燃料生产的微藻, 而真眼点藻属藻株表现更为明显的优势。
真眼点藻纲; 氮源; 藻液pH; 油脂; 脂肪酸
微藻由于其能够大量积累油脂被认为是一种非常有潜质的生物燃料的原料来源。研究表明, 氮是影响微藻生长和调控油脂代谢最重要的营养因子之一[1], 在氮胁迫条件下可以促进油脂积累 , 但与此同时生物量会有所降低[2]。何思思等[3]利用不同浓度硝酸钠对魏氏真眼点藻进行培养, 结果发现,魏氏真眼点藻在17.6 mmol/L氮浓度培养下生物量达到最高9.14 g/L, 但其总脂仅达到了较低。随着氮浓度的降低, 油脂含量逐渐增加, 在3.0 mmol/L氮浓度下达到最高为60.82%。在5.9 mmol/L浓度下油脂产率为0.24 g/(L·d), 为最适培养条件。因此,氮浓度能显著地影响藻细胞生长与油脂积累, 调控生物量与油脂含量。
微藻可利用多种形式的氮源, 主要包括硝态氮、铵态氮和有机氮, 对于不同形式的氮源, 藻类所对应的吸收代谢机制也有所不同[4]。硝酸盐由于其价格低, 优势较为明显, 是常用的氮源形式[5]。铵态氮能直接在谷氨酰胺合成酶/谷氨酸合成酶的催化下, 通过转氨基作用直接合成氨基酸而被吸收,而硝态氮则需要硝酸还原酶将其转化为铵态氮才能被利用, 尿素也需要尿素酶酶解后才能被利用,因此, 从能量消耗角度来看, 藻类会优先利用铵氮,但过高浓度的氨则会对藻细胞有毒害作用。但由于不同藻株具有不同的生理特性, 对氮源种类和氮浓度具有不同的耐受性, 需要寻找最合适藻细胞生长的氮源种类与氮源浓度, 实现藻细胞的快速生长与高油脂积累。Sourish Bhattacharya等[6]研究发现用碳酸氢铵代替碳酸氢钠作为氮源培养小球藻(Chlorella variabilis ATCC PTA 12198)可以有效的提高其生物量和总脂产率。比较分析标志链带藻(Desmodesmus insignis)在不同氮源及其氮浓度培养下, 藻细胞生长及油脂、碳水化合物和淀粉积累的影响, 结果发现藻细胞均能在硝酸钠、碳酸氢铵和尿素中进行生长, 硝酸钠作为氮源时, 在低氮浓度(3 mmol/L)下, 油脂积累量最高达到32.61%。在高氮浓度下均能促进该藻淀粉的积累, 但油脂含量较低, 当以碳酸氢铵为氮源, 氮浓度为18 mmol/L培养时淀粉含量达到最高为55.33%[7]。因此, 不同种类的氮源及氮浓度对微藻在生长和油脂积累有较大影响, 不同藻株的生长和生物质的积累情况也和氮源的形式有关。同时培养基的营养成分及光照、温度、pH等理化因素也会影响微藻细胞的油脂积累量[8]。故需要优化培养条件, 获得高生物量与高油脂积累的培养条件, 找到生物量和油脂积累之间找到最优的平衡点[2]。
真眼点藻纲是1970 年Hibberd和Leedale根据其细胞学和超微结构的特征, 将原黄藻纲(Xanthophyceae)中的一些成员重新调整而成立的一个新纲, 目前仅有两个目——真眼点藻目(Eustigmatales Hibberd)和角绿藻目(Goniochloriales), 报道的有6个科, 14个属, 30多个种。而随着越来越多的研究发现, 真眼点藻纲是一个高度多样化的纲, 有越来越多的新种等待被发现和鉴定[9]。真眼点藻纲的藻分布广泛, 在淡水、海水和土壤表面等环境都可生存[10]。真眼点藻纲的色素组成也十分特别, 用于光合作用的叶绿素成分仅有叶绿素a, 不含叶绿素b和c, 另外还含有特殊的类胡萝卜素, 如: 堇菜黄素(violaxanthin)、无隔藻黄素(vaucheriaxanthin)等[10]。研究表明, 该纲的大多数种类能积累大量的储藏性油脂,特别是生产生物柴油的重要原料三酰甘油(TAG),且真眼点藻纲的藻株均含有二十碳五烯酸(EPA),是极具微藻生物能源开发潜力的藻种资源[11]。其中, 拟微绿球藻属不仅具有高的生物量、油脂产量、光合作用效率并且能够非常好的进行大规模培养, 被认为是最有潜力的工业产油的模式研究藻种, 尤其是该属中的海水种由于其可观的中性脂产量和对人体有益的多不饱和脂肪酸产量被广泛关注。然而, 目前对真眼点藻纲中的其他株系研究较少, 但研究价值更大[12]。
因此, 本研究选择了真眼点藻纲中2个科3个属的8株微藻作为研究对象, 利用3种氮源(硝酸钠、碳酸氢铵和尿素)及4种氮浓度(18、9、6和3 mmol)这4种氮浓度条件下进行培养, 比较分析8株真眼点藻在不同培养条件下藻液pH变化, 生物量、总脂含量、中性脂含量、脂肪酸种类及含量的差异, 获得有利于真眼点藻高生物量和高油脂积累的氮源和氮浓度, 对微藻的规模化培养和工业化应用提供重要的参考依据。
1 材料与方法
1.1 实验材料
真眼点藻纲的8株微藻如表 1所示, 保藏于暨南大学水生生物研究中心微藻生物技术与生物能源实验室[购于美国德克萨斯大学奥斯汀分校藻种库(UTEX)]。
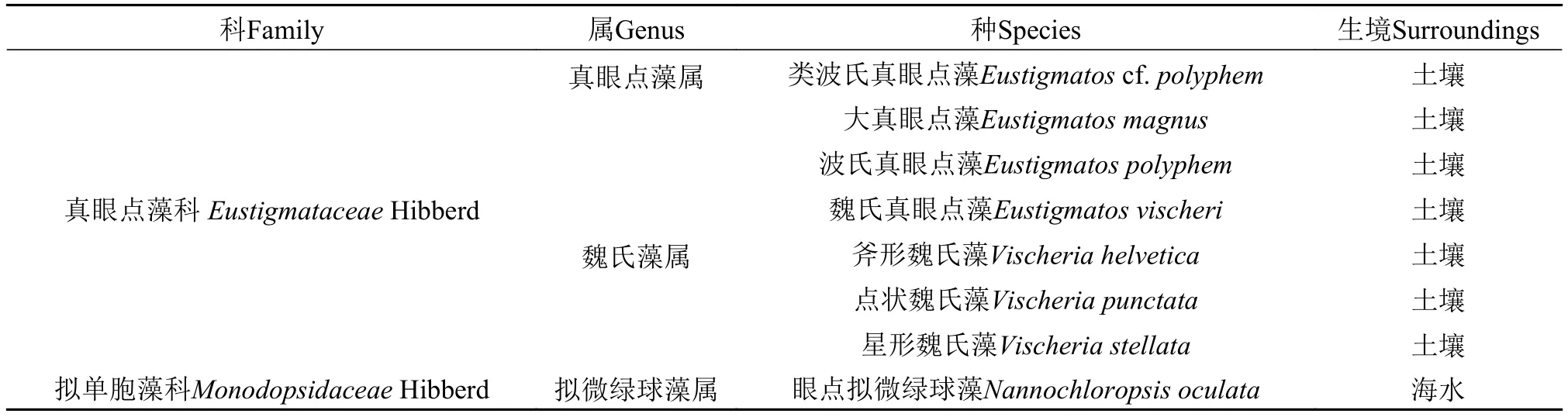
表 1 八株真眼点藻Tab. 1 The eight strains microalgae of Eustgmatophyceae
1.2 主要仪器及试剂
高压蒸汽灭菌锅(D-1)、恒温干燥箱(DHG-9140)、电子天平(Sartorius BS224S)、高速冷冻离心机(SORVALL biofuge)、冷冻干燥机(VirTis wizard 2.0)、恒温磁力搅拌器(94-2 ThermoFinnigan)、氮吹仪(NEVAPTM 111)、pHB-3型pH计(上海三信仪表厂)、气相色谱(Agilent6890N)。分析纯: 硝酸钠、碳酸氢铵、尿素、二甲基亚砜、甲醇、乙醚、氯仿、丙酮; 色谱纯: 正己烷。
1.3 实验方法
藻细胞的培养 眼点拟微绿球藻选用海水培养基, 其余7株微藻采用改良BG-11培养基。氮源分别为硝酸钠、碳酸氢铵和尿素, 氮浓度分别为18、9、6和3 mmol, 每组设置3个平行。将培养至对数生长中期的藻细胞离心(3500 r/min, 5min)收集, 用无菌水洗涤后接种, 初始接种密度为A750=0.6±0.02,微藻培养采用内径为3 cm(体积 约300 mL)的柱状光生物反应器, 通入1% CO2的压缩空气搅拌, 采用日光灯提供持续光照, 光强为300 μmol photons/(m2·s)的, 培养温度为(25±1)℃, 培养周期为15d。收获培养至第15天的藻液于3000 r/min离心5min, 收获的藻泥放置于−20℃的冰箱冷冻结冰, 再放入冷冻干燥机干燥48h。冻干的藻粉于4℃保存待用。
pH测定 每24h取约5 mL藻液置于洁净的小玻璃瓶中, 将pHB-3型pH计的测试电极放入藻液中, 搅动后静置, 待读数稳定后记录显示值。
生物量测定 将孔径为0.45 μm的混合纤维膜放入恒温烘箱中进行干燥, 干燥至恒重(W1)。取培养至15天时的藻液5 mL, 用预先烘干的滤膜进行抽滤, 再次放入恒温烘箱中干燥至恒重, 放置于干燥器中冷却后称重(W2), 生物量(g/L)计算公式为:
总脂含量的测定 取冻干的藻粉, 按照改进的Khozin-Goldberg等[13]提供的总脂提取方法进行总脂含量的测定。称取藻粉M0(80—100 mg), 放入预先放置有磁力搅拌转子玻璃离心管中, 每个样品设置2个平行, 分别向管中加入2 mL的二甲基亚砜-甲醇溶液(v:v=1:9), 放入磁力搅拌水浴锅中50℃下搅拌提取1.5h后3000 r/min下离心5min, 并将上清液倒入洁净干燥的玻璃小瓶中, 再向剩余的藻渣中加4 mL乙醚-正己烷溶液(v:v=1:1), 继续在磁力搅拌锅中冰浴搅拌1.5h, 3000 r/min离心5min, 取上清液。上述过程再重复一次直至藻渣变为灰白色。将离心后的上清液全部倒入上述玻璃小瓶中, 并向其中加入4 mL蒸馏水, 静置分层。将上层的有机相转移到另一干净的玻璃离心管中, 3000 r/min离心5min, 取上清液置于另一干净的小玻璃瓶中并用氮吹仪吹干。取对应样品的2 mL Eppendorf管, 称重(管重记为M1), 将小玻璃瓶中吹干的脂质用乙醚溶解后转移至Eppendorf管中, 并用氮吹仪吹干, 称重(记为M2)。利用差量法计算干藻粉中总脂的含量。计算公式为
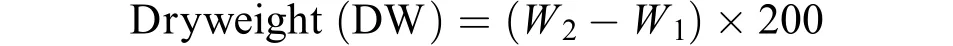
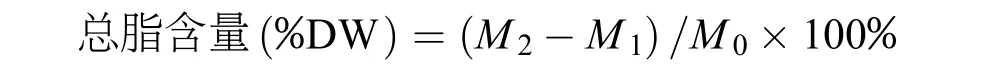
总脂分级 参考Alonzo等[14,15]的方法并加以改进, 利用硅胶层析柱将总脂进一步分级分离,分离出中性脂。用氯仿对样品进行洗脱, 得到中性脂(NLs), 将分离得到的中性脂用氮气吹至较小体积后转移至预先称重的2 mL Eppendorf管中, 用氮气吹干至恒重, 利用差量法计算中性脂分别占总脂和干藻粉的百分含量。
脂肪酸组成分析 参考Bigogno等[16]的方法并进行改进。准确称取冻干藻粉25 mg, 置于预先加入转子的玻璃离心管中, 加入2 mL含有2% H2SO4的无水甲醇-甲苯混合液(v:v=1:1), 同时加入50 μL 0.5%的十七烷酸标样, 充氩气后, 置于80℃恒温磁力搅拌水浴锅中抽提1.5h, 冷却后加入1 mL纯水和1 mL正己烷, 振荡混匀后3000 r/min, 离心5min, 将上层有机相移至另一干净玻璃小瓶中, 用氮气吹干, 再用200 μL正己烷转移至气相色谱样品瓶中, 密封保存于–20℃冰箱中待测。利用气相色谱仪(Agilent6890N)分析测定脂肪酸组成及其相对含量。
单位体积总脂、中性脂和总脂肪酸产率的计算
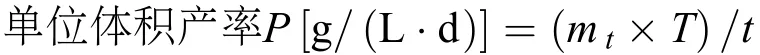
其中, mt为生物质浓度(g/L), T分别为总脂、中性脂或总脂肪酸占干重的比例(%DW), t为培养时间(d)。
数据处理与分析 采用Excel和Origin8.6对数据进行分析处理。并用SPSS19.0软件对数据进行单因素方差分析, P<0.05表示显著水平差异。
2 结果
2.1 不同氮源及其氮浓度条件下藻液的pH变化
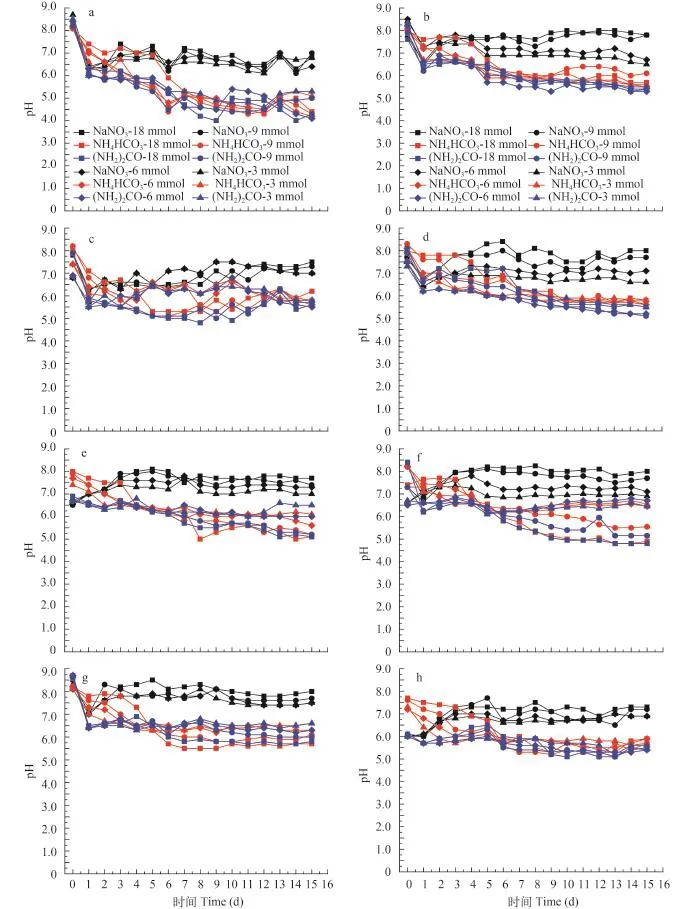
图 1 不同氮源及氮浓度对8株真眼点藻培养液pH的影响Fig. 1 Effects of different nitrogen source and nitrogen concentration on the pH value of culture medium of eight species of Eustigmatophyceaea. 类波氏真眼点藻; b. 大真眼点藻; c. 波氏真眼点藻; d. 魏氏真眼点藻; e. 斧型魏氏藻; f. 点状魏氏藻; g. 星形魏氏藻; h. 眼点拟微绿球藻; 下同a. E. cf. polyphem; b. E. magnus; c. E. polyphem; d. E. vischeri; e. V. helvetica; f. V. punctata; g. V. stellata; h. N. oculata; the same applies below
如图 1所示, 拟微绿球藻、斧形魏氏藻、点状魏氏藻的培养液在碳酸氢铵为氮源时初始的pH偏碱性在7.5—8.0, 而硝酸钠、尿素作为氮源时初始pH偏酸性大约在6.0左右; 另外5株微藻培养液在刚培养时pH都比较高在8.0—9.0, 呈碱性。在培养15d的过程中, 8株藻的pH在第0到第1天都有一个快速的下降, 第1天之后硝酸钠培养条件下pH略有增长, 然后趋于平稳; 在另外两种培养条件下pH继续降低然后趋于平稳。在硝酸钠培养条件下pH变化幅度比较小, 最后一天的pH (大约在7.0左右)明显高于在碳酸氢铵及尿素条件下培养的最后一天的pH (大约在5.0—6.0)。在硝酸钠培养条件下高氮浓度(18和9 mmol)比低氮浓度(6和3 mmol) pH高, 在另外两种氮源条件下低氮浓度比高氮浓度的pH高,尤其在3种魏氏藻中十分明显。
2.2 不同氮源及其氮浓度对8株真眼点藻纲微藻生长的影响
从图 2中可以看出, 眼点拟微绿球藻第15天的生物量随氮浓度的降低而降低, 最大值出现在18 mmol氮浓度下, 而另外7株真眼点藻第15天的生物量在9及6 mmol氮浓度下明显比18和3 mmol氮浓度条件下高。在尿素作为氮源的培养条件下生物量普遍较另外两种氮源高。8株真眼点藻纲微藻第15天的生物量最大值分别为: 大真眼点藻、点状魏氏藻和类波氏真眼点藻均在6 mmol的尿素条件下生物量最高, 分别达到达到10.22、10.02和8.8 g/L。波氏真眼点藻、斧形魏氏藻、魏氏真眼点藻和星形魏氏藻在9 mmol的尿素条件下生物量最高分别为10.96、8.86、8.53和8.5 g/L, 眼点拟微绿球藻在18 mmol的尿素条件下达到9.22 g/L。单因素方差分析表明, 不同氮源培养条件下差异不显著(P>0.05), 各浓度组间的生物质浓度也没有明显差异(P>0.05)。
2.3 不同氮源及氮浓度对8株真眼点藻总脂含量的影响
对在不同氮源及氮浓度培养条件下8株真眼点藻纲微藻培养到第15天时细胞内总脂的含量进行单因素方差分析发现, 不同氮源培养条件下差异不显著(P>0.05), 低氮组(3 mmol)和高氮组(18 mmol)之间差异极显著(P<0.01)。由图 3可知, 总脂含量随着氮浓度降低而增加, 最高总脂含量均在3 mmol氮浓度时达到。8株藻最高总脂含量最大值分别为: 波氏真眼点藻、类波氏真眼点藻在尿素为氮源时, 总脂含量分别占细胞干重的59.03%和58.87%;魏氏真眼点藻、大真眼点藻、眼点拟微绿球藻、星形魏氏藻在碳酸氢铵条件下分别达到59.24%、58.77%、56.31%和56.08%; 斧型魏氏藻、点状魏氏藻在硝酸钠条件下最大值分别为57.52%和53.55%。总体来说, 8株真眼点藻的总脂含量都非常高, 全都占细胞干重的50%以上, 其中真眼点藻属的总脂含量整体较高, 而魏氏藻属和眼点拟微绿球藻的则相对较低。
2.4 不同氮源及氮浓度对8株真眼点藻中性脂含量的影响
参照总脂分级方法, 对获得的总脂进行分级,分离出中性脂。由图 4可知, 培养到第15天时中性脂含量都非常高, 且随着氮浓度的降低中性脂含量增加, 在3 mmol氮浓度条件下8株真眼点藻纲微藻都获得了最大中性脂含量, 分别为波氏真眼点藻、类波氏真眼点藻、大真眼点藻和斧型魏氏藻在尿素条件下分别可达57.42%、55.02%、52.93%和48.90%; 点状魏氏藻、魏氏真眼点藻和眼点拟微绿球藻在碳酸氢铵条件下分别可达: 52.47%、49.75%和48.06%。星形魏氏藻在硝酸钠条件下达50.48%; 在4种真眼点藻属中波氏真眼点藻的中性脂含量最高达57.42%; 在3种魏氏藻属中点状魏氏藻的中性脂含量最高达52.47%。对其进行单因素方差分析发现, 在不同氮源培养条件下差异不显著(P>0.05), 不同氮浓度之间差异显著(P<0.05)。实验结果进一步表明了此8株真眼点藻纲微藻都是高产油的微藻。
2.5 不同氮源及氮浓度对8株真眼点藻纲微藻脂肪酸含量的影响
表 2表示在3种氮源及4种氮浓度培养条件下8株真眼点藻纲微藻细胞内的脂肪酸组分及其相对含量(占总脂肪酸的百分比), 图 5表示其脂肪酸绝对含量(占细胞干重的百分比)。如表 2所示真眼点藻所含主要的脂肪酸成分有饱和脂肪酸[包括C14∶0(豆蔻酸)、C16∶0(棕榈酸)], 单不饱和脂肪酸[包括C16∶1(棕榈油酸)、C18∶1(油酸)]和多不饱和脂肪酸[包括C18∶2(亚油酸)、C20∶4(花生四烯酸)、C20∶5(EPA)]。其中, 眼点拟微绿球藻中相对含量最高的是棕榈酸约占总脂肪酸的50%左右其次是棕榈油酸和油酸, 而其他真眼点藻中相对含量最高的是棕榈油酸占总脂肪酸含量在40%—60%。棕榈油酸的相对含量随着氮浓度的降低而增高, 而亚油酸、花生四烯酸和EPA随着氮浓度降低有降低趋势。另外, 由图 5可以看出, 各脂肪酸组分占细胞干重的含量随氮浓度的降低而增加,在氮浓度3 mmol时达到最大, 与总脂含量与中性脂含量的变化趋势一致。8株微藻的最高总脂肪酸绝对含量分别为: 魏氏真眼点藻、类波氏真眼点藻、波氏真眼点藻和斧形魏氏藻在尿素条件下分别达56.50%、54.65%、54.64%和50.00%; 点状魏氏藻、星形魏氏藻和大真眼点藻在碳酸氢铵条件下分别达: 53.19%、52.35%和49.26%; 眼点拟微绿球藻总脂肪酸绝对含量最高的在是3 mmol硝酸钠条件下, 达48.54%。在4种真眼点藻属中, 总脂肪酸绝对含量最高魏氏真眼点藻, 达到56.50%。在魏氏藻属的3个种中, 总脂肪酸绝对含量最高是点状魏氏藻, 达到53.19%。研究表明[17], 富含单不饱和脂肪酸的原料更适合于生产生物柴油, 另外, 饱和脂肪酸的存在也具有重要作用。由脂肪酸分析可以看出, 8株真眼点藻脂肪酸的主要组成成分都是棕榈酸棕榈油酸和油酸, 尤其是真眼点藻科的7株藻, 在低氮(3 mmol)条件下棕榈油酸和油酸的相对含量都占总脂肪酸的60%以上, 突显出了其作为生物柴油生产原料的天然优势性。
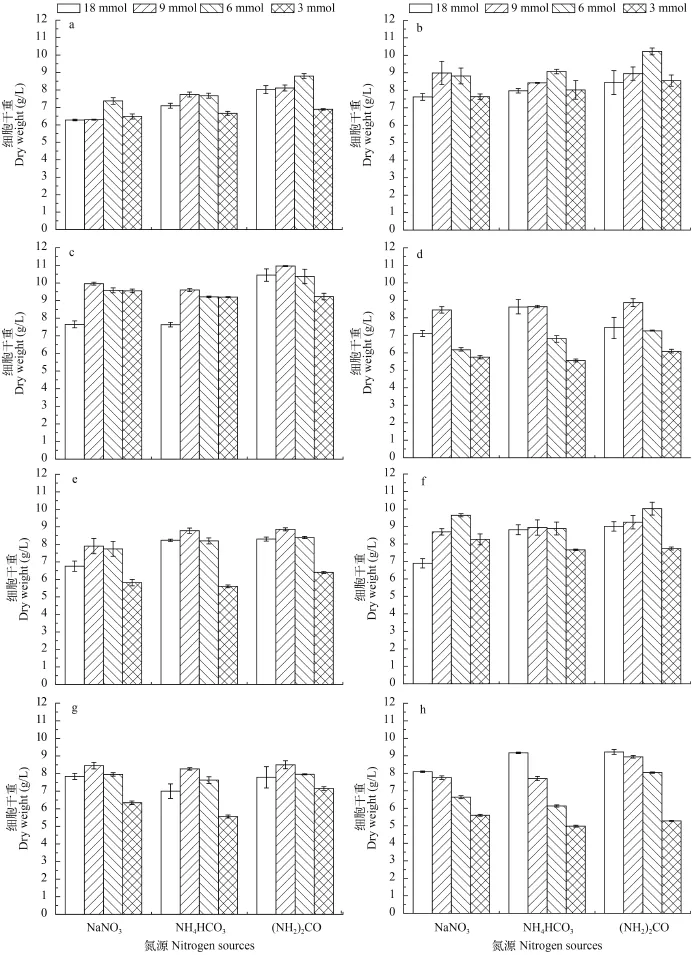
图 2 不同氮源及氮浓度对8株真眼点藻第15天生物量的影响Fig. 2 Effects of different nitrogen source and nitrogen concentration on the growth of eight species of Eustigmatophyceae on day 15

图 3 不同氮源及氮浓度对8株真眼点藻第15天总脂含量的影响Fig. 3 Effects of different nitrogen source and nitrogen concentration on the total lipid contents of eight species of Eustigmatophyceae on day 15
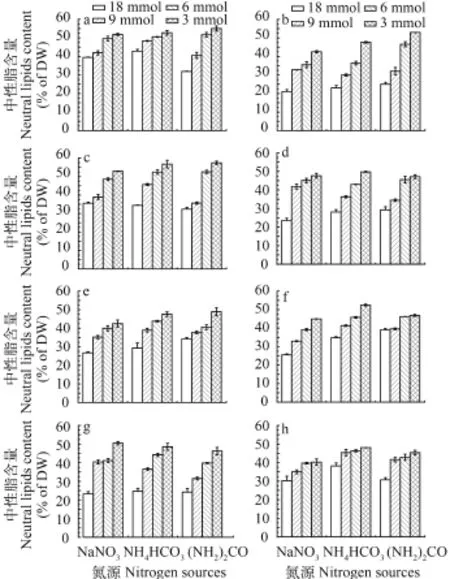
图 4 不同氮源及氮浓度对8株真眼点藻第15天中性脂的绝对含量(占细胞干重)的影响Fig. 4 Effects of different nitrogen source and nitrogen concentration on the neutral lipid contents of eight species of Eustigmatophyceae on day 15
2.6 不同氮源及氮浓度对8株真眼点藻单位体积总脂、中性脂和总脂肪酸产率的影响
由图 6可知, 在一般情况下中间氮浓度(9和6 mmol)培养条件下产率较高, 高氮(18 mmol)条件下产率最低。第15天的总脂、中性脂及总脂肪酸产率最大值如下: 类波氏真眼点藻分别达0.30、0.30和0.26 g/(L·d), 大真眼点藻分别达: 0.32、 0.32和0.29 g/(L·d), 波氏真眼点藻分别达0.40、0.36和0.36 g/(L·d), 魏氏真眼点藻分别达0.23、0.21和0.23 g/(L·d), 斧型魏氏藻分别达0.28、0.24和0.25 g/(L·d), 点状魏氏藻分别达0.31、0.31和0.31 g/ (L·d), 星形魏氏藻分别达0.27、0.22和0.26 g/(L·d),眼点拟微绿球藻分别达0.29、0.25和0.19 g/(L·d)。
3 讨论
3.1 氮源种类对8株真眼点藻的生长及油脂积累的影响
在自然界中, 除了少数蓝藻具有固氮能力之外大多数微藻必须利用其生长环境中的氮源来满足自身的生长、繁殖所需, 且不同的藻种对氮源的种类和浓度需求不同[18]。有报道指出, 不同藻类对氮的吸收利用途径会有所不同, 进而引起培养基pH的变化, 在吸收利用时会释放出OH–导致培养液的pH升高, 吸收利用时会释放出H+使得培养液的pH降低, 而在吸收利用CO(NH2)2时培养液pH变化不大[19]。而培养基的pH会影响光合作用中CO2的可利用性以及微藻对有机碳源的利用效率;另外pH直接影响细胞膜的渗透性, 影响微藻细胞对培养液中离子的吸收和利用, 故pH是影响藻类生长代谢的重要因子之一[20]。本研究利用了硝酸盐、铵盐、尿素3种不同类型的氮源对8株真眼点藻纲的微藻进行了培养, 研究发现, 这8株微藻在不同氮源种类的培养条件下, 初始的pH差别较大, 拟微绿球藻、斧形魏氏藻、点状魏氏藻的培养液在硝酸钠、尿素作为氮源时初始pH偏酸性, 其他培养条件下大都呈碱性, 而真眼点藻属的几株微藻, 培养液的初始pH呈较强的碱性。培养1d后, pH都有一个大幅的降低, 培养至第15天时, 除硝酸钠培养条件下的培养液pH约呈中性, 在另外两种氮源条件下培养液的pH都呈弱酸性, 结合对第15天生物量和油脂含量的测定, 可以得出弱酸性的环境更加适合此8株真眼点藻纲微藻的生长代谢及油脂积累。
有研究表明, 氮源种类还会对细胞的生长和繁殖产生影响, Mulholland等[21]发现蓝藻门中的束毛藻不仅在尿素中比在其他氮源中生长速度快, 而且在有尿素可利用的情况下, 优先使用尿素作为其所需的氮源。另外, 在不同氮源培养条件下其细胞内总脂的含量也有很大的变化, 陈小妹[22]研究了尖状栅藻在尿素和硝酸钠培养下总脂积累的情况, 发现在尿素培养下的尖状栅藻其细胞内总脂积累速度要明显快于硝酸钠培养下的积累速度。本研究的实验结果也显示在尿素作为氮源的情况下8株真眼点藻纲的微藻普遍生长更好些, 可获得更大的生物量。眼点拟微绿球藻在18 mmol的尿素条件下获得最大生物量达到9.22 g/L; 在魏氏藻属的3个种中,第15天生物量最高的是在6 mmol的尿素条件下培养的点状魏氏藻, 达到10.02 g/L; 在真眼点藻属4个种中, 第15天生物量最高的是在9 mmol的尿素条件下培养的波氏真眼点藻, 达到10.96 g/L。另外, 在培养到第15天时真眼点藻纲的8株微藻的总脂含量都较高, 在不同氮源条件下获得的总脂含量差异不大, 眼点拟微绿球藻在碳酸氢铵条件下, 获得最大总脂含量为56.31%; 在魏氏藻属的3个种当中, 总脂含量最高的是在3 mmol的硝酸钠条件下培养的斧形魏氏藻, 达到57.52%。在真眼点藻属的4个种中,总脂含量最高的是3 mmol的碳酸氢铵条件下培养的魏氏真眼点藻, 达到59.24%。因而可以推断不同氮源对此真眼点藻纲的8株微藻总脂含量的影响不显著。
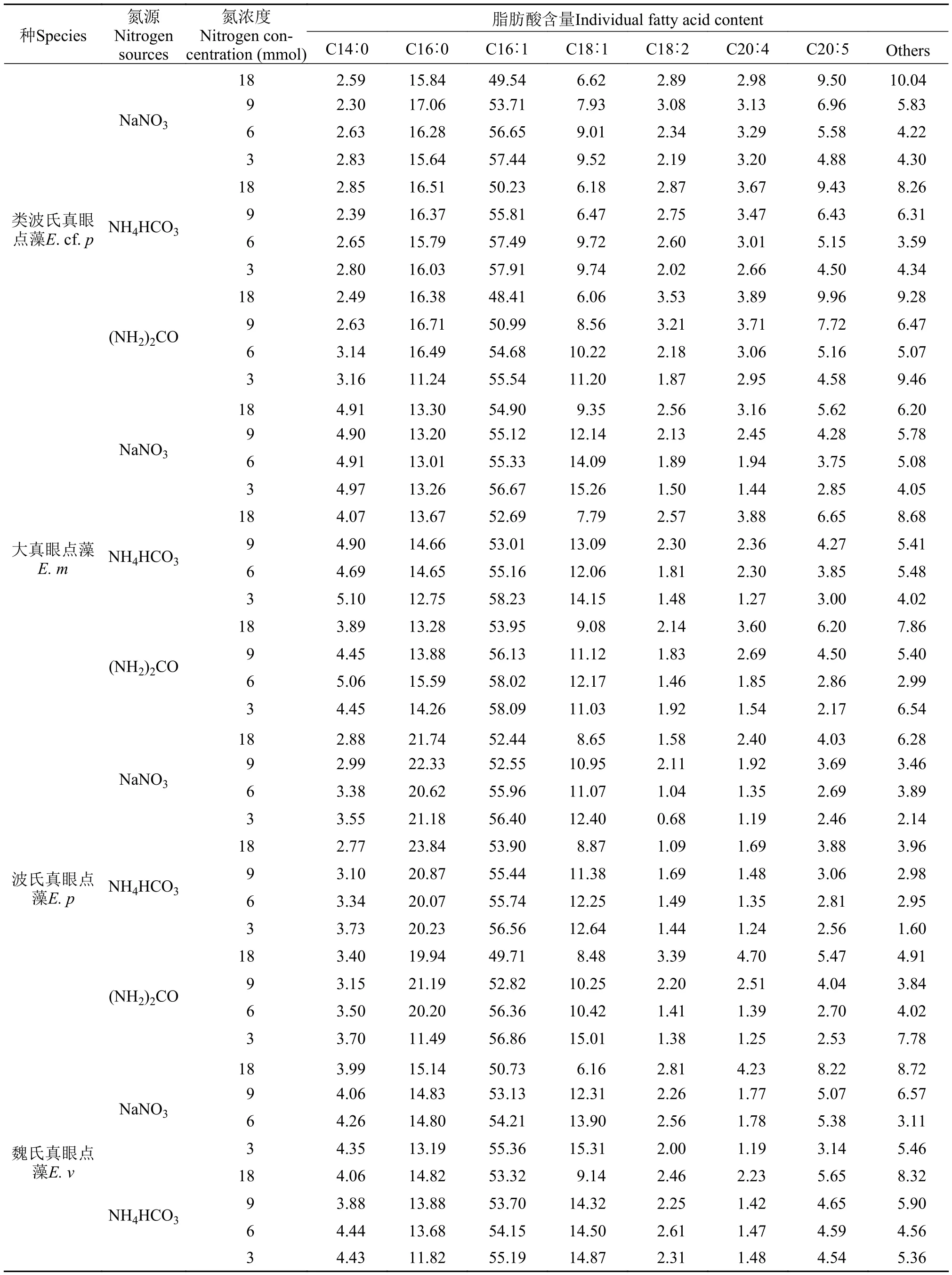
表 2 不同氮源及氮浓度条件下8株真眼点藻脂肪酸组成及相对含量变化Tab. 2 The fatty acid profiles and relative contents in eight species of Eustigmatophyceae under different nitrogen source and nitrogen concentration

续表2

续表2
3.2 氮浓度对8株真眼点藻的生长及油脂积累的影响
氮源是微藻细胞内合成氨基酸的重要来源, 在一定的氮浓度条件下微藻才能正常生长及繁殖, 过低的氮浓度会导致细胞营养不足, 细胞生长代谢停滞[23]。而过高的氮源浓度则会造成细胞内通过同化过程而产生的过多铵离子无法迅速转移到氨基酸的合成中去, 从而引起藻细胞铵中毒, 进而影响微藻的生长, 甚至会直接导致微藻的死亡[24]。在本研究中, 7株真眼点藻科的微藻在高氮(18 mmol)和低氮(3 mmol)条件下的生物量都不如中等氮浓度(9和6 mmol)的生物量高, 而拟单胞藻科的拟微绿球藻却在高氮条件下获得了最大的生物量, 说明这两个科的藻在氮浓度的耐受性上有较大的差异。此外, 同一种氮源的不同浓度同样会影响微藻细胞内油脂的积累, 在氮胁迫的条件下微藻细胞能积累大量的油脂。本研究的实验结果显示, 8株微藻均在低氮条件下获得最大的总脂、中性脂、脂肪酸含量, 与其他文献报道的研究结果相一致。
3.3 氮浓度对真眼点藻纲微藻脂肪酸组成的影响
微藻细胞中含有的脂肪酸种类多种多样, 不同种类的藻细胞内脂肪酸的种类有很大差异, 同一种微藻在不同的培养条件下脂肪酸的种类也会有差异[25]。真眼点藻纲藻类的主要脂肪酸组成为豆蔻酸(Myristic acid, C14:0)、棕榈酸(Palmitic acid, C16:0)、棕榈油酸(Palmitoleic acid, C16:1)、油酸(Oleic acid, C18:1)、亚油酸(Linoleic acid, C18:2)、花生四烯酸(Arachidonic acid, C20:4) 和二十碳五烯酸(Eicosapentaenoic acid, EPA, C20:5), 真眼点藻纲的藻类富含长链多不饱和脂肪酸, 特别是EPA[11]。实验结果表明在眼点拟微绿球藻中脂肪酸含量最高的是棕榈酸约占总脂肪酸含量的50%左右, 且随着氮浓度的降低而增加, 真眼点藻纲的另外7株微藻中脂肪酸含量最高的是棕榈油酸占总脂肪酸含量的40%—60%, 随着氮浓度的降低有所增加的趋势。但是亚油酸、花生四烯酸和EPA这几种多不饱和脂肪酸含量随着氮浓度降低有降低趋势。
本文的主要研究目的是比较真眼点藻纲的8株微藻在3种氮源4种氮浓度条件下的生长情况及油脂产率, 以便能更好地对真眼点藻纲的微藻进行进一步的开发与利用。研究结果表明此真眼点藻纲的这8株微藻都是高产油的微藻, 尿素在3种氮源当中是最有利于其生长的氮源, 中等氮浓度(9和6 mmol)能获得更高的生物量, 低氮浓度(3 mmol)能获得更高的油脂含量, 而在中等氮浓度条件下能够获得最大的油脂产率。比较油脂产率、中性脂产率以及总脂肪酸产率发现在真眼点藻属中, 波氏真眼点藻的这3种产率最高, 分别达0.40、0.36和0.36 g/(L·d);在魏氏藻属中, 点状魏氏藻的这3种产率也是最高,分别达0.31、0.31和0.31 g/(L·d)。此两株藻分别在属内具有明显的优势, 具有非常高的深入研究价值。
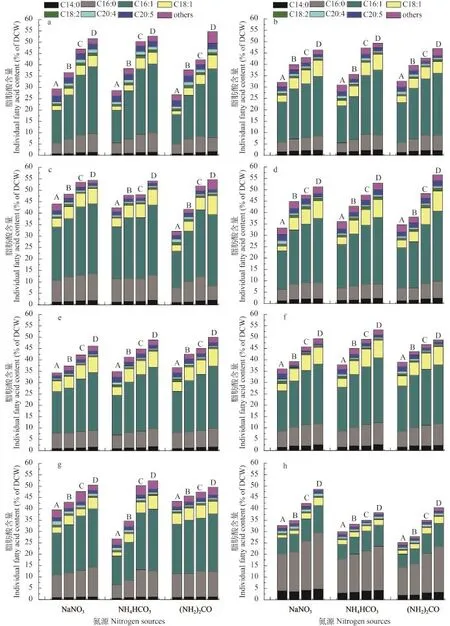
图 5 不同氮源及氮浓度对8株真眼点藻第15天脂肪酸绝对含量的影响Fig. 5 Effects of different nitrogen source and nitrogen concentration on the fatty acid absolute contents of eight species of Eustigmatophyceae on day 15
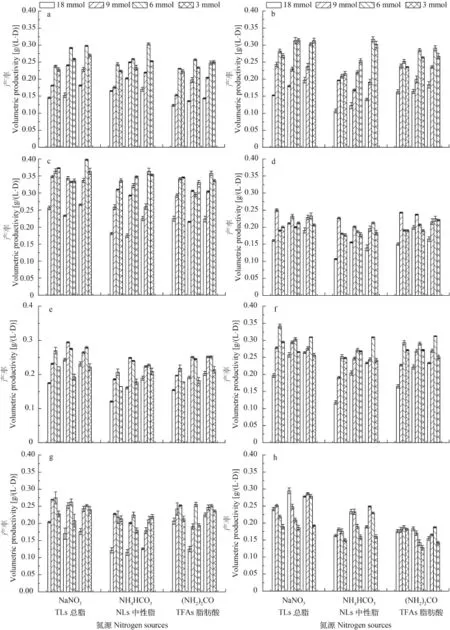
图 6 不同氮源及氮浓度对8株真眼点藻第15天单位体积总脂、中性脂和总脂肪酸产率的影响Fig. 6 Effects of different nitrogen source and nitrogen concentration on the volumetric productivity of total lipids, neutral lipids and total fatty acids of eight species of Eustigmatophyceae on day 15
参考文献:
[1]Chandra T S, Deepak R S, Kumar M M, et al. Evaluation of indigenous fresh water microalga Scenedesmus obtusus for feed and fuel applications: Effect of carbon dioxide, light and nutrient sources on growth and biochemical characteristics [J]. Bioresource Technology, 2016, 207: 430—439
[2]Adams C, Godfrey V, Wahlen B, et al. Understanding precision nitrogen stress to optimize the growth and lipid content tradeoff in oleaginous green microalgae [J]. Bioresource Technology, 2013, 131: 188—194
[3]He S S, Gao B Y, Lei X Q, et al. Effect of initial nitrogen supply on the growth, morphology and lipid accumulation of oleaginous microalga Eustigmatos vischeri (Eustigmatophyceae) [J]. Acta Hydrobiologica Sinica, 2015, 39(3): 574—582 [何思思, 高保燕, 雷学青, 等. 初始硝酸钠浓度对魏氏真眼点藻的生长, 形态和油脂积累的影响. 水生生物学报, 2015, 39(3): 574—582]
[4]Syrett P J, Leftley J W. Nitrate and urea assimilation by algae [J]. Perspectives in Experimental Biology, 2016, 2: 221—234
[5]Guo Z D, Dai G Z, Qiu B S, et al. Ammonium tolerance in the cyanobacte-rium Synechocystis sp. strain PCC 6803 and the role of the psbA multigene family [J]. Plant Cell Environment, 2013, 37: 840—851
[6]Bhattacharya S, Soundarya R, Mishra S. Ammonium bicarbonate as nutrient substitute for improving biomass productivity of Chlorella variabilis [J]. Chemical Engineering & Technology, 2016, 39(9): 1738—1742
[7]Wu G X, Huang L D, Zhang C W, et al. Effects of different nitrogen sources and concentrations on starch and lipid biosynthesis by Desmodesmus insignis [J]. Acta Microbiologica Sinica, 2016, 56(7): 1168—1177 [吴桂秀,黄罗冬, 张成武, 等. 不同氮源及其浓度对标志链带藻合成淀粉和油脂的影响. 微生物学报, 2016, 56(7): 1168—1177]
[8]Hu Q, Sommerfeld M, Jarvis E, et al. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances [J]. The Plant Journal, 2008, 54(4): 621—639
[9]Fawley K P, Eliáš M, Fawley M W. The diversity and phylogeny of the commercially important algal class Eustigmatophyceae, including the new clade Goniochloridales [J]. Journal of Applied Phycology, 2014, 26(4): 1773—1782
[10]Li Q Y, Li A F, Zhang C W. The method of extraction and determination of pigment in Eustigmatophyceae [J]. Ecological Science, 2012, 31(3): 278—283 [李其雨, 李爱芬, 张成武. 真眼点藻类色素的提取与测定方法. 生态科学, 2012, 31(3): 278—283]
[11]Gao B Y, Zhang C W, Wan L L, et al. Systematics, biological characteristics and potential application of Eustigmatophyceae [J]. Acta Hydrobiologica Sinica, 2014, 38(5): 945—956 [高保燕, 张成武, 万凌琳, 等. 真眼点藻纲的系统分类, 生物学特性及应用研究. 水生生物学报, 2014, 38(5): 945—956]
[12]Jinkerson R E, Radakovits R, Posewitz M C. Genomic insights from the oleaginous model alga Nannochloropsis gaditana [J]. Bioengineered, 2013, 4(1): 37—43
[13]Khozin-Goldberg I, Shrestha P, Cohen Z. Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga Parietochloris incisa [J]. Biochimica et Biophysica Acta (BBA)- Molecular and Cell Biology of Lipids, 2005, 1738(1): 63—71
[14]Alonzo F, Mayzaud P. Spectrofluorometric quantification of neutral and polar lipids in zooplankton using Nile red [J]. Marine Chemistry, 1999, 67(3): 289—301
[15]Zhang J J, Lü X J, Zhang C W, et al. Rapid estimation of lipids in microalgae cells [J]. China Biotechnology, 2012, 32(1): 64—72 [张敬键, 吕雪娟, 张成武, 等. 微藻细胞油脂含量的快速检测方法研究. 中国生物工程杂志, 2012, 32(1): 64—72]
[16]Bigogno C, Khozin-Goldberg I, Boussiba S, et al. Lipid and fatty acid composition of the green oleaginous alga Parietochloris incisa, the richest plant source of arachidonic acid [J]. Phytochemistry, 2002, 60(5): 497—503
[17]Stansell G R, Gray V M, Sym S D. Microalgal fatty acid composition: implications for biodiesel quality [J]. Journal of Applied Phycology, 2012, 24(4): 791—801
[18]Jiang H M, Gao K S. Effects of nitrogen sources and concentrations on the growth and fatty acid composition of Phaeodacylum tricornutum [J]. Acta Hydrobiologica Sinica, 2004, 28(5): 545—551 [蒋汉明, 高坤山. 氮源及其浓度对三角褐指藻生长和脂肪酸组成的影响. 水生生物学报, 2004, 28(5): 545—551]
[19]Wu J Y, Wu S Y, Shu J J, et al. Effect of phosphate and nitrogen resources on lipid-rich microalgae cultivation from textile wastewater [M]. Environmental Technology and Innovations. CRC Press. 2016, 65—70
[20]Wang C, Li H, Wang Q Q, et al. Effect of pH on growth and lipid content of Chlorella vulgaris cultured in biogas slurry [J]. Chinese Journal of Biotechnology, 2010, 26(8): 1074—1079 [王翠, 李环, 王钦琪, 等. pH值对沼液培养的普通小球藻生长及油含量积累的影响. 生物工程学报, 2010, 26(8): 1074—1079]
[21]Mutholland M R, Ohki K, Capone D G, et al. Nitrogen utilization and metabo-lism relative to patterns of N2fixation in cultures of Trichodesmium NIBB1967 [J]. Journal of Phycology, 1999, 35: 977—988
[22]Chen X M. Effects of the initial supplies of nitrogen sources and trophic modes on the growth and lipids accumulation of Senedesmus acuminatus (Chlorophyceae) [D]. Jinan University. 2013 [陈小妹. 氮源初始供应量和营养方式对尖状栅藻生长和油脂积累的影响. 广州: 暨南大学. 2013]
[23]Wang L Y, Sang M, Li A F, et al. Effects of different nitrogen nutrition level on the growth and photosynthetic physiology of Odontella aurita [J]. China Biotechnology, 2012, 32(6): 48—56 [王璐瑶, 桑敏, 李爱芬, 等. 不同缺氮营养水平对金色奥杜藻生长及光合生理的影响. 中国生物工程杂志, 2012, 32(6): 48—56]
[24]Guo Z D, Qiu B S, Forchhammer K, et al. Ammonium tolerance in the cyanobacterium Synechocystis sp. strain PCC 6803 and the role of the psb A multigene family [J]. Plant, Cell & Environment, 2013, 37(4): 840—851
[25]Sun S Q, Wang J T, Sun B W, et al. The fatty acid composition in membrane and intracellular components of five species of marine microalgae [J]. Periodical of Ocean University of China, 2010, 40(S1): 191—196 [孙书勤, 王江涛, 孙宝维, 等. 5 种海洋微藻细胞膜与细胞内脂肪酸组成分析. 中国海洋大学学报: 自然科学版, 2010, 40(S1): 191—196]
EFFECTS OF DIFFERENT NITROGEN SOURCE AND CONCENTRATION SUPPLIES ON THE GROWTH AND LIPID ACCUMULATION OF EUSTGMATOPHYCEAN MICROALGAE
SU Yi, GAO Bao-Yan, HUANG Luo-Dong, WU Man-Man, LI Ai-Fen and ZHANG Cheng-Wu
(Research Center for Hydrobiology, Department of Ecology, Jinan University, Guangzhou 510632, China)
To investigate the effects of nitrogen on the growth and lipids accumulation of Eustgmatophyceae, three different nitrogen sources (sodium nitrate, ammonium bicarbonate and urea) and four different initial nitrogen concentrations (18 mmol, 9 mmol, 6 mmol and 3 mmol) were used to culture eight species of Eustgmatophyceae (Eustigmatos cf. polyphem, Eustigmatos magnus, Eustigmatos polyphem, Eustigmatos vischeri, Vischeria helvetica, Vischeria punctata, Vischeria stellata and Nannochloropsis oculata) to select the best culture condition. The pH values of culture medium, biomass, lipids accumulation and fatty acid composition of Eustgmatophyceae were utilized to assess its effects. The results showed that three kinds of nitrogen sources were suitable for the eight species. For the prolong culture, the pH values of culture medium gradually reduced to 5.0—6.0 when ammonium bicarbonate and urea were used as nitrogen sources, and the pH values of culture medium remained at 7.0—8.0 when sodium nitrate was used as nitrogen sources. Meanwhile, the higher biomass could be obtained when urea was used as nitrogen source, but different species reached to the highest biomass under different nitrogen concentrations. The highest biomass of 10.96 g/L was achieved in E. Polyphem at 9 mmol. Low nitrogen level could stimulate the lipids accumulation in all species with the highest lipid content of 59.24% of dry weight in E. vischeri. The total fatty acid contents of the eight species were about 50%—58% of dry weight, and the mainly fatty acids were myristic acid (C14:0), palmic acid (C16:0), palmitoleic acid (C16:1), oleic acid (C18:1) and eicosapentaenoic (C20:5). In N. oculata, the content of palmic acid was the highest one, which was about 50% of total fatty acids. However, in other seven species, the content of palmitoleic acid reached about 40%—60% of total fatty acids. In conclusion, urea (at 6 mmol nitrogen concentrations) is the best condition for the eustigmatophycean microalgae to accumulate biomass and oil. In general, all eight species of Eustgmatophyceae can accumulate large contents of lipids, and Eustigmatos showed the best potential to produce biofuels.
Eustigmatophyceae; Nitrogen source; pH; Lipids; Fatty acid
S968.4
A
1000-3207(2017)03-0677-15
10.7541/2017.86
2016-08-26;
2016-11-24
国家“863”计划(2009AA06440, 2013AA065805); 国家“973”计划(2011CB2009001); 国家自然科学基金(31170337, 41176105);广东省教育部产学研结合项目(2010A090200008); 广东省发改委低碳专项资金(2011-051); 珠海市科技重点项目(PC20081008)资助 [Supported by Grants from National High Technology Research and Development Program of China (863 Program, 2009AA06440, 2013AA065805); the National Basic Research Program of China (973 Program, 2011CB2009001); the National Natural Science Foundation of China (31170337, 41176105); Special Project on the Integration of Industry, Education and Research of Guangdong Province (2010A090200008); Special Program for Low-Carbon, Reform and Development Commission of Guangdong Province (2011-051); Scientific and Technical R & D Program of Zhuhai City (PC20081008)]
苏怡(1991—), 女, 湖南岳阳人; 硕士研究生; 研究方向为微藻生物能源与生物技术。E-mail: 499035782@qq.com
张成武(1963—), 男, 博士, 教授, 博士生导师; 研究方向为微藻生物学与生物技术。E-mail: tzhangcw@jnu.edu.cn

