氨氮对中华小长臂虾的急性毒性及非特异性免疫指标的影响
包 杰姜宏波程 慧于业辉李晓东,
(1. 沈阳农业大学畜牧兽医学院, 沈阳 110866; 2. 盘锦光合蟹业有限公司, 盘锦 124200)
氨氮对中华小长臂虾的急性毒性及非特异性免疫指标的影响
包 杰1姜宏波1程 慧1于业辉1李晓东1,2
(1. 沈阳农业大学畜牧兽医学院, 沈阳 110866; 2. 盘锦光合蟹业有限公司, 盘锦 124200)
采用生物毒性实验方法研究了氨氮对中华小长臂虾的急性毒性作用, 结果表明: 在温度为(18±1)℃, pH为7.3±0.1条件下, 氨氮对中华小长臂虾24h、48h、72h、96h 的半致死浓度(LC50)分别为565.47、371.16、291.16和272.50 mg/L, 安全浓度为 27.25 mg/L。转化为非离子氨的LC50分别为3.74、2.45、1.93 和1.80 mg/L,安全浓度为0.18 mg/L。根据96h 的LC50和安全浓度按照等差数列设置5个氨氮浓度梯度, 分别60、100、140、180和220 mg/L, 研究氨氮胁迫对中华小长臂虾非特异性免疫指标的影响。结果显示: 在24h时, 除了220 mg/L的肌肉组织, 中华小长臂虾肝胰腺和肌肉中的超氧化物歧化酶(SOD)活性显著性高于对照组, 并具有明显的剂量效应, 在48—96h均回落到正常水平; 在24h时, 中华小长臂虾氨氮处理组中肝胰腺的酸性磷酸酶(ACP)与对照组未发生显著变化, 而碱性磷酸酶(AKP)则显著高于对照组, 在48—96h两者的140、180和220 mg/L处理组均显著低于对照组; 除了140 mg/L 处理组的ACP活性外, 肌肉中的ACP和AKP活性从24h开始就出现了显著性下降, 始终低于对照组。研究获得了氨氮对中华小长臂虾的急性毒性结果和在高氨氮胁迫下非特异性免疫指标的变化规律, 发现中华小长臂虾对氨氮具有较强的耐受性, 但高浓度的氨氮会对中华小长臂虾的免疫酶活性产生抑制作用, 研究结果可为中华小长臂虾健康养殖发展提供科学依据。
中华小长臂虾; 氨氮; 急性毒性; SOD; ACP; AKP
中华小长臂虾(Palaemonetes sinensis)是我国唯一有记载的小长臂虾属物种, 在分类地位上隶属于十足目, 长臂虾科, 小长臂虾属[1]。研究表明, 中华小长臂虾是一种优良的经济虾类, 除了在湖泊、河流、水库等生态系统中具有重要的作用外[2], 还是一种非常受水族爱好者养殖的品种, 具有良好的观赏价值, 更重要的是它味道鲜美、营养价值高, 深受国内外消费者的喜爱。然而, 资源环境的恶化使得中华小长臂虾在自然界中的数量急剧减少, 再加上国内和日韩市场的旺盛需求导致其供不应求, 价格也逐年飙升, 因此养殖中华小长臂虾可以使人们获得较高的经济效益。但是, 目前关于中华小长臂虾的基础研究非常有限, 多是在做资源调查时有所提及[3], 尚缺乏关于其基础生态学方面的系统研究,这也极大地限制了中华小长臂虾人工高密度养殖工作的开展。
氨氮是甲壳动物高密度养殖过程中最重要的胁迫因子之一, 随着养殖密度的升高, 水体中养殖动物的排泄物和残饵使得水体中氨氮含量居高不下[4], 高浓度的氨氮不仅会影响到甲壳动物的快速生长, 还会造成免疫力下降、代谢机能紊乱、发病率高, 严重影响养殖户的经济效益[5—7]。甲壳动物以非特异性免疫为主, 不具有脊椎动物的获得性免疫, 因此缺乏抗体介导的免疫反应来保护机体健康,主要通过血细胞及从细胞释放到血浆中的多种活性因子来抵抗外物的入侵[8]。在多种体液因子中,超氧化物歧化酶(SOD)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)等酶活力高低常被用做衡量甲壳动物免疫活力高低的参照指标[9,10], 这些酶在消化分解异物颗粒、免疫反应、营养物质的消化吸收、骨化过程和细胞损伤与修复过程中起着重要的作用[11,12]。因此, 实验以中华小长臂虾为对象, 首先通过96h的氨氮毒性实验获得中华小长臂虾的安全浓度, 在此基础上研究氨氮胁迫对其免疫酶活性的影响, 旨在探讨氨氮对中华小长臂虾的毒害机制,为中华小长臂虾的健康养殖提供理论依据。
1 材料与方法
1.1 实验材料
实验在沈阳农业大学水产养殖室进行, 所用中华小长臂虾由盘锦光合蟹业有限公司提供, 在实验室内养殖2周待其适应室内环境后, 挑选体色正常,体质健壮, 体重为(0.28±0.05) g的个体进行实验。
1.2 实验方法
氨氮急性毒性实验 实验设有对照组和实验组, 对照组所用水为经静置曝气后的自来水, 根据预试验结果, 按照等比数列设置实验组浓度梯度,分别为131、181、249、344、475和656 mg/L, 氨氮浓度用氯化铵(分析纯)配制, 每24h换实验液1次。每个实验梯度均设置3个平行组, 每个平行组有10尾中华小长臂虾, 实验水体为2 L, 温度为(18±1.0)℃, pH为7.3±0.1。实验期间不充气, 定时观察个体死亡情况, 及时取出死亡个体, 准确记录24h、48h、72h和96h的死亡尾数。实验结束后以直线内插法求出氨氮对中华小长臂虾的半致死浓度(LC50) , 并按公式计算出安全浓度(SC)。
氨氮对中华小长臂虾免疫指标的影响 通过急性毒性实验获得中华小长臂虾的96h半致死浓度为272.50 mg/L, 安全浓度为 27.25 mg/L, 在此区间按照等差数列设置5个浓度梯度, 分别60、100、140、180和220 mg/L, 以不添加氨氮的自来水为对照组。实验组氨氮浓度用氯化铵(分析纯)来调节。每组3个平行组, 每个平行放 20尾虾, 实验在30 L的玻璃缸中进行, 水体为 15 L。实验期间不投饵, 并及时清污, 每24h换实验液一次。在实验开始后24h、48h和96h取肝胰腺和肌肉用于SOD、ACP和AKP活性测定。免疫酶的测定方法如下: 样品蛋白浓度、SOD、ACP、AKP活性均使用南京建成试剂盒进行测定, 具体测定参照试剂盒说明书进行。
肝胰腺和肌肉SOD酶活性单位定义为每毫克蛋白在1 mL反应液中SOD抑制率达到50%时所对应的SOD量为1个酶活性单位[13], 以U/mg prot表示;肝胰腺和肌肉ACP酶活性单位定义为每克蛋白样品在37℃与基质作用30min产生1 mg酚为1个活性单位[13], 以金氏单位/g prot表示; 肝胰腺和肌肉AKP酶活性单位定义为每克蛋白样品在37℃与基质作用15min产生1 mg酚为1个活性单位[13], 以金氏单位/g prot表示。
1.3 数据处理
根据前期统计的死亡数量, 计算出死亡百分率,将死亡百分率转化为死亡概率单位, 建立24h、48h、72h和96h的氨氮质量浓度的对数(x)与中华小长臂虾死亡概率单位(y)间的直线回归方程, 根据方程求算LC50;应用 SC=0.1×96h LC50求得氨氮安全质量浓度估算值。非离子氨的计算公式如下:

利用SPSS 18.0软件对不同氨氮浓度处理下3种酶活性进行单因素方差分析(ANOVA)和Duncan多重比较, 以P<0.05作为差异显著性水平。
2 结果
2.1 氨氮急性毒性实验
结果表明(表 1): 对照组在 96h内无死亡, 实验组则是氨氮浓度越高, 对中华小长臂虾的毒性越强,死亡率越强。同一氨氮浓度, 随时间的延长, 对中华小长臂虾的毒性作用增强。根据表 1的数据求出氨氮对中华小长臂虾 24h、48h、72h和96h的半致死浓度分别为 565.47、371.16、291.16和272.50 mg/L,安全浓度为 27.25 mg/L。将24h、48h、72h和96h的半致死浓度、安全浓度转化为非离子氨的浓度分别为3.74、2.45、1.93、1.80和0.18 mg/L (表 2)。
2.2 氨氮对中华小长臂虾SOD活性的影响
从图 1可以看出, 在24h时, 酶活性是随着氨氮浓度的上升而上升, 对照组的酶活性最低, 显著低于140、180和220 mg/L处理组(P<0.05); 在氨氮浓度为220 mg/L时最高, 并显著高于其他处理组(P<0.05)。随着处理时间的延长, 各氨氮处理组的酶活性均开始下降, 48h和96h的酶活与对照组之间并无显著性差异(P>0.05)。

表 1 氨氮对中华小长臂虾对虾急性毒性实验结果Tab. 1 The acute toxicity of ammonia-N on P. sinensis
从总体上看, 各氨氮处理组中华小长臂虾肌肉中SOD活性变化趋势与肝胰腺相近(图 2)。在24h时, 酶活性是随着氨氮浓度的上升而上升, 但在浓度为220 mg/L处理组时, 酶活性突然降至最低,与对照组的酶活性无显著性差异, 并显著低于140和180 mg/L处理组(P<0.05); 在所有处理组中以氨氮浓度为180 mg/L时最高, 显著高于其他处理组(P<0.05)。同肝胰腺一样, 随着处理时间的延长, 除220 mg/L外的各氨氮处理组的酶活性均开始下降, 48h和96h与对照组之间并无显著性差异(P>0.05)。
2.3 氨氮对中华小长臂虾ACP活性的影响
从图 3可以看出, 在24h时, 各氨氮处理组的ACP活性与对照组均无显著性差异(P>0.05)。在48h时, 除了60 mg/L处理组外, 其他处理组的ACP活性均显著性低于对照组(P<0.05)。到了96h, 处理组中浓度为140、180和220 mg/L的ACP活性仍显著低于对照组(P<0.05), 但60和100 mg/L处理组与对照组之间无显著性差异(P>0.05)。
中华小长臂虾肌肉中的ACP活性与肝胰腺有所不同(图 4), 在24h时, 各氨氮处理组的ACP活性已经开始下降, 除140 mg/L处理组外, 其他处理组均显著低于对照组(P<0.05), 在220 mg/L时降至最低, 显著低于其他各处理组(P<0.05)。相比于24h、48h的各氨氮处理组的ACP活性进一步下降, 并全部显著低于对照组(P<0.05)。在96h时, 各处理组的ACP活性仍显著低于对照组, 其中以最高浓度的220 mg/L最低, 显著低于其他各氨氮处理组(P<0.05)。
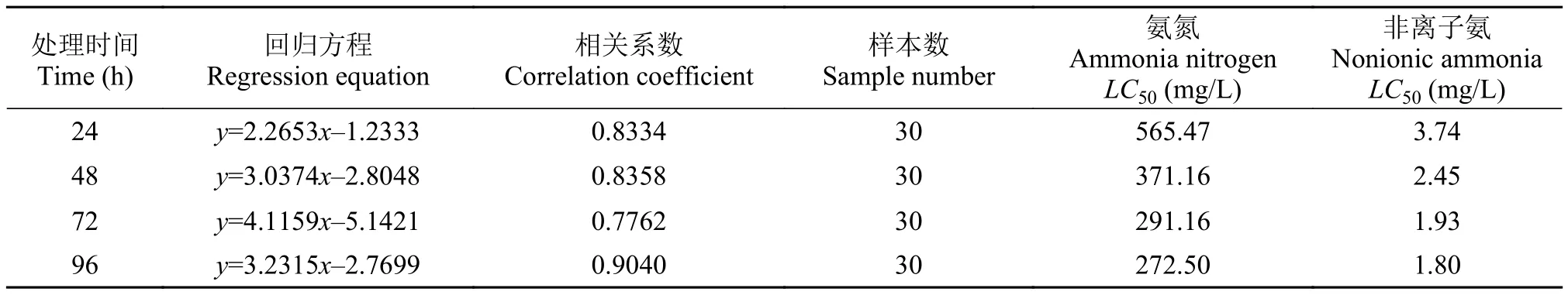
表 2 中华小长臂虾不同时间的半致死浓度Tab. 2 The half lethal concentration of P. sinensis in different time

图 1 氨氮对中华小长臂虾肝胰腺SOD活性的影响Fig. 1 The effect of ammonia-N on hepatopancreas SOD activity of P. sinensis

图 2 氨氮对中华小长臂虾肌肉SOD活性的影响Fig. 2 The effect of ammonia-N on muscle SOD activity of P. sinensis
2.4 氨氮对中华小长臂虾AKP活性的影响
从图 5可以看出, 在24h时, 相比于对照组, AKP活性有所升高, 除了100 mg/L外, 其他各处理组均显著高于对照组(P<0.05)。与24h不同, 在48h时, 随着氨氮浓度的上升, AKP活性开始下降,除了低浓度的60 mg/L处理组外, 其他氨氮浓度均显著低于对照组(P<0.05)。到96h时, 100 mg/L处理组AKP活性有所回升, 与对照组间差异不显著(P>0.05), 但140、180和220 mg/L处理组仍显著低于对照组(P<0.05)。
如图 6所示, 在24h时, 中华小长臂虾肌肉中AKP活性与肝胰腺表现出了不同的趋势, 各氨氮处理组的AKP活性并未上升, 反而开始下降, 各处理组均显著低于对照组(P<0.05)。相比于24h, 48h的各氨氮处理组AKP活性均有所下降, 尤其在180和220 mg/L处理组下降较为剧烈, 显著低于其他处理组(P<0.05)。到96h, 100和140 mg/L处理组的肌肉AKP活性进一步下降, 各处理组的AKP活性仍显著低于对照组(P<0.05)。

图 3 氨氮对中华小长臂虾肝胰腺ACP活性的影响Fig. 3 The effect of ammonia-N on hepatopancreas ACP activity of P. sinensis
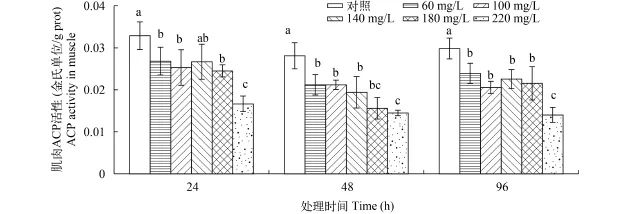
图 4 氨氮对中华小长臂虾肌肉ACP活性的影响Fig. 4 The effect of ammonia-N on muscle ACP activity of P. sinensis
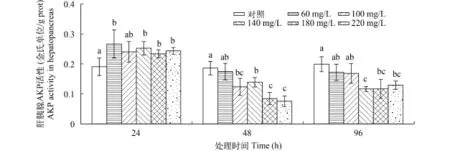
图 5 氨氮对中华小长臂虾肝胰腺AKP活性的影响Fig. 5 The effect of ammonia-N on hepatopancreas AKP activity of P. sinensis
图 6 氨氮对中华小长臂虾肌肉AKP活性的影响Fig. 6 The effect of ammonia-N on muscle AKP activity of P. sinensis
3 讨论
氨氮是甲壳动物蛋白质代谢的最终产物, 占甲壳动物氮代谢的60%—80%[14]。在工厂化养殖过程中, 由于养殖的高密度会导致养殖生物的代谢废物和残饵量加大, 进而造成氨氮含量升高, 容易诱发鱼病, 这也是影响工厂化高密度养殖成功的主要因素之一。因此, 研究虾类氨氮的毒性实验, 是了解虾类在氨氮胁迫条件下对氨氮耐受性的基础, 在养殖过程中具有重要的意义。从本研究结果可以看出, 中华小长臂虾对氨氮具有较强的耐受能力。在本实验条件下, 中华小长臂虾的96h LC50达到了272.50 mg/L。相比之下, 在水温24℃、盐度31、pH 8.1条件下, 氨氮对脊尾白虾(Exopalamon carincauda)幼虾(体长1.2cm)的96h LC50为80.40 mg/L, 成虾(体长4.3cm)为120.86 mg/L[15]; 在水温(24.93± 2.7)℃条件下, 氨氮对体重为(6.8±1.2) g和体重为(12.8±1.1) g的克氏原螯虾(Procambarus clarkii)的96h LC50分别为169.83和262.60 mg/L[16]; 在温度为30℃, pH为8, 盐度为34.5条件下, 氨氮对斑节对虾(Penaeus monodon)96h LC50为29.94 mg/L[17]。可以看出, 这些研究中的虾对氨氮的耐受性均低于中华小长臂虾。当然, 由于氨氮耐受性的影响因素较多,体重、pH、温度和盐度等因素都会影响到生物对氨氮的耐受程度, 因此如果想对不同虾的氨氮耐受性进行比较, 还需对实验条件进行统一。
在养殖水体中氨氮浓度可能在短时间内急剧升高, 从而会对养殖生物造成急性胁迫, 引起水产动物代谢异常而产生大量的活性氧自由基(ROS),这些氧自由基会威胁生物体健康, 及时地清除掉体内的ROS, 能够保障细胞发挥正常功能[18]。而SOD是生物体内一种十分重要的抗氧化酶, 能够对抗与阻断因ROS对细胞造成的损害, 在防御机体衰老和保护生物体健康等方面发挥重要作用[19,20]。本研究发现, 当中华小长臂虾受到氨氮胁迫24h时, 除了220 mg/L的肌肉组织外, 肝胰腺和肌肉组织中的SOD酶活性均会应激性升高, 并且具有明显的浓度依赖性, 即处理组的氨氮浓度越高, SOD酶活性越高。随着时间的延长, 处理组的SOD酶活性开始下降, 并在48h和96h时恢复到正常水平。这与李永等[17]、任海等[21]的研究结果相似, 他们研究结果发现斑节对虾在氨氮胁迫12h时SOD活性升到最高,并在48h时酶活性恢复到正常水平, 除低浓度氨氮组外, 脊尾白虾氨氮胁迫6—24h, 血淋巴和肝胰腺组织SOD活力都有不同程度的升高, 胁迫48—72h上述指标则开始下降并逐渐低于对照组。出现这种变化趋势的主要原因可能是氨氮胁迫后会导致体内的ROS增加, 进而导致SOD酶活性应激性升高,促进机体活性氧的清除, 随着氨氮胁迫的持续, ROS的不断增多造成中华小长臂虾肝胰腺和肌肉组织SOD持续消耗, 逐渐恢复到正常水平[22]。
ACP和AKP普遍存在于动植物体内, 是两种参与免疫防御的重要水解酶, 可催化各种含磷化合物的水解过程[23]。在本研究中, 肝胰腺中的AKP出现了短暂升高, 这可能是短时间内一定浓度的氨氮使得中华小长臂虾通过去磷酸化应激反应来适应氨氮的胁迫有关[24]。但随着氨氮胁迫时间的延长, 肝胰腺和肌肉的ACP和AKP活力均呈现显著降低的趋势, 这与甲壳动物在密度、盐度和温度等胁迫条件下酶活力随时间的变化趋势基本一致[25]。可以看出, 长时间的氨氮胁迫会显著抑制中华小长臂虾肝胰腺和肌肉中ACP和AKP的活力, 出现免疫疲劳,降低中华小长臂虾机体的免疫防御能力, 对中华小长臂虾的养殖是不利的。
国家渔业水质标准中规定非离子氨的含量不能超过0.02 mg/L, 本实验发现中华小长臂虾非离子氨的安全浓度为0.18 mg/L, 说明中华小长臂虾对高密度养殖过程中产生的氨氮胁迫具有较强的耐受性。但长时间受到氨氮胁迫会导致中华小长臂虾免疫力下降, 因此, 在养殖过程中应该注意氨氮含量控制在安全范围内, 避免胁迫导致中华小长臂虾疾病的发生。
[1]Li X Z, Liu R Y, Liang X Q. The zoogeography of Chinese Palaemonoidea fauna [J]. Biodiversity Science, 2003, 11(5): 393—406 [李新正, 刘瑞玉, 梁象秋. 中国长臂虾总科的动物地理学特点. 生物多样性, 2003, 11(5): 393—406]
[2]Jin K W, Shi W L, Yu X Y, et al. Predation of adhesive eggs of fishes by three freshwater prawns [J]. Journal of Dalian Fisheries University, 1997, 12(4): 19—23 [金克伟, 史为良, 于喜洋, 等. 三种淡水虾摄食鱼卵的试验研究. 大连水产学院学报, 1997, 12(4): 19—23]
[3]Zhang J, Yu H X. Study on zoobenthos community structure and water quality assessment in Songhua River along Harbin city [J]. Chinese Journal Fisheries, 2009, 22(2): 40—45 [张静, 于洪贤. 松花江哈尔滨段春季底栖动物群落结构研究及水质评价. 水产学杂志, 2009, 22(2): 40—45]
[4]Cai J H, Shen Q Y, Zheng X Y, et al. Advancement in researches of ammonia pollution hazards on aquaculture and its treatment technology [J]. Journal of Zhejiang Ocean University (Natural Science), 2010, 29(2): 167—172. [蔡继晗, 沈奇宇, 郑向勇, 等. 氨氮污染对水产养殖的危害及处理技术研究进展. 浙江海洋学院学报(自然科学版), 2010, 29(2): 167—172]
[5]Chang Z W, Chiang P C, Cheng W, et al. Impact of ammonia exposure on coagulation in white shrimp, Litopenaeus vannamei [J]. Ecotoxicology & Environmental Safety, 2015, 118: 98—102
[6]Zhang, W Y, Jiang, Q, Liu X, et al. The effects of acute ammonia exposure on the immune response of juvenile freshwater prawn, Macrobrachium nipponense [J]. Journal of Crustacean Biology, 2015, 35(1): 76—80
[7]Verghese B, Radhakrishnan E, Padhi A. Effect of environmental parameters on immune response of the Indian spiny lobster, Panulirus homarus (Linnaeus, 1758) [J]. Fish & Shellfish Immunology, 2007, 23: 928—936
[8]Ellis R P, Parry H, Spicer J I, et al. Immunological function in marine invertebrates: Responses to environmental perturbation [J]. Fish & Shellfish Immunology, 2011, 30(6): 1209—1222
[9]Liu C H, Chen J C. Effect of ammonia on the immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus [J]. Fish & Shellfish Immunology, 2004, 16: 321—334
[10]Jiang G, Yu R, Zhou M. Modulatory effects of ammonia-N on the immune system of Penaeus japonicus to virulence of white spot syndrome virus [J]. Aquaculture, 2004, 241: 61—75
[11]Zhang R Q, Chen Q X, Zheng W Z, et al. Inhibition kinetics of green crab (Scylla serrata) alkaline phosphatase activity by dithiothreitol or 2-mercaptoethanol [J]. International Journal of Biochemistry and Cell Biology, 2000, 32: 865—872
[12]Liao J H, Chen Q, LIN L R, et al. Purification and Characterization of Alkaline Phosphatase from Haliotis diversicolor [J]. Journal of Xiamen University (Natural Science), 2005, 44(2): 272—275 [廖金花, 陈巧, 林丽蓉, 等.鲍鱼碱性磷酸酶的分离纯化和性质研究. 厦门大学学报: 自然科学版, 2005, 44(2): 272—275]
[13]Wang Z, Yao Z L, Lin T T, et al. Effects of carbonate alkalinity stress on SOD, ACP, and AKP activities in the liver and kidney of juvenile Gymnocypris przewalskii [J]. Journal of Fishery Sciences of China, 2013, 20(6): 1212—1218 [王卓, 么宗利, 林听听, 等. 碳酸盐碱度对青海湖裸鲤幼鱼肝和肾SOD、ACP和AKP酶活性的影响. 中国水产科学, 2013, 20(6): 1212—1218]
[14]Weihrauch D, Becker W, Postel U, et al. Potential of active excretion of ammonia in three different haline species of crabs [J]. Journal of Comparative Physiology B, 1999, 169(1): 25—37
[15]Liang J P, Li J, Li J T, et al. Acute toxicity of ammonia nitrogen to juvenile and adult ridgetail white prawn, Exopalaemon carinicauda [J]. Fisheries Science, 2012, 31(9): 526—529 [梁俊平, 李健, 李吉涛, 等. 氨氮对脊尾白虾幼虾和成虾的毒性试验. 水产科学, 2012, 31(9): 526—529]
[16]Zhong J W, Zhu Y A, Meng Q L, et al. Acute toxicity of ammonia-N to two specifications of Procambarus clarkii adult [J]. Journal of Yangtze University (Natural Science Edition), 2013, 10(23): 55—59 [钟君伟, 朱永安, 孟庆磊,等. 氨氮对2种规格克氏原螯虾的急性毒性研究. 长江大学学报(自然科学版), 2013, 10(23): 55—59]
[17]Li Y, Yang Q B, Su T F, et al. The toxicity of ammonia-N on Penaeus monodon and immune parameters [J]. Journal of Shanghai Ocean University, 2012, 21(3): 358—362 [李永, 杨其彬, 苏天凤, 等. 氨氮对斑节对虾的毒性及免疫指标的影响. 上海海洋大学学报, 2012, 21(3): 358—362]
[18]Winston G W. Oxidants and antioxidants in aquatic animals [J]. Comparative Biochemistry & Physiology Part C Comparative Pharmacology & Toxicology, 1991, 100(1—2): 173—176
[19]Dou J H, Yu S X, Fan S L, et al. SOD and plant stress resistance [J]. Molecular Plant Breeding, 2010, 8(2):359—364 [窦俊辉, 喻树迅, 范术丽, 等. SOD与植物胁迫抗性. 分子植物育种, 2010, 8(2): 359—364]
[20]Wu Y F, Lin F, Yan J, et al. Relationships of serum contents of 6 inorganic elements and activity of SOD to aging in human [J]. Journal of Nanchang University (Medical Sciences), 2015, 55(5): 76—79 [吴一峰, 林菲, 阎冀, 等.血清中6种宏微量元素及SOD含量与人体衰老的关系.南昌大学学报: 医学版, 2015, 55(5): 76—79]
[21]Ren H, Li J, Li J T, et al. Effects of acute ammonia stresses on antioxidant enzyme activities and GPx gene expression in Exopalaemon carinicauda [J]. Journal of Agro-Environment Science, 2014, 33(4): 647—655 [任海,李健, 李吉涛, 等. 急性氨氮胁迫对脊尾白虾(Exopalaemon carinicauda)抗氧化系统酶活力及GPx基因表达的影响. 农业环境科学学报, 2014, 33(4): 647—655]
[22]de Oliveira U O, da Rosa Araújo A S, Belló-Klein A, et al. Effects of environmental anoxia and different periods of reoxygenation on oxidative balance in gills of the estuarine crab Chasmagnathus granulate [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2005, 140(1): 51—57
[23]Zou G Z, Sun H S. Research advances and prospect in aquatic crustaceans immunology [J]. Life Science Instrument, 2009, 7(6): 17—21 [邹广众, 孙虎山. 水产甲壳动物免疫学研究进展与前景展望. 生命科学仪器, 2009, 7(6): 17—21]
[24]Stebbing A R D. Hormesis the stimulation of growth by low levels of inhibitors [J]. Science of the Total Environment, 1982, 22(1): 213—234
[25]Zhang H J, Li Z J, Zhang J S, et al. Effects of stocking density on immune parameters and growth of juvenile Litopenaeus vannamei [J]. South China Fisheries Science, 2012, 8(4): 43—48 [张华军, 李卓佳, 张家松, 等. 密度胁迫对凡纳滨对虾稚虾免疫指标及生长的影响. 南方水产科学, 2012, 8(4): 43—48]
EFFECT OF AMMONIA NITROGEN ON ACUTE TOXICITY AND NONSPECIFIC IMMUNE PARAMETERS OF PALAEMONETES SINENSIS
BAO Jie1, JIANG Hong-Bo1, CHENG Hui1, YU Ye-Hui1and LI Xiao-Dong1,2
(1. College of Animal Science and Veterinary Medicine, Shenyang Agricultural University, Shenyang 110866, China; 2. Panjin Guanghe Crab Ltd., Co., Panjin 124200, China)
The current study explored the acute biological toxicity of ammonia-N on Palaemonetes sinensis. In the condition of (18±1)℃, pH 7.3±0.1, the half lethal concentrations of ammonia-N were 565.47 mg/L for 24h, 371.16 mg/L for 48h, 291.16 mg/L for 72h, and 272.50 mg/L for 96h, respectively, and the safe concentration was 27.25 mg/L. In the same condition, half lethal concentrations of non-ionic ammonia were 3.74 mg/L for 24h, 2.45 mg/L for 48h, 1.93 mg/L for 72h, 1.80 mg/L for 96h respectively and the safe concentration was 0.18 mg/L. Five different concentrations (60 mg/L, 100 mg/L, 140 mg/L, 180 mg/L and 220 mg/L) were used to study the influence of ammonia nitrogen stress on the non-specific immune indexes based on 96h LC50and safety concentration. Results showed that the superoxide dismutase (SOD) in hepatopancreas and muscle of P. sinensis significantly increased by ammonia nitrogen at 24h except muscle tissue in 220 mg/L, which decreased to the normal level at 48—96h. Compared with the control group, acid phosphatase (ACP) in hepatopancreas of P. sinensis by ammonia nitrogen treatment was not changed significantly at 24h, while alkaline phosphatase (AKP) was significantly increased. At 48—96h, both ACP and AKP were lower than the control group. Muscle ACP and AKP by ammonia nitrogen treatments except 140 mg/L were significantly lower than those in the control group at 24 and 96h. This study revealed that P. sinensis had strong tolerance to ammonia nitrogen. High ammonia nitrogen had can inhibit the activities of immune enzyme. The results will provide the scientific basis for the aquaculture of P. sinensis.
Palaemonetes sinensis; Ammonia-N; Acute toxicity; SOD; ACP; AKP
S968.22
A
1000-3207(2017)03-0516-07
10.7541/2017.66
2016-05-05;
2016-07-06
辽宁省教育厅项目(L2015472、L2014254); 辽宁省自然科学基金(201602654)资助 [Supported by the fund of Liaoning Provincial Department of Education (L2015472, L2014254); Natural Foundation of Liaoning Province (201602654)]
包杰 (1980—), 女, 满族, 辽宁人; 讲师, 博士; 研究方向为甲壳动物遗传育种。E-mail: yh_baojie@163.com, Tel: 15904088690
李晓东 (1965—), 男, 教授, 博士; 研究方向为甲壳动物遗传育种。E-mail: lxd001@ceraap.com

