共生与非共生爪哇伪枝藻对高温胁迫的响应
雷亚萍 许丽红 曾 臻 吴 丽
(武汉理工大学资源与环境工程学院, 武汉 430070)
共生与非共生爪哇伪枝藻对高温胁迫的响应
雷亚萍 许丽红 曾 臻 吴 丽
(武汉理工大学资源与环境工程学院, 武汉 430070)
研究以自由生长的爪哇伪枝藻(Free-living S. javanicum, fs)和分离自地衣的爪哇伪枝藻(Symbiotic S. javanicum, ss)为研究对象, 探究了不同生长状态爪哇伪枝藻对高温(45℃)胁迫的响应。结果发现在高温胁迫下, 爪哇伪枝藻光合活性、叶绿素a及类胡萝卜素含量下降; 丙二醛(MDA)、胞外多糖及可溶性蛋白含量上升。在高温处理下, 与fs相比, ss光合活性下降较慢, 且高温处理后ss的叶绿素a及类胡萝卜素含量也明显高于fs。高温处理下, 与fs相比, ss的MDA含量和增长速度均较低; 并且在面临高温胁迫时, ss能够更快的分泌胞外多糖和可溶性蛋白质, 从而在一定程度上达到自我保护的目的。研究结果表明, 在暴露于高温胁迫时, 相较于自由生长状态, 来自地衣的爪哇伪枝藻具有更高的自我保护效率。
生物结皮; 爪哇伪枝藻; 自由生长; 共生; 高温胁迫; 生理生化
生物结皮广泛存在于全球干旱、半干旱地区,是由藻类、地衣、苔藓、真菌及异氧细菌等生物组分胶结土壤颗粒在地表形成的一层易剥离的生物土壤复合层[1]。在其形成过程中能够增加土壤中的有机质, 固定大气中的氮素, 具有稳定地表、沃土增肥等重要生态功能[1,2]。生物结皮一般按照“藻结皮—地衣结皮—藓结皮”的阶段进行发育演替[3]。与藻结皮相比, 地衣结皮的表面更加粗糙, 抗压能力更强, 以及更高的固碳及固氮能力[4,5]。因此, 藻结皮向地衣结皮阶段的发育演替, 对于生物结皮生态功能的发挥具有重要意义。当藻结皮演替为地衣结皮时, 结皮中虽然藻类生物量(包括地衣中共生的藻类生物量)增加, 但自由生长的藻类(不包括地衣中共生的藻类)生物量却下降, 此时大部分藻类都处于共生状态, 以地衣共生体的形式存在[6]。已有研究表明, 与自由生长的藻类相比, 地衣共生体对环境胁迫的保护机制更为有效[7—9]。因此, 藻类生长状态的改变很可能是结皮发育演替的重要机制之一; 同时研究共生状态对藻类生理特性的影响, 对了解藻类适应荒漠环境的机理也有着非常重要的科学意义。
在荒漠地区, 较高的昼夜气温差异和温度波动是影响荒漠藻类生存的重要环境因子, 同时, 高温也能够导致PS II反应中心及捕光色素复合体的不可逆灭活等[10]。有关文献报道[11], 在夏秋季节时,流沙表面温度最高时达到66℃, 生物结皮在灼热的沙表面不可避免受到高温胁迫。爪哇伪枝藻(Scytonema javanicum)作为生物结皮中优势种类之一, 对结皮的形成和发育具有十分重要的作用, 其主要分布在结皮表面, 因此也更容易受到外界环境条件的影响[12]。Brock等[13]指出自由生长的藻类对干旱的耐受力较小; 当藻类周围的水势降低时, 自由生长的藻类的光合活性比地衣的停止得更早一些。因此, 本研究以自由生长的爪哇伪枝藻和分离自地衣中的爪哇伪枝藻为实验材料, 对比高温条件下两种爪哇伪枝藻生理生化特性的差异, 从而探究共生后藻类对高温胁迫响应的变化, 揭示共生关系对藻类抗胁迫能力的影响。
1 材料与方法
1.1 藻种的培养
共生与非共生爪哇伪枝藻是从荒漠地表的生物结皮中分离、纯化所得。将以真菌共生体形式存在的爪哇伪枝藻分离纯化, 将其记为共生态爪哇伪枝藻(Symbiotic S. javanicum, ss); 非共生爪哇伪枝藻是指结皮中分离的自由生长的爪哇伪枝藻(Free-living S. javanicum, fs)。将分离纯化的ss和fs转至BG-110培养基中, 待藻体生长到对数生长期后, 将藻液转接到2 L的培养瓶中通气培养, 培养温度为(25±1)℃, 光强为40 μE/(m2·s)(连续光照)。培养15—20d后收集藻液, 将藻液在离心机8000 r/ min离心10min, 然后将藻体收集在0.22 μm的微孔滤膜上备用。
1.2 试验的设计
在荒漠地区的夏季, 地表温度在正午一般高于40℃, 有研究发现35℃有利于保持藻体细胞的形态结构, 而45℃的高温胁迫则显著破坏了藻体细胞结构[11], 因此本实验采用45℃作为高温处理, 从而研究共生与非共生的爪哇伪枝藻抗高温胁迫能力的差异。高温处理前将收集的两种藻体分别涂布于海绵表面, 放置于盛有BG110培养基的培养皿中使藻丝能够得到足够的水分及营养。之后将培养皿置于45℃条件下进行处理[光照强度为40 μE/(m2·s)],在不同处理时间(0、1h、5h、12h和24h)取样进行相应生理指标的测定, 每组3个样品作为重复。实验中以25℃培养温度为对照。
1.3 生理指标的测定
光化学效率 将处理好的样品放入黑暗处使其暗适应20min, 然后利用便携式光合作用仪LI-6400测定其叶绿素荧光参数: 最大荧光(Fm)和初始荧光(Fo), 计算藻体PSⅡ最大光化学效率(Fv/Fm):
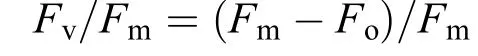
式中, Fv/Fm为可变荧光与最大荧光之比。
叶绿素a含量 取0.1 g的藻体, 加入2—3 mL的100%丙酮用研钵充分研磨, 转移到10 mL的离心管中, 定容至5 mL, 摇匀。然后放入4℃冰箱中黑暗静置18—24h, 8000 r/min离心15min后取上清液,用紫外可见分光光度计测定663、490和384 nm处光密度(OD)值, 以三色公式[14]Chl.a=(1.02A663–0.027A384–0.01A490)/CChl.a×V/m计算样品中所含叶绿素a含量, 单位为μg/g。其中, Chl.a 代表叶绿素a含量; CChl.a为叶绿素的消光系数, 取值为92.5, 单位为L/(g·cm); V为丙酮提取液体积(mL); m为样品质量(g)。
类胡萝卜素(Carotenoid)含量 类胡萝卜素的测定方法同上, 计算公式为[14]Car=(1.02A490–0.08A384– 0.026A663)/CChl.a×V/m, 计算类胡萝卜素的含量, 单位为μg/g。其中, Car代表类胡萝卜素含量; Ccar为类胡萝卜素的消光系数, 取值为250, 单位为L/(g·cm); V为丙酮提取液体积(mL); m为样品重量(g)。
丙二醛(MDA)含量 参照李合生[15]的方法,将干燥处理的藻体0.2 g, 加入2 mL的10%TCA和少量石英砂, 研磨至匀浆, 再加8 mL的TCA进一步研磨, 匀浆在4000 r/min离心10min, 上清液为样品提取液。
取上清液2 mL (对照加2 mL蒸馏水), 加入2 mL 0.67% TBA溶液, 混匀物于沸水浴上反应20min, 迅速冷却后再离心。取上清液分别在532、600和450 nm波长下测定OD度。丙二醛含量(μmol/g)计算公式为:
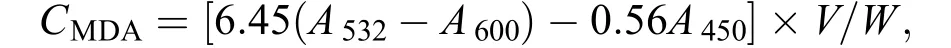
式中, CMDA为丙二醛含量, V为提取液体积(mL) ; W为藻体干重(g)。
可溶性蛋白质含量 采用考马斯亮蓝G-250的方法测定细胞内可溶性蛋白质的含量[15]。取0.2 g藻体, 加入PBS缓冲液, 于冰水浴下破碎, 3000 r/ min离心10min, 弃去沉淀物。取上清液1 mL加入具塞试管中, 再加入5 mL的考马斯亮蓝G-250, 充分混合, 放置2min后在595 nm下比色, 测定OD值, 并通过标准曲线查得蛋白质含量, 并计算测试样品中蛋白质含量。
胞外多糖(Exopolysaccharide, EPS) 胞外多糖含量的测定采用苯酚硫酸法[15]。 称取样品0.2 g放入具塞管中, 加入5 mL蒸馏水, 于沸水中提取30min(提取2次), 再吸取1 mL样品液于试管中(重复2次), 加蒸馏水1 mL, 按顺序分别加入苯酚、浓硫酸溶液, 显色并在485 nm处测定OD值。由标准线性方程求出糖的量, 并计算测试样品中糖含量。
1.4 数据的分析
本文中方差分析利用One-way ANOVA进行分析, 多重比较采用Duncan法进行。所有的数据分析都在SPSS19.0进行, 显著水平为P<0.05, 极显著水平为P<0.001。
2 结果
2.1 高温处理对fs和ss的光化学效率的影响
如图 1, 在25℃条件下, fs和ss随着培养时间的延长, 其Fv/Fm均呈现逐渐下降的趋势, 但各时间点上两种伪枝藻的Fv/Fm值之间无显著性差异(P>0.05)。高温处理后(45℃), fs和ss的Fv/Fm值都随处理时间呈极显著下降趋势(P<0.001), 且两种藻的Fv/Fm值都显著低于对照组(P<0.05)。处理1h后, fs的Fv/Fm值下降了23%, 5h后, 下降了97%; 而ss的Fv/Fm值在处理1h后只下降了12%, 5h后下降了94%。 5h后fs和ss的Fv/Fm值都趋于稳定, 无显著性变化(P>0.05)。
2.2 高温处理对叶绿素a和类胡萝卜素含量的影响
如图 2, 在高温处理1h后, fs和ss的叶绿素a含量均出现显著下降(P<0.05), 分别下降37%和17%。之后随着处理时间的延长, 叶绿素a含量逐渐趋于稳定(P>0.05), 然而与对照相比, 在高温处理24h后, fs与ss的叶绿素a含量分别下降28%和9%, 且在整个高温处理过程中, ss的叶绿素a含量均极显著高于fs (P<0.001)。
在高温处理后, fs和ss的类胡萝卜素含量随处理时间呈相同变化趋势, 即均呈现先降低再升高,之后再降低的变化趋势(图 3)。在高温处理24h后, fs与ss的类胡萝卜素含量分别下降23%和15%, 且在整个高温处理过程中, ss的类胡萝卜素含量均明显高于fs (P<0.001)。
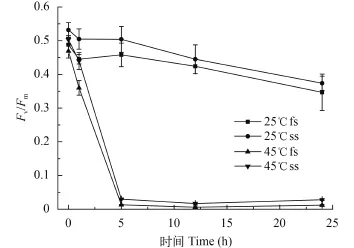
图 1 高温处理对fs和ss的光化学效率的影响Fig. 1 The effect of high temperatures on the maximum photochemical efficiency

图 2 高温处理对fs和ss的叶绿素a含量的影响Fig. 2 The effect of high temperature on the contents of chlorophyll a
2.3 高温处理对fs和ss的丙二醛含量的影响
在高温处理下, fs和ss的MDA含量均随处理时间呈明显增加趋势(P<0.001; 图 4)。在高温处理早期(1h), fs的MDA含量显著高于ss (P<0.05); 然而在高温处理5h后, ss的MDA含量却显著高于fs (P<0.05)。之后随处理时间的延长, fs的MDA含量急剧增加, 而ss的MDA含量增加却相对缓慢, 直至在高温处理24h后, fs的MDA含量极显著高于ss (P<0.001), 此时fs的MDA含量为处理前的4.1倍, 而ss的MDA含量为处理前的3.7倍。
2.4 高温处理对胞外多糖含量的影响
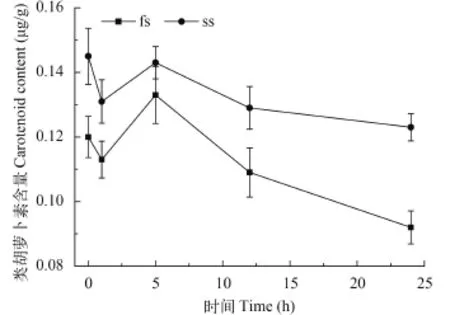
图 3 高温处理对fs和ss的类胡萝卜素含量的影响Fig. 3 The effect of high temperature on the contents of carotenoid

图 4 高温处理对fs和ss的丙二醛含量的影响Fig. 4 The effect of high temperatures on the contents of MDA of fs and ss
在45℃高温处理下, fs和ss的胞外多糖含量都是随处理时间呈现逐渐增加的趋势(图 5)。处理前5h, 两种藻的胞外多糖含量与初始量相比均只有略微的增加, 并无显著性差异(P>0.05); 然而处理12h后, 两种藻的胞外多糖含量均出现显著增加。高温处理前fs的胞外多糖含量明显高于ss(P<0.05),然而高温处理24h后, 二者之间的的胞外多糖含量却基本相同, 无明显差别(P>0.05)。与高温处理前相比, 处理24h后fs的胞外多糖含量增加了1.1倍, 而ss的胞外多糖含量却增加了2.1倍。
2.5 高温处理对可溶性蛋白质含量的影响
在整个高温处理过程中, fs的可溶性蛋白质含量均极显著高于ss (P<0.001; 图 6)。高温处理1h后,两种藻的可溶性蛋白质含量均出现明显增加(P<0.05), 之后在高温处理12h内, 可溶性蛋白质含量均无明显增加(P>0.05), 直到处理24h后, 两者的可溶性蛋白质含量再次出现明显增加, 此时fs的可溶性蛋白质含量为处理前的2.7倍, 而ss的可溶性蛋白质含量为处理前的3.7倍。

图 5 高温处理对fs和ss的胞外多糖含量的影响Fig. 5 The effect of high temperatures on the contents of EPS of fs and ss不同字母代表差异显著(P < 0.05); 下同Different letters represent significant differences; the same applies below
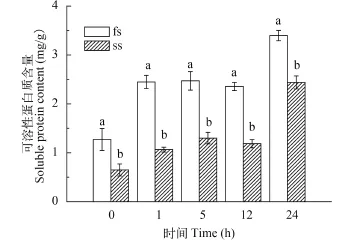
图 6 高温处理对fs和ss的可溶性蛋白质含量的影响Fig. 6 The effect of high temperatures on the contents of Soluble protein of fs and ss
3 讨论
爪哇伪枝藻是藻结皮的一种重要的优势种类,直接分布于结皮的最表面, 因此经常受到外部环境胁迫条件的影响[16]。而当藻结皮演替到地衣结皮时, 爪哇伪枝藻又可以同真菌共生形成地衣, 以共生状态在结皮中出现。生存状态的改变不仅会影响结皮藻类的生理代谢特性, 也可能对其环境适应以及整个生物结皮微生态系统的发育有着重要的意义。
暗适应后叶绿素a的可变荧光与最大荧光的比值(Fv/Fm)是PS II最大光化学产量, 反映PSII反应中心的最大光能转换效率, 是植物(包括藻类)潜在的、最大的光合活性[17]。在没有受到胁迫的时候,光合生物Fv/Fm值维持在稳定的水平, 高等植物通常大于0.8, 真核藻类约为0.6, 而蓝藻维持在0.4—0.5[18]。然而当处于胁迫状态时, Fv/Fm值便会出现下降。在本研究中, 高温处理5h后fs和ss的Fv/Fm值接近于0, 说明5h高温处理已使两种状态S. javanicum的PSII反应中心受到严重破坏, 甚至丧失活性。高温处理后fs和ss叶绿素a含量的显著下降也证实了这一点。然而对比不同生长状态的两种伪枝藻, 实验结果表明ss的光合活性一直是高于fs, 并且在高温处理后, 其光合活性下降速度也慢于fs, 这说明与真菌共生后, S. javanicum对高温的耐受能力要高于其自由生长状态, 同时也说明自由生长的藻类对光抑制更加的敏感, 会遭受更严重的损伤。另外, 在高温处理条件下, ss的叶绿素a含量只降低1/4左右, 而fs的叶绿素a含量却降低了近1/2。这也进一步说明高温对fs的细胞造成了更为严重的损伤;相对于自由生长状态, 共生后的S. javanicum可能存在某种保护机制, 降低了高温对其造成的损伤, 进而使更多的叶绿素a分子得以保留。同时, 实验结果还表明在高温处理的1–5h时内, fs和ss的类胡萝卜素含量均明显增加, 这很可能是S. javanicum在受到高温胁迫时, 藻细胞通过合成大量类胡萝卜素来淬灭细胞内产生的活性氧。此外高温处理24h后, ss产生的类胡萝卜素含量是远远大于fs, 这也可能说明ss对高温的保护机制更为有效。
丙二醛(MDA)是植物细胞在逆境下发生膜脂过氧化作用的产物之一, 通常将它作为膜脂过氧化作用强弱的一个重要指标。MDA既是过氧化产物,又是一种能强烈地与细胞内各种成分发生反应的物质, 能引起对酶和膜的严重损伤, 导致膜的结构及生理完整性的破坏[19]。有研究表明, 蓝藻在遭受胁迫时, 细胞内的MDA会急剧增加[20]。本研究发现, 从整体来看, 高温处理后fs的MDA含量是明显高于的ss的, 说明fs的膜结构遭受到了更为严重的损伤, 同时也说明在与真菌共生后, ss对活性氧的清除是更为有效的, 这与高温处理后, fs中更低的叶绿素a浓度及类胡萝卜素含量的结果是一致的。
当植物受到高温胁迫时, 所吸收多余的光能很难以热能形式或者通过光化学作用耗散掉, 因此就会在细胞内产生大量的活性氧, 进而对其类囊体膜、蛋白以及色素造成氧化损伤[21,22]。已有研究显示, 生物结皮中藻类胞外多糖对保护藻类自身和其他生物抵御荒漠环境条件(高温、干旱、辐射等)的影响起着重要的作用[23]; 同时这些胞外多糖在控制藻细胞水分的吸收、输出中也起着重要的调节作用, 从而使细胞在吸胀和收缩过程中免受伤害。作为胞外基质, 胞外多糖中沉积有大量色素类物质, 能够吸收、屏蔽掉大部分UV辐射, 减少UV辐射伤害[24]。另外, 也有研究证实胞外多糖还能够有效清除活性氧, 降低藻体的氧化损伤[25,26]。本研究发现, 当藻细胞从常温转到45℃高温下时,胞外多糖含量明显增加, 这也进一步证实胞外多糖在藻细胞抵御高温胁迫中的作用。当暴露于高温胁迫时, ss中胞外多糖的合成速率要明显高于fs, 这也很可能是ss具有更强的抗高温胁迫的另一重要原因。此外, 作为一种重要的渗透调节物质和营养物质, 可溶性蛋白的增加和积累能提高细胞的保水能力, 对细胞的生命物质及生物膜起到保护作用[27]。本研究发现虽然fs的可溶性蛋白质含量一直都是高于ss的, 但是ss的可溶性蛋白质增加的量却高于fs, 这也进一步说明ss对细胞的保护作用更加有效和快速。
本实验研究发现, 当暴露于高温胁迫时, 以共生形式存在的ss能够保存更多的叶绿素a, 且Fv/Fm值的下降速率明显低于自由生长形式的fs, 而EPS的合成速率明显高于fs; ss的类胡萝卜素含量、可溶性蛋白含量均明显高于高于fs。以上结果均说明, 当藻类与真菌共生后, 有利于光合产物的产生,藻类和真菌的相互刺激, 增加了其光保护和抗氧化能力, 总而言之, 共生关系的发生有效提高了S. javanicum对高温胁迫的适应能力, 有利于S. javanicum在荒漠地区生存发展, 这也很可能是地衣结皮取代藻结皮成为优势类型的重要内在机理之一。
4 结论
本文通过在实验室条件下培养自由生长的爪哇伪枝藻和与分离自地衣共生体的爪哇伪枝藻, 研究了在高温条件下两者的生理生化特性变化。实验结果发现, 在高温胁迫下, ss光合活性的降低速率明显慢于fs; 且处理24h后, ss保存的叶绿素a及类胡萝卜素含量明显高于fs; 同时ss的MDA含量和其增长速率明显低于fs; 暴露于高温胁迫时, ss能够更快的分泌出胞外多糖和可溶性蛋白质, 保护自身细胞免受更严重的损伤。因此, 本研究发现共生关系对藻类细胞有一定的保护作用, 能够明显提高S. javanitus对高温胁迫的耐受能力。
[1]Belnap J, Rosentreter R, Leonard S, et al. Biological soil crusts: ecology and management [J]. Ecological Studies, 2001, (47): 119—131
[2]Bowker M A, Maestre F T, Escolar C. Biological crusts as a model system for examining the biodiversity-ecosystem function relationship in soils [J]. Soil Biology & Biochemistry, 2010, 42(3): 405—417
[3]Lan S B, Wu L, Zhang D L, et al. Successional stages of biological soil crusts and their microstructure variability in Shapotou region (China) [J]. Environmental Earth Science, 2012, 65(1): 77—88
[4]Redfield E, Barns S M, Belnap J, et al. Comparative diversity and composition of cyanobacteria in three predominant soil crusts of the Colorado Plateau [J]. FEMS Microbiology Ecology, 2002, 40(1): 55—63
[5]Housman D C, Powers H H, Collins A D, et al. Carbon and nitrogen fixation differ between successional stages of biological soil crusts in the Colorado Plateau and Chihuahuan Desert [J]. Journal of Arid Environments, 2006, 66(4): 620—634
[6]Wu L, Zhang G K, Chen X G, et al. Development and succession of biological soil crusts and the changes of microbial biomasses [J]. Environmental Science, 2014, 35(4): 1479—1485 [吴丽, 张高科, 陈晓国, 等. 生物结皮的发育演替与微生物生物量变化. 环境科学, 2014, 35(4): 1479—1485]
[7]Brock T D. The effect of water potential on photosynthesis in whole lichens and in their liberated algal components [J]. Planta, 1975, 124(1): 13—23
[8]Lange O L, Pfanz H, Kilian E, et al. Effect of low water potential on photosynthesis in intact lichens and their liberated algal components [J]. Planta, 1990, 182(3): 467—472
[9]Ilse K, W John C, Margret Z, et al. Antioxidants and photoprotection in a lichen as compared with its isolated symbiotic partners [J]. Proceedings of the National Academy of Sciences, 2005, 102(8): 3141—3146
[10]Lan S B, Li W, Zhang D, et al. Desiccation provides photosynthetic protection for crust cyanobacteria Microcoleus vaginatus from high temperature [J]. Physiologia Plantarum, 2014, 152(2): 345—354
[11]Wu P P, Rao B Q, Hao Z J, et al. Physiological and ultrastructural characteristics of Scytonema javanicum under high temperature [J]. Acta Hydrobiologica Sinica, 2012,36(4): 735—743 [吴沛沛, 饶本强, 郝宗杰, 等. 高温培养条件下爪哇伪枝藻的生理特性和超微结构特征. 水生生物学报, 2012, 36(4): 735—743]
[12]Brock T D. The effect of water potential on photosynthesis in whole lichens and in their liberated algal components [J]. Planta, 1974, 124(1): 13—23
[13]Rao B Q. Influences of environmental factors on desert algae and developments of algal crust [D]. Thesis for doctor of Science, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan. 2009 [饶本强. 生态环境因子对荒漠藻及其结皮生长发育的影响研究. 博士学位论文, 中国科学院水生生物研究所, 武汉. 2009]
[14]Garcia-Pichel F, Castenholz R W. Characterization and biological implications of scytonemin, a cyanobacterial sheath pigment [J]. Journal of Phycology, 1991, 27(3): 395—409
[15]Li H S. Experiment Principle and Technology of Plant Physiology and Biochemistry [M]. Beijing: High Education Press. 2000, 134—260 [李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社. 2000. 134—260]
[16]Wu L, Lan S B, Zhang D L, et al. The structure and small-scale vertical distribution of the algae in lichen soil crusts [J]. Microbial Ecology, 2011, 62(3): 715—724
[17]Wu L, Zhang G K, Lan S B, et al. Longitudinal photosynthetic gradient in crust lichens’ thalli [J]. Microbial Ecology, 2014, 67(4): 888—896
[18]Kolber Z, Zehr J, Falkowski P. Effects of growth irradiance and nitrogen limitation on photosynthetic energy conversion in photosystem II [J]. Plant Physiology, 1988, 88(3): 923—929
[19]Halliwell B, Gutteridge J M, Cross C E. Free radicals, antioxidants, and human disease: where are we now [J]. Journal of Laboratory & Clinical Medicine, 1992, 119(6): 598—620
[20]Rio D D, Stewart A J, Pellegrini N. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress [J]. Nutrition Metabolism & Cardiovascular Diseases, 2005, 15(4): 316—328
[21]Müller P, Li X P, Niyogi K K. Non-photochemical quenching. A response to excess light energy [J]. Plant Physiology, 2001, 125(4): 1558—1566
[22]Guo Y P, Zhou H F, Zhang L C. Photosynthetic characteristics and protective mechanisms against photooxidation during high temperature stress in two citrus species [J]. Scientia Horticulturae, 2006, 108(3): 260—267
[23]Hu C, Liu Y, Paulsen B S, et al. Extracellular carbohydrate polymers from five desert soil algae with different cohesion in the stabilization of fine sand grain [J]. Carbohydrate Polymers, 2003, 54(1): 33—42
[24]Wright D J, Smith S C, Joardar V, et al. UV irradiation and desiccation modulate the three-dimensional extracellular matrix of Nostoc commune (Cyanobacteria) [J]. Journal of Biological Chemistry, 2005, 280(48): 40271—40281
[25]Potts M. Desiccation resistance of prokaryotes [J]. Microbiological Reviews, 1994, 58: 755—805
[26]Chen L, Yang Y, Deng S, et al. The response of carbohydrate metabolism to the fluctuation of relative humidity (RH) in the desert soil cyanobacterium Phormidium tenue [J]. European Journal of Soil Biology, 2012, 48(2): 11—16
[27]Ga B, Pj S, Edwards M K K. Role of K+and amino acids in osmoregulation by the free [J]. Microbiology, 2000, 146(2): 427—433
RESPONSE TO HIGH TEMPERATURE STRESS IN SYMBIOTIC AND FREELIVING SCYTONEMA JAVANICUM
LEI Ya-Ping, XU Li-Hong, ZENG Zhen and WU Li
(School of Resources and Environmental Engineering, Wuhan University of Technology, Wuhan 430070, China)
Biological soil crusts (BSCs) are widely distributed in global arid and semi-arid environment, where high temperature stress is one of the critical environmental factors to control the survival of algae. As a common species in BSCs, Scytonema javanicum appears in alga crust stage as free-living form and in lichen crust as symbiotic form to regulate the formation and development of BSCs. This study explored the effect of high temperature stress (45℃) on symbiotic (ss) and free-living S. javanicum (fs). The results showed that high temperature stress declined the photosynthetic activity more dramatically in ss compared with in fs, and high temperature stress induced a higher biomass in ss compared with in fs. Compared with fs, ss had lower growth rate and MDA content, and faster extropolysaccharides-released and soluble protein- to protect from damages. The results showed that, compared with free-living form, the S. javanicum from lichens had higher self-protection efficiency when exposed to high temperature.
Biological crust; Scytonema javanicum; Free; Symbiosis; High temperature stress; Physiological and biochemical
Q142
A
1000-3207(2017)03-0671-06
10.7541/2017.85
2016-05-31;
2016-12-28
国家自然科学基金(31300100)资助 [Supported by the National Natural Science Foundation of China (31300100)]
雷亚萍(1990—), 女, 湖北武汉人; 硕士研究生; 研究方向为藻类环境生物学。E-mail: 695975007@qq.com
吴丽(1983—), 博士; E-mail: wuli774@126.com

