不同湿地模型净水效果与基质酶活性相关性的比较研究
王 林李 冰,余家辉朱加宾朱 健,
(1. 南京农业大学无锡渔业学院, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室, 无锡 214081)
不同湿地模型净水效果与基质酶活性相关性的比较研究
王 林1李 冰1,2余家辉1朱加宾1朱 健1,2
(1. 南京农业大学无锡渔业学院, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室, 无锡 214081)
为了研究不同植物和基质组合的小型湿地模型净水效果及其与基质酶活性(脲酶和磷酸酶)之间的相关性, 并选出净水效果最佳的模型, 通过对两种植物(茭白和慈姑)和两种基质(石榴石和磁铁矿)进行组合构建不同的湿地模型, 对不同湿地模型进出水口水质和基质酶活性进行测定并加以分析进行优化选择。结果表明:湿地模型对亚硝态氮的去除率最高, 最高能达到98.87%, 最低也能达到58.06%, 对高锰酸盐的去除率最低, 最高37.91%, 最低2.51%; 湿地模型X5-X6对各污染物的去除率基本上都比X1-X4高, 总氮去除率平均高3%, 氨氮去除率平均高10%, 亚硝态氮去除率平均高10%, 总磷去除率平均高15%, 正磷酸盐去除率平均高20%, 高锰酸盐去除率平均高8%; 在相同种植数量的情况下, 茭白和慈姑混合种植的湿地模型总体上比茭白和慈姑单一种植的湿地模型具有更好的净水效果, 是实验中的最佳湿地模型; 湿地模型的脲酶活性与总氮去除率具有显著的相关性(相关系数为0.903—0.980), 脲酶可作为判定人工湿地去除养殖水体中总氮效能的指标, 湿地模型磷酸酶活性与高锰酸盐去除率总体上具有显著相关性(相关系数为0.821—0.992), 磷酸酶可作为判定人工湿地去除养殖水体中高锰酸盐效能的指标。研究为人工湿地植物和基质优化选择和基质酶活性评价净水效果提供了理论依据。
湿地模型; 净水效果; 脲酶活性; 磷酸酶活性; 相关性
我国是世界上水资源严重缺乏的国家之一, 水质污染和水资源浪费问题日渐严峻[1]。在水产养殖过程中, 未经处理的养殖废水直接排放, 会污染外在的生态环境。因此, 有效的水处理措施能够净化污水, 对于维护健康的水域生态环境, 保障水产品质量安全和渔业经济发展等具有重要意义具有十分重要的意义。
被誉为“地球之肾”的湿地系统, 具有强大的污水净化功能和丰富的生物多样性[2,3]。人工湿地系统是由自然湿地系统演变形成, 主要是由植物和基质两大部分组成, 并具有结构简单、运行费用低、易于操作、易于管理等优点被国内外广泛应用于水质净化[4—8]。例如: 赵晶[9]等研究了复合垂直流人工湿地对水库水质的净化效果, Zhu等[10]研究了人工湿地系统对城市废水的处理效果, 王加鹏等[11]研究了人工湿地净化海水养殖外排水效果, Farzadkia等[12]研究了人工湿地对污水处理厂营养物质的去除效果等。同样, 人工湿地与水产养殖池塘组合的循环水养殖系统, 能够有效地利用人工湿地净水效果, 将养殖水体净化并循环利用, 减少了对环境的污染, 对渔业减排有着重大意义。在循环水养殖系统基质中存在大量酶类, 这些酶能够加速基质中有机物质的转化, 并能在养殖水体净化过程中起到十分重要的作用。其中, 脲酶是线性酰胺的C-N键(非肽)的水解酶, 磷酸酶能够酶促有机磷化物的水解[1], 在养殖水体净化过程中都具有独特的作用。目前, 在人工湿地净化养殖水体的机制研究中, 有关湿地植物的微生物学、水力动力学和植物生理学等相关报道较多, 但是基质酶学的研究国内外尚不多见[1]。
人工湿地是由植物和基质两大部分组成, 植物具有直接吸收污染物和向根区输送氧气等功能[13],基质能够通过吸附等作用去除污染物, 也能为微生物和植物生长等提供附着面[14]。人工湿地植物和基质的研究备受科学研究者青睐。乔木植物[15—17]和草本植物[18,19]作为湿地植物的研究和火山石、生物陶粒、沸石和活性炭等作为湿地基质[20,21]的研究都有诸多报道。在所研究的湿地植物中, 同时具有净水功能和经济价值, 又体现区域特色的水生植物较少; 所研究的基质大多数都是常规应用的人工湿地滤料。本实验选用慈姑和茭白作为人工湿地植物, 考虑到慈姑和茭白是长江下游常见的水生经济植物; 选用石榴石和磁铁矿作为人工湿地基质, 因为相比于陶瓷、鹅卵石和页岩等常规滤料,石榴石和磁铁矿都是化学稳定性好的新型耐磨净水材料, 并且磁铁矿能够富集有害微生物[22]。本研究通过以上两种植物和两种基质的组合构建不同的小型人工湿地模型, 通过对不同人工湿地净水效果的比较, 筛选出净水效果最佳的组合, 并分析基质酶与净水效果的相关性, 为人工湿地植物和基质的优化选择提供理论依据, 为采用酶活性评价人工湿地系统净水效果提供基础研究资料。
1 材料与方法
1.1 小型湿地模型的构建
小型湿地模型构建的人工湿地植物是茭白和慈姑, 基质是石榴石和磁铁矿。根据多变量实验设计方法进行设计, 分别对两种植物和两种基质进行组合, 共6种组合(表 1)。
湿地模型主要是由进水口、出水口、基质、植物和塑料桶组成(图 1)。湿地模型的基本数据下:上端直径为0.565 m, 低端直径为0.455 m, 高度为0.705 m, 基质填埋深度为0.550 m, 水力负荷为2.151 m3/(m2·d), 孔隙度为47%, 水力停留时间为0.120/d, 水体流量为0.540 m3/d, 其中水力负荷和水力停留时间计算详见公式(1)和(2)。所有的湿地模型建立在养殖池塘旁, 实验地点在中国水产科学研究院淡水渔业研究中心大浦实验基地。组装完成后的小型湿地模型, 根据表 1中的植物和基质组成,先将已经清洗完的基质装入小型湿地中, 再将植物移栽入已装入的基质中, 所有湿地模型中的植株数量相同。利用水泵将养殖池塘水接入湿地模型的进水口, 每一个湿地模型进水口都通过阀门控制水的流速, 保持所有实验组合水体流速相同。进水口连接养殖池塘, 池塘养殖模式为主养鲫鱼, 兼养鲢鱼、鳙鱼、草鱼和青鱼, 是长江下游典型的池塘养殖模式。
1.2 样品采集
湿地模型构建运行后, 每隔10天采样一次, 在上午10—12点采样, 采集样品前, 先用便携式pH仪和溶氧仪测定每个湿地模型的pH、溶解氧和温度,分别测定3次取平均值。然后分别采取进水口水样和每个湿地模型出水口水样, 每一个采样点平行采样3次。再在湿地模型的根际部位采集基质样品,每个湿地模型平行采样3次。采集后将样品放入4℃冰箱待测。
1.3 测定方法
温度、pH和溶氧(DO)分别使用便携式pH测定仪(梅特勒SG2)、便携式溶解氧测定仪(YSI DO200)于现场采样时测定。基质中的脲酶采用奈氏比色法, 磷酸酶采用磷酸苯二钠比色法[23]。水质理化指标测定方法见表 2。
1.4 数据分析
水力负荷a [m3/(m2·d)]计算公式:
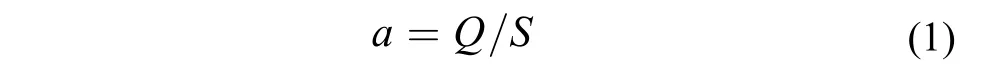
式中: Q-水体流量(m3/d); S-湿地模型表面积(m2)。水力停留时间HRT (/d)计算公式:式中: ε-滤料孔隙度; hm-湿地模型深度(m); a-水力负荷[m3/(m2·d)]。

图 1 小型湿地模型示意图Fig. 1 Diagrammatic drawing of a wetland model
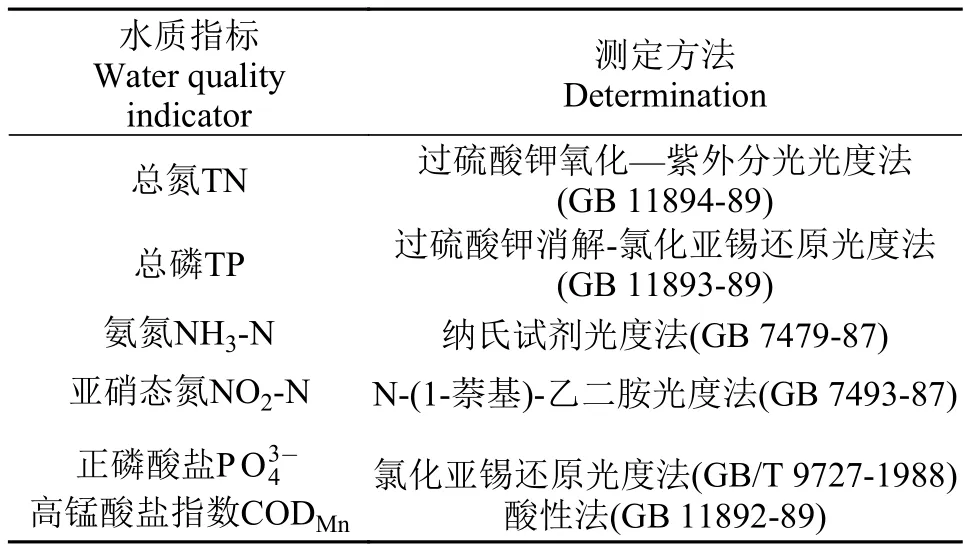
表 2 水质理化指标的测定方法Tab. 2 Water physical and chemical parameters and the methodology for measuring each parameter
总氮、总磷、氨氮、亚硝态氮、正磷酸盐和高锰酸盐去除率R计算详见公式(3):

式中: Z0表示进水口水体各理化指标的浓度(mg/L); Z1代表各湿地模型出水口水体各理化指标浓度(mg/L)。
本文使用Excel进行常规计算及作图, 并使用SPSS 20.0 软件进行样品ANOVA方差分析, 采用LSD法进行差异性多重比较。
2 结果
2.1 各湿地模型的净水效果
本实验的湿地模型运行于2015年8—9月, 每隔10天采样一次, 表 3中的数据为进水口和各个湿地的温度、pH和溶解氧值。表 3的数据显示在人工湿地运行期间, 水温一直在下降, 9月8号之后的水温下降加快, 平均下降了3—4℃, 但pH和溶解氧在整个运行期间变化较小。
图 2为湿地模型对污染物去除率的树状图, 湿地模型对亚硝态氮的去除率最高, 最高能达到98.87%, 最低也能达到58.06%; 对高锰酸盐的去除率最低, 最高达到37.91%, 最低2.51%。这说明本实验中的湿地模型对养殖水体中的亚硝态氮去除效果最好。
2.2 脲酶和磷酸酶活性
表 4中的数据表明, 各湿地模型的脲酶活性整体呈现“低-高-低”的趋势, 9月8号脲酶活性最高。表 5中的数据表明, 各湿地模型的磷酸酶活性整体呈现“低-高-低”的趋势, 8月28号最高, 并且与9月8号的磷酸酶活性相差0.3 mg (C6H6O)/(24h×1 g)左右, 磷酸酶活性属于急速下降状态。
2.3 污染物去除率与酶活性的相关性
表 6中的数据表明, 各湿地模型的脲酶活性与总氮去除率具有显著的相关性, 两者之间的相关系数为0.903—0.980, 与高锰酸盐去除率没有显著的相关性。表 7中的数据显示, 各湿地模型的磷酸酶活性与总磷去除率没有显著的相关性, 与高锰酸盐去除率总体上具有显著相关性。
3 讨论
3.1 各湿地模型水质净化的比较分析
图 2显示, 随着湿地的运行, 对于总氮、铵态氮、亚硝态氮和正磷酸盐的去除率总体呈现“低-高-低”的趋势, 对于总磷和高锰酸盐的去除率随着运行则逐渐降低。人工湿地系统对氮的去除主要由物理作用、化学作用和生物作用3种途径协同作用, 其中生物作用起到主要作用, 生物作用包括微生物作用和植物的吸收[24,25]。微生物的硝化和反硝化作用的去氮量能够占人工湿地系统总去氮量的80%左右[26], 是人工湿地去除氮的主要途径, 相关研究也证实了这一结果[27,28]。这能够解释本实验湿地模型对亚硝态氮的去除率最高的原因。总氮、铵态氮和亚硝态氮的去除与水温、溶解氧、营养水平和微生物等有直接关系, 湿地运行初期主要受系统中营养水平的影响, 此时适宜的水温非常适合微生物的活动, 但是小型湿地系统的有机物负荷较小和植物移植后生长并不稳定, 导致总氮、铵态氮和亚硝态氮去除率较低; 随着湿地系统的运行, 有机物负荷增加, 植物生长逐渐稳定, 总氮、铵态氮和亚硝态氮去除率逐渐增加, 9月8号去除率达到最高; 运行后期, 水温成为总氮、铵态氮和亚硝态氮最主要的限制因素, 此时水温大幅度下降, 不适合微生物活动, 硝化和反硝化等作用受到抑制,导致总氮、铵态氮和亚硝态氮去除率下降。此结果与赵晶等[9]具有相似之处。
人工湿地对磷的去除途径有物理吸附、化学吸附与沉淀和生物作用, 其中物理吸附和化学吸附与沉淀是主要的去除途径[29]。养殖水体中的总磷主要包括有机磷和无机磷等。湿地运行初期, 基质的孔隙度较大, 物理吸附和化学吸附与沉淀能力较强, 总磷去除率较高, 随着湿地的运行, 基质孔隙度越来越小, 物理吸附和化学吸附与沉淀能力越来越小, 总磷的去除率也就越来越小。高锰酸盐去除率是人工湿地对养殖水体中有机物质去除的重要指标, 它的去除原理和总磷的去除原理相似, 去除率也呈现逐渐下降的趋势。正磷酸盐的去除则是主要通过植物和微生物的吸收累积, 水温和营养水平是正磷酸盐去除率变化的主要因素, 去除原理与铵态氮相似, 呈现“低-高-低”的趋势。
根据图 2, 在5次采样中, 湿地模型X5-X6对污染物的去除率基本上都比X1-X4高, 其中, 总氮去除率平均高3%, 氨氮去除率平均高10%, 亚硝态氮去除率平均高10%, 总磷去除率平均高15%, 正磷酸盐去除率平均高20%, 高锰酸盐去除率平均高8%。结合表 1中湿地模型的植物和基质组成, 可能的原因是单一的植物和单一的基质组成的小型湿地模型对污染物的去除率容易受外界环境因素的影响。这能够说明, 在相同种植数量的情况下, 两种植物混合种植的湿地模型对于污染物的去除率更高, 也更加稳定。郭萧等[30]研究也证实多种植物配制的人工湿地对污染物的去除率比单一植物要更高。X1-X4对污染物的去除率变化没有呈现一定的规律, 而X5-X6对污染物的去除率相差较小。本实验中的基质在小型湿地模型净水效果中的作用不是非常显著, 可能的原因是两种基质的孔隙度相似, 但是基质在总磷去除、为微生物和植物根系提供附着面等方面具有十分重要的作用。
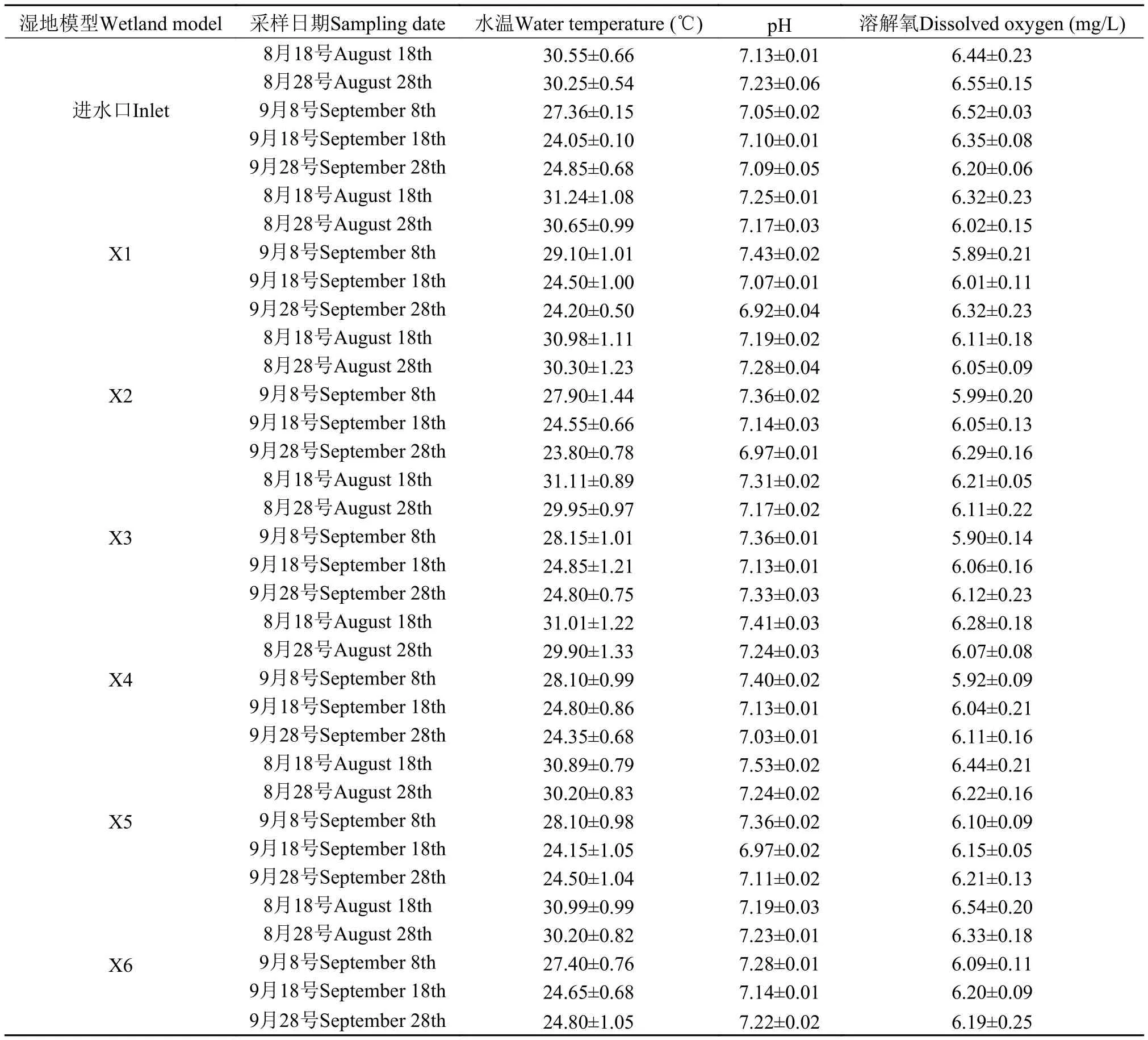
表 3 进水口和各湿地模型温度、pH和溶解氧值Tab. 3 Measurements of water temperature, pH and dissolved oxygen of inflow water in each wetland model
3.2 湿地模型中脲酶和磷酸酶活性变化分析
脲酶活性的变化主要与水温、表层溶解氧、微生物活动等有关。湿地运行初期, 适宜的水温促进了微生物的大量繁殖, 氮素营养水平也在逐渐增加, 微生物的数量逐渐增加, 微生物分泌脲酶的能力也在逐渐增加, 导致酶活性逐渐增加; 9月18日之后, 水温的大幅度下降导致微生物繁殖速度下降,分泌脲酶的能力下降, 脲酶活性也随之下降。湿地的脲酶活性在同一采样时间没有显著差异性, 这可能与植物的根系分泌物有一定的关系。有研究表明, 植物根系分泌物对湿地微生物群落有显著的影响[31]。由于根系分泌物组成成分的原因, 导致六组湿地模型中能够分泌脲酶的微生物数量相似, 致使湿地的脲酶活性在同一采样时间没有显著差异性。
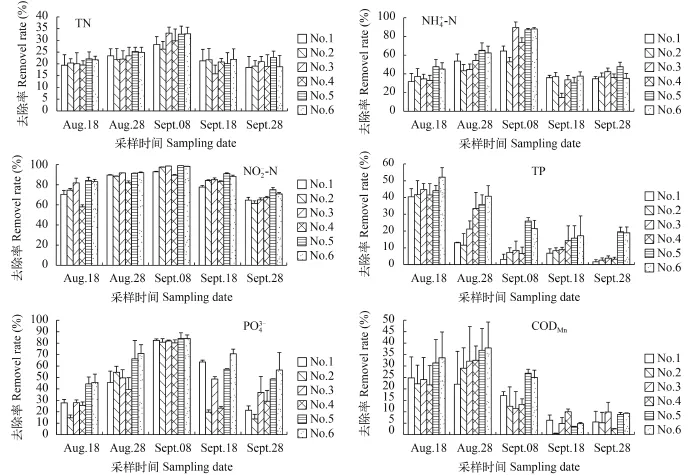
图 2 各小型湿地模型对总氮、铵态氮、亚硝态氮、总磷、正磷酸盐、高锰酸盐的去除率Fig. 2 Removal rate of TN,-N,-N, TP,and CODMnin wetland models

表 4 湿地模型脲酶活性变化Tab. 4 Changes of urease activities in wetland models [mg(NH3-N)/(24h·1 g)]
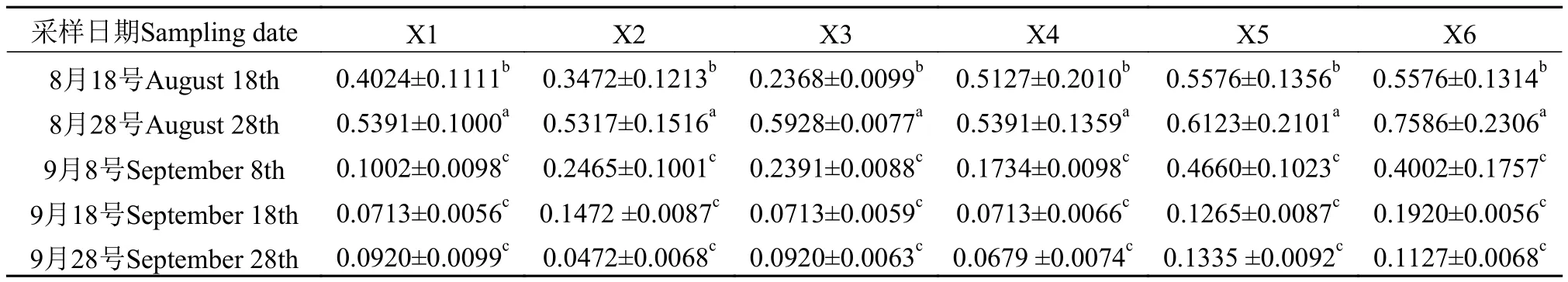
表 5 湿地模型磷酸酶活性变化Tab. 5 Changes of phosphatase activities in wetland models [mg(C6H6O)/(24h·1 g)]
磷酸酶活性与水温、溶解氧、底物浓度水平和微生物活性有直接的关系。湿地运行初期, 适宜的水温促进了微生物的大量繁殖, 磷素营养水平逐渐增加, 微生物的数量逐渐增加, 微生物分泌磷酸酶的能力也在逐渐增加, 导致酶活性逐渐增加; 9月8号磷酸酶活性的急速下降, 可能与反应底物的有机磷含量下降有直接的关系; 9月18号之后水温大幅度下降, 磷酸酶活性下降与脲酶活性下降原理相似。磷酸酶活性在同一采样时间, 湿地模型X5-X6总体上大于X1-X4, 可能的原因是由于根系分泌物组成成分的影响, X5-X6中能够分泌磷酸酶的微生物数量多于其他小型湿地模型。
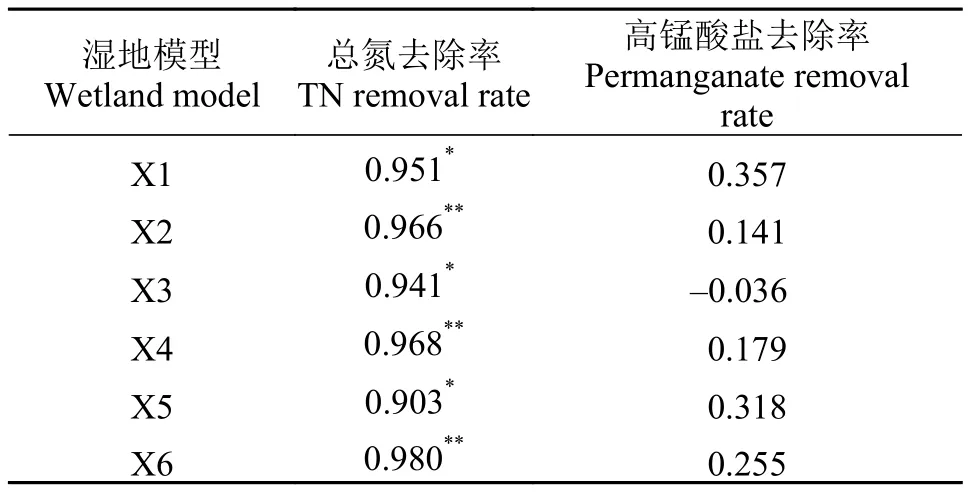
表 6 湿地模型脲酶活性与污染物去除率的相关系数Tab. 6 Correlation between urease activity and contaminants removal rate in wetland models
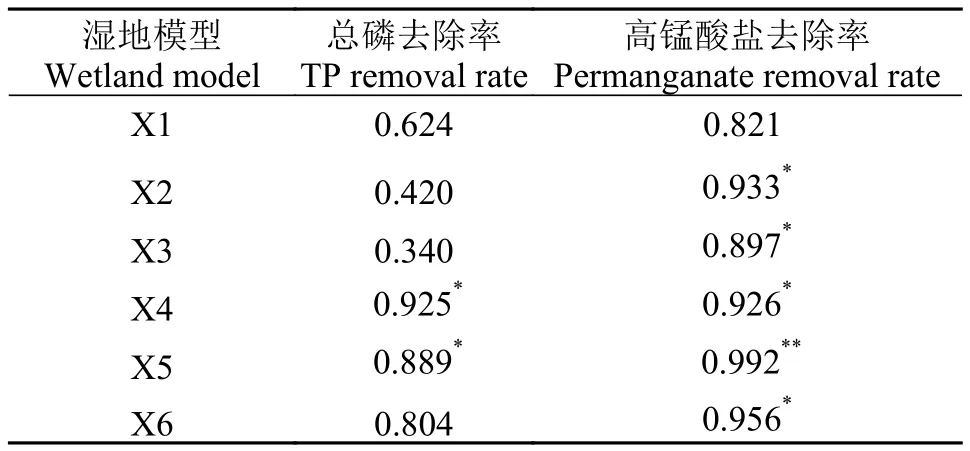
表 7 湿地模型磷酸酶活性与污染物去除率的相关系数Tab. 7 Correlation between phosphatase activity andcontaminants removal rate in wetland models
3.3 湿地模型的污染物去除率与酶活性的相关性比较分析
脲酶是一种酰胺酶, 能够酶促有机质分子中肽键的水解, 在本实验中, 可能是总氮中的有机氮比例较高, 致使脲酶活性与总氮去除率有着显著的相关性。高锰酸盐去除率是人工湿地对养殖水体中有机物质去除的重要指标, 虽然有机氮在总氮中的比例较高, 但是有机氮在总有机物质中的比例可能较低, 致使高锰酸盐指数与脲酶活性显著性并不高。此结果与梁威等[1]研究的相似。说明脲酶可作为判定人工湿地去除养殖水体中总氮效能的指标。
这说明磷酸酶不是人工湿地去除总磷的最重要途径, 上文也提到磷去除的最主要途径是物理化学吸附。根据磷酸酶是酶促有机磷分解的生理特性, 可能的原因是本实验养殖水体中含磷的有机物在总有机物中的比例较大。此结果与岳春雷等[32]研究结果相似。说明磷酸酶可作为判定人工湿地去除养殖水体中高锰酸盐效能的指标。
4 结论
(1) 湿地模型对亚硝态氮的去除率最高, 对高锰酸盐的去除率最低, 对于总氮、铵态氮、亚硝态氮和正磷酸盐的去除率总体呈现“低-高-低”的趋势, 对于总磷和高锰酸盐的去除率随着运行则逐渐降低, 湿地模型X5-X6对养殖水体的净水效果总体上高于模型X1-X4; (2) 湿地模型中的脲酶活性和磷酸酶活性整体呈现“低-高-低”的趋势, 同一采样时间各湿地模型中的脲酶没有显著差异, 但是湿地模型X5-X6中的磷酸酶活性总体上高于模型X1-X4,本试验中, 湿地模型的脲酶活性与总氮去除率具有显著的相关性, 脲酶可作为判定人工湿地中去除养殖水体中总氮效能的指标, 湿地模型的磷酸酶活性与高锰酸盐去除率总体上具有显著相关性, 磷酸酶可作为判定人工湿地中去除养殖水体中高锰酸盐效能的指标; (3) 人工湿地系统具有净水效果好和环境友好等优点, 已被应用于工业废水、生活废水和农业废水的处理。同样, 人工湿地与养殖池塘相结合形成的循环水养殖系统对于养殖水体净化、鱼类病害防控和水产品质量安全等都具有良好的作用。人工湿地中的植物和基质的选择, 应该在保证净水效果良好的前提下, 体现节本增效。另外,人工湿地面积与养殖池塘面积应按照最适比例构建循环水养殖系统, 而系统的最适配比还需要深入研究。
[1]Liang W, Wu Z B, Zhou Q H, et al. Relationship between the phosphatase and urease activities in plant root-zone and purification of wastewater in the integrated vertical constructed wetland [J]. Plant Physiology Communications, 2002, 38(6): 545—548 [梁威, 吴振斌, 周巧红, 等.复合垂直流构建湿地植物根区磷酸酶及脲酶活性与污水净化的关系. 植物生理学通讯, 2002, 38(6): 545—548]
[2]Li G G, TU X X, Wang P E, et al. Influence of freshwater discharge on zooplankt community distribution in the mudflat wetlands of the hangzhou bay [J]. Acta Hydrobiologica Sinica, 2013, 37(3): 397—404 [李共国, 屠霄霞,王佩儿, 等. 淡水排放对杭州湾湿地浮游动物群落分布的影响. 水生生物学报, 2013, 37(3): 397—404]
[3]Liu W S, Xiao J G, Lin Q P, et al. Using planted constructed wetlands to treat wastewaters from circulating aquaculture of Clarias fuscus [J]. Acta Hydrobiologica Sinica, 2008, 32(1): 33—37 [刘文生, 肖建光, 林齐鹏,等. 人工湿地对胡子鲇养殖水体循环净化的研究 (英文). 水生生物学报, 2008, 32(1): 33—37]
[4]Liu D, Wu X, Chang J, et al. Constructed wetlands as biofuel production systems [J]. Nature Climate Change, 2012, 2(3): 190—194
[5]Wu X L. Mechanism of wetland treatment in constructed wetland [J]. Environment Science, 1995, 16(3): 83—86 [吴晓磊. 人工湿地废水处理机理. 环境科学, 1995, 16(3): 83—86]
[6]Liu D, Ge Y, Chang J, et al. Constructed wetlands in China: recent developments and future challenges [J]. Frontiers in Ecology and the Environment, 2008, 7(5): 261—268
[7]Greenway M. Suitability of macrophytes for nutrient removal from surface flow constructed wetlands receiving secondary treated sewage effluent in Queensland, Australia [J]. Water Science and Technology, 2003, 48(2): 121—128
[8]Chen C G, Wang X, Qi J Y. Application and study advances of artificial wetland technology in foreign [J]. China Water & Wastewater, 2003, 19(12): 105—106 [陈长太, 王雪, 祁继英. 国外人工湿地技术的应用及研究进展. 中国给水排水, 2003,19(12): 105—106]
[9]Zhao J, Zhao H P, Xu L F, et al. Analysis of water purification efficiency of integrated constructed wetland in drinking water supply reservoir [J]. Chinese Journal of Environmental Engineering, 2013, 7(12): 4816—4822 [赵晶, 赵和平, 许良峰, 等. 复合人工湿地对水源地库区水质净化效果分析. 环境工程学报, 2013, 7(12): 4816—4822]
[10]Zhu H Y, Zhou M, Liu X. Application of Artificial Wetland Technology in Rural Water Pollution Control [C]. Advanced Materials Research. Trans Tech Publications. 2014, 717—720
[11]Wang J P, Cui Z G, Zhou Q, et al. Removal effect of mariculture wastewater and analysis of microbial communities in constructed wetlands [J]. Progress in Fishery Sciences, 2014, 35(6): 1—9 [王加鹏, 崔正国, 周强, 等.人工湿地净化海水养殖外排水效果与微生物群落分析.渔业科学进展, 2014, 35(6): 1—9]
[12]Farzadkia M, Ehrampoush M H, Abouee Mehrizi E, et al. Investigating the efficiency and kinetic coefficients of nutrient removal in the subsurface artificial wetland of Yazd wastewater treatment plant [J]. Environmental Health Engineering and Management Journal, 2015, 2(1): 23—30
[13]Li L F, Nian Y G, Jiang G M. Macrophytes in constructed wetland for wastewater treatment [J]. Environment Pollution & Control, 2006, 28(8): 616—620 [李林锋, 年跃刚, 蒋高明. 人工湿地植物研究进展. 环境污染与防治, 2006, 28(8): 616—620]
[14]Tang X Q, Li J Z, Li X J, et al. Comparison between performance of pollutant removal by different packings in constructed wetland [J]. Technology of Water Treatment, 2007, 33(5): 45—48 [汤显强, 李金中, 李学菊, 等. 人工湿地不同填料去污性能比较. 水处理技术, 2007, 33(5): 45—48]
[15]Jing Y X, Yang D J, Chen Z H, et al. Growth characteristics and sewage purifying effect of amphibious banyan in constructed wetland [J]. Acta Ecologica Sinica, 2003, 23(3): 614—619 [靖元孝, 杨丹菁, 陈章和, 等. 两栖榕在人工湿地的生长特性及其对污水的净化效果. 生态学报, 2003, 23(3): 614—619]
[16]Bolton K G E, Greenway M. Pollutant removal capability of a constructed Melaleuca wetland receiving primary settled sewage [J]. Water Science and Technology, 1999, 39(6): 199—206
[17]Hu H B, Zhou H M, Wang G Z, et al. Mining explosives sewage was treated by constructed wetland [J]. Environmental Science & Technology, 1997, (3): 17—18 [胡焕斌, 周化民, 王桂珍, 等. 人工湿地处理矿山炸药污水.环境科学与技术, 1997, (3): 17—18]
[18]Haberl R, Perfler R, Mayer H. Constructed wetlands in Europe [J]. Water Science and Technology, 1995, 32(3): 305—315
[19]Bankston J L, Sola D L, Komor A T, et al. Degradation of trichloroethylene in wetland microcosms containing broad-leaved cattail and eastern cottonwood [J]. Water Research, 2002, 36(6): 1539—1546
[20]Jin X C, He K, Lu S Y, et al. Adsorption effect of ammonia by four fillings [J]. Journal of Lake Sciences, 2008, 20(6): 755—760 [金相灿, 贺凯, 卢少勇, 等. 4种填料对氨氮的吸附效果. 湖泊科学, 2008, 20(6): 755—760]
[21]Zhang X W, Li F M, Lu L, et al. The adsorption properties of ten CW substrates on phosphorus [J]. Technology of Water Treatment, 2014, 40(3): 49—52 [张修稳, 李锋民, 卢伦, 等. 10 种人工湿地填料对磷的吸附特性比较.水处理技术, 2014, 40(3): 49—52]
[22]Li J, Pan Y. Environmental factors affect magnetite magnetosome synthesis in Magnetospirillum magneticum AMB-1: implications for biologically controlled mineralization [J]. Geomicrobiology Journal, 2012, 29(4): 362—373
[23]Guan S Y. Soil Enzyme and Method [M]. Beijing: Agriculture Press. 1986, 294—311 [关松荫. 土壤酶及其研究法. 北京:农业出版社. 1986, 294—311]
[24]Dierberg F E, DeBusk T A, Jackson S D, et al. Submerged aquatic vegetation-based treatment wetlands for removing phosphorus from agricultural runoff: response to hydraulic and nutrient loading [J]. Water Research, 2002, 36(6): 1409—1422
[25]Verhoeven J T A, Meuleman A F M. Wetlands for wastewater treatment: opportunities and limitations [J]. Ecological Engineering, 1999, 12(1): 5—12
[26]Constructed Wetlands and Aquatic Plant Systems for Municipal Wastewater Treatment [M]. US Environmental Protection Agency, Office of Research and Development. 1988
[27]Bai J H, Ouyang H, Deng W, et al. A review on nitrogen transmission processes in natural wetlands [J]. Acta Ecologica Sinica, 2005, 25(2): 326—333
[28]Lu S Y, Zhang P Y, Yu G, et al. Stabilization pond-plant bed composite system treatment of farmland irrigation and drainage water [J]. China Environmental Science, 2004, 24(5): 605—609
[29]Lu S Y, Jin X C, Yu G. Phosphorus removal mechanism of constructed wetland [J]. Ecology and Environment, 2006, 15(2): 391—396 [卢少勇, 金相灿, 余刚. 人工湿地的磷去除机理. 生态环境, 2006, 15(2): 391—396]
[30]Guo X, Xiong F, Zhao A N, et al. Effect of plant disposition on purification efficiency of surface flow wetlands [J]. Environment Pollution & Control, 2010, (5): 57—60 [郭萧, 熊飞, 赵安娜, 等. 植物配置对表层流湿地净化效果的影响研究. 环境污染与防治, 2010, (5): 57—60]
[31]Lu S L, Zhang C, Xu J W. Root exudates of wetland plants and the influence on the microbial community in constructed wetlands [J]. Ecology and Environmental Sciences, 2011, 20(4): 676—680 [陆松柳, 张辰, 徐俊伟. 植物根系分泌物分析及对湿地微生物群落的影响研究.生态环境学报, 2011, 20(4): 676—680]
[32]Yue C L, Chang J, Ge Y, et al. Spatial distribution of enzymatic activity in substrate of constructed wetland and its correlation with purification of wastewater [C]. Lake Protection and Ecological Civilization—Paper of Fourth Forum on China Lake. 2014 [岳春雷, 常杰, 葛滢, 等. 复合垂直流人工湿地基质酶活性及其与水质净化效果之间的相关性. 湖泊保护与生态文明建设—第四届中国湖泊论坛论文集. 2014]
THE COMPARATIVE ANALYSIS OF THE SUBSTRATE ENZYME ACTIVITY AND WATER PURIFICATION EFFECT IN DIFFERENT WETLAND MICROCOSM
WANG Lin1, LI Bing1,2, YU Jia-Hui1, ZHU Jia-Bin1and ZHU Jian1,2
(1. Wuxi Fisheries College Nanjing Agricultural University, Wuxi 214081, China; 2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Wuxi 214081, China)
The aim of current research was to determine the most efficient model for water purification, by studying different combinations of plants and matrixes and related enzyme activities (urease and phosphatase) in small wetland models. Two types of plants: Zizania latifolia and Sagittaria graminea, and two types of matrixes: garnet and magnetite were used to construct six different wetland models. Within a wetland system, the quality of inflow and outflow water and the matrix enzyme activities were measured. The results indicated the wetland models have the highest removal rate of nitrite nitrogen, ranging between 98.87% and 58.06%, and the lowest removal rate of CODMn, ranging between 37.91% and 2.51%. Compared with the single plantation model, combination of both plant species yielded a synergy effect in improving water quality, evident by the increased average removal rates of total nitrogen (by 3%), ammonia nitrogen (by 10%), nitrite (10%), total phosphorus (15%), orthophosphate (20%), and CODMn(8%). This effect was independent of the use of matrix. The filter material urease activity was highly correlated with the total nitrogen removal rate (r2: 0.903—0.980), whereas phosphatase activity was highly correlated with the CODMnremoval rate (r2: 0.821—0.992). Hence, urease and phosphatase can be used as predictors of the total content of nitrogen and CODMn, respectively, in a wetland system. This research provides a theoretical basis in optimal selection of wetland plants and matrixes and in evaluation of water purification effect by assessing substrate enzyme activities.
Wetland model; Water purification effect; Urease activity; Phosphatase activity; Correlation coefficient
X832
A
1000-3207(2017)03-0692-08
10.7541/2017.87
2016-06-06;
2016-07-27
“十二·五”国家科技支撑计划项目(2012BAD25B07); 中央级公益性科研院所基本科研业务费专项(2015JBFM24); 国家大宗淡水鱼类产业技术体系项目(nyeytx-46)资助 [Supported by the National “Twelfth Five-Year” Plan for Science & Technology Support (2012BAD25B07); National Nonprofit Institute Research Grant of Freshwater Fisheries Research Center, CAFS (2015JBFM24); the Projects of National Technology System for Conventional Freshwater Fish Industries (nyeytx-46)]
王林(1993—), 男, 安徽滁州人; 硕士研究生; 主要从事水产健康养殖工作。E-mail: 1501532221@qq.com
朱健, 男, 研究员; 主要从事水产健康养殖研究。E-mail: zhuj@ffrc.cn

