99份小麦地方品种抗白粉病种质发掘及其分子鉴定
张小辉,畅志坚,乔麟轶,郭慧娟,詹海仙,李欣,任永康,任文斌,张晓军
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院作物科学研究所,作物遗传与分子改良山西省重点实验室,山西太原030031;3.山西省农业科学院棉花研究所,山西运城044000)
99份小麦地方品种抗白粉病种质发掘及其分子鉴定
张小辉1,畅志坚2,乔麟轶2,郭慧娟2,詹海仙2,李欣2,任永康2,任文斌3,张晓军2
(1.山西大学生物工程学院,山西太原030006;2.山西省农业科学院作物科学研究所,作物遗传与分子改良山西省重点实验室,山西太原030031;3.山西省农业科学院棉花研究所,山西运城044000)
利用国内白粉菌流行小种E09和E20分别对收集到的99份小麦农家种及地方品种进行了苗期抗性鉴定,共筛选出10份兼抗2个小种的材料,其中对2个小种均达到高抗以上的材料有6份,分别为028079、石家庄8号、菏泽2号、复壮30、冀麦2号和白齐麦。利用抗白粉病基因Pm21,Pm52,PmLK906和PmLX66对99份材料进行了分子检测,结果发现,复壮30、菏泽2号分别含有Pm5E和Pm52,台中23和成都秃头含有PmLK906,其余材料均未检测到上述抗白粉病基因,也未见有含抗白粉病基因的报道。这6份材料可以作为有效抗源应用于小麦抗病育种中。
小麦;地方品种;抗白粉病;种质资源;分子鉴定
由专化型寄生真菌小麦白粉菌(Blumeria graminis f.sp.tritici)侵染引起的小麦白粉病是我国小麦主产区的常见真菌病害之一,其中以黄淮麦区、北部冬麦区为害尤为严重,年发病面积高达600万~800万hm2[1],是影响小麦产量增加、品质改善的重大疾病。培育和种植抗病品种是防治小麦白粉病为害的有效措施[2],但随着矮秆、高密等高产品种的普及,单一品种的大规模产业化发展,加速了白粉菌生理小种的变异,致使原有的抗病基因迅速丧失抗性[3]。因此,不断发掘与利用抗白粉病品种,筛选和鉴定出更多的抗白粉病基因,拓宽小麦育种中抗白粉病基因来源,进一步推进小麦的抗病分子育种工作,做到抗白粉病基因的合理布局,是我国小麦抗病育种重要的研究内容[4]。
本研究利用国内白粉菌流行小种E09和毒性最强的小种E20对作物遗传与分子改良山西省重点实验室收集的99份小麦农家种及地方品种进行苗期接种鉴定,并利用E09对其进行成株期接种鉴定,评价其抗性表现;利用生产上起主要作用的抗白粉病基因连锁标记对所选种质资源进行分子标记检测。根据抗病鉴定与分子标记检测结果,发掘仍然有效的优质抗源及抗病新基因,旨在为小麦抗病育种提供参考。
1 材料和方法
1.1 供试材料
供试小麦材料为99份小麦农家种及地方品种,由山西省农业科学院谷子研究所张俊灵研究员提供,作物遗传与分子改良山西省重点实验室保存。小麦白粉菌E09,E20小种由中国农业科学院植物保护研究所段瑕瑜、周益林研究员提供,以高感白粉病小麦品系SY95-71活体繁菌保存。感病对照及病菌诱发材料均为SY95-71,由成都电子科技大学杨足君教授惠赠。抗病对照品种分别为杨麦21、良星99、良星66和兰考906,均为目前我国小麦主产区大面积推广品种。
1.2 试验方法
1.2.1 白粉病抗性鉴定白粉病抗性鉴定采用苗期人工接菌鉴定法,在山西省农业科学院作物科学研究所人工气候培养室内进行,分别接种白粉菌E09和E20小种。
将99份试验材料与对照品种于2015年10月播种于72穴育苗盘内,每份材料播种2穴,每穴5粒,共10粒。感病对照均匀种植在每盘的4个角以及中间穴内。培养室温度18℃,湿度70%,光照强度为10 000 lx,光照时间14 h/d。待鉴定材料生长至1叶1心,且第1叶片完全展开时,用喷雾器适当喷湿幼苗,采用扫抹法分别接种白粉菌小种E09和E20的新鲜孢子,第2天重复接种一次。接种10~15 d后,当感病对照SY95-71充分发病时,调查记载其苗期抗性。抗病反应型根据叶片侵染严重度分为6个级别,分别为0(免疫)、0;(过敏性坏死)、1(高抗)、2(中抗)、3(中感)和4(高感),其中,0~2级为抗病型,3~4级为感病型[5]。
1.2.2 抗病基因的分子标记检测供试材料采用SDS法[6]提取基因组DNA。用于鉴定与筛选抗病基因的分子标记分别采用目前我国生产上起主要作用的抗白粉病基因Pm21,Pm52,PmLK906和PmLX66的连锁标记,所用引物由上海生物工程技术服务有限公司(上海生工)合成,引物序列列于表1。
PCR扩增在PTC-200型热循环仪(MJ Research,美国)上进行。PCR反应体系(15 μL)为:1.5 μL 10×PCR buffer,0.15 mmol/L dNTP,0.75 U Taq酶,0.25 μmol/L引物和50 ng模板DNA。PCR扩增程序:94℃预变性3min;94℃变性1min,退火45s,每对引物的退火温度参考表1,72℃延伸1min,共35个循环;72℃延伸5 min。扩增产物用8%非变性聚丙烯酰胺凝胶电泳进行分离,经硝酸银染色后观察照相。

表1 用于抗白粉病基因检测的分子标记
2 结果与分析
2.1 白粉病苗期抗性鉴定
利用国内白粉菌流行小种E09和E20分别对99份小麦农家种及地方品种进行苗期抗性鉴定,结果表明,只对E09小种表现为抗性(IT=0~2级)的材料共有22份,占全部材料的22.22%。其中,表现为免疫(IT=0)和近免疫(IT=0;)的材料有8份,高抗的(IT=1)有4份,中抗的(IT=2)有10份,其余77份均中感或高感E09小种。只对E20小种表现为抗性的材料共有16份,占全部材料的16.16%。其中,表现为免疫和近免疫的材料有5份,高抗的有4份,中抗的有7份,其余83份均中感或高感E20小种。对E09和E20均表现为抗性的材料共有10份,占全部材料的10.1%。但同时对2个小种均表现为免疫或近免疫的材料仅有4份,分别为复壮30、石家庄8号、028079和菏泽2号。对E09和E20均表现为感病的材料共有71份,占全部材料的71.72%。感病对照品种SY95-71对2个小种均表现为高感(IT=4)。抗病对照品种除兰考906分别表现为高抗和中抗以外,其余3个品种(杨麦21、良星99和良星66)均表现为免疫(表2)。
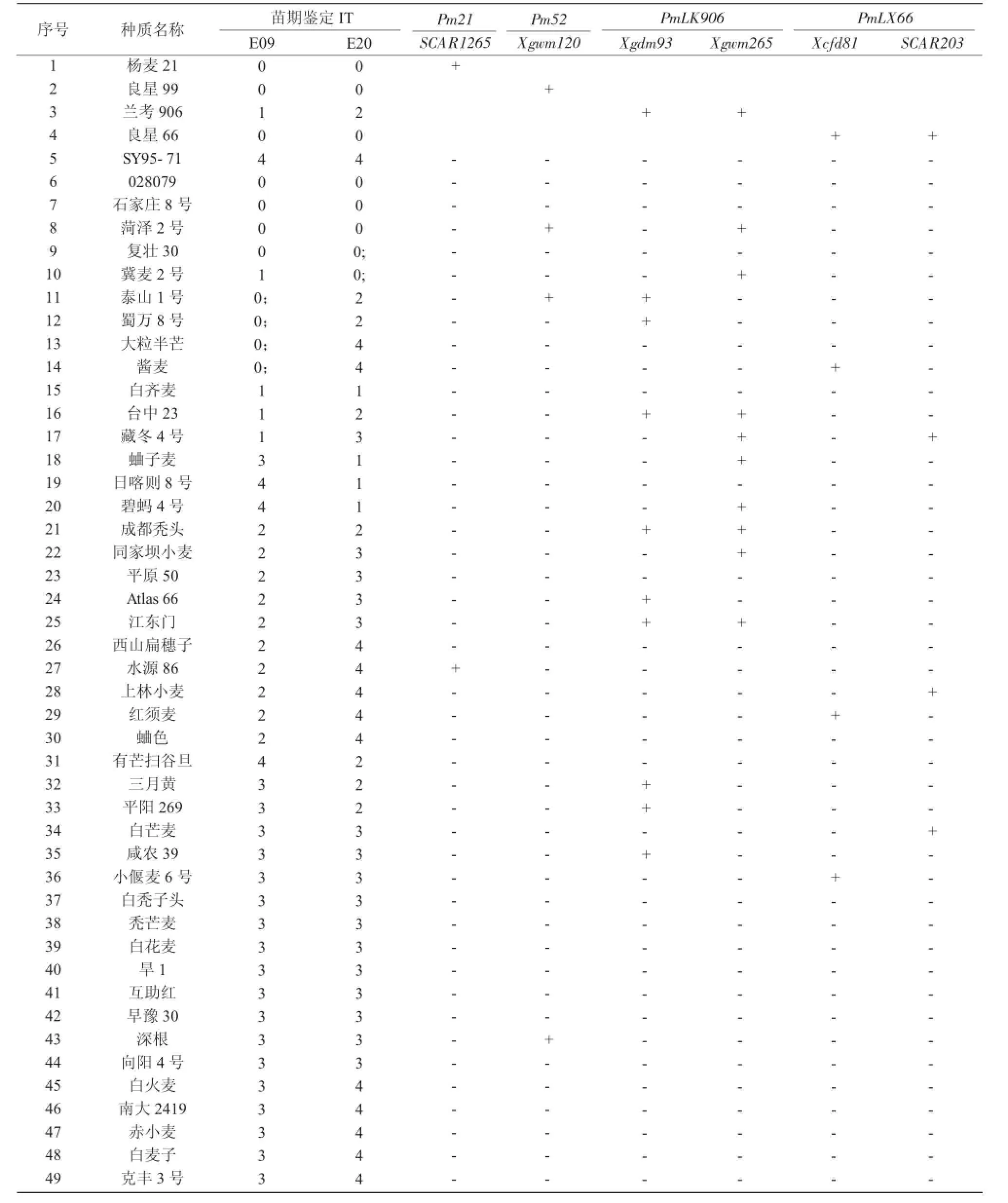
表299 份小麦种质对E09,E20的抗性表现及标记检测

续表2
2.2 抗病基因连锁标记的分子鉴定
2.2.1 Pm21的分子标记检测以杨麦21作为阳性对照,用刘志勇等[7]开发的SCAR标记SCAR1265对99份供试材料进行检测,结果发现,仅在水源86上能够扩增出相应的1 265 bp的特异片段(图1),在其他材料上均未能扩增出相应的条带。由此可见,除水源86外,其余98份材料中均不含有Pm21基因。而水源86对E09表现为中抗,对E20表现为高感,根据Pm21对白粉病的抗性表现,水源86含有Pm21的可能性也较小。
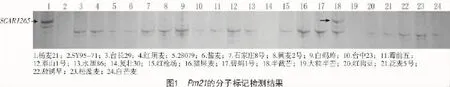
2.2.2 Pm52的分子标记检测利用与Pm52[8]紧密连锁的分子标记Xgwm120进行PCR扩增,以良星99作为阳性对照,结果发现,在99份材料中,有8份材料可以扩增出和Pm52连锁的特异性条带(图2),分别为丰产3号、济南2号、鲁麦19、菏泽2号、泰山1号、汉中白、深根和敦化春化,其中,菏泽2号对E09和E20都具有良好的抗性,泰山1号近免疫E09,对E20则表现为中抗,这2份材料中可能含有Pm52基因;其余6份材料对E09和E20则表现为中感或高感,都不含有该基因,表现为假阳性。

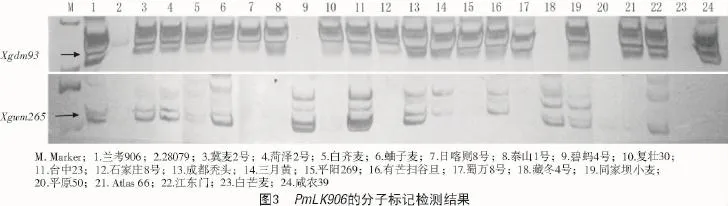
2.2.3 PmLK906的分子标记检测以兰考906为阳性对照,利用与PmLK906[9]紧密连锁的分子标记Xgdm93和Xgwm265对99份材料进行了检测,其中,利用Xgdm93可以在泰山1号、台中23、成都秃头、三月黄、平阳269、蜀万8号、Atlas 66、江东门和咸农39等9份材料中扩增出与PmLK906连锁的特异性条带,利用Xgwm265可以在冀麦2号、菏泽2号、蛐子麦、碧蚂4号、台中23、成都秃头、藏冬4号、同家坝等8份材料中扩增出与PmLK906连锁的特异性条带(图3)。Xgdm93和Xgwm265都能扩增出特异性条带的材料为台中23和成都秃头,这2份材料对E09和E20都表现为高抗或中抗,表明这2份材料可能含有PmLK906基因,其余材料虽然也能表现一定的抗性,但其中含有PmLK906基因的可能性较小。
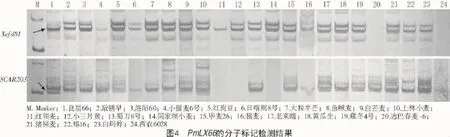
2.2.4 PmLX66的分子标记检测以良星66为阳性对照,利用与PmLX66[10]连锁的分子标记Xcfd81和SCAR203对99份材料进行PCR扩增,其中,利用Xcfd81可以在小偃麦6号、红须麦、酱麦等3份材料中扩增出约300 bp的特异性条带;利用SCAR203可以在白芒麦、上林小麦、老来瞎、藏冬4号、边巴春麦-6、猪屎麦等6份材料中扩增中约203 bp的特异性条带(图4)。这9份材料中,除酱麦对E09表现为近免疫、对E20则高感,藏冬4号对E09高抗、对E20中感外,其余7份材料对2个小种均表现为中感或高感,且Xcfd81和SCAR203的特异性条带并未在酱麦和藏冬4号中同时出现,表明这2份材料虽然对E09具有抗性,但其中含有PmLX66的可能性较小,其可能含有其他抗性基因,其余7份材料均不含有抗白粉病基因PmLX66。
3 结论与讨论
3.1 地方品种在小麦品种改良中的作用
我国具有悠久的小麦种植历史,在长期驯化栽培过程中,形成了多种多样的小麦地方品种及农家栽培品种[11]。据考证,我国拥有1.3万多份在品质、抗病等方面具有地方特色的小麦农家种及地方品种资源,具有丰富的遗传多样性,同时也蕴含着大量的抗病基因源[12],具有世界上许多国家不可比拟的资源优势。HUANG等[13]从我国农家品种复壮30中发现了小麦抗白粉病基因Pm5E;XUE等[14]从地方品种齿牙糙中发现并定位了抗白粉病基因Pm24;MA等[15]利用我国小麦品种Yingbo 700鉴定出了PmYB,位于等位基因Pm2的染色体区域,具有广谱抗性,对来自我国不同地区的48个白粉菌株均表现抗性。望水白对小麦赤霉病具有良好抗性,是当前抗性最好的赤霉病抗源之一[16]。尽管国际上已在64个等位基因位点正式命名了50个小麦抗白粉病基因(Pm1~Pm50)[17],但由于白粉菌小种毒性增长快、变异频率高,许多白粉病基因已在我国主要麦区逐渐减弱甚至丧失抗性[18],失去其应用价值。因此,充分发掘和利用小麦地方品种及农家栽培品种中的有益基因资源对于现代小麦抗病育种及遗传改良具有重要意义。
3.2 抗白粉病基因Pm21,Pm52,PmLK906和PmLX66的分子检测
本试验使用的4个抗白粉病基因载体品种对白粉菌小种E09和E20,除兰考906对2个小种分别表现为高抗和中抗外,其余3个品种(杨麦21、良星99和良星66)均表现为免疫。供试的99份材料中,共筛选出10份兼抗2个小种的材料,其中对2个小种均达到高抗以上抗性的材料有6份,分别为28079、石家庄8号、菏泽2号、复壮30、冀麦2号和白齐麦,除复壮30中含有抗白粉病基因Pm5E外,其余材料中未见到含有抗白粉病基因,且未见有报道。Pm21分子标记均未在这10份材料中检测到其特异性条带,仅在水源86上扩增出相应的1 265 bp的特异片段,而水源86对E09表现为中抗,对E20表现为高感。由于供试的99份材料均为经过长期驯化栽培的地方品种[19],而Pm21是齐莉莉等[20]于1995年利用远缘杂交从簇毛麦中导入的抗白粉病基因,其虽具有较好的抗性,但作为抗病亲本应用于小麦育种时间尚短,因此,认为水源86中并不含有Pm21,其所扩增出的条带应为假阳性。
Pm52分子标记检测结果显示,在8份材料中可以扩增出和Pm52连锁的特异性条带,但只有菏泽2号和泰山1号对E09和E20表现出良好抗性,因此,推测这2份材料中可能含有Pm52基因,其余6份材料由于中感或高感白粉病,都不含有该基因。其原因可能是由于分子标记Xgwm120与Pm52连锁距离较远,单个标记检测的准确性不高。与PmLK906连锁的2个分子标记Xgdm93和Xgwm265都能在台中23和成都秃头2个材料中扩增出特异性条带,而这2份材料对E09和E20都表现为高抗或中抗,与兰考906的抗性结果基本一致,表明这2份材料都含有PmLK906基因。而与Pm-LX66连锁的分子标记Xcfd81和SCAR203并未能在同一材料中同时扩增出特异性条带,虽然酱麦和藏冬4号分别对E09和E20有较好的抗性,但其含有PmLX66的可能性较小。
综上所述,本试验所检测的99份材料中,有6份对白粉菌小种E09和E20表现出良好抗性,分别为28079、石家庄8号、菏泽2号、复壮30、冀麦2号和白齐麦;泰山1号、蜀万8号、大粒半芒、酱麦、台中23、藏冬4号等6份材料仅对E09表现出较好抗性,蛐子麦、日喀则8号、碧蚂4号等3份材料仅对E20表现出较好抗性。其中,复壮30含有Pm5E,菏泽2号含有Pm52,另外台中23和成都秃头含有PmLK906,其余材料则可能含有未公布的新抗病基因。由于28079、石家庄8号、菏泽2号、复壮30、冀麦2号和白齐麦具有良好抗性,而且它们都不含有其他不良性状,故可作为优良亲本应用于小麦抗病育种。
[1]赵紫慧,黄江,陆鸣,等.山东省和河北省小麦白粉菌毒性与遗传多样性分析[J].作物学报,2013,39(8):1377-1385.
[2]张晶,曹远银,程艳辉,等.小麦白粉病生防菌株的筛选及其防效的初步研究[J].河南农业科学,2011,40(6):97-99.
[3]杨作民,唐伯让,沈克全,等.小麦抗病育种的战略问题:小麦对锈病、白粉病第二线抗源的建立和应用[J].作物学报,1994,20(4):385-394.
[4]刘红彦,王俊美,高素霞,等.河南省农科院小麦抗白粉病基因研究进展[J].河南农业科学,2009(9):109-113.
[5]盛宝钦.用反应型记载小麦苗期白粉病[J].植物保护,1988(1):49.
[6]侯丽媛,乔麟轶,张晓军,等.抗条锈病基因YrCH5026的遗传分析及分子定位[J].华北农学报,2015,30(5):7-15.
[7]刘志勇,孙其信,李洪杰,等.小麦抗白粉病基因Pm21的分子鉴定和标记辅助选择[J].遗传学报,1999,26(6):673-682.
[8]ZHAO Z,SUN H,SONG W,et al.Genetic analysis and detection of the gene PmLX99 on chromosome 2BLconferringresistance topowdery mildew in the wheat cultivar Liangxing 99[J].Theor Appl Genet,2013,126(12):3081-3089.
[9]NIU J S,JIA H Y,YIN J,et al.Development of an STS marker linked to powdery mildewresistance genes PmLK906 and Pm4a by gene chip hybridization[J].Journal of Integrative Agriculture,2010,9(3):331-336.
[10]HUANG J,ZHAO Z,SONG F,et al.Molecular detection of a gene effective against powderymildewin the wheat cultivar Liangxing66 [J].Molecular Breeding,2012,30(4):1737-1745.
[11]刘三者,郑殿升.中国小麦选育品种与地方品种的遗传多样性[J].中国农业科学,2000,33(4):104-105.
[12]刘爱峰,段友臣,程敦公,等.山东小麦种质资源品质特性多样性研究及利用[J].植物遗传资源学报,2012,13(4):515-528.
[13]HUANG X,WANG L,XU M,et al.Microsatellite mapping of the powderymildewresistance gene Pm5e,in common wheat(Triticum aestivum L.)[J].Theor Appl Genet,2003,106(5):858-865.
[14]XUE F,WANG C,LI C.Molecular mapping of a powdery mildew resistance gene in common wheat landrace Baihulu and its allelism with Pm24[J].Theor Appl Genet,2012,125(7):1425-1432.
[15]MA P,ZHANG H,XU H,et al.The gene PmYB,confers broad-spectrum powdery mildew resistance in the multi-allelic Pm2,chromosome region of the Chinese wheat cultivar Yingbo 700[J].Molecular Breeding,2015,35(5):1-10.
[16]廖玉才,余毓君.小麦地方品种望水白抗赤霉病性的遗传分析[J].华中农学院学报,1985,4(2):6-14.
[17]MWALE VM,CHILEMBWE E H C,ULUKOH C.Wheat powdery mildew(Blumeria graminis f.sp.tritici):Damage effects and genetic resistance developed in wheat(Triticum aestivum)[J].Int Res J Plant Sci,2014,5(1):1-16.
[18]吴先华,罗培高.小麦抗白粉病基因的定位及其在育种中的应用研究进展[J].中国农学通报,2006,22(5):346-351.
[19]赵宁娟,薛飞,王长有,等.小麦农家品种白葫芦抗白粉病基因的SSR分析[J].麦类作物学报,2010,30(3):411-414.
[20]齐莉莉,陈佩度,刘大钧,等.小麦白粉病新抗源——基因Pm21[J].作物学报,1995,21(3):257-262.
Germplasms Discovering and Molecular Identification from 99 Wheat Landraces with Powdery Mildew Resistance
ZHANGXiaohui1,CHANGZhijian2,QIAOLinyi2,GUOHuijuan2,ZHANHaixian2,LI Xin2,RENYongkang2,RENWenbin3,ZHANGXiaojun2
(1.College ofBio-engineering,Shanxi University,Taiyuan 030006,China;2.Institute ofCrop Sciences,Shanxi Academy ofAgricultural Sciences,Shanxi Province KeyLaboratoryofCrop Genetics and Molecular Improvement,Taiyuan 030031,China;3.Institute ofCotton,Shanxi AcademyofAgricultural Sciences,Yuncheng044000,China)
To discover more powdery mildew resistance germplasms and genes,seedling resistance identification for 99 wheat landraces were carried with Bgt races E09 and E20,respectively.Ten resistant varieties were found from them to both the two Bgt races. Among them,028079,Shijiazhuang 8,Heze 2,Fuzhuang 30,Jimai 2 and Baiqimai had a excellent resistance.Molecular identification was screened for the 99 wheat landraces with six linked molecular markers of four wheat powdery mildewresistance genes Pm21,Pm52, PmLK906 and PmLX66.Besides the Fuzhuang 30 contained Pm5E gene,we found that Heze 2 contained Pm52 gene,Taizhong 23 and Chengdututou contained PmLK906 gene.The other materials were not detected powdery mildewresistance genes,and reports containing these genes.Therefore,the sixwheat landraces can be used towheat powderymildewresistance breedingas effective resistance sources.
wheat;landrace;powderymildewresistance;germplasmresource;molecular identification
10.3969/j.issn.1002-2481.2017.05.05
S512.1
:A
:1002-2481(2017)05-0692-07
2016-12-12
国家重点研发计划(2016YFD0102004-07);山西省科技攻关项目(20150311001-1);山西省自然科学基金项目(201601D102051,201601D011001);山西省青年基金项目(2015021145);山西省农业科学院重点项目(YGG1602)
张小辉(1991-),男,山西孝义人,在读硕士,研究方向:小麦遗传育种。张晓军为通信作者。

