高密度CO2处理虾肌球蛋白形成凝胶的临界浓度与凝胶强度
刘书成,郭明慧,邓倩琳,刘 媛,刘蒙娜,吉宏武,毛伟杰,高 静
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研发中心,广东普通高校水产品深加工重点实验室,湛江524088)
高密度CO2处理虾肌球蛋白形成凝胶的临界浓度与凝胶强度
刘书成,郭明慧,邓倩琳,刘 媛,刘蒙娜,吉宏武,毛伟杰,高 静
(广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省海洋食品工程技术研发中心,广东普通高校水产品深加工重点实验室,湛江524088)
为了探讨高密度CO2(dense phase carbon dioxide,DPCD)诱导蛋白质形成凝胶的机制,以凡纳滨对虾肌球蛋白为研究对象,研究了DPCD处理压强、温度和时间对虾肌球蛋白形成凝胶的临界浓度和对虾肉糜凝胶强度的影响。研究结果表明:DPCD处理压强和温度对虾肌球蛋白溶液形成凝胶的临界浓度有显著影响,处理时间对肌球蛋白溶液形成凝胶的临界浓度无显著影响,但增加处理时间,可以形成更加紧实的凝胶。在40 ℃和5~30 MPa时虾肌球蛋白溶液形成凝胶的临界质量浓度为14 mg/mL,在50 ℃和5、10 MPa时虾肌球蛋白溶液形成凝胶的临界质量浓度为12 mg/mL,在50 ℃和15~30 MPa时虾肌球蛋白溶液形成凝胶的临界质量浓度为11 mg/mL,在60 ℃和5~30 MPa时虾肌球蛋白溶液形成凝胶的临界质量浓度为10 mg/mL。DPCD处理压强和温度对虾肉糜的凝胶强度也具有显著影响(P<0.05),且随着压强增加和温度升高,虾肉糜凝胶强度呈增加趋势(P<0.05);在50 ℃和25 MPa下处理虾肉糜20 min,形成的凝胶强度较好,达到了(14.28±0.57)N·mm。DPCD处理温度越高,虾肌球蛋白形成凝胶的临界浓度就越低,而虾肉糜形成凝胶的强度越高;DPCD处理压强越高,虽然对虾肌球蛋白形成凝胶的临界浓度影响较小,但能使虾肌球蛋白和虾肉糜形成凝胶的强度增加。从分析中还可以推断,DPCD低压(5~10 MPa)诱导虾肉糜形成凝胶主要是热效应的作用,DPCD较高压强(>10 MPa)诱导虾肉糜形成凝胶是热和CO2分子效应的共同作用。研究结果为进一步阐明DPCD诱导蛋白质形成凝胶的机制提供了基础数据。
压强;蛋白;凝胶化;高密度CO2;临界浓度;肌球蛋白
刘书成,郭明慧,邓倩琳,刘 媛,刘蒙娜,吉宏武,毛伟杰,高 静. 高密度CO2处理虾肌球蛋白形成凝胶的临界浓度与凝胶强度[J]. 农业工程学报,2017,33(7):295-301.doi:10.11975/j.issn.1002-6819.2017.07.039 http://www.tcsae.org
Liu Shucheng, Guo Minghui, Deng Qianlin, Liu Yuan, Liu Mengna, Ji Hongwu, Mao Weijie, Gao Jing. Least gelation concentration and gel strength of myosin fromLitopenaeus vannameiinduced by dense phase carbon dioxide[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(7): 295-301. (in Chinese with English abstract)doi:10.11975/j.issn.1002-6819.2017.07.039 http://www.tcsae.org
0 引 言
肌球蛋白是动物肌肉组织中含量最高的蛋白质,它具有较强的凝胶形成能力。肌球蛋白形成凝胶的能力与很多因素密切相关,如蛋白质质量浓度、离子强度、pH值、肌肉类型和品质、处理方式、食品添加剂等[1-3]。其中,蛋白质质量浓度是影响肌球蛋白形成凝胶的一个非常重要的因素。一般来说,蛋白质质量浓度越高,其形成凝胶的能力越大,其质构特性也越好。当蛋白质质量浓度较低时,即使采用高强度的处理条件,蛋白质也可能不会形成凝胶;但随着蛋白质质量浓度的增加,分子间的距离变小,蛋白质分子内部和蛋白质分子间的相互作用增强,形成凝胶的能力就大大增强,其凝胶强度也大大增加[1-6]。已有研究表明:在热诱导肌球蛋白形成凝胶过程中,蛋白质质量浓度对其凝胶强度和保水性的影响是线性的,其原因可能是高浓度肌球蛋白形成的纤维会相互交织成一个紧密的立体网状结构[7]。
凡纳滨对虾(Litopenaeus vannamei)是中国对虾养殖产量最高的品种,因肉质鲜美和营养丰富而深受消费者的喜爱,除了鲜食之外,主要用于冷冻加工,产品形式单一。近年来,对虾即食调理食品受到消费者和研究者的关注,而虾肉丸和虾肉肠是虾类高附加值即食调理的重要产品之一。目前,虾肉丸和虾肉肠的生产已具有机械化的连续生产线,但是虾肉蛋白形成凝胶的技术仍然是采用传统的热诱导,而热处理会损失较多的其色、香、味、功能性及营养等成分。高密度CO2(dense phase carbon dioxide,DPCD)技术是一种非常有前景的非热食品加工技术,最初应用于食品的杀菌和钝酶,但在研究中发现一定强度的DPCD处理也能使食品的蛋白质发生变性[8-11],甚至使蛋白质形成凝胶[12-16]。本课题组前期研究表明:DPCD能够诱导凡纳滨对虾肉糜形成凝胶,而且制备凝胶的感官特性、营养特性、微观结构和质构特性等都显著优于热诱导的[16]。为了阐明DPCD诱导虾肉糜形成凝胶的机制,本研究以凡纳滨对虾肌球蛋白为对象,探讨DPCD处理压强、温度和处理时间对肌球蛋白形成凝胶的临界浓度和虾肉糜凝胶强度的影响,为利用DPCD开发优质的肉类凝胶制品奠定理论基础。
1 材料与方法
1.1 材 料
凡纳滨对虾(Litopenaeus vannamei),规格50~60 尾/kg,购于湛江霞山东风水产批发市场,保活运至实验室。用自来水清洗后,选取完整、大小均一个体,去头、去壳、去肠腺,待用。胶原蛋白肠衣(直径20 mm),购于河北保定天泰肠衣食品有限公司。
1.2 试剂与仪器
试剂:Lowry法蛋白质含量测定试剂盒购于上海荔达生物科技有限公司;5-三磷酸腺苷二钠盐(adenosine triphosphate,ATP)、二硫代苏糖醇(DL-dithiothreitol,DTT)、牛血清蛋白标准购于广州市齐云生物技术有限公司;碘盐,市售;其他化学试剂均为分析纯。CO2气体纯度为99.9 %,购于湛江氧气厂。
仪器与设备:HA221-50-10-C型超临界装置(南通华安超临界萃取有限公司),UX2200H电子天平(日本岛津仪器有限公司),HH-8数显恒温水浴箱(常州澳华仪器有限公司),PHS-25数显pH计(上海精密科学仪器有限公司雷磁仪器厂),CR22GⅡ型高速冷冻离心机(日本日立公司),UV-2550型紫外可见分光光度计(岛津仪器(苏州)有限公司),AUY220型分析天平(日本岛津仪器有限公司),TMS-Pro型物性分析质构仪(美国FTC公司)等。
1.3 试验方法
1.3.1 肌球蛋白的提取
肌球蛋白的提取参考文献[17]。采用改良Lowery法[18]测定蛋白质浓度。
1.3.2 高密度CO2处理
间歇式DPCD处理流程参考文献[19]。
1.3.3 形成凝胶临界浓度的测定
形成凝胶临界浓度的测定参考文献[20-21],并稍有改动。将提取的肌球蛋白溶液用缓冲溶液稀释成不同浓度梯度(1、2、3、4、5、6、7、8、9、10、11、12、13、14 mg/mL),分别取10 mL置于平底小杯中,利用DPCD处理一定时间,取出后放置至室温,随后将小杯倒置,观察杯内肌球蛋白溶液的流动情况。具有固定的形态且不随小杯的倾斜而流动,则认为在该浓度下可形成凝胶。据此判断虾肌球蛋白在不同DPCD处理条件下形成凝胶的临界浓度(C0)。设常压 CO2处理和水浴热处理作为对照组。
DPCD处理组:首先,考察压强和温度对肌球蛋白形成凝胶临界浓度的影响。依据前期研究结果[8],设定温度水平为30、40、50、60 ℃,压强水平为5、10、15、20、25、30 MPa,处理时间为30 min。其次,考察压强和时间对肌球蛋白形成凝胶临界浓度的影响。依据上一试验结果,确定处理温度为50 ℃,肌球蛋白浓度为14 mg/mL,压强水平为5、15、25 MPa,处理时间水平为5、10、20、 30 min。采用双因素等重复试验设计。
常压CO2处理组:将样品放置在DPCD处理釜中,密封,打开进出处理釜的阀门,维持1 min,将处理釜中的空气排出后,关闭进出处理釜的阀门,使处理釜压强维持在0.1 MPa。温度水平为30、40、50、60 ℃,处理时间30 min。
水浴热处理组:将样品放置到恒温水浴中进行处理,温度水平为30、40、50、60℃,处理时间30 min。
1.3.4 虾肉糜凝胶的制备
虾肉糜凝胶制备流程参考文献[16]。试验设常压CO2处理和水浴热处理作为对照组。DPCD凝胶化:依据前面的试验结果,设定温度水平为40、50、60 ℃,压强水平为5、10、15、25 MPa,处理时间20 min,采用双因素等重复试验设计。常压CO2凝胶化:保持处理釜在0.1 MPa,温度分别为40、50、60 ℃,处理时间20 min。热诱导凝胶化:水浴温度水平为40、50、60 ℃,处理时间20 min。
1.3.5 凝胶强度的测定
凝胶强度测定参考文献[16]。
1.3.6 数据处理
每个试验测定3次,数据用平均值±标准差表示。用JMP10.0软件进行方差分析(ANOVA)和Tukey’s HSD法多重比较以及作图。
2 结果与分析
2.1 压强和温度对虾肌球蛋白形成凝胶临界浓度的影响
从图1可以看出,对于水浴热处理组,30和40 ℃都不能使虾肌球蛋白形成凝胶;而 50和 60 ℃均能使14 mg/mL的虾肌球蛋白溶液形成凝胶。热诱导肌球蛋白形成凝胶分两步:第一步是由于原生态蛋白质受热发生变性而使肽链展开;第二步是展开的蛋白质因聚合作用而形成较大分子的凝胶体[22]。凡纳滨对虾肌球蛋白的变性温度为42.8 ℃[23]。当处理温度低于42.8 ℃时,肌球蛋白未发生变性而不能形成凝胶;当处理温度高于 42.8 ℃时,肌球蛋白发生热变性展开,再聚合后形成有序三维网状结构的凝胶。黄鸿兵等[24]在低于40 ℃下处理兔骨骼肌肌球蛋白,蛋白质变性凝聚程度也较低,而当温度高于40 ℃时,蛋白质逐渐变性而聚集,并且随着温度的升高聚合程度增加。
对于常压CO2处理组,30和40 ℃也不能使虾肌球蛋白形成凝胶;而50 ℃可使13 mg/mL的肌球蛋白溶液形成凝胶,60 ℃可使12 mg/mL肌球蛋白溶液形成凝胶,并且该临界浓度低于水浴热处理的。这说明常压 CO2处理不仅有热效应,而且还可能存在 CO2与蛋白质的相互作用。常压 CO2与蛋白质相互作用主要是酸碱相互作用,因为蛋白质中含有碱性氨基酸(精氨酸、赖氨酸、组氨酸),而CO2溶于水形成碳酸[25]。
对于DPCD处理组,30 ℃不能使虾肌球蛋白形成凝胶。这是因为30 ℃低于凡纳滨对虾肌球蛋白的变性温度42.8 ℃,热效应较弱;虽然在 30 ℃下压强从 5上升到30 MPa,CO2在水中的溶解度从 24.65增加到35.72 dm3/kg[26],但是由于CO2溶于水后形成H2CO3,酸性较弱,仅靠 CO2作用难以使蛋白质发生较大程度的变性。40 ℃ DPCD处理能使14 mg/mL虾肌球蛋白溶液形成凝胶,而40 ℃水浴热处理不能使虾肌球蛋白形成凝胶。这是因为在接近于虾肌球蛋白变性温度 42.8 ℃附近时,压强下 CO2的分子效应在其变性聚集过程中起了作用。在50 ℃时,5和10 MPa的压强能使12 mg/mL虾肌球蛋白溶液形成凝胶,15~30 MPa的压强能使11 mg/mL虾肌球蛋白溶液形成凝胶。随着处理压强增加,虾肌球蛋白形成凝胶的临界浓度下降。这是因为压强增加,CO2在水中的溶解度增加,增强了 CO2与肌球蛋白的相互作用。在60 ℃时,5~30 MPa的压强均能使10 mg/mL虾肌球蛋白溶液形成凝胶。在相同处理压强下,从 40升高到60 ℃,虾肌球蛋白形成凝胶的临界浓度从14 mg/mL降低到10 mg/mL。这是因为温度升高,热效应使肌球蛋白变性加剧而有利于发生聚集形成凝胶体。

图1 高密度CO2(DPCD)处理温度和压强对肌球蛋白形成凝胶临界浓度的影响Fig.1 Effect of temperature and pressure of dense phase carbon dioxide (DPCD) on least gelation concentration of myosin
以上分析可知,DPCD在诱导虾肌球蛋白形成凝胶的过程中既存在温度效应也存在 CO2的分子效应,其中温度对虾肌球蛋白形成凝胶的临界浓度的影响较大,压强的影响较小;温度和压强之间存在一定的协同作用。DPCD要诱导虾肌球蛋白形成凝胶,其处理温度必须大于40 ℃,处理压强大于5 MPa即可。陈亚励[27]用动态流变学研究凡纳滨对虾肌球蛋白的凝胶形成能力,发现DPCD处理压强为5 MPa时可使肌球蛋白形成弹性较好的凝胶。李玉娜等[13]也发现在常温下5 MPa的DPCD处理即可使全蛋液形成凝胶。Floren等[14]发现6 MPa和40 ℃的DPCD处理即可使蚕丝蛋白形成特性较好的凝胶。Rao等用10 MPa和50或60 ℃的DPCD处理15min制备了羊肉肠凝胶[15]。这与本研究的结果基本一致。
2.2 压强和时间对虾肌球蛋白形成凝胶临界浓度的影响
从图2可以看出,当虾肌球蛋白质量浓度为14 mg/mL和处理温度为50 ℃时,水浴热处理5 min即可形成凝胶。常压CO2处理需要20 min以上才可以形成凝胶。这是由于在短时间内常压CO2溶于水形成的弱酸具有缓冲作用,对蛋白质具有保护作用,使蛋白质变性聚集需要更多的处理时间。利用DPCD处理5 min即可形成凝胶,并随处理压强增加和时间的延长,形成的凝胶质构更加紧实(见图3)。李玉娜等[13]在常温下用DPCD处理全蛋液,随着压强升高和处理时间延长,全蛋液凝胶强度呈增加趋势,在15 MPa处理25 min时,全蛋液的凝胶强度最大。Thiering等[28]用CO2处理大豆蛋白,处理20 min时蛋白质形成了较小的聚集体,当处理时间从20增加到60 min时,蛋白质颗粒直径急剧增大,蛋白质形成较大的聚集体。这是因为随着DPCD处理时间的延长,CO2与蛋白质的相互作用充分,蛋白质变性和聚集加剧,更容易形成致密的三维网状结构。

图2 DPCD处理压强和时间对肌球蛋白形成凝胶临界浓度的影响Fig.2 Effects of pressure and time of DPCD on least gelation concentration of myosin

图3 在50 ℃处理20 min时肌球蛋白形成凝胶的形态Fig.3 Gel formation of myosin treated at 50 ℃ for 20 min
2.3 DPCD处理对虾肉糜凝胶强度的影响
从图4可以看出,对于水浴热处理和常压CO2处理,温度对虾肉糜凝胶强度均有显著影响(P<0.05),60 ℃时凝胶强度最大;相同处理温度下,水浴热处理和常压CO2处理的虾肉糜凝胶强度之间无显著差异(P>0.05),这说明2组处理均为热诱导形成的凝胶,常压CO2是不能诱导虾肉糜形成凝胶的。这与图1中常压CO2在50和60 ℃分别能诱导13和12 mg/mL虾肌球蛋白溶液形成凝胶存在矛盾之处,主要是因为图 1的试验对象为肌球蛋白溶液,常压 CO2可以溶于水溶液中与肌球蛋白相互作用,而图4的试验对象为虾肉糜,常压CO2仅能与表面的蛋白质相互作用,难以渗透进入虾肉糜与内部的蛋白质相互作用。
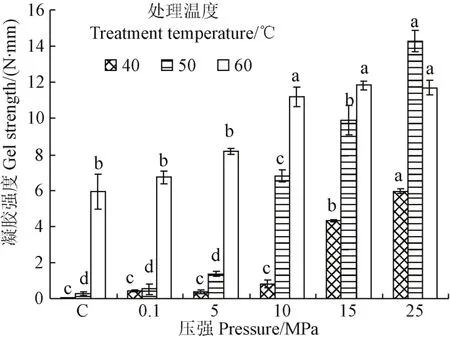
图4 DPCD对虾肉糜凝胶强度的影响Fig.4 Effect of DPCD on gel strength of shrimp surimi
对于DPCD处理,在相同处理温度下,随着DPCD处理压强增加,虾肉糜的凝胶强度呈增加的趋势(P<0.05);50 ℃和25 MPa处理的虾肉糜凝胶强度最大,达到了(14.28±0.57) N·mm。其原因有2个方面:1)随着压强升高,CO2在水中的溶解度是增加的[26]。虾肉糜含有80%左右的水分,压强升高会使更多的CO2溶解于虾肉糜中,单位质量的虾肉糜在高压强下能够接触到更多的CO2分子,增强CO2与虾肉蛋白的相互作用;2)高压强下 CO2的扩散速度增加,能快速渗入到虾肉糜中。这两方面的共同作用使较高压强 CO2诱导虾肉糜形成凝胶的强度更大。
当DPCD处理压强为5~15 MPa时,虾肉糜凝胶强度均随温度升高而显著增加(P<0.05)。从理论上分析,在固定压强下,随着温度升高,CO2在水中的溶解度是下降的;在固定的温度变化范围内,随着压强升高,CO2在水中溶解度的减量是显著减小的[26]。因此,温度升高引起的 CO2在水中溶解度的下降不足以减弱 CO2与肌球蛋白的相互作用,造成凝胶强度的下降,相反温度升高产生的热效应具有增强凝胶强度的作用。当处理压强为25 MPa时,从40升高到50 ℃,虾肉糜凝胶强度是显著增加的(P<0.05),而从50升高到60 ℃,虾肉糜凝胶强度反而下降(P<0.05)。25 MPa下从40 ℃升高到60 ℃,CO2在水中溶解度的变化较小。因此,从 40到 50 ℃虾肉糜凝胶强度显著增加主要是热效应引起的,而从 50到 60 ℃虾肉糜凝胶强度下降可能是因为虾肉糜中存在一种碱性蛋白酶(最适温度为60 ℃)降解了虾肉糜凝胶,出现凝胶劣化现象[29]。虽然DPCD具有钝酶作用,但是 DPCD对该碱性蛋白酶的影响还有待进一步研究。
不同处理诱导虾肉糜形成的凝胶外观见图5。从图5可以看出,在40 ℃处理20 min,水浴热处理和常压CO2处理的虾肉糜凝胶成型较差,而DPCD处理的虾肉糜凝胶成型较好;在50和60 ℃处理20 min,所有处理的虾肉糜凝胶成型均较好,但是DPCD处理的色泽比水浴热处理和常压 CO2处理的更加鲜亮,这与本课题组前期的研究结果一致[30]。
图5 在40、50、60 ℃下处理20 min虾肉糜形成凝胶的形态Fig.5 Gel formation of shrimp surimi treated for 20 min at 40, 50, 60 ℃
由以上分析可以推断,DPCD低压(5~10 MPa)诱导虾肉糜形成凝胶可能主要是热效应的作用,而 CO2的诱导作用较弱;DPCD较高压强(>10 MPa)诱导虾肉糜形成凝胶可能是由热效应和CO2的分子效应共同作用。
2.4 DPCD处理虾肌球蛋白形成凝胶的临界浓度与虾肉糜凝胶强度的关系
从表1可以看出,在相同DPCD处理压强下,温度越高,虾肌球蛋白形成凝胶的临界浓度就越低,而虾肉糜形成凝胶的强度越高;在40和60 ℃下,随着DPCD处理压强的升高,虽然虾肌球蛋白形成凝胶的临界浓度无变化,但是虾肉糜的凝胶强度呈增加趋势,这也与2.1中的结果相一致,即随处理压强升高,虾肌球蛋白会形成更加紧实的凝胶;在50 ℃下,DPCD处理压强从10升高到15 MPa,虾肌球蛋白形成凝胶的临界质量浓度从12降到11 mg/mL,这可能是因为50 ℃与虾肌球蛋白的变性温度(42.8 ℃)[23]比较接近,此时压强在 DPCD诱导虾肌球蛋白形成凝胶的过程中起了关键作用。

表1 DPCD处理条件下虾肌球蛋白形成凝胶的临界浓度与虾肉糜凝胶强度的关系Table1 Relation of least gelation concentration of shrimp myosin and shrimp surimi gel strength under DPCD treatment conditions
3 结 论
以凡纳滨对虾肌球蛋白为研究对象,探讨了 DPCD处理压强、温度和时间对虾肌球蛋白形成凝胶临界浓度和虾肉糜凝胶强度的影响,结论如下:
1)高密度CO2(dense phase carbon dioxide, DPCD)处理压强和温度对虾肌球蛋白溶液形成凝胶的临界浓度都有显著影响,处理时间对虾肌球蛋白溶液形成凝胶的临界浓度无影响,但增加处理时间,可以形成更加紧实的凝胶。对于 DPCD处理,在 40 ℃和压强大于 5 MPa时虾肌球蛋白溶液形成凝胶的临界浓度为14 mg/mL,在50 ℃和5、10 MPa时虾肌球蛋白溶液形成凝胶的临界质量浓度为12 mg/mL,在50 ℃和15~30 MPa时虾肌球蛋白溶液形成凝胶的临界质量浓度为11 mg/mL,在60 ℃和5~30 MPa时虾肌球蛋白溶液形成凝胶的临界质量浓度为10 mg/mL。
2)DPCD处理压强和温度对虾肉糜的凝胶强度具有显著的影响(P<0.05),且随着压强增加和温度升高,虾肉糜凝胶强度呈增加趋势(P<0.05);在50 ℃和25 MPa下处理虾肉糜 20 min,形成的凝胶强度较好,达到了(14.28±0.57)N·mm;DPCD诱导的虾肉糜凝胶外观优于热诱导的。
3)DPCD处理温度越高,虾肌球蛋白形成凝胶的临界浓度就越低,而虾肉糜形成凝胶的强度越高;DPCD处理压强越高,对虾肌球蛋白形成凝胶的临界浓度影响较小,但能使虾肌球蛋白和虾肉糜形成凝胶的强度增加。
研究结果为进一步阐明DPCD诱导蛋白质形成凝胶的机制提供了基础数据。
[1] 徐幸莲,周光宏,黄鸿兵,等. 蛋白质浓度、pH值、离子强度对兔骨骼肌肌球蛋白热凝胶特性的影响[J]. 江苏农业学报,2004,20(3):159-163. Xu Xinglian, Zhou Guanghong, Huang Hongbing, et al. Effects of protein concentration, pH value and ionic strength on heat-induced gel properties of myosin from rabbit skeletal muscle[J]. Jiangsu Journal of Agricultural Science, 2004, 20(3): 159-163. (in Chinese with English abstract)
[2] 刘海梅. 鲢鱼糜凝胶及形成机理的研究[D]. 武汉:华中农业大学,2007. Liu Haimei. Studies on Silver Carp Surimi Gel and Gel Forming Mechanism[D]. Wuhan: Huazhong Agricultural University, 2007. (in Chinese with English abstract)
[3] 韩敏义. 兔骨骼肌肌球蛋白浊度、溶解度及热诱导凝胶强度研究[D]. 南京:南京农业大学,2003. Han Minyi. Study on Turbidity, Solubility and Heat Induced Gelation Strength of Rabbit Skeletal Muscle[D]. Nanjing: Nanjing Agricultural University, 2003. (in Chinese with English abstract)
[4] 白云,钟国良,周光宏,等. 蛋白浓度对兔腰大肌肌球蛋白热凝胶特性的影响[J]. 食品科学,2009,30(21):83-86. Bai Yun, Zhong Guoliang, Zhou Guanghong, et al. Effect of protein concentration on heat-induced gel properties of myosin from rabbit psoas major muscles[J]. Food Science, 2009, 30(21): 83-86. (in Chinese with English abstract)
[5] Famelart M H, Chapron L, Piot M, et al. High pressure-induced gel formation of milk and whey concentrates[J]. Journal of Food Engineering, 1998, 36(2): 149-164.
[6] Camp J V, Huyghebaert A. High pressure-induced gel formation of a whey protein and haemoglobin protein concentrate[J]. LWT-Food Science and Technology, 1995, 28(1): 111-117.
[7] Ishioroshi M, Samejima K, Yasui T. Heat-induced gelation of myosin filaments at a low salt concentration[J]. Agricultural & Biological Chemistry, 2014, 47(12): 2809-2816.
[8] 闫文杰,崔建云,戴瑞彤,等. 高密度二氧化碳处理对冷却猪肉品质及理化性质的影响[J]. 农业工程学报,2010,26(7):346-350. Yan Wenjie, Cui Jianyun, Dai Ruitong, et al. Effects of dense phase carbon dioxide on quality and physical-chemical properties of chilled pork[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010, 26(7): 346-350. (in Chinese with English abstract)
[9] Xu D, Yuan F, Jiang J, et al. Structural and conformational modification of whey proteins induced by supercritical carbon dioxide[J]. Innovative Food Science & Emerging Technologies, 2011, 12(1): 32-37.
[10] Yan W, Xu B, Jia F, et al. The Effect of high-pressure carbon dioxide on the skeletal muscle myoglobin[J/OL]. Food and Bioprocess Technology, 2016, doi:10.1007/s11947-016-1747-5.
[11] Zhao F, Zhou L, Wang Y, et al. Role of peach proteins in juice precipitation induced by high pressure CO2[J]. Food Chemistry, 2016, 209(1): 81-89.
[12] 曲亚琳,张德权,饶伟丽,等. 高密度CO2对羊肉糜凝胶特性的影响[J]. 核农学报,2010,24(6):1226-1231. Qu Yalin, Zhang Dequan, Rao Weili, et al. Influence of dense phase CO2on gel properties of minced mutton[J]. Journal of Nuclear Agricultural Sciences, 2010, 24(6): 1226-1231. (in Chinese with English abstract)
[13] 李玉娜,迟玉杰,孙强. 高密度CO2对全蛋液功能性质的影响[J]. 食品与发酵工业,2012,38(8):88-92. Li Yuna, Chi Yujie, Sun Qiang. Effects of dense carbon dioxide on functional properties of liquid whole eggs[J]. Food and Fermentation Industries, 2012, 38(8): 88-92. (in Chinese with English abstract)
[14] Floren M L, Spilimbergo S, Motta A, et al. Carbon dioxide induced silk protein gelation for biomedical applications[J]. Biomacromolecules, 2012, 13(7): 2060-2072.
[15] Rao W, Li X, Wang Z, et al. Dense phase carbon dioxide combined with mild heating induced myosin denaturation, texture improvement and gel properties of sausage[J/OL]. Journal of Food Process Engineering. 2016, doi: 10.1111/ jfpe.12404.
[16] 屈小娟,刘书成,吉宏武,等. 高密度CO2诱导制备虾糜凝胶的特性[J]. 农业工程学报,2012,28(20):282-287. Qu Xiaojuan, Liu Shucheng, Ji Hongwu, et al. Gel properties of shrimp surimi induced by dense phase carbon dioxide[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(20): 282-287. (in Chinese with English abstract)
[17] Hwang G C, Watabe S, Hashimoto K. Changes in carp myosin ATPase induced by temperature acclimation[J]. Journal of Comparative Physiology B, 1990, 160(3): 233-239.
[18] Lowry O H, Rosebrough N J, Farr A L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275.
[19] 张良,刘书成,章超桦,等. 神经网络优化牡蛎的高密度CO2杀菌工艺[J]. 农业工程学报,2011,27(12):369-373. Zhang Liang, Liu Shucheng, Zhang Chaohua, et al. Optimization of oyster-associated bacteria inactivation by dense phase carbon dioxide based on artificial neural network[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(12): 369-373. (in Chinese with English abstract)
[20] Coffmann C W, García V V. Functional properties and amino acid content of a protein isolate from mung bean flour[J]. Journal of Food Technology, 1977, 12: 473-484.
[21] Peyrano F, Speroni F, Avanza M V. Physicochemical and functional properties of cowpea protein isolates treated with temperature or high hydrostatic pressure[J]. Innovative Food Science & Emerging Technologies, 2016, 33(1): 38-46.
[22] Ferry J D. Protein gels[J]. Advances in Protein Chemistry, 1948, 4: 1-78.
[23] 蓝尉冰. 凡纳滨对虾肌肉蛋白组成及其肉糜特性研究[D].湛江:广东海洋大学,2012. Lan Weibing. Study on the Muscle Protein Composition ofLitopenaeus vannameiand Its Meat Surimi Properties[D]. Zhanjiang: Guangdong Ocean University, 2012. (in Chinese with English abstract)
[24] 黄鸿兵,徐幸莲,周光宏. 兔骨骼肌肌球蛋白分子形成凝胶过程的负染观察[J]. 食品科学,2004,25(7):47-51. Huang Hongbin, Xu Xinglian, Zhou Guanghong. Observation of gel formation from rabbit striated muscle myosin molecules[J]. Food Science, 2004, 25(7): 47-51. (in Chinese with English abstract)
[25] Cundari T R, Wilson A K, Drummond M L, et al. CO2-formatics: How do proteins bind carbon dioxide[J]. Journal of Chemical Information & Modeling, 2009, 49(9): 2111-2115.
[26] IUPAC-NIST Solubility Data Series[EB/OL]. http:// http://srdata.nist.gov/solubility/index.aspx.
[27] 陈亚励. 高密度CO2对凡纳滨对虾肌球蛋白物理特性的影响[D]. 湛江:广东海洋大学,2015. Chen Yali. Effects of Dense Phase Carbon Dioxide on the Physical Properties of Myosin FromLitopenaeus vannamei[D]. Zhanjiang: Guangdong Ocean University, 2015. (in Chinese with English abstract)
[28] Thiering R, Hofland G, Foster N, et al. Carbon dioxide induced soybean protein precipitation: protein fractionation, particle aggregation, and continuous operation[J]. Biotechnology Progress, 2001, 17(3): 513-521.
[29] Eakpetch P, Benjakul S, Visessanguan W, et al. Autolysis of pacific white shrimp (Litopenaeus vannamei) meat: Characterization and the effects of protein additives[J]. Journal of Food Science, 2008, 73(2): 95-103.
[30] 屈小娟. 高密度CO2对凡纳滨对虾肌肉品质和蛋白质特性的影响[D]. 湛江:广东海洋大学,2013. Qu Xiaojuan. Effects of Dense Phase Carbon Dioxide on Muscle Quanlties and Protein Characteristics ofLitopenaens vannamei[D]. Zhanjiang: Guangdong Ocean University, 2013. (in Chinese with English abstract)
Least gelation concentration and gel strength of myosin fromLitopenaeus vannameiinduced by dense phase carbon dioxide
Liu Shucheng, Guo Minghui, Deng Qianlin, Liu Yuan, Liu Mengna, Ji Hongwu, Mao Weijie, Gao Jing
(College of Food Science and Technology,Guangdong Ocean University,Key Laboratory of Aquatic Products Processing and Safety,Guangdong Provincial Seafood Engineering Technology Research Center,Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang524088,China)
Dense phase carbon dioxide (DPCD), also known as high pressure carbon dioxide (HPCD), is a promising non-thermal food processing technology. DPCD was originally applied to inactivate microorganisms and enzymes in food. However, many researchers found that DPCD could induce some proteins associated with microorganism metabolism inactivation and the change of the secondary structure of enzyme protein when the food was treated by DPCD. Meanwhile, they also found that DPCD could induce some food protein inactivation. DPCD could not only improve the functional properties of protein but also induce protein to form gel. Our previous study results showed that DPCD could induce shrimp surimi to form gel and the microstructure and texture of gel were better than those induced by heat. Myosin is the key protein of forming gel for animal meat. Protein concentration is an important factor affecting myosin to form gel. Generally, the higher the protein concentration, the greater the ability of forming gel, and the better the texture of gel was. In order to clarify the mechanism of shrimp surimi forming gel induced by DPCD, we used myosin fromLitopenaeus vannameias the subject and researched the effects of DPCD treatment pressure, temperature and time on the least gelation concentration of myosin forming gel and gel strength of shrimp surimi. Firstly, myosin was extracted using the method of reference and the myosin solution with the concentration of 1-14 mg/mL was treated by DPCD, and the least gelation concentration of myosin forming gel was determined. Secondly, shrimp surimi gel was prepared by DPCD and the gel strength was determined using a TMS-PRO texture instrument. The study results were showed as follows: Treatment pressure and temperature of DPCD had a significant effect on the least gelation concentration of myosin forming gel. Though treatment time of DPCD had no significant effect on the least gelation concentration, myosin could form the firm gel by extending treatment time. The least gelation concentration of myosin forming gel was 14 mg/mL at 40 ℃ under the pressure of 5-30 MPa, 12 mg/mL at 50 ℃ under 5-10 MPa, 11 mg/mL at 50 ℃ under 15-30 MPa, and 10 mg/mL at 60 ℃ under 5-30 MPa. Treatment pressure and temperature of DPCD had a significant effect on gel strength of shrimp surimi (P<0.05), and gel strength of shrimp surimi increased with the treatment pressure and temperature increasing (P<0.05). The gel strength of shrimp surimi induced by DPCD was (14.28±0.57) N·mm at 50 ℃ under 25 MPa for 20 min. The higher the temperature of DPCD treatment, the lower the least gelation concentration of myosin was, and the higher the shrimp surimi gel strength was. The pressure of DPCD treatment had a little effect on the least gelation concentration of myosin, but the higher pressure could increase the gel strength of myosin and shrimp surimi. When DPCD induced the shrimp surimi to form gel at the lower pressure of 5-10 MPa, the heating effect was main and the molecular effect of carbon dioxide was weak. However, when DPCD induced the shrimp surimi to form gel at the higher pressure of above 10 MPa, the heating effect and the molecular effect of carbon dioxide were cooperative. The results will provide the basic data for clarifying the mechanism of forming gel induced by DPCD.
pressure; proteins; gelation; dense phase carbon dioxide; least gelation concentration; myosin
10.11975/j.issn.1002-6819.2017.07.039
TS254.4
A
1002-6819(2017)-07-0295-07
2016-07-12
2017-04-09
国家自然科学基金项目(31371801);广东省科技计划项目(2015A020209158);现代农业产业技术体系专项基金(CARS-47)。
刘书成,男,博士,教授,研究方向为水产品非热加工技术基础理论与应用。湛江 广东海洋大学食品科技学院,524088。
Email:Lsc771017@163.com

