“生物体维持pH稳定的机制”实验改进
马 玲 (北京第十二中学 北京 100071)
《普通高中生物课程标准》倡导探究性学习,发展学生的科学探究能力和科学素养。“个体水平的调节和稳态”内容比较抽象,恰当的实验探究能帮助学生更好地理解稳态。“生物体维持pH稳定的机制”实验选自人教版高中生物学必修3稳态与环境第1章第2节“内环境稳态的重要性”[1],其目的是通过比较自来水、缓冲液和生物材料在加入酸或碱后pH的变化,进一步解释生物体如何维持pH稳定。
在以往的实验教学中,学生的完成度不高,推测原因主要有以下几方面:若使用pH试纸测溶液pH,颜色不易区分,且要在6 s内读取以防褪色;而若使用pH计或pH传感器测量溶液pH,则学生需要学会相关仪器的使用方法、清洗和维护,而pH传感器读数灵敏,等待时间较长。综合以上因素,很难在1节课内完成多种实验材料的pH测定,并绘制曲线分析pH稳定的机制。
为了让学生从重复清洗、辩色困难中解脱,将精力更多地用于关注实验目的,分析实验结果,笔者设想“让溶液显色,且溶液的颜色随pH变化而呈现颜色梯度变化”,对原实验进行改进。
1 实验原理
在自来水、缓冲液和生物材料中加入混合酸碱指示剂显色,滴加一定滴数的酸或碱后,观察颜色变化,以此推断pH变化。通过比较三者的颜色变化情况,推测生物体如何维持pH稳定。
配制混合酸碱指示剂的方法[2]:
按表1的配方称取试剂后研磨均匀,用200 mL 95%酒精润湿并溶解,加150 mL蒸馏水稀释,用0.1 mol/L的NaOH溶液中和直至溶液显绿色,再加水至400 mL。其pH值为8.1。

表1 混合酸碱指示剂配方
表2显示pH 4~10范围内,溶液酸性不同,呈现不同的颜色。可将混合酸碱指示剂溶液直接加入待测液中观察颜色以测定pH,也可将试纸润湿后晾干制成pH试纸供测试时参考比色。
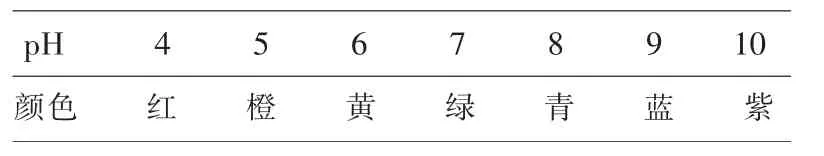
表2 混合酸碱指示剂显色范围
2 实验材料
0.1 mol/L NaOH(滴瓶)、0.1 mol/L HCl(滴瓶)、混合酸碱指示剂(滴瓶)、自来水、pH=7的磷酸盐缓冲液、生物材料(用5倍水稀释的蛋清溶液、用5倍水稀释的大白菜匀浆、用5倍水稀释的黄瓜去皮后匀浆等);50 mL锥形瓶、50 mL量筒、滴管。
3 实验步骤
1)绘制实验记录表。
表3 实验记录
2)取 6 个 50 mL 锥形瓶,标记为 1、2、3、4、5、6,分别向1、2号锥形瓶中加入25 mL自来水,3、4锥形瓶中加入25 mL磷酸盐缓冲液,5、6号锥形瓶中加入25 mL蛋清溶液。
3)分别向6个锥形瓶中滴入3滴混合酸碱指示剂,观察颜色并记录。
4)分别向 2、4、6号锥形瓶中滴加 0.1 mol/L HCl,1次加1滴,然后轻轻摇动。加入5滴后再记录颜色。重复该步骤直至加入30滴为止。将测定结果记入表中。
5)充分冲洗 2、4、6号 3个锥形瓶,并分别向其中加入与步骤2相同的25 mL自来水、25 mL磷酸盐缓冲液和25 mL蛋清溶液,并滴入3滴混合酸碱指示剂,观察颜色并记录。再如步骤4,逐滴加入0.1 mol/L NaOH,测定并记录颜色。
6)测试其他生物材料,可省略 1、2、3、4 号锥形瓶,其他步骤同上。
4 实验结果和结论
4.1 实验结果(表4)
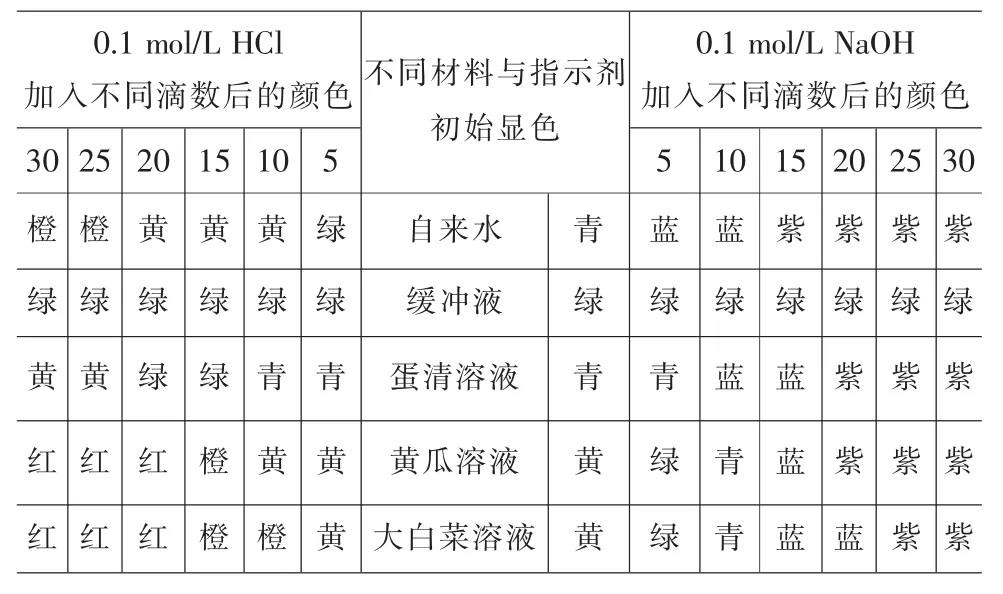
表4 实验记录
或记录颜色变化(表5)。
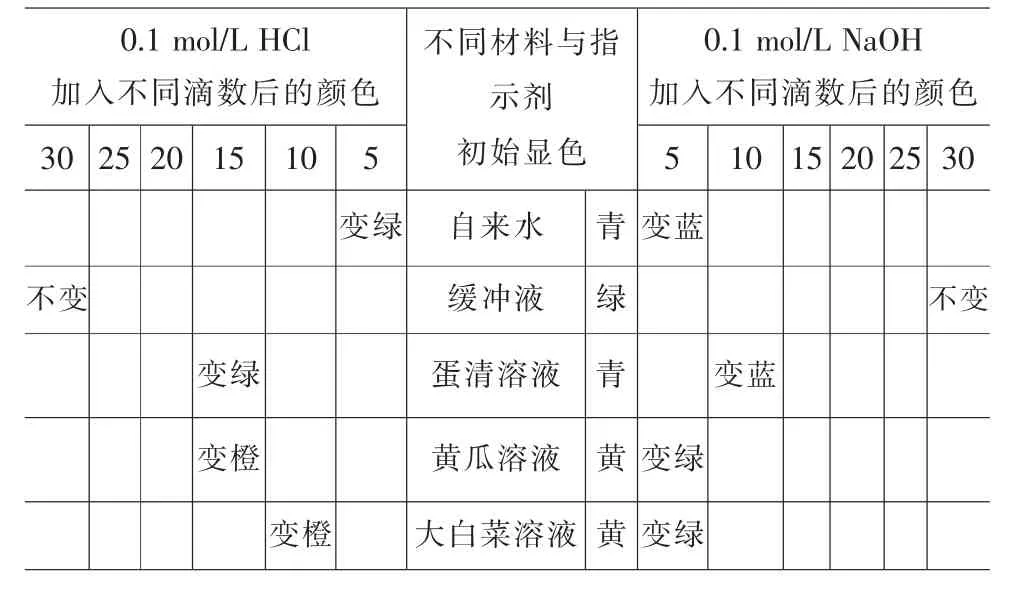
表5 颜色变化
自来水中加入混合酸碱指示剂后颜色呈青色。加入1滴HCl,颜色立即变绿,并随着滴加量的增加,颜色变化更加剧烈。而加入1滴NaOH后,溶液变蓝色,并随着滴加量的增加,颜色更深。
磷酸盐缓冲液中加入混合酸碱指示剂后颜色呈绿色。加入1滴HCl或NaOH后,颜色不变,直至加入30滴后,颜色基本不变。
蛋清溶液中加入混合酸碱指示剂后颜色呈青色。加入1滴HCl后,颜色不变,直至加入15滴后,颜色变绿。而加入1滴NaOH后,颜色不变,直至加入10滴NaOH后,颜色变蓝。
黄瓜溶液初始为浅黄色,加入混合酸碱指示剂后呈黄色。加入1滴HCl后,颜色不变,直至加入15滴后,颜色变为橙色。而加入1滴NaOH后,颜色不变,直至加入5滴NaOH后变绿。
大白菜溶液初始为浅黄色,加入混合酸碱指示剂后呈黄色。加入1滴HCl后,颜色不变,直至加入10滴后,颜色变为橙色。而加入1滴NaOH后,颜色不变,直至加入5滴NaOH后变绿。
4.2 结论 根据实验结果发现,加入HCl或NaOH后的生物材料pH的变化,更类似于缓冲液而不是自来水。不同生物材料的缓冲能力有差异,蛋清溶液的缓冲能力强于大白菜。
5 教学实践与反思
1)笔者采用以上方案进行学生分组实验,每2人一组,在40 min内可以完成以下教学内容:测定自来水、缓冲液和至少3种自选生物材料的pH变化;填写pH与颜色变化相关表格;不同组的学生分析比较加入HCl或NaOH后,自来水、缓冲液和生物材料的pH变化,以及不同生物材料的缓冲能力差异等;对“缓冲”“稳态”等概念进行深入的讨论。
与教材中实验相比,不再使用pH试纸或pH计,而是改为使用混合酸碱指示剂,其优点在于:①pH试纸或pH计需要反复在试纸上滴加或清洗探头并等待,每次读数所需时间较长,而混合酸碱指示剂直接滴入溶液中显色,颜色易于观察,节约大量时间;②混合酸碱指示剂显色的pH范围虽然略有缩小,但是颜色更容易区分,便于读取和记录;③记录数据时,既可记录具体颜色,也可记录颜色变化起始时间,结果更加直接;④pH计或传感器价格昂贵,易损坏,日常维护要求高;而混合酸碱指示剂配方为常见指示剂,价格便宜,配制方便,易于清洗。
2)为了达到更好的实施效果,建议在组织学生实验时:①教师配制一组pH 4~10范围内酸碱性不同的溶液,呈现不同的颜色进行展示,充分呈现颜色变化,或将试纸浸入上述溶液中润湿后晾干制成pH试纸供学生测试时参考比色。配制方法:用1 mol/L HCl和1 mol/L NaOH稀释后配制pH梯度为4~10的溶液,取2 mL pH溶液,加入2滴混合酸碱指示剂后显色。梯度显色液封口后可以较长时间放置。②选择多种合适的生物材料,尽量减少颜色的干扰,初始pH在混合酸碱指示剂显色范围内。③配制生物材料溶液时,根据不同的稀释度,调整记录的滴数差或调整滴加所用的酸或碱的浓度,以得到更加直观的缓冲范围。例如,对于用5倍水稀释的大白菜匀浆、用5倍水稀释的黄瓜去皮后匀浆等材料,可以采取每滴加1滴酸或碱后进行记录,也可以使用0.05 mol/L NaOH或HCl。
主要参考文献
[1]朱正威,赵占良.生物:必修3:稳态与环境.北京:人民教育出版社,2007.
[2]黄春,岳京立.医用化学.武汉:华中科技大学出版社,2010:45.
[3]中华人民共和国.普通高中生物课程标准.北京:高等教育出版社,2003.

