膜性肾病合并肾功能轻度受损的抗肾小球基底膜病一例报道及文献复习
包红梅 张建春 陈晓明 郭文岗 王素霞 章友康
·论著·
膜性肾病合并肾功能轻度受损的抗肾小球基底膜病一例报道及文献复习
包红梅 张建春 陈晓明 郭文岗 王素霞 章友康
目的 通过1例典型病例分析结合文献资料的复习探讨膜性肾病合并抗肾小球基底膜(glomerular basement membrane,GBM)病的临床表现、发病机制、治疗方法和预后。方法 对本院收治的1例膜性肾病合并抗GBM病患者的病理特点和临床治疗进行回顾性分析,复习相关文献资料。结果 本例患者青年男性,既往体健,有吸烟病史,感染20 d后出现肺出血、肉眼血尿、大量蛋白尿、低蛋白血症、浮肿、血肌酐轻度增高,抗GBM抗体阳性,肾脏病理为膜性肾病合并有抗GBM病伴有亚急性肾小管间质肾病。前期给予甲泼尼龙0.5 g/d,共4 d,环磷酰胺0.4 g/d、0.6 g/d,连续2 d冲击治疗后尿蛋白明显减少,肉眼血尿消失,但肾功能和血色素无改善,同时出现胸闷、气短,活动后加重等症状,胸片显示肺出血加重,经8次双重血浆置换、配合激素、环磷酰胺治疗后,抗GBM抗体转为阴性,肺出血完全控制,尿蛋白定量明显降低,肾功能正常。结论 膜性肾病合并抗GBM病较少见,临床容易误诊或漏诊,治疗不及时多预后不佳,尤其合并肺出血者病情变化快。对临床可疑者需尽早行抗GBM抗体或肾穿刺检查明确诊断。对伴有肺出血、肾功能轻度受损者经积极血浆置换和激素、环磷酰胺治疗可改善预后。
抗肾小球基底膜病;急性肾损伤;膜性肾病;肺出血
患者王某,男,20岁,以“乏力20余天,肉眼血尿、浮肿伴血肌酐升高5天”于2015年7月5日入住京东誉美中西医结合肾病医院。患者于20 d前感冒后自觉乏力,未予重视。5 d前出现下肢浮肿,伴有浓茶色尿,就诊于当地某附属医院,测血压正常。实验室检查:血肌酐165.1 μmol/L,尿素氮8.8 mmol/L,二氧化碳结合力20.2 μmol/L;血液常规示白细胞10.23×109/L,红细胞2.34×1012/L,血红蛋白58 g/L,血小板432×109/L;贫血三项示叶酸7.73 nmol/L,维生素B1267.98 pmol/L,血清铁蛋白45.21 ng/ml,转铁蛋白饱和度42%;尿常规示蛋白(+++),潜血(+++),红细胞1 585 个/μl。当地彩超:双肾、膀胱、前列腺超声未见异常,双侧肾动脉超声未见明显异常。狼疮系列(-),ANCA谱组合:ANCA-PR3(-),ANCA-MPO(-); 抗GBM抗体(-)。间断给予输血(红细胞悬液800 ml),口服“百令胶囊、钙剂、叶酸片、维生素B12片、螺内酯片、速尿片(具体不详)”等对症治疗,病情无好转。
患者入院时神志清,精神欠佳,饮食及睡眠可,诉倦怠乏力,活动后时有心慌,余无不适。尿色为浓茶色,下肢轻度浮肿,24 h尿量约1 600 ml,大便正常。既往体健,吸烟3年余,平均每日20支左右,偶有少量饮酒。10余天前饮酒后曾出现咳血痰一口,余无不适,未予重视。个人史、家族史无特殊,无装修、汽油、工业粉尘等接触史。体格检查:体温36.5 ℃,脉搏80次/分,呼吸20次/分,血压110/60 mmHg;体型适中,全身皮肤黏膜无皮疹及出血点,浅表淋巴结无肿大,贫血貌,双眼睑轻度浮肿,睑结膜苍白,右肺呼吸音减弱,左侧呼吸音清晰,未闻及干湿性啰音,心律齐,心率80次/分,各瓣膜听诊区未闻及病理性杂音;腹软,无压痛、反跳痛及肌紧张,移动性浊音阴性,双下肢轻度浮肿。实验室检查:尿常规示蛋白(+++),潜血(++),红细胞359.2个/HP,多形红细胞90%;血常规示白细胞8.08×109/L,红细胞2.44×1012/L,血红蛋白60 g/L,血小板321×109/L,网织红细胞绝对值74.5×109/L,网织红细胞百分比3.2%;贫血三项示叶酸24.40 ng/ml,维生素B12207 pg/ml,铁蛋白45.7 ng/ml;生化全项示丙氨酸转氨酶16.6 U/L,天冬氨酸转氨酶14.1 U/L,总蛋白39.7 g/L,白蛋白17 g/L,球蛋白22.7 g/L,尿素氮11.64 mmol/L,肌酐141.9 μmol/L,尿酸451.2 μmol/L,总胆固醇5.5 mmol/L,三酰甘油1.72 mmol/L,钙1.88 mmol/L,肌酐清除率58.6 ml/min,磷1.74 mmol/L,二氧化碳结合力24.9 mmol/L,渗透压266.2 mOsm/L;C反应蛋白(定量)5.32 mg/L;免疫全项及补体示IgG 3.95 g/L,IgA 1.25 g/L,IgM 1.16 g/L,C3 0.95 g/L,C4 0.21 g/L;血清、尿免疫固定电泳阴性示B型钠尿肽<100 pg/mL;血沉71 mm/h;CRP、ASO、RF、凝血四项均正常;乙肝五项、丙肝、艾滋病、梅毒抗体均阴性;血气分析:pH值7.44,二氧化碳分压31.9 mmHg,氧分压78 mmHg,乳酸0.71 mmol/L,碱剩余-2 mmol/L,实际碳酸氢盐21.9 mmol/L,氧饱和度96%,二氧化碳总量23 mmol/L;尿本周蛋白测定均阴性;24h尿蛋白定量11.85 g;尿蛋白电泳示白蛋白:81.6%,球型蛋白:18.4%;粪便常规示褐色软便,未见异常。彩超:左肾大小约11.7 cm×5.2 cm,右肾11.7 cm×5.3 cm,双肾大小、形态基本正常,包膜略增厚,尚光滑,实质厚约为1.6 cm,实质回声略增强,皮髓质分界尚清,肾结构尚清,肝脏、胆囊、脾脏大小、形态、结构、回声未见明显异常。心脏二尖瓣少量返流。心电图:1.窦性心律;2.正常范围心电图。胸片:双肺弥漫性改变,肺水肿?建议CT检查(图1)。肺CT:两肺野透过度降低,可见弥漫分布较淡模糊状影,呈磨玻璃样;右肺中叶内侧段,左肺上叶后段、双肺下叶肺野外带见斑片状模糊影。双肺下叶内基底段见条片影,右肺内基底段见局限性透光区。双肺改变-符合肺出血改变,右肺下叶局限性肺气肿。
在对症处理的同时完善狼疮系列、ANCA、抗GBM等检查,结果回报:C-ANCA,P-ANCA均阴性,抗GBM抗体阳性(99 RU/ml),给予糖皮质激素治疗的同时建议患者血浆置换,但患者因经济原因暂不同意,故未进行。7月10日给予肾脏活检。
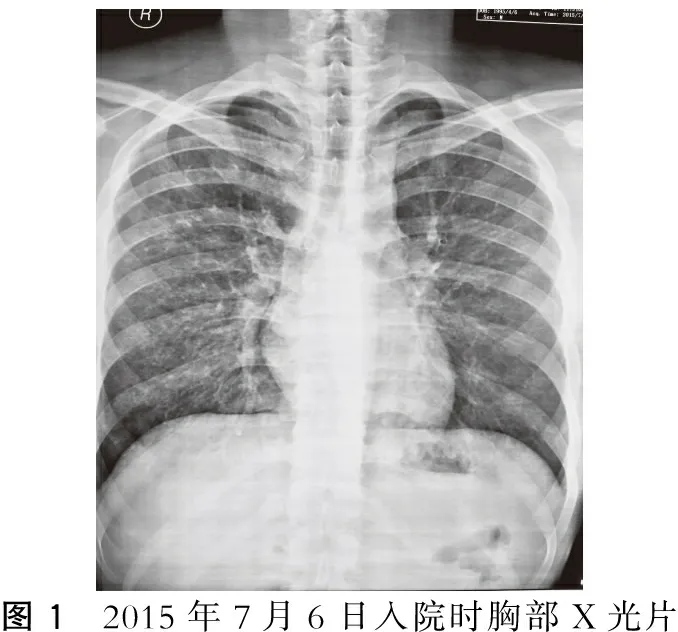
图1 2015年7月6日入院时胸部X光片
肾穿刺病理:免疫荧光可见5个肾小球(1个新月体),IgG(++~+++),IgA(-),IgM(+),C3(+~++),C1q(+),FRA(+),Alb(-),沿毛细血管壁线条样、颗粒样沉积(图2);光镜下可见19个肾小球(图3~4);肾小球系膜细胞和基质轻度节段增生,节段性内皮细胞增生,基底膜空泡变性,轻度增厚,上皮下嗜复红蛋白沉积,部分小球毛细血管袢严重破坏,其中1个节段性纤维素样坏死,3个细胞性、4个细胞纤维性新月体;2个小细胞性、1个小细胞纤维性新月体形成;肾小管上皮空泡及颗粒变性,灶状萎缩,可见红细胞及蛋白管型;肾间质灶状淋巴和单核细胞浸润伴纤维化,小动脉管壁增厚;电镜下可见肾小球系膜细胞和基质轻度节段增生伴中性白细胞浸润,上皮下多数块状电子致密物沉积,基底膜节段皱缩,上皮足突大部分融合,肾小囊内细胞性新月体形成(图5)。病理诊断:Ⅰ期膜性肾病伴抗肾小球基底膜(glomerular basement membrane,GBM)病及亚急性肾小管间质肾病。
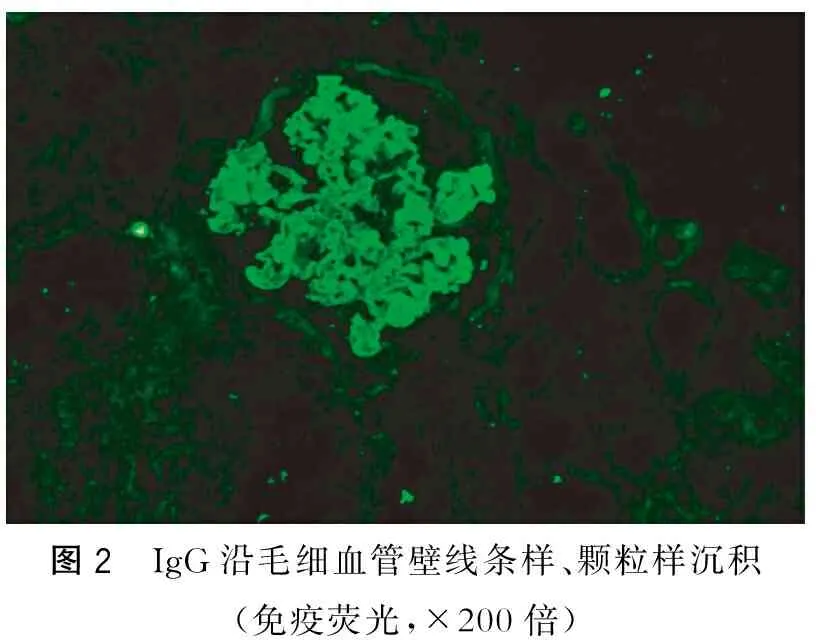
图2 IgG沿毛细血管壁线条样、颗粒样沉积(免疫荧光,×200倍)
根据临床及病理结果,给予甲泼尼龙0.5 g/d,共4 d,环磷酰胺0.4 g/d、0.6 g/d,连续2 d冲击治疗。1周后24h尿蛋白定量明显好转,由11.85 g降到5.6 g,尿红细胞明显减少,而肾功能和血红蛋白无改善,同时出现胸闷、气短,活动后加重,胸片显示肺出血加重(图6),再次与家属沟通,建议及早血浆置换。于7月18日开始双重血浆置换,隔日1次,共8次。患者于8月2日检查抗GBM抗体(-),滴度<20 RU/ml,肺出血控制(图7)。2个月后肾功能完全正常,于2015年10月8日出院。出院时患者一般状况良好,无不适。
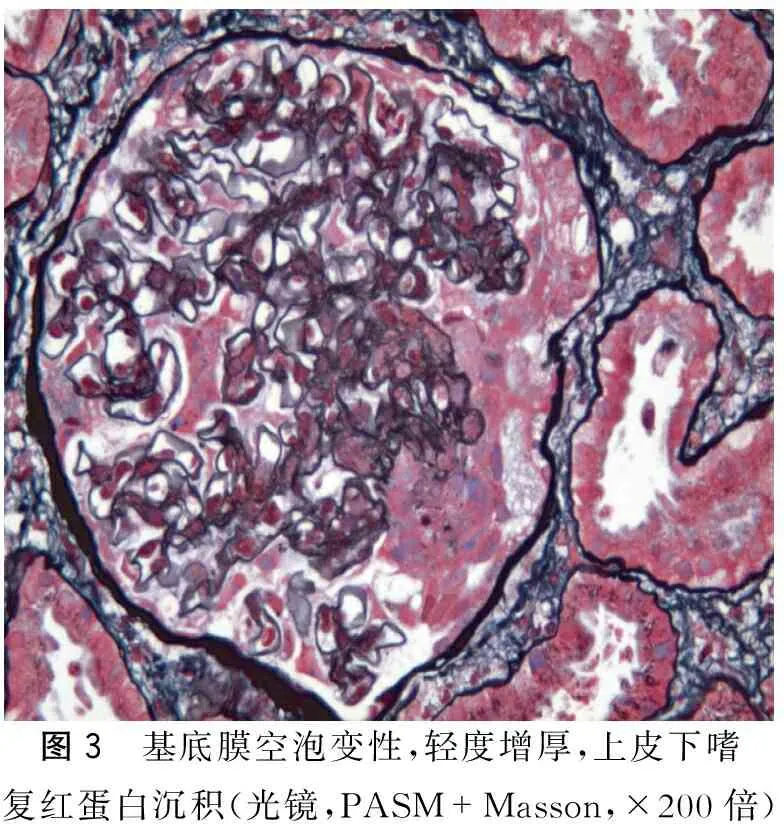
图3 基底膜空泡变性,轻度增厚,上皮下嗜复红蛋白沉积(光镜,PASM+Masson,×200倍)
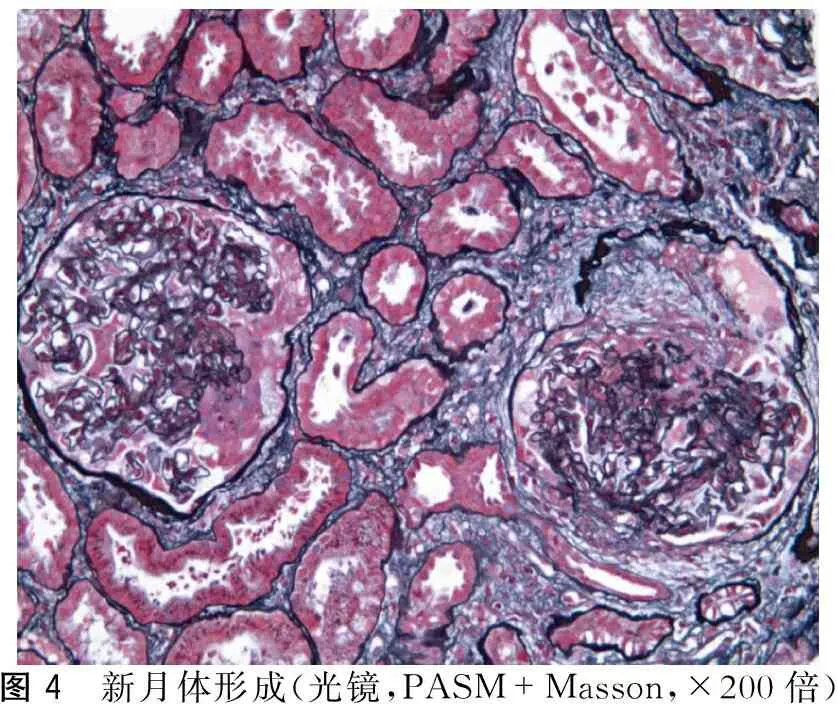
图4 新月体形成(光镜,PASM+Masson,×200倍)

图5 上皮下多数块状电子致密物沉积(电镜,×12000倍)
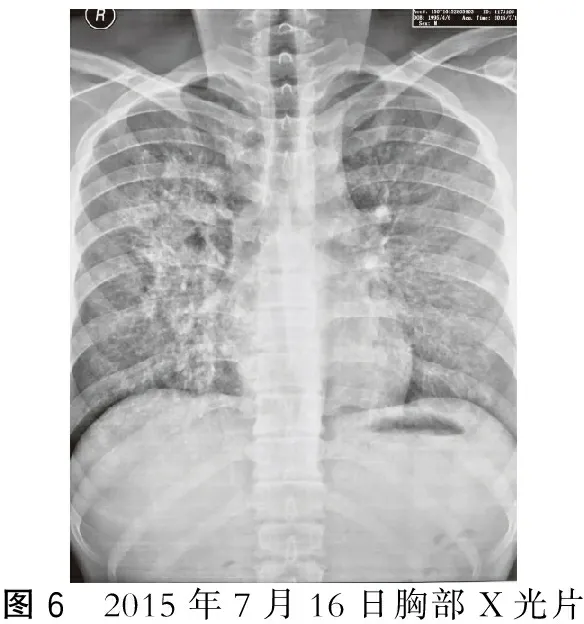
图6 2015年7月16日胸部X光片

图7 2015年7月29日胸部X光片
讨 论
总结患者病例特点:患者青年男性,发病20 d,起病急,有上感诱因,以乏力、肉眼血尿、浮肿为首发表现,大量蛋白尿、低蛋白血症、肉眼血尿、血肌酐轻度增高符合肾病综合征合并肾炎综合征表现,同时伴有肺出血。在肺出血、肾脏病变同时存在时,临床上我们要具体分析,要排除是系统性疾病所致还是肾脏疾病合并有其他疾病所致:系统性疾病中要考虑狼疮肾炎、ANCA相关性血管炎、 抗磷脂抗体综合征、血栓性微血管病、过敏性紫癜性肾炎、抗GBM病等,合并疾病中需要考虑是否合并肺部感染、肺结核、肺栓塞、支气管扩张、肺含铁血黄素沉着症、或合并心衰、心脏瓣膜病等心脏病。该患者其他相关疾病检查均阴性,外院首次检查抗GBM抗体阴性,而入我院后抗GBM抗体阳性(滴度为99RU/ml),最终临床诊断Goodpasture病,病理诊断: 期膜性肾病伴抗GBM病及亚急性肾小管间质肾病。
抗GBM病指循环中的抗GBM抗体在脏器中沉积所引起的一组自身免疫性疾病,特点是外周血中检测到抗GBM抗体,和(或)肾活检可见IgG和C3沿肾小球基底膜呈线样沉积[1-2]。它的靶抗原为肾小球基底膜IV型胶原α3链非胶原区1[α3(IV)NC1][3],应用蛋白重组技术进一步确定为氨基酸的2个主要抗原决定簇,EA(第17~31位氨基酸)和EB(第127~141位氨基酸。识别EA的抗体几乎存在于所有抗GBM 病患者血液中,与抗原的亲和力较高,被认为是主要的致病性抗体[4]。
抗GBM病患者绝大多数血中可检测出抗GBM抗体阳性,该患者外院血清学检测抗GBM抗体阴性,使早期诊断方向发生偏移。Lettieri等[5]也报道过1例肾功能及尿常规正常的GPS患者,起初血清抗GBM抗体阴性,而后复查发现GBM抗体变成了阳性,并随即出现肾小球肾炎。而近期有学者报道个别患者肾组织免疫荧光为典型的线条样沉积,而血清学检测抗GBM抗体为阴性[6]。分析原因考虑为:①检测方法的敏感性不同,使用荧光法敏感性较差,ELISA法敏感性(95%)、特异性(99%)较高;②抗体亲和力很高,更容易与肾组织的靶抗原结合,而使循环中的抗体相对很低,无法检测;③疾病晚期原有抗体沉积在肾脏,与肾组织结合,而血液中不再产生新的抗体;④抗体识别特殊类型靶抗原,需要用特殊的检测方法如间接免疫荧光法、免疫印迹法等方可检测出来。因此临床中可以存在血中抗GBM抗体阴性的抗GBM病,需肾活检明确诊断。该患者于外院血清学检测抗GBM抗体阴性,而入我院后复查抗GBM抗体阳性,考虑有两种可能:①检测方法敏感性不够,发病初期抗体滴度相对较低;②膜性肾病诱发了GBM的损害和GBM抗原的暴露,进而导致机体产生了抗GBM抗体有关。因为患者有膜性肾病和抗GBM病的临床和病理特点,我们更倾向后者。
此患者肾脏病理检查为非典型、单一的抗GBM病,其中免疫荧光IgG、C3 沿毛细血管壁除线条样沉积外,合并有颗粒样沉积。光镜除新月体肾炎表现外合并有基底膜空泡变性,轻度增厚,上皮下嗜复红蛋白沉积。电镜可见上皮下多数块状电子致密物沉积,基底膜节段皱缩,上皮足突大部分融合,均表现为合并有典型的膜性肾病的病理改变。所以临床表现为蛋白尿更突出,低蛋白血症更明显,均与膜性肾病病变有关。
膜性肾病诱发抗GBM病的发病机制目前不十分清楚,可能机制为GBM上皮侧免疫复合物沉积使GBM受损使隐藏的GBM抗原[α3(IV)NC1]暴露并导致抗GBM抗体产生。肺泡基底膜与GBM具有共同的抗原决定簇,抗GBM抗体与GBM相结合,并也可与肺泡基底膜相结合(特别是吸烟患者),可同时导致肺出血、肺损伤及肾损伤、抗GBM病。而抗GBM抗体介导的肾脏损伤使抗原释放,在上皮侧免疫复合物沉积。膜性肾病合并抗GBM病临床中较少见,有研究总结8例膜性肾病合并抗GBM病与30例经典的抗GBM病分析比较存在如下特点:抗GBM抗体识别GBM抗原决定簇EB的水平较低,抗PLA2R抗体多为阴性,少尿/无尿比例低,肉眼血尿比例低,尿蛋白定量更突出,发病时血肌酐相对较低,给予相同治疗预后(一年时)相对较好[7]。本例患者发病后无少尿或无尿表现,低蛋白血症,大量蛋白尿表现更突出,血肌酐仅轻度增高,经积极治疗后肾功能正常,尿蛋白定量明显好转,效果较理想。
多数学者认为Goodpasture病可能系病毒、溶血性链球菌感染和或吸入某些化学性物质引起原发性肺损害[8-11]。患者的肺泡壁毛细血管基底膜和肾小球基底膜在胶原蛋白上存在共同的抗原决定簇,由于某些发病因素原发性损伤肺泡间隔和肺毛细血管基膜,后者刺激机体产生抗肺基膜抗体,在补体等作用下引起肺泡一系列免疫反应,而肺泡壁基底膜和肾小球基底膜间存在交叉抗原,引起肾小球受损。此患者既往有吸烟史,且发病前存在上呼吸道感染情况,均可诱发肺泡间隔和肺毛细血管基膜损伤,破坏了肺泡毛细血管的完整性,使抗体结合到肺泡基底膜机会大大增加,可能导致临床表现为肺出血更突出,而肾脏受累相对较轻。
抗GBM病是所有肾脏病中预后相对较差的疾病。崔昭等[12]研究表明决定肾脏预后的因素为:确诊时血肌酐>600 μmol/L、出现少尿或无尿者、肾小球中新月体所占比例>85%者、以肾脏受累为首发表现者预后较差;对于确诊时血肌酐<600 μmol/L,或肺脏受累为首发表现者,预后较好。然而合并肺出血的患者病情变化快,肺部动态变化明显,需要积极血浆置换治疗。有研究证实,血浆置换是唯一能够改善该病预后的方法[13]。本例患者前期因经济原因不同意血浆置换,虽使用激素及环磷酰胺冲击治疗,使患者尿蛋白明显减少,但肺出血仍进一步加重,直至血浆置换后肺出血方得到控制,肾功能改善和血红蛋白上升均在抗体转阴、停止置换后一周左右,也进一步证实此研究结论。
目前发现随着检测方法的改进抗GBM病并不少见,应提高对该病的认识,及时检测抗GBM抗体
(ELISA法)做到早期诊断,减少漏诊,而肾穿刺可明确病理类型,指导治疗、判断预后。同时重视肺出血的患者,在诊断特发性肺出血综合征之前须及时检测血清抗GBM抗体[14-15],对高度可疑者建议重复检测。该患者长期预后仍需进一步随访观察。
[1] 赵明辉, 丁焦生, 刘玉春, 等. 41例抗肾小球基底膜抗体相关疾病的临床和病理分析[J]. 中华内科杂志, 2001, 40(5): 316-320.
[2] Falk RJ, JennetteC, Nachman PH. Primary glomerular diseases[M]. In:Brenner BM.The Kidney.7th ed.Philadelphia:WB Saunders,2004:1293-1380.
[3] Hellmark T, Johansson C,Wieslander J. Characterization of anti-GBM antibodies involved in Goodpasture’s syndrome[J]. Kidney Int, 1994, 46(3): 823-829.
[4] Netzer KO, Leinonen A, Boutaud A, et al. The goodpasture autoantigen.Mapping the major conformational epitope(s) of alpha3(IV) collagen to residues 17-31 and 127-141 of the NC1 domain[J]. J Biol Chem, 1999, 274(16): 11267-11274.
[5] Lettieri C, Pina J. Goodpasture’s syndrome:a case of delayed appearance of autoantibodies and renal disease[J]. Military medicine, 2001, 166(9): 827-830.
[6] Xiao-Yu Jia, Zhen Qu, Zhao Cui, et al. Circulating anti-glomerular basement membrane autoantibodies against 3(IV)NC1 undetectable by commercially available enzyme-linked immunosorbent assays[J]. Nephrology, 2012, 17(17): 160-166.
[7] Jia XY, Hu SY, Chen JL, et al, The clinical and immunological features of patients with combined anti-glomerular basement membrane disease and membranous nephropathy[J]. Kidney International, 2014, 85(4): 945-952.
[8] CashmanSJ, Pusey CD, Ewans DJ. Extraglomerular distribution of immunoreactive Goodpasture antigen[J]. J Pathol, 1988, 155(1): 6-70.
[9] Bowley NB, Steiner RE, Chin WS. The chest X-ray in antiglomerular basement membrane antibody Disease (Goodpasture’s syndrome)[J]. ClinRadiol, 1979, 30(4): 419-429.
[10]Wasaki A, Matsuzoe D, Yoneda S, et al. Thoracoscopic diagnosis of Goodpasture’s syndrome[J]. Surg Laparose Endosc, 1996, 6(4): 304-306.
[11]Kelly PT, HaponikEF. Goodpasture’s syndrome:molecular and clinical advances [J]. Medicine, 1994, 73(4): 171-185.
[12]崔昭, 赵明辉, 刘玉春, 等. 抗肾小球基底膜抗体相关疾病的预后研究[J]. 临床内科杂志, 2004, 21(10): 677-680.
[13]Daly C, Conlon PJ, Medwar W, et al. Characteristics and outcome of antiglomerular basement membrane disease:a single-center experience[J]. Renal Failure, 1996, 18(1): 105-112.
[14]Bell DD, Moffatt SL, Singer M, et al. Antibasement membrane antibody disense without clinical evidence of renal disease[J]. Am Rev Respir Dis, 1990, 142(1): 234-237.
[15]姚小丹. 抗肾小球基膜疾病的基础与临床[J]. 肾脏病与透析肾移植杂志, 1997, 6(5): 468.
Membranous nephropathy combined mild damage to kidney function of anti glomerular basement membrane disease
BAOHong-mei,ZHANGJian-chun,CHENXiao-ming,GUOWen-gang,WANGSu-xia,ZHANGYou-kang.
DepartmentofNephrology,JingDongYumeiInregrativeMedicine,Langfang065201,China
ZHANGYou-kang,E-mail:zyk2467@sohu.com
Objective The clinical manifestations, treatment methods, pathogenesis and prognosis of rare membranous nephropathy combined with anti glomerular basement membrane disease were discussed through 1 typical case analysis and literature review.Methods The pathological characteristics and clinical treatment of one cases of membranous nephropathy combined with anti glomerular basement membrane disease were retrospectively analyzed, and the related literature was reviewed.Results The patients were young men and past physical health, smoking history, Twenty days after infection appeared pulmonary hemorrhage, gross hematuria, large proteinuria, hypoproteinemia, edema, blood creatinine slight increase, anti GBM antibody positive renal pathology as membranous nephropathy with anti GBM disease with sub acute tubular interstitial nephropathy. Pre given methylprednisolone 0.5 g/d. A total of four days, cyclophosphamide 0.4 g/d, 0.6 g/d, continuous two days after shock treatment urinary protein was significantly reduced, the naked eye hematuria disappeared, but renal function and hemoglobin no improvement, also appear chest tightness, shortness of breath, activities after aggravating symptoms such as chest radiograph shows pulmonary blood increased, urine protein significantly reduced by eight double plasma exchange, with the hormone, cyclophosphamide, anti GBM antibody turn negative and pulmonary hemorrhage in complete control and renal function normal.Conclusions Membranous nephropathy combined with anti GBM disease is rare, clinical easy to misdiagnosis or missed diagnosis, treatment is not timely prognosis is not good, especially with the rapid change of the patient's condition. The diagnosis of clinical suspected as early as possible to anti GBM antibody or renal biopsy. The prognosis of patients with pulmonary hemorrhage, mild impairment of renal function by positive plasma exchange and hormone and cyclophosphamide therapy.
Anti glomerular basement membrane disease;Acute kidney injury;Membranous nephropathy;Pulmonary hemorrhage
10.3969/j.issn.1671-2390.2017.04.006
065201 廊坊,京东誉美中西医结合肾病医院肾内科(包红梅,张建春,陈晓明,郭文岗);100034 北京,北京大学第一医院肾内科(王素霞,章友康)
章友康,E-mail: zyk2467@sohu.com
2015-12-13
2016-07-09)

